2. 澳门大学中华医药研究院中药质量研究国家重点实验室, 澳门
2. State Key Laboratory of Quality Research in Chinese Medicine, Institute of Chinese Medical Sciences, University of Macau, Macau, China
聚合物胶束 (polymeric micelles) 作为纳米级药物载体已在医学和药学领域引起广泛的关注,其特点包括增溶难溶性药物、控制药物释放速度和提高药物靶向性等[1]。在药物递送过程中胶束的完整性问题已获得越来越多的重视,其原因主要包括: ① 胶束的完整性决定着药物的释放特性,尤其是难溶性药物,胶束的过快解散可能引起药物的快速释放与析晶,达不到增溶的目的,但释药过于迟缓可能又会影响药效的发挥[2]; ② 胶束的完整性决定着药物的体内分布,尤其是作为靶向制剂时,胶束需在血液循环中保持完整形式,才能使药物在到达靶部位前能滞留在胶束内核中,从而增加运送到靶部位的几率[3]; ③ 胶束的完整性影响着生物安全性,胶束的组成成分单聚体能从被破坏或解散的胶束中释放,单聚体会穿过细胞膜进而引起溶血等反应,带来毒性[4]。
在口服给药方式中胶束的完整性同样重要,除了能保护所载药物不被胃肠道环境破坏或降解[5],也可能会改变药物的转运途径从而影响药物跨过小肠上皮层而被吸收的量[6],甚至完整摄取的胶束会改变药物在体内的分布[7]。但是目前关于胶束完整性研究主要集中在胶束是否以完整形式被摄取入胞,随后在胞浆中释放出包载物[8],也有人研究胶束经静脉注射入血后是否在血液循环中保持完整[9]。关于胶束在口服递送药物过程中跨细胞单层的完整性研究较少。在前期研究中,作者报道了载香豆素6的聚乙二醇-聚ε-己内酯 [poly(ethylene glycol)-co-poly(ε-caprolactone),PEG-PCL] 胶束跨犬肾极性上皮细胞(madin-darby canine kidney,MDCK) 细胞单层的转运过程以及胶束的亲疏水性对香豆素6跨MDCK细胞单层以及大鼠口服吸收的影响[10-12],结果均表明胶束可以增加难溶性药物的跨膜转运,本研究拟以MDCK细胞单层为模型,利用荧光共振能量转移 (Förster resonance energy transfer,FRET) 技术研究PEG-PCL胶束跨极性上皮细胞单层转运的完整性,为认识纳米载体转运难溶性药物的机制奠定基础,为纳米材料作为药物递送系统的设计和应用提供依据。
FRET技术是少数可以用来研究在体内和体外纳米级距离及距离变化的工具之一[13]。FRET现象的原理是当供体被入射光激发,则会通过偶极-偶极耦合作用将其能量以非辐射的方式传递给受体分子,供体分子衰变到基态而发射的荧光减弱,受体分子由基态跃迁到激发态,再衰变到基态,同时发射荧光。这一过程称为FRET[14]。两个荧光团若有FRET现象需满足两个条件: 一是两者距离在1~10 nm,二是一个荧光团 (供体,donor) 的发射光谱与另一个荧光团 (受体,acceptor) 的吸收光谱发生重叠[15]。目前,FRET技术已广泛用于研究纳米载体的完整性及蛋白之间的相互作用[16]。
本文拟选择的载体材料为PEG-PCL。PEG具有良好的亲水性,无抗原性或免疫原性,可对纳米载体的体内转运起到有效的保护作用; PCL具有良好的生物相容性、生物可降解性和较强的包载难溶性药物的能力[17]。目前,PEG-PCL已被美国食品药品监督管理局批准在人体内使用。拟制备的胶束有两种: 一种是同时物理包载FRET荧光对DiO与DiI的胶束 (DiO-DiI-M); 另一种是含有部分PEG-PCL-FITC载体材料并物理包载DiI的胶束 (FITC-DiI-M),其中PEG-PCL-FITC中FITC与DiI也是FRET荧光对。通过这两种胶束跨膜转运的比较从不同的角度说明胶束跨膜转运完整性的问题。
材料与方法药品和试剂 mPEG3000-PCL2500(PEG-PCL,Mw 5 500,加拿大Advanced Polymer Materials Inc.公司);对硝基苯基氯甲酸酯 (4-nitrophenylchloroformate,PNP,美国Sigma-Aldrich公司); 乙二胺 (ethylenediamine,ED)、吡啶 (北京化工厂); 异硫氰酸荧光素 (fluorescein isothiocyanate isomer I,FITC,美国Amresco公司);3,3'-dioctadecyloxacarbocyanine perchlorate (DiO,Mw 881.72)、1,1'-dioctadecyl-3,3,3',3'-tetramethylindocarbocyanine perchlorate (DiI,Mw933.88) (碧云天生物科技有限公司); 胎牛血清 (fetal bovine serum,FBS,美国Gibco公司); Dulbecco’smodified eagle media (DMEM,含4.5 g∙L-1葡萄糖、谷氨酰胺,pH 7.4) 无血清培养液、100 u∙mL-1青霉素、100 μg∙mL-1链霉素、0.25% 胰蛋白酶/0.02% EDTA、4% 多聚甲醛和抗荧光衰减封片液 (北京迈晨生物科技有限公司); Hoechst 33258 (美国Molecular ProbesInc.公司); 细胞培养瓶 (25 cm2)、12孔细胞培养板、Transwell板 (12孔,孔径3μm,聚碳酸酯膜) (美国Corning公司)。
主要仪器 NanoZS激光粒度测定仪 (英国Malvern Instruments公司);TU1900双光束紫外可见分光光度计 (北京普析通用仪器有限责任公司); F-7000荧光分光光度计 (日本Hitachi公司);Millicell ERS电阻仪 (美国Millipore公司); TCS激光扫描共聚焦荧光显微镜 (Confocal,德国Leica公司)。
细胞株 MDCK细胞购于中国医学科学院细胞资源中心。将MDCK细胞培养于25 cm2的培养瓶 中,培养液为含10% FBS、1% 青霉素和1% 链霉素的DMEM培养液,培养环境为95% 相对湿度、5% CO2的37 ℃细胞培养箱。隔天更换细胞培养液。培养细胞至细胞汇合度达80%~90% 时用0.25% 胰酶/0.02% EDTA消化传代。
FITC-ED的合成与鉴定 取FITC17.1 mg (47 μmol) 置于10 mL棕色样品瓶中,加入甲醇2 mL溶解,边搅拌边加入ED 17 μL (250 μmol),室温下搅拌3 h,真空干燥,即得FITC-ED (合成路线1)。产物采用电喷雾电离质谱 (ESI-MS) 进行鉴定。
PEG-PCL-PNP的合成与鉴定 称取PNP4 mg (20 μmol) 于干燥的茄形瓶中,加入无水二氯甲烷 5 mL溶解,冰浴下缓慢加入吡啶2.5 μL,逐滴加入 溶解于无水二氯甲烷的PEG-PCL溶液,其中含PEG- PCL 56 mg (10 μmol),冰浴下搅拌反应30 min,室温、N2保护下继续反应4 h。将反应液加热,使二氯甲烷挥发至剩余约1 mL,加入10 mL冰乙醚沉淀产物,10 000 r·min-1离心15 min,所得沉淀真空干燥即得PEG-PCL-PNP(合成路线1)。采用Galdwell法测定PEG-PCL上PNP的取代度[18],即将适量产物溶 解于0.4% NaOH中,室温下搅拌1 h,分光光度法在402 nm波长下测定吸光度。
PEG-PCL-FITC的合成与鉴定 将上述产物溶解于8 mL DMF中,加入过量的FITC-ED,再加入三乙胺5 μL,N2保护下搅拌反应24 h[19]。将反应液用透析袋 (截留分子量为3 500) 于4 ℃下透析,产物冷冻干燥即得PEG-PCL-FITC (合成路线1)。所得产物采用荧光光谱法进行鉴定,即分别将适量PEG-PCL、PEG-PCL-FITC溶于乙腈中,各配制5 μg∙mL-1溶液,将适量FITC溶于乙腈配制50 ng∙mL-1溶液。设定激发光波长为485 nm,在500~600 nm内分别扫描3种物质的荧光谱。
胶束的制备 采用薄膜水化法[10]制备两种胶束: ① 同时物理包载FRET荧光对DiO与DiI的胶束(DiO-DiI-M,图 1A);② 含有部分化学荧光标记载体材料PEG-PCL-FITC并物理包载DiI的胶束 (FITC- DiI-M) (图 1B)。DiO-DiI-M的制备方法: 取PEG-PCL 1 mg置于25 mL茄形瓶中,加入乙腈5 mL溶解,再加入250 μg∙mL-1 DiO储备液8 μL、250 μg∙mL-1 DiI储备液8μL (DiO∶DiI∶PEG-PCL = 1∶1∶500,w/w/w)。避光,40 ℃旋转蒸发除去有机溶剂,在茄形瓶内壁 形成一层均匀的薄膜。加入预热的PBS 1 mL,剧烈涡旋使薄膜完全水化,再超声分散至溶液澄清,得DiO-DiI-M。同法制备单独包载DiO或DiI的胶束DiO-M、DiI-M作为对照。FITC-DiI-M的制备方法: 取PEG-PCL 947 μg和PEG-PCL-FITC (含FITC3 μg) 53 μg置于25 mL茄形瓶中,加入乙腈5 mL溶解,再加入250 μg∙mL-1 DiI储备液8 μL (FITC∶DiI∶PEG-PCL = 1.5∶1∶500,w/w/w)。其余步骤同DiO- DiI-M的制备。同法制备单独含有PEG-PCL-FITC荧光物质的胶束FITC-M作为对照。临用前用无血清的DMEM稀释5倍。

|
Scheme1 Synthesis for fluorescein isothiocyanate isomer I (FITC) conjugated poly(ethylene glycol)-co-poly(ε-caprolactone) (PEG- PCL)(PEG-PCL-FITC) |

|
Figure 1 Schematic diagram of the micelles used in the Förster resonance energy transfer (FRET) experiment. A: 3,3'-Dioctadecyloxacarbocyanine perchlorate (DiO) and 1,1'-dioctadecyl-3,3,3',3'-tetramethylindocarbocyanine perchlorate (DiI) co-loaded PEG-PCL micelles (DiO-DiI-M); B: DiI loaded and PEG-PCL- FITC contained micelles (FITC-DiI-M); C: Cell culture model for transcytosis study |
胶束粒径的测定 采用动态光散射法测定各种胶束的粒径及粒度分布。设定粒度测定仪的激光束波长为633 nm,入射光与散射光束的夹角为90°,测定温度为25 ℃,每个样品测定20个循环。
胶束稳定性的测定 分别吸取稀释5倍后的DiO-DiI-M或FITC-DiI-M胶束溶液5 mL,装入透析袋 (MWCO 14 000)内,两端扎紧后置于盛有45 mL释放介质 (PBS,pH 7.4) 的三角瓶中,用封口膜封口。恒温37 ℃,恒速100 r·min-1振荡。分别于0、15、30 min和1、1.5、2、4h定时取出胶束1 mL。DiO-DiI-M在激发光波长为470 nm条件下,在490~600 nm内扫描胶束的荧光发射光谱; FITC-DiI-M在激发光波长为488 nm条件下,在500~600 nm内扫描胶束的荧光发射光谱。将胶束以丙酮稀释5倍破坏,作为时间无穷大时胶束中荧光物质释放的情况。根据谱图的荧光强度,按下面的公式计算各时刻胶束FRET效率的变化[20]。
EffFRET (%) = IR / (IG + IR)
EffFRET: FRET效率;IR: DiI在565 nm的荧光强度; IG: DiO在501nm的荧光强度 (DiO-DiI-M中)或FITC在525 nm的荧光强度 (FITC-DiI-M中)。
FRET SE模式研究胶束与细胞相互作用可行性的验证性实验 将灭菌后的圆形玻片置于12孔板中,以每孔3×105个细胞接种MDCK细胞,待细胞汇合度达到80% 以上可进行实验。吸去完全培养液,用37 ℃的PBS洗3次。分别加入DiO-M (单供体)、DiI-M (单受体) 和DiI-DiO-M (FRET) 的DMEM溶液1mL,37 ℃/5% CO2条件下孵育4 h,吸去胶束分散液,以 4 ℃的PBS洗涤3次,4%多聚甲醛室温固定细胞 15 min,PBS洗涤3次,加抗荧光衰减封片液,封片。同法制备FITC-M (单供体)、DiI-M(单受体)、FITC- DiI-M (FRET) 样品。将制备好的样品置于激光扫描共聚焦显微镜载物台上,调节物镜 (63×油镜),先用共聚焦显微镜内置相差观测系统调节样品焦距至视野清晰,再进行双通道荧光分析,DiO、FITC采用488nm激发光通道检测,DiI采用561 nm 激发光通道检测。进入FRET 发射光敏化 (sensitized emission,SE) 模式,分别对DiO-M、FITC-M、DiI-M、DiO-DiI-M或FITC-DiI-M5种样品采集图像。DiO或FITC通道采用488 nm激发光、检测500~550 nm发射光 的图像; FRET通道采用488 nm激发光、检测580~650 nm发射光的图像; DiI通道采用561 nm 激发光、检测580~650 nm发射光的图像。在经过参数设定步骤后,在FRET样品图像中划定目标区域 (region of interest,ROI),得出ROI的FRET效率。本实验中样品的FRET效率为15个以上ROI的平均值 (每个视野取3个以上ROI,每个样品取5个以上视野)。为了辅助说明结果,同时对DiO或FITC与DiI的共定位情况进行了考察,选用Person’s系数作为共定位的考量,同样统计5个以上视野。Person’s系数是莱卡共聚焦分析软件 (LAS AF) 中基于待分析通道荧光强度的算法,结果由软件自动算出,不受人为设置阈值的限制。
用于胶束跨膜转运完整性研究的 MDCK细胞的培养 按照图 1C所示装置培养细胞[11]。MDCK细胞单层 (Transwell层) 的培养: 将1×105个MDCK单细胞悬液接种至Transwell小室的供给池中,同时于下层接收池补充新鲜的DMEM完全培养液1.5 mL。静置2~3 min,待细胞沉降至Transwell膜上,将Transwell培养板置于培养箱中进行细胞培养。每天换液,并测定Transwell膜两侧电阻值(transepithelial electrical resistance,TEER)。接收层 (Receive层)细胞的培养: 待细胞单层TEER达到200 Ω·cm时,在12孔板的孔中放入洁净且灭菌的圆形玻片,将 MDCK单细胞悬液按照每孔3×105个细胞接种于玻片上。将Transwell小室置于圆形玻片上方继续培养,约24 h后接收层的细胞贴壁可用于后续实验。
胶束跨膜完整性的研究 按照图 1C所示装置培养细胞合格后吸去培养液,用37 ℃的PBS洗涤3次。分别在上层小室中加入无血清DMEM培养液0.5 mL稀释的DiO-M、FITC-M、DiI-M、DiO-DiI-M或FITC-DiI-M,在下室加入无血清DMEM培养液1.5 mL,将培养板置于37 ℃/5% CO2条件下孵育1或4h。孵育结束后,弃去含胶束培养液,体系以4 ℃的PBS洗涤3次,4% 多聚甲醛于室温固定细胞15 min,PBS洗涤3次,Hochest 33258于室温下染细胞核20 min。将Transwell膜切下,细胞面向上置于载玻片上,滴加抗荧光衰减封片液适量,加盖玻片,制成Transwell层样品。将圆形玻片取出,滴加抗荧光衰减封片液适量,细胞面向下置于载玻片上,制成接收层样品。两种样品均用激光扫描共聚焦显微镜的FRET SE模式观察,DiO、FITC采用488 nm激发光通道检测,DiI采用561 nm激发光通道检测。在视野中的细胞部位选择包含亮点的3~5个ROI,统计5个以上视野的ROI平均值作为该样品的FRET效率。
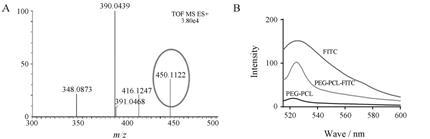
结果与讨论 1 PEG-PCL-FITC的合成与鉴定ESI-MS检测产物FITC-ED的质谱图 (图 2A) 可见,相对分子质量为450.1的峰与FITC-ED理论相对分子质量 (449.5) 相符。图谱中相对分子质量为390.0的峰为未反应的FITC (理论相对分子质量为389.4)。由于最终反应产物PEG-PCL-FITC将经过透析的方法进行纯化,所以此步骤未对反应产物进行纯化。
|
Figure 2 Identification of PEG-PCL-FITC. ESI-MS of FITC-ED (A) and fluorescence spectra of PEG-PCL,FITC and PEG-PCL-FITC in acetonitrile with excitation wavelength at 488 nm (B) |
PEG-PCL-PNP中PNP的取代度采用Galdwell法进行测定。其原理是[18]: PEG-PCL-PNP在0.4% NaOH中可以释放亮黄色的对硝基苯酚,在402nm波长下有紫外吸收。按照对硝基苯酚在该波长下的吸光系数为133.3 L·(g·cm)-1进行计算,得出产物PNP的取代度为99.7%。
最终的反应产物PEG-PCL-FITC采用荧光光谱法进行鉴定,由其荧光光谱图 (图 2B) 可见,PEG-PCL-FITC的荧光光谱与FITC相似,最大发射波长位置基本一致,但峰型有所不同。说明PEG-PCL-FITC中含有与FITC相似的结构,PEG-PCL的连接使FITC的结构发生了改变,所以峰型有所不同。
2 胶束的粒径各种荧光标记胶束的粒径及其分布如表 1所示,各胶束的粒径均在30 nm左右,多分散系数 (polydispersity index,PDI) 均在0.1左右,粒径分布均匀,各胶束间无显著性差异。
| Table 1 Particle size and polydispersity index (PDI) of the PEG-PCL polymeric micelles. n = 3,x± s |
为了研究胶束在跨膜转运过程中的完整性,首先要了解胶束在孵育介质中是否完整。在预实验中 发现无血清DMEM的荧光特性会干扰待测胶束的FRET效率检测,这种干扰不是来自于酚红,可能是其中含有的氨基酸或其他物质,难以排除。根据文 献[20, 21]采用PBS为释放介质考察了胶束的稳定性。DiO-DiI-M和FITC-DiI-M胶束分别释放4 h的荧光光谱 (图 3) 可知,DiO-DiI-M的FRET效率约为48%,FITC-DiI-M的FRET效率约为65%。在释放4 h过程中,DiO-DiI-M和FITC-DiI-M的荧光光谱均未发生明显变化,FRET效率也基本不变 (表 2)。同时也监测了释放介质中可能释放包载物的荧光强度,均未检测到相关信号变化。这些结果说明,在该释放条件下,4 h内两种胶束都是完整的,没有荧光物质泄漏和胶束解散现象的发生。加入丙酮后,DiO-DiI-M与FITC-DiI-M的FRET效率变为32.4% 和17.0%,较0 h均显著下降,说明由于丙酮的破坏作用,胶束不再完整,胶束内FRET荧光对难以保持有效的距离,所以FRET效率大幅下降[20]。

|
Figure 3 Fluorescence spectra changes of DiO-DiI-M (A) and FITC-DiI-M (B) in phosphate buffered saline (PBS) at different time and in acetone with excitation wavelength at 470 nm and 488 nm,respectively |
| Table 2 FRET efficiency (EffFRET,%) of DiO-DiI-M and FITC- DiI-M in PBS at different time and in acetone |
DiO-DiI-M或FITC-DiI-M与贴壁细胞孵育4 h后不同通道的观测结果 (图 4) 可见,两种胶束均能明显地被细胞摄取,各通道均能检测到较强的荧光信号,FRET通道的信号也较强,说明两种胶束的FRET效率明显,Merge通道显示明显的黄色,说明两种荧光染料共定位良好。选定亮点区域作为ROI,计算FRET效率。亮点可能是吸附在细胞表面而未被内吞的胶束,或是内吞于囊泡内未被破坏的胶束。DiO- DiI-M与细胞孵育4 h后FRET 效率为 (43.1 ± 2.2)%,FITC-DiI-M与细胞孵育4 h后FRET效率为 (45.5 ± 2.5) %,说明两种胶束与细胞相互作用4 h后均保持显著的FRET现象,也就是说本方法可以用来研究DiO-DiI-M和FITC-DiI-M跨膜转运的完整性。

|
Figure 4 Verification experiment on the FRET efficiency conservation when FRET micelles interacted with cells. In DiO-DiI-M,DiO was set as donor and DiI was set as acceptor (A); In FITC-DiI-M,FITC was set as donor and DiI was set as acceptor (B) |
DiO-DiI-M胶束和细胞相互作用后,DiO与DiI共定位Person’s系数为0.86 ± 0.02; FITC-DiI-M胶束和细胞相互作用后,FITC与DiI共定位Person’s系数为0.75 ± 0.05, 说明两种胶束中的FRET荧光对均有良好的共定位,进一步说明胶束和细胞作用4 h后具有显著的FRET效率是可信的,本方法可以用来研究其跨膜转运后的完整性。
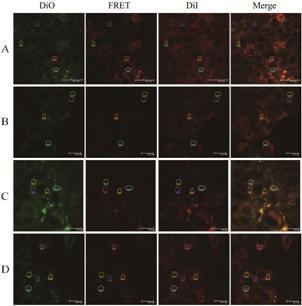
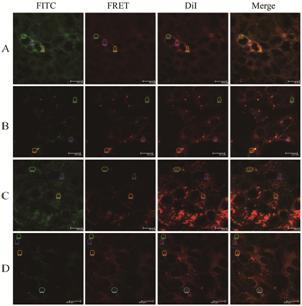
5 胶束跨膜转运的完整性DiO-DiI-M和FITC-DiI-M分别与细胞单层孵育1和4 h后,收集Transwell层和接收层的样品采集图像见图 5和图 6,结果表明两种胶束的接收层荧光强度均弱于Transwell层。文献[11]表明,在本实验条件下,PEG-PCL胶束的跨膜量小于0.1%,跨膜后再被接收层的细胞摄取量更少,所以各接收层样品的荧光强度均较弱。同样对胞浆部位包含亮点的位置划定ROI,计算FRET效率和Person’s系数,结果见表 3。
|
Figure 5 Confocal laser scanning microscope (CLSM) FRET SE mode images after DiO-DiI-M interacted with madin-darby canine kidney (MDCK) monolayer for 1 h (A and B) and 4 h (C and D). A and C: Transwell layer; B and D: Receive layer |
|
Figure 6 CLSM FRET SE mode images after FITC-DiI-M interacted with MDCK monolayer for 1 h (A and B) and 4 h (C and D). A and C: Transwell layer; B and D: Receive layer |
| Table 3 FRET efficiency (EffFRET) and Person’s coefficient of Transwell layer and Receive layer of DiO-DiI-M or FITC-DiI-M interacted with MDCK monolayer for 1 h or 4 h |
DiO-DiI-M跨膜转运1 h时,Transwell层和接收层的FRET效率分别为32.4% 和30.3%,Person’s系数分别为0.37和0.36,说明在1 h时两层间FRET效率及Person’s系数变化不大,胶束以完整的形式穿过细胞单层。而在4 h时,Transwell层和接收层的FRET效率分别为30.0% 和25.8%,Person’s系数分别为0.39和0.34,说明在4 h时接收层的FRET效率及Person’s系数均低于Transwell层,有部分胶束完整性受到了破坏。再比较Transwell层1 h和4h的FRET效率,发现也有一定的下降,说明这种破坏在Transwell层已经发生了。
FITC-DiI-M跨膜转运1 h时,Transwell层和接收层的FRET效率分别为39.1% 和34.7%,Person’s系数均为0.38; 4h时,Transwell层和接收层的FRET效率分别为34.4% 和24.6%,Person’s系数分别为0.38和0.32。其趋势与DiO-DiI-M的跨膜转运结果基本一致,但降低的程度均大于DiO-DiI-M。
胶束中药物的释放可能有两种情况引发: 一种是胶束完整,包载物扩散出来; 另一种是胶束解散的同时包载物释放出来。DiO-DiI-M同时物理包载了具有FRET效应的两种荧光染料,FRET效率的变化反映了包载物释放,但并不能区别是由哪种原因引起的。FITC-DiI-M含有部分PEG-PCL-FITC,FITC的荧光指示着胶束脂材本身的变化,物理包载的DiI指示着包载物的释放。由于这两种胶束均物理包载DiI,扩散引起的释放导致FRET效率变化是相同的,这两种胶束FRET变化的差异主要是由胶束的解散产生的。
1 h时,两种胶束跨膜转运后Transwell层和接收层样品的FRET效率和Person’s系数无显著下降,说明胶束内含有的两种荧光分子维持在较近距离,胶束以完整形式存在。4 h时,两种胶束跨膜转运后Transwell层和接收层样品的FRET效率和Person’s系数均显著下降,说明胶束在两层细胞中的存在状态发生了明显改变。再对DiO-DiI-M和FITC-DiI-M的FRET效率变化趋势进行比较,FITC-DiI-M组制得的样品较DiO-DiI-M组制得的样品的FRET效率和Person’s系数下降幅度均更大,说明包载物的释放不仅与扩散有关,也与胶束的解散有关,即部分胶束不再维持完整形式。在前期研究中作者曾经考察过分别包载DiO或DiI的胶束与MDCK细胞孵育后FRET效率的变化,结果表明,1 h时FRET效率非常低,不到1%; 4 h时略有增加,但仍然维持很低的水平[10]。所以认为DiO-DiI-M在Transwell层和接收层展现的FRET效率以及共定位系数均是由完整胶束引起的, 并不是由于胶束解散后释放出的荧光染料在胞内脂质域富集并产生FRET效应或共定位的情况。对于FITC- DiI-M,由于PEG-PCL-FITC和DiI的性质差别很大,二者同时富集在某一区域的可能性更低,所以也认为FITC-DiI-M在Transwell层和接收层表现的FRET效率以及共定位系数是由完整胶束引起的。至于完整转运胶束的量,按照以往跨膜转运研究的结果进行推算, 如果认为1 h时胶束是完整转运的话,PEG-PCL胶束转运香豆素6的量不足给药量的0.1%[11],也就是说完整转运的胶束也不足给药量的0.1%。时间延长后, 跨膜转运的香豆素的量就由完整胶束转运和胶束解散后释放的香豆素6两部分共同组成,更难以确定哪部分是完整转运,哪部分是解散后转运。
结论本研究构建了两种具有FRET效应的胶束,一种是共同物理包载DiO与DiI的胶束,一种是将FITC化学连接于脂材PEG-PCL、物理包载DiI的胶束。利用FRET SE模式和共定位现象,研究了PEG-PCL胶束跨越MDCK细胞单层的完整性。结果表明,1 h时胶束可基本保持完整并以完整形式从极性上皮细胞基底侧排出再被接收室中的细胞摄取; 4 h时有部分胶束在与细胞单层相互作用的过程中被破坏,以完整形式跨膜的比例有所下降。当然,研究还需要完善,比如设计具有FRET效应的两种荧光物质修饰的脂材制备的胶束以及更多种荧光标记胶束的组合进行跨膜转运研究,可以使结论更加丰富和严谨。
| [1] | Bose T, Latawiec D, Mondal PP, et al. Overview of nanodrugs characteristics for clinical application:the journey from the entry to the exit point[J]. J Nanopart Res , 2014, 16 :2527. DOI:10.1007/s11051-014-2527-7 |
| [2] | Batrakova EV, Li S, Li Y, et al. Distribution kinetics of a micelle-forming block copolymer Pluronic P85[J]. J Control Release , 2004, 100 :389–397. DOI:10.1016/j.jconrel.2004.09.002 |
| [3] | Diezi TA, Bae Y, Kwon GS. Enhanced stability of PEGblock-poly (N-hexyl stearate L-aspartamide) micelles in the presence of serum proteins[J]. Mol Pharm , 2010, 7 :1355–1360. DOI:10.1021/mp100069p |
| [4] | Letchford K, Liggins R, Burt H. Solubilization of hydrophobic drugs by methoxy poly (ethylene glycol)-block-polycaprolactone diblock copolymer micelles:theoretical and experimental data and correlations[J]. J Pharm Sci , 2008, 97 :1179–1190. DOI:10.1002/jps.21037 |
| [5] | Chai GH, Xu YK, Chen SQ, et al. Transport mechanisms of solid lipid nanoparticles across Caco-2 cell monolayers and their related cytotoxicology[J]. ACS Appl Mater Interfaces , 2016, 8 :5929–5940. DOI:10.1021/acsami.6b00821 |
| [6] | Zhang D, Pan XL, Wang S, et al. Multifunctional poly (methyl vinyl ether-co-maleic anhydride)-graft-hydroxypropyl-β-cyclodextrin amphiphilic copolymer as an oral high-performance delivery carrier of tacrolimus[J]. Mol Pharm , 2015, 12 :2337–2351. DOI:10.1021/acs.molpharmaceut.5b00010 |
| [7] | Mathot F, van Beijsterveldt L, Préat V, et al. Intestinal uptake and biodistribution of novel polymeric micelles after oral administration[J]. J Control Release , 2006, 111 :47–55. DOI:10.1016/j.jconrel.2005.11.012 |
| [8] | Chen H, Kim S, Li L, et al. Release of hydrophobic molecules from polymer micelles into cell membranes revealed by Förster resonance energy transfer imaging[J]. Proc Natl Acad Sci USA , 2008, 105 :6596–6601. DOI:10.1073/pnas.0707046105 |
| [9] | Liu JB, Zeng FQ, Allen C. In vivo fate of unimers and micelles of a poly (ethylene glycol)-block-poly (caprolactone) copolymer in mice following intravenous administration[J]. Eur J Pharm Biopharm , 2007, 65 :309–319. DOI:10.1016/j.ejpb.2006.11.010 |
| [10] | Yu C, He B, Zhang H, et al. Transcellular process of coumarin 6 loaded PEG-PCL micelles on MDCK epithelial cells[J]. Acta Pharm Sin (药学学报) , 2013, 48 :1484–1490. |
| [11] | Yu C, He B, Xiong MH, et al. The effect of hydrophilic and hydrophobic structure of amphiphilic polymeric micelles on their transport in epithelial MDCK cells[J]. Biomaterials , 2013, 34 :6284–6298. DOI:10.1016/j.biomaterials.2013.05.006 |
| [12] | Deng FY, Yu C, Zhang H, et al. The effect of hydrophilic and hydrophobic structure of amphiphilic polymeric micelles on their transportation in rats[J]. Curr Drug Deliv , 2016, 13 :105–110. DOI:10.2174/1567201812666150722122657 |
| [13] | Ha T, Enderle T, Ogletree DF, et al. Probing the interaction between two single molecules:fluorescence resonance energy transfer between a single donor and a single acceptor[J]. Proc Natl Acad Sci USA , 1996, 93 :6264–6268. DOI:10.1073/pnas.93.13.6264 |
| [14] | Algar WR, Kim H, Medintz IL, et al. Emerging non-traditional Förster resonance energy transfer configurations with semiconductor quantum dots:investigations and applications[J]. Coord Chem Rev , 2014, 263-264 :65–85. DOI:10.1016/j.ccr.2013.07.015 |
| [15] | Kedia N, Bagchi S. Time resolved FRET measurement in various heterogeneous media using merocyanine dye as a donor[J]. Spectrochim Acta A , 2015, 145 :467–472. DOI:10.1016/j.saa.2015.03.075 |
| [16] | Savić R, Azzam T, Eisenberg A, et al. Assessment of the integrity of poly (caprolactone)-b-poly (ethylene oxide) micelles under biological conditions:a fluorogenic-based approach[J]. Langmuir , 2006, 22 :3570–3578. DOI:10.1021/la0531998 |
| [17] | Zou T, Dembele F, Beugnet A, et al. Nanobody-functionalized PEG-b-PCL polymersomes and their targeting study[J]. J Biotechnol , 2015, 214 :147–155. DOI:10.1016/j.jbiotec.2015.09.034 |
| [18] | Luo LB, Tam J, Maysinger D, et al. Cellular internalization of poly (ethylene oxide)-b-poly (ε-caprolactone) diblock copolymer micelles[J]. Bioconjug Chem , 2002, 13 :1259–1265. DOI:10.1021/bc025524y |
| [19] | Wang CH, Qiao L, Zhang Q, et al. Enhanced cell uptake of superparamagnetic iron oxide nanoparticles through direct chemisorption of FITC-Tat-PEG600-b-poly (glycerol monoacrylate)[J]. Int J pharm , 2012, 430 :372–380. DOI:10.1016/j.ijpharm.2012.04.035 |
| [20] | Chen HT, Kim S, He W, et al. Fast release of lipophilic agents from circulating PEG-PDLLA micelles revealed by in vivo Förster resonance energy transfer imaging[J]. Langmuir , 2008, 24 :5213–5217. DOI:10.1021/la703570m |
| [21] | Letchford K, Burt HM. Copolymer micelles and nanospheres with different in vitro stability demonstrate similar paclitaxel pharmacokinetics[J]. Mol Pharm , 2012, 9 :248–260. DOI:10.1021/mp2002939 |
 2016, Vol. 51
2016, Vol. 51



