2. 厦门大学生物医学工程研究中心, 福建 厦门 361005
2. Research Center of Biomedical Engineering of Xiamen University, Xiamen 361005, China
随着纳米制剂的研究不断深入,近年来,形状对纳米粒功能的影响已经引起重视,并且在药物传递领域的应用也取得了很大进展[1],具有精确形状的聚合物粒子已经被广泛应用到各个方面。尤其是在设计新型载药系统时,非球形聚合物粒子在药物释放、体内传输、循环、靶向能力、被巨噬细胞内吞的速率以及细胞膜上的黏附作用等多方面都比相应的球形粒子表现出更加明显的优越性[2, 3],所以探索非球形聚合物粒子的自组装方法具有重要的意义。
羟基喜树碱 (hydroxy camptothecin,HCPT) 是喜树碱的衍生物,它通过抑制拓扑异构酶Ⅰ来达到抑制肿瘤细胞的增殖目的。但其不溶于水、难溶于脂、内酯环结构不稳定和毒副作用较大等特性,在临床应用中受到了限制[4]。
单甲氧基聚乙二醇 [methoxyl poly(ethylene glycol),MePEG] 是一种性质优良的生物材料,在人体内降解时,降解产物可参与新陈代谢,并最终形成二氧化碳和水,不会在体内聚集。因此,其生物相容性好、无免疫原性和安全性高[5]。聚乳酸聚乙醇酸 [poly(lactic-co-glycolic acid),PLGA] 的亲水性强、无毒、无免疫反应、柔韧性好和抗蛋白吸附性能强,并且具有良好的生物相容性和生物降解性,常被用作表面修饰材料,用来提高载药体系在体内的存留时间,从而达到长效缓释作用[6]。有研究表明,采用单甲氧基聚乙二醇-聚乳酸聚乙醇酸 (MePEG-PLGA) 这种两亲性嵌段聚合物作为载体,在制备载药体系的过程中可达到减少乳化剂用量的作用[7]。
SPG膜 (Shirasu porous glass membrane,SPG) 是一种多孔玻璃膜,可用作膜乳化法中的微孔膜。用SPG膜乳化法制备的乳液具有操作简单、液滴大小易于控制和乳液单分散性好等特点,此方法常被用于单分散微球或微粒的制备[8]。曾有学者借助模板的粒子组装法制备了聚合物球链,制备出异形纳米粒[9]。
本课题组以两亲性聚合物MePEG-PLGA为载体,以HCPT为模型药物,采用SPG模板技术,制备了载HCPT的彗星状双嵌段共聚物粒子 (MePEG-PLGA- HCPT),并曾进行过初步的研究报道[10]。本文对此制剂进行了优化制备和性能考察,并对肝癌细胞生物学效应进行初步评价。
材料与方法材料 HCPT (纯度≥99%,湖北李时珍医药集团); MePEG-PLGA (PEG:5000D,济南岱罡生物科技有限公司); SPG膜 (日本SPG Technology公司); N,N-二甲基甲酰胺 (DMF)、醋酸铵 (分析纯) (国药集团化学试剂有限公司); 丙酮(分析纯,汕头市达濠精细化学品公司); 二甲基亚砜 (DMSO) (分析纯,广东省汕头市西陇化工厂); RPMI-1640培养基、胰蛋白酶、胎牛血清 (美国Gibco公司); 3-(4,5-二甲基噻唑- 2)-2,5-二苯基四氮唑溴盐 (MTT,美国Sigma公司); 人肝癌细胞株BEL-7402 (源自中国科学院上海药物研究所,由厦门大学生物医学工程研究中心冻存); 其他试剂均为分析纯。
仪器 高效液相色谱仪 (2996-2695,美国Waters公司); 紫外分光光度计 (DU800,美国Beckman公司); 粉末-X’pert PRO X射线衍射仪 (荷兰PANalytical公司); 差示扫描量热仪 (DSC-204,德国Netzsch公司); 透射电子显微镜 (JEM-2100,日本JEOL公司); 激光粒度zeta电位分析仪 (Nano-zs,美国Malvern公司); 场发射扫描电子显微镜 (LEO-1530,德国LEO公司); 恒温振荡培养箱 (HZP-150,上海精宏实验设备有限公司); 酶标仪 (BIO-RAD680,美国伯乐公司)。
高效液相色谱法 (HPLC) 测定HCPT
色谱条件[11] 分析柱RP-C18 (Symmetry,250 mm × 4.6 mm,5 μm); C18预柱 (10 mm × 4.6 mm,5 μm); 流动相0.075 mol·L-1醋酸铵 (冰醋酸调pH至6.4)∶乙腈 (72∶28,v/v); 进样量50 μL; 流速0.8 mL·min-1; 紫外检测波长380 nm; 温度30 ℃。
标准曲线 精确称取HCPT标准品10 mg,置于100 mL棕色量瓶中,加DMF稀释并定容至刻度得100 μg·mL-1母液。再将母液用DMF稀释得到1、3、5、7、9、11、13和15 μg·mL-1系列浓度 HCPT标准溶液,在380 nm波长处测定各个浓度的紫外吸收值,以峰面积 (Y) 为纵坐标、HCPT浓度 (X) 为横坐标进行线性回归。
精密度 取1、5和15 μg·mL-1标准溶液,每个平行测定6次,考察方法的精密度。
稳定性 取1、5和15 μg·mL-1标准溶液避光保存,分别于0、2、4、6、12和24 h进行测定,考察溶液的稳定性。
回收率实验 精密称取HCPT标准品适量,加入MePEG-PLGA,并用DMF溶解,配制成质量浓度为1、5和15 μg·mL-1溶液,测定HCPT的浓度,计算回收率。
彗星状MePEG-PLGA-HCPT共聚物粒子的制备 将一定量HCPT在60 ℃溶解于80 mL丙酮中,一定量MePEG-PLGA溶解于20 mL丙酮中,待溶液温度降为室温,将两溶液充分混合后注入膜乳化器的分散相进料口中,将超纯水注入膜乳化器的连续相,采用SPG膜为模板,在一定的纯氮气压力下使 分散相溶液迅速进入连续相,得到MePEG-PLGA- HCPT混悬液,将上述混悬液真空旋蒸,去除丙酮和大量水分后超声5×5 s (50 W),用1 μm超滤膜超滤以去除未被包裹的药物,再将所得混悬液置于冷冻干燥机中真空冻干24 h,即得到MePEG-PLGA-HCPT粉末。
优化制备的正交设计 根据预实验,以载药量、收率和zeta电位为考察指标,以药物与载体投料质量比 (A)、氮气压力 (B) 与SPG膜孔径 (C) 3个因素的3个水平进行正交设计,采用L9(33) 见表 1。
| Table 1 Factor-level in orthogonal-design experiments of L9(33). A: Ratio of HCPT to MePEG-PLGA; B: Nitrogen pressure; C: SPG membrane pore size. HCPT: Hydroxy camptothecin; MePEG: Methoxyl poly(ethylene glycol); PLGA: Poly(lactic-co-glycolic acid); SPG: Shirasu porous glass membrane |
形态观察 将彗星状载药粒子分散于适量的去离子水中,然后将分散液滴在干净的硅片上,室温下自然干燥后,真空条件下喷金15 s,制得扫描电镜 (SEM) 样品; 将分散液滴在300目的铜网上,室温下自然干燥后制得透射电镜 (TEM) 样品。
粒径及zeta电位的测定 将彗星状载药粒子分散在去离子水中,适当超声后将其置于检测皿中进行粒度分析及zeta电位测定。每个样品重复测试3次。
载药量及收率的测定 精确称取100 mg彗星状载药粒子粉末,依HPLC法进行HCPT含量测定。按下列公式计算: 载药量 (%) = (载药微粒中药物的质量/载药微粒的质量) × 100%; 收率 (%) = (实际载药量/理论载药量) × 100%。
HCPT在粒子中的状态
X-射线衍射分析 (XRD) 分别将彗星状MePEG- PLGA-HCPT共聚物粒子、HCPT、空白MePEG-PLGA及HCPT和空白MePEG-PLGA的物理混合物 (混合物摩尔比按载药粒子的载药量取相应值) 进行XRD。电流: 30 mA,电压: 40 kV,扫描范围: 2θ = 5°~60°,扫描步长: 0.016°/步,每步时间: 10 s/步,靶: 铜靶,单色器: 石墨单色器。
差示扫描量热分析 (DSC) 同上取样品5~10 mg置于铝盘内并密封,升温速率10 ℃·min-1,于氮气 (40 mL·min-1) 保护下测定样品的热性能,考察HCPT在载药粒子中的物理状态。
体外释药实验 制备不同载药量粒子 (载药量: 46.2%、21.7% 和11.4%),精确称取这些彗星状载药粒子粉末并装入透析袋内 (截留分子量3 500),加入少量0.1 mol·L-1磷酸盐缓冲液 (PBS,pH 7.4),扎紧后将其置于100 mL PBS中,在 (37 ± 0.5) ℃、100 r·min-1条件下恒温振荡,定时取样,并立即补加相同量的 释药介质。样品用水系0.2 μm针式过滤器过滤后用HPLC测定其在380 nm处吸收度,根据标准曲线得到HCPT的浓度,计算累积释放量。
细胞培养 将人肝癌细胞系BEL-7402接种于含10% 小牛血清及青霉素、链霉素各含100 u·mL-1的RPMI-1640培养基中,置于37 ℃含5% CO2培养箱中培养。取对数生长期细胞,0.25% 胰蛋白酶溶液消化后,培养基稀释,按1∶2传代培养备用。
细胞毒性测定 调整上述细胞悬液浓度,在96孔平底板上每孔加入100 μL,铺板使待测细胞数至 1 000~10 000个/孔,孵育至细胞单层铺满孔底,加入含浓度梯度为10、5、2.5、1.25和0.625 μmol·L-1 HCPT、MePEG-PLGA和MePEG-PLGA-HCPT混悬液各100 μL,设5个复孔。培养48 h后,每孔加入 5 mg·mL-1 MTT溶液20 μL,即0.5% MTT,继续培 养4 h后每孔再加入DMSO 150 μL,置摇床上低速 振荡10 min,使结晶物充分溶解。采用酶联免疫检测仪在570 nm波长下测定各孔的吸收度 (A)。计算细胞生长抑制率:
| $抑制率({\rm{\% }}){\rm{ = }}\left( {1 - \frac{{{A_{实验组}}}}{{{A_{对照组}}}}} \right) \times 100{\rm{\% }}$ |
在色谱条件下,HCPT标准曲线回归方程为Y = 0.068 9 X + 0.009 1,R2 = 0.999 9 (Y为峰面积,X为HCPT浓度,R2为线性相关系数)。线性范围: 1~15 μg·mL-1。精密度实验平均RSD为1.45%; 稳定性实验平均RSD 2.44%; 测得平均回收率为98.6%,RSD为2.32% (n = 6)。结果表明,所建HPLC方法用于测定HCPT准 确、可靠。
2 正交试验结果3因素正交设计试验结果见表 2~4。直观分析表明,3因素中HCPT与MePEG-PLGA的投料比和氮气压力对载药粒子的载药量和收率影响较大,SPG膜孔径的影响较小,即各影响大小依次为: B > A > C,其中B对收率的影响因素最为显著,而3种因素对zeta电位的影响均较小。所以选择载药量和收率进行综合评分。由试验结果得知,当氮气压力为50 kPa时,载药量和收率明显减少,这是由于此时的氮气压力不足以使分散相中的线性HCPT完全进入连续相,大 部分药物被SPG膜所阻挡,附着在膜表面或孔道中,未能进入连续相。经综合分析,优化后的最佳条件为A2B2C3,即HCPT与MePEG-PLGA的质量比为1∶1,氮气压力为100 kPa,SPG膜孔径为1.1 μm。以优化条件制得的粒子载药量为46.2%,收率达到96.4%,zeta电位-31.4 mV。
| Table 2 Results of orthogonal-design experiments L9(33) |
| Table 3 The drug loading efficiency in different experimental conditions |
| Table 4 The encapsulation efficiency in different experimental conditions |
图 1是载药粒子的SEM形貌图,图中所示粒子呈头部螺旋成束,尾部散开的彗星状,长度为10~15 μm,局部放大图显示彗星状粒子的头部呈螺旋结构,直径为400~1 500 nm,尾部是由宽度为80~200 nm的纳米束组成[10],且分散性、均一性良好。以彗星图 (图 2a) 为参照可见,粒子形状像彗星[10],图 2b为载药粒子的TEM图。采用粒度分析仪测定载药粒子的平均粒径为119.3 nm,多分散系数为0.096,zeta电位为-31.4 mV,见图 3。

|
Figure 1 Scanning electron microscopy (SEM) micrographs of comet-shaped particles with preparation membrane pore size of (a-c) 400 nm,(d,e ) 600 nm,and (f-i) 1.1 μm. (b) and (c) are higher magnification SEM image of (a). (e),(g),and (i) are higher magnification SEM image of (d),(f),and (h),respectively. Scale bars are 5 μm (a),700 nm (b),500 nm (c),4 μm (d),200 nm (e),4 μm (f),1 μm (g),5 μm (h),and 500 nm (i) |

|
Figure 2 The comet image (a) and the transmission electron microscopy (TEM,b) image of comet-shaped MePEG-PLGA- HCPT particles |

|
Figure 3 Dynamic light scattering (DLS) analyze of the MePEG-PLGA-HCPT comet-shaped particles |
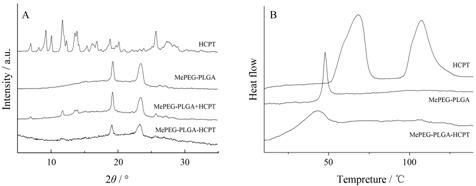
彗星状MePEG-PLGA-HCPT共聚物粒子的XRD图如图 4A所示。HCPT在5° < 2θ < 35°内呈许多强结晶衍射峰,表明HCPT主要以结晶型存在。MePEG- PLGA在2θ为19.206°、23.422°有聚乙二醇单甲醚 的特征峰,彗星状粒子的衍射图与MePEG-PLGA、MePEG-PLGA和HCPT物理混合物 (1∶1,摩尔比) 的相似,兼具二者的特征峰; MePEG-PLGA与HCPT物理混合物中HCPT的特征峰有所减弱; 彗星状粒 子的HCPT特征峰明显消失。结果表明,在所得的 载药粒子中MePEG-PLGA不是单纯与HCPT混合,也不是单纯的包裹HCPT晶体骨架,而是在MePEG- PLGA与HCPT混合时,两种物质分子相互碰撞将HCPT分散成无定形态,形成掺杂MePEG-PLGA的 HCPT骨架后,MePEG-PLGA再将HCPT骨架包裹 而成。DSC谱图见图 4B。HCPT的谱图在60 ℃和130 ℃有2个尖锐的吸热峰,MePEG-PLGA的谱图 只有1个峰,此峰反映的是纳米粒的玻璃化转变温度 (Tg) 50 ℃,而彗星状粒子的谱图中只出现了MePEG- PLGA吸热峰,且有一定的偏移,说明HCPT是以无定形状态分布于载药粒子中。此结果与XRD实验结果相吻合。
|
Figure 4 The X-ray diffraction (XRD) patterns (A) and differential scanning calorimetry (DSC) thermograms (B) of different particles |
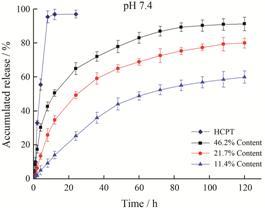
3种载药粒子的释药曲线有所不同,如图 5所示,与HCPT纯药相比,三者均具有缓释效果,在120 h内能缓慢持续释放。载药量越大的粒子,药物释放越快,在释药的最初12 h内,载药量为46.2% 的粒子己释放近50%; 载药量为21.7% 的粒子释放34.7%; 而载药量为11.4% 的粒子释放仅13.9%。载药量越大,粒子内药物的浓度越高,聚合物外壳内外药物的浓度差较大,表现在药物的初始释放速率较快,因此含药量高的载药粒子表现为持续而快速的释药。另外,载药粒子中的高载药量能提高释药过程中药物扩散的势能 (药物的浓度梯度)。因此,药物含量高,释药速度快。
|
Figure 5 Invitro release profiles of comet-shaped MePEG- PLGA-HCPT particles at different drug loading content |
为了较好地评价彗星状MePEG-PLGA-HCPT共聚物粒子对肿瘤细胞的毒性作用,按照曾用过的方法[12]制备不同浓度球形载药纳米粒 (MePEG-PLGA- HCPT-NPs),并与不同浓度彗星状载药粒子、HCPT纯药和空白粒子 (MePEG-PLGA) 对人肝癌细胞BEL- 7402的影响进行比较,见图 6。结果显示,给药组对肝癌细胞均有一定程度的毒性作用,与MePEG-PLGA相比有明显的杀伤作用。其中两种载药粒子组较纯药组杀伤性稍强,彗星状载药粒子组相对于球形载药粒子组杀伤性更强,且其对细胞的抑制率与药物浓度呈明显依赖关系。

|
Figure 6 Invitro cytotoxicity assay of different particles on human liver BEL-7402 cells (48 h). n = 3,x± s |
彗星状载药粒子的头部直径与制备时所用的SPG膜孔径呈正相关性,即膜孔径越大,粒子的头部直径越大。此外发现,在彗星状载药粒子自组装过程中,部分粒子的头部有捆绑现象 (图 1h,i),这可能是由于在氮气压力下,混悬液从分散相射入连续相过程中,经过孔道交错的SPG膜挤压自组装而成。而且研究中发现粒子尾部的分散幅度与制备时氮气压力有关,随着制备时氮气压力的增大,粒子尾部的分散幅度减小。这是因为压力越大分散相的溶液射入到连续相的速度越快,通过膜孔道时受到挤压也越大,从而粒子在一端螺旋聚集的同时,另一端射入到连续相的幅度也越小。这种调节彗星状粒子尾部分散幅度大小的方法,可能会成为调节进入细胞快慢的方法之一。
彗星状载药粒子在液体状态下呈伞型状,其柄部可能被尾部的多个纳米束罩着,使得粒度仪测定的结果是每束的粒径平均大小,而并不是整个彗星状粒子的大小,显示为纳米级。而扫描电镜是样品干燥状态下测定整个彗星状粒子的大小,故显示微米级的结果。但扫描电镜中显示的粒子尾部单个纳米束的宽度在200 nm内,与粒度仪所检测到的平均粒径基本吻合。
体外释药实验表明,彗星状载药粒子具有药物缓释的优点,且药物释放的速度随着载药量的增加而增大。但体外释药曲线仅表示该粒子具有一定的缓释效果,其体内释药情况有待于进一步研究。初步的释药实验研究显示高载药量的粒子缓释效果较差,在未来的制剂开发研究中可能需要优化选择载药量,以达到理想的缓释效果和抗肿瘤作用。
有研究表明,细胞在接触非球形粒子时,若接触到粒子的细小尖端,可能将其通道打开,进行有效的降解和吞噬[13]。猜测彗星状载药粒子的尺寸与人体细胞为同一数量级,并具有纳米束这一微观结构,当细胞接触到纳米束的尖端时,会误以为是小颗粒物体而对其吞噬,使得彗星状载药粒子相对于球形载药粒子更具杀死细胞的趋势。所以,这种形貌的载药粒子相对于球形载药粒子对细胞的生长和增殖抑制作用可能更强。但两者没有显著性差异,说明在相同药物剂量下,二者的药效学可能相近,还需要对抗肿瘤作用进一步深入研究。预期作为异形粒子静脉给药时,抗肿瘤靶向效果可能更好,在肿瘤部位的药物浓度更高,抗肿瘤的效果更好[10, 13]。
本研究制备了高载药量、具有一定缓释功效的彗星状MePEG-PLGA-HCPT双嵌段共聚物粒子,其载药量远高于球形粒子[14, 15],为HCPT提供一种新型缓释制剂的可能。后续将进一步探索该制剂的药代动力学和药效学等,为未来的开发应用提供理论依据。
| [1] | Sacanna S, Pine DJ. Shape-anisotropic colloids:building blocks for complex assemblies[J]. Curr Opin Colloid Interf Sci , 2011, 16 :96–105. DOI:10.1016/j.cocis.2011.01.003 |
| [2] | Li HF, Zhang BM, Guo XL. Preparation of micro-/nanononspherical polymer particles[J]. Prog Chem (化学进展) , 2011, 23 :1196–1210. |
| [3] | Jordan C, Shuvaev VV, Bailey M, et al. The role of carrier geometry in overcoming biological barriers to drug delivery[J]. Curr Pharm Design , 2016, 22 :1259–1273. DOI:10.2174/1381612822666151216151856 |
| [4] | Qin LZ, Zhang X, Wu LN, et al. Preparation and in vitro embolic efficiency evaluation of hydroxycamptothecine-loaded liquid embolic agent[J]. Acta Pharm Sin (药学学报) , 2014, 49 :1069–1075. |
| [5] | Pasut G, Veronese FM. PEG conjugates in clinical development or use as anticancer agents:an overview[J]. Adv Drug Deliv Rev , 2009, 61 :1177–1188. DOI:10.1016/j.addr.2009.02.010 |
| [6] | Anand P, Nair HB, Sung B, et al. Design of curcumin-loaded PLGA nanoparticles formulation with enhanced cellular uptake,and increased bioactivity in vitro and superior bioavailability in vivo[J]. Biochem Pharmacol , 2010, 79 :330–338. DOI:10.1016/j.bcp.2009.09.003 |
| [7] | Farokhzad OC, Langer R. Impact of nanotechnology on drug delivery[J]. ACS Nano , 2009, 3 :16–20. DOI:10.1021/nn900002m |
| [8] | Liu R, Ma GH, Meng FT, et al. Preparation of uniform-sized PLA microcapsules by combining Shirasu porous glass membrane emulsification technique and multiple emulsionsolvent evaporation method[J]. J Control Release , 2005, 103 :31–43. DOI:10.1016/j.jconrel.2004.11.025 |
| [9] | Sung KE, Vanapalli SA, Mukhija D, et al. Programmable fluidic production of microparticles with configurable anisotropy[J]. J Am Chem Soc , 2008, 130 :1335–1340. DOI:10.1021/ja0762700 |
| [10] | Yang XR, Wu SC, Li Y, et al. Integration of an anti-tumor drug into nanocrystalline assemblies for sustained drug release[J]. Chem Sci , 2015, 6 :1650–1654. DOI:10.1039/C4SC03392B |
| [11] | Yang L, Cui FD, Cun DM, et al. Preparation,characterization and biodistribution of the lactone form of 10-hydroxycamptothecin (HCPT)-loaded bovine serum albumin (BSA) nanoparticles[J]. Int J Pharm , 2007, 340 :163–172. DOI:10.1016/j.ijpharm.2007.03.028 |
| [12] | Luo Y, Li L, Wang YG, et al. Preparation and characteristic of hydroxycamptothecin-loaded PLA nanoparticles using dialysis method[J]. J Xiamen Univ (Natural Sci)(厦门大学学报(自然科学版)) , 2010, 49 :832–837. |
| [13] | Gratton SEA, Ropp PA, Pohlhaus PD, et al. The effect of particle design on cellular internalization pathways[J]. Proc Nat Acad Sci USA , 2008, 105 :11613–11618. DOI:10.1073/pnas.0801763105 |
| [14] | Zhang XJ, Ke LM, Yang J, et al. Preparation and characterization of poly (lactic-co-glycolic acid) microspheres containing 10-hydroxycamptothecin[J]. BME Clin Med (生物医学工程与临床) , 2012, 16 :114–117. |
| [15] | Liu ZJ, Li XC, Zhao MF, et al. Preparation and in vitro evaluation of nanoparticles loaded with 10-hydroxycamptothecin[J]. Chin J Hosp Pharm (中国医院药学杂志) , 2015, 35 :1910–1914. |
 2016, Vol. 51
2016, Vol. 51


