2. 天津药物研究院新药评价中心, 释药技术与药代动力学国家重点实验室, 天津 300193
2. Tianjin Center for New Drug Evaluation and Research, State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
中药延胡索为罂粟科紫堇属植物延胡索 (Corydalis yanhusuo W.T.Wang) 的干燥块茎。味辛、苦,有活血化瘀、行气、止痛的功效,用于胸胁、脘腹疼痛、胸痹心痛、经闭痛经、产后瘀阻、跌扑肿痛。现代药理研究表明延胡索具有显著的镇痛、镇静和催眠作用,在中枢神经系统、消化系统、心血管系统以及垂体肾上腺皮质系统等方面有广泛的药理活性,在临床上应用十分广泛。生物碱类化合物是延胡素的主要化学成分,如延胡索乙素、原阿片碱等,具有一系列药理活性[1, 2]。
近年来,液质联用技术已广泛应用于中药及复方多成分的鉴定[3, 4],四级杆飞行时间质谱仪是高分辨串联质谱,具有灵敏度高、选择性高、测定化合物质荷比精确、离子扫描范围宽等特点。高效液相色谱与飞行时间质谱联用 (HPLC-QTOF/MS) 分辨能力强,可在全扫描模式下保证微量成分不被遗失,从而获得大量有效的化合物结构鉴定信息,是一种快速有效的化合物鉴定方法。
G蛋白偶联受体 (G protein-coupled receptor,GPCR) 是一大类膜蛋白受体的统称,含有7个α螺旋跨膜区段,是迄今发现的最大的受体超家族。GPCR在生物体中普遍存在,广泛地参与了人生理系统的各个调节过程,对很多疾病起到关键的作用,是人体内数量最多的细胞表面受体家族[5]。大多数GPCR可以与多种信息物质如神经递质、多肽和离子等结合并被激活,激活的GPCR可以通过G蛋白依赖性和非依赖性两种途径传导信号来调节神经、心血管、免疫等多个系统的功能[6, 7]。目前市场上应用的治疗药物,25%~50% 都是通过GPCR介导的信号途径发挥药理作用,是非常重要的药物治疗靶点[8, 9]。
为明确延胡索药材活性成分并阐释其物质基础及作用机制,本研究利用HPLC-QTOF/MS对延胡索药材的化学成分进行系统分析鉴定,并选取与镇痛、镇静、理气、活血化瘀等密切相关的6个G蛋白偶联受体,即5-羟色胺受体 (5-hydroxytryptamine 1A receptor,5-HT1A)、μ阿片受体 (μ opioid receptor,OPRM1)、β2肾上腺素受体 (β2 adrenergic receptor,ADRB2)、 多巴胺受体 (dopamine receptor,D2)、乙酰胆碱受体 (acetylcholine receptor,M2) 和血栓素-前列腺素受体 (thromboxane-prostaglandin receptor,TP) 为研究对象,采用胞内钙离子荧光技术检测法,探究了延胡索提取物、原阿片碱、巴马汀和延胡索乙素对6个受体的激动和拮抗作用,从而在功能受体层面初步揭示延胡索的药效作用机制及物质基础。
材料与方法仪器与试剂 Agilent 1260高效液相色谱仪 (美国Agilent公司),micrOTOF-QⅡ质谱仪 (德国Bruker公司),AB204-N电子天平 (德国Mettler公司)。FLIPR® Calcium 4 assay kit (美国Molecular Devices公司),多巴胺 (dopamine)、奋乃静 (perphenazine)、5-羟色胺 (5-HT)、DAMGO ([D-Ala2,N-Me-Phe4,Gly5-ol]- enkephalin)、异丙肾上腺素 (isoproterenol)、卡巴胆碱 (carbachol)、AF-DX-384、U-46619、DMSO购自美国Sigma公司,L-670596购自英国Tocris公司,延胡索乙素、(去氢) 延胡索甲素、D-四氢药根碱、四氢小檗碱、原阿片碱、黄连碱、荷包牡丹碱、别隐品碱、药根碱、小檗碱、巴马汀等对照品购于成都曼斯特生物科技有限公司 (纯度≥98%)。
试药 本实验所用延胡索药材 (醋制) 由甘肃陇神戎发制药有限公司提供,经天津药物研究院张铁军研究员鉴定为延胡索 (Corydalis yanhusuo W. T. Wang) 的干燥块茎,标本现存于天津药物研究院中药质量控制技术工程实验室。
HPLC-QTOF/MS样品制备及分析测定
样品制备 精密称定醋制延胡索5.135 9 g,置于100 mL圆底烧瓶中,精密加入60%乙醇50 mL,精密称定,加热回流3 h,冷却至室温,用60%乙醇补足减失的重量,摇匀滤过,即得延胡索药材溶液。
色谱条件 色谱柱为Ultimate C18 (4.6 mm × 250 mm,5 μm)。流动相: 乙腈 (A),0.4‰乙酸铵溶液 (冰醋酸调pH 5.0,B)。梯度洗脱程序: 0~40 min,10%~25% A; 40~45 min,25% A; 45~80 min,25%~80% A; 80~85 min,80%~100% A。流速为1.0 mL·min-1,柱温30 ℃,样品室温度25 ℃,进样量10 μL。
质谱条件 实验采用正、负两种模式测定,参数如下: 采用电喷雾 (ESI) 离子源; V模式; 毛细管电压正模式3.0 kV,负模式2.5 kV; 锥孔电压30 V; 离子源温度110 ℃; 脱溶剂气温度350 ℃; 脱溶剂氮气流量600 L·h-1; 锥孔气流量50 L·h-1; 检测器电压正模式1.9 kV,负模式2 kV; 采样频率0.1 s,间隔0.02 s; 质量数检测范围50~1 500 Da; 柱后分流,分流比为1∶5; 内参校准液采用甲酸钠溶液。
GPCR分析的样品制备及检测
样品制备 称取醋制延胡索药材100 g,加入3倍量60%乙醇,浸泡24 h后,加热回流提取3 h,提取液滤过,药渣加入2倍量60%乙醇加热回流2 h,滤过、合并提取液,减压回收至稠膏,得延胡索提取物13.39 g。精确称取原阿片碱、巴马汀、延胡索乙素和延胡索提取物并溶解于适量DMSO中,配制成 5倍于实验用检测浓度的储存液,置于-20 ℃备用。检测时用Hank’s平衡盐溶液 (HBSS缓冲液,含20 mmol·L-1 HEPES) 进行稀释,使得原阿片碱、巴马汀、延胡索乙素的最终给药高浓度为100 μmol·L-1,低浓度为10 μmol·L-1,延胡索提取物最终给药高质量浓度为600 μg·mL-1,低质量浓度为60 μg·mL-1。本研究中DMSO浓度均未超过0.5%。
细胞培养 稳定表达6种GPCR受体的CHO-K1和HEK293细胞分别培养于含10%胎牛血清Ham’s F12和10%胎牛血清DMEM的10 cm培养皿中,在37 ℃、5% CO2培养箱中培养,当细胞汇合度达到80%~85%时,进行消化处理,将收集到的细胞悬液,以每孔15 000的密度接种到384微孔板,然后放入37 ℃、5% CO2培养箱中继续过夜培养后用于实验。
激动剂检测 首先配制染料工作液 (参照Molecular Devices公司产品说明书操作),然后将培养过夜的细胞取出,每孔加入染料20 μL后将细胞板放到37 ℃、5% CO2培养箱孵育1 h,最后于室温平衡15 min。检测时,将细胞板、待测化合物板放入FLIPR内指定位置,由仪器自动加入5×检测 浓度的阳性激动剂 (5-HT、DAMGO和异丙肾上腺素) 及待测化合物10 μL检测相对荧光强度 (relative fluorescene unit,RFU) 值。
抑制剂检测 首先配制染料工作液,然后向培养过夜的细胞中每孔加入染料20 μL,给药组和阳性对照组分别加入待测化合物溶液和阳性抑制剂溶液 (奋乃静、AF-DX-384和L-670596) 10 μL,将细胞板放到37 ℃、5% CO2培养箱孵育1 h,最后于室温平衡15 min。检测时,将细胞板、阳性激动剂板放入FLIPR内制定位置,由仪器自动加入5×EC80浓度的阳性激动剂 (多巴胺、卡巴胆碱和U-46619) 12.5 μL检测RFU值。
数据分析 数据采集和分析使用Excel和GraphPad Prism 6软件程序。对于每个检测孔而言,以1~20 s的平均荧光强度值作为基线,21~120 s的最大荧光强度值减去基线值即为ΔRFU,根据该数值并依据公式1和2可计算出激活或抑制百分比。
| $\begin{array}{l} {\rm{激活率}}\left( \% \right) = \left( {\Delta {\rm{RF}}{{\rm{U}}_{{\rm{Compound}}}} - \Delta {\rm{RF}}{{\rm{U}}_{{\rm{Background}}}}} \right)/\\ \left( {\Delta {\rm{RF}}{{\rm{U}}_{{\rm{AgonistcontrolatEC100}}}} - \Delta {\rm{RF}}{{\rm{U}}_{{\rm{Background}}}}} \right) \times 100\% \end{array}$ | (1) |
| $\begin{array}{l} {\rm{抑制率}}\left( \% \right) = \left[ 1 \right. - \left( {\Delta {\rm{RF}}{{\rm{U}}_{{\rm{Compound}}}} - \Delta {\rm{RF}}{{\rm{U}}_{{\rm{Background}}}}} \right)/\\ \left. {\left( {\Delta {\rm{RF}}{{\rm{U}}_{{\rm{AgonistcontrolatEC80}}}} - \Delta {\rm{RF}}{{\rm{U}}_{{\rm{Background}}}}} \right)} \right] \times 100\% \end{array}$ | (2) |
统计学处理 实验采用GraphPad Prism 6统计软件进行数据分析,多组间比较采用单因素方差分析 (One-Way ANOVA),以P < 0.05为具有统计学意义差异。
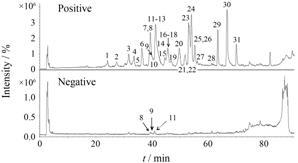
结果 1 延胡索物质基础对延胡索药材进行一级质谱测定后,可以得到物质准分子离子峰 ([M]+、[M+H]+ 或 [M-H]- ) 的相关信息,在此基础上,以准分子离子为母离子在相应的模式下进行二级碎片 (二级质谱) 的测定,根据二级质谱信息,对照品信息以及结合相关文献[10-15]{Shi,2010 #31}的报道,对延胡索化学物质组进行鉴定分析。以24号峰为例,在质谱图中显示其准分子离子峰 为m/z 356 [M+H]+,二级质谱图中获得了m/z 192的 [C11H13O2N]+碎片和m/z 165的 [C10H12O2]+ 碎片,这与RDA裂解反应的C环开环反应是相符的,也是生物碱的特征裂解途径,与文献[10]描述一致。另外,m/z 177处也发现了碎片离子,这是从m/z 192的碎片离子中丢失了一个甲基自由基所形成的离子。故判断其为四氢原小 檗碱型生物碱,与对照品谱图比对发现其与延胡索乙素的质谱图一致,因此24号峰鉴定为延胡索乙素。通过此方法,共得到延胡索药材中的31个色谱峰,鉴定出28个化合物,主要为生物碱类成分。具体鉴定结果参见表 1,色谱图见图 1。
| Table 1 MS/MS data in the positive and negative ESI modes and the identification results of Corydalis Rhizoma extract. aVerification with reference standards |
|
Figure 1 Total ion chromatograms of Corydalis Rhizoma extract in positive and negative ESI mode. Peaks 1-31 are listed in Table 1 |
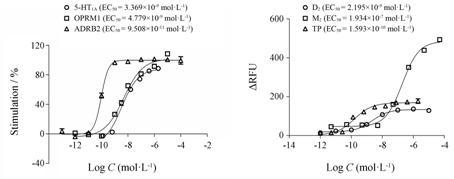
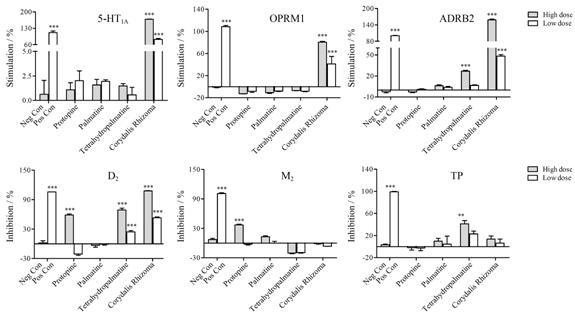
阳性激动剂对6个GPCR受体以及阳性抑制剂 对3个GPCR受体的剂量效应曲线见图 2、图 3。延胡索药材提取物对6个GPCR受体的激动和拮抗作用见图 4。由分析结果可知,与空白对照组比较,延胡索药材提取物给药后对5-HT1A、OPRM1、ADRB2受体有显著的激动作用,并且体现出浓度梯度依赖性,对D2受体产生了显著的抑制作用,但对M2和TP受体没有明显的抑制效果。说明延胡索药材提取物可能是通过与5-HT1A、OPRM1、ADRB2和D2受体结合来调节一系列的下游生物信号转导效应,从而发挥多种生物活性,也体现了其多靶点多途径的作用特点。
|
Figure 2 Dose response tests of 5-HT (agonist of 5-HT1A),DAMGO (agonist of OPRM1),isoproterenol (agonist of ADRB2),dopamine (agonist of D2),carbachol (agonist of M2) on CHO-K1/Ga15 and U46619 (agonist of TP) on 293 cells. RFU: Relative fluorescence unit; 5-HT1A: 5-Hydroxytryptamine 1A receptor; OPRM1: μ opioid receptor; ADRB2: β2 Adrenergic receptor; D2: Dopamine receptor; M2: Acetylcholine receptor; TP: Thromboxane-prostaglandin receptor |

|
Figure 3 Dose response tests of perphenazine (antagonist of D2),AF-DX-384 (antagonist of M2) on CHO-K1/Ga15 and L-670596 (antagonist of TP) on 293 cells |
|
Figure 4 Stimulative and inhibitory effects of Corydalis Rhizoma,protopine,palmatine and tetrahydropalmatine on GPCRs. n = 3,x± s. **P < 0.01,***P < 0.001 vs negative control group (Neg Con) |
延胡索代表性单体成分原阿片碱、巴马汀和延胡索乙素对6个GPCR的作用结果如图 4所示。分析发现,与空白对照组比较,延胡索乙素高剂量组可激动ADRB2,且对D2和TP受体显示出一定的拮抗作用; 原阿片碱高剂量组对D2和M2受体有拮抗作用; 而巴马汀对6个GPCR受体均没有显著的激动和拮抗作用。结果提示,延胡索乙素和原阿片碱可能为延胡索药材的主要药效物质基础。
讨论本实验采用HPLC-QTOF/MS方法,对延胡索药材60%乙醇提物进行了色谱分离及结构鉴定,共获取31个化合物,鉴定出28个生物碱类成分,主要包括原小檗碱型生物碱 (叔胺类: 延胡索甲素、延胡索乙素等; 季铵类: 小檗碱、巴马汀等)、原托品碱型生物碱 (原阿片碱、α-别隐品碱等)、阿朴菲型生物碱 (d-海罂粟碱等) 等,初步明确了延胡索主要成分,为其药材质量控制以及药效物质基础的确立提供了 参考依据。
5-HT1A受体是脑内分布最广的5-HT受体亚型,涉及焦虑、抑郁、致幻行为和饮食障碍等致病机制,是药物治疗的重要靶点[16]。激活中枢的5-HT1A受体可引起血压降低、心跳减慢和运动反应的增加,其激动剂可用于治疗焦虑和抑郁。OPRM1受体主要分布于脑干,被吗啡激活后可产生镇痛作用。外源性阿片类药物可作用于阿片受体,引起膜电位超极化,使神经递质释放减少,从而阻断神经冲动的传递而产生镇痛等各种效应[17]。在中枢神经系统,多巴胺受体的存在与自主运动、进食、情感、认知、注意力、睡眠以及内分泌调整等一系列的重要功能调节密切相关[18]。通过分析实验结果,推测延胡索是通过与5-HT1A、OPRM1、D2受体结合,引发下游生物级联反应,通过调节多种生物途径而发挥中枢镇痛、镇静的药效。同时,原小檗碱型化合物延胡索乙素和原托品碱型化合物原阿片碱对D2受体有拮抗作用,此二类化合物可能是延胡索重要的药效物质基础。
ADRB2受体主要存在于支气管和血管平滑肌,激动后可引起支气管与血管的舒张,是治疗哮喘、心血管疾病的重要靶标之一[19]。乙酰胆碱受体可产生副交感神经兴奋效应,即心脏活动抑制、支气管胃肠平滑肌和膀胱逼尿肌收缩、消化腺分泌增加、瞳孔缩小等。M2受体亚型主要分布于心肌和平滑肌,激动后可引起内脏平滑肌收缩痉挛[20]。TP受体主要在血小板、血管平滑肌细胞、内皮细胞和上皮细胞等多种细胞表达,激活后会强烈诱导血小板聚集,使血管和支气管平滑肌收缩、痉挛,导致血管内广泛微血栓的形成[21]。受体实验结果表明,延胡索发挥行气、活血化瘀功效的作用机制可能是通过激动ADRB2、抑制M2和TP受体。实验发现,单体与药材提取物对M2和TP受体结果不一致,分析可能是由于药材提取物中单体浓度[22] (原阿片碱: 3.80 μmol·L-1、巴马汀: 3.87 μmol·L-1、延胡索乙素: 7.93 μmol·L-1) 过低,未能达到拮抗M2、TP受体的最低有效浓度所致。并且,由于延胡索提取物中化学成分复杂,也可能会存在化合物间的生物拮抗作用,这或许是实验结果不一致的另一原因。另外,巴马汀对6个受体均没有生物活性,可能由于其结构中带正电,导致极性太强,不易与膜受体结合所致。
本研究基本明确了延胡索药材的生物碱类物质基础,初步阐释了延胡索发挥活血化瘀、行气止痛的药效物质基础及作用机制。但对于延胡索非生物碱类成分的分析鉴别以及延胡索更深层次作用机制的研究,仍需后续大量实验探索。
| [1] | He K, Gao JL, Zhao GS. Advances in studies on chemistry,pharmacology,and quality control of Corydalis yanhusuo[J]. Chin Tradit Herb Drugs (中草药) , 2007, 38 :1909–1912. |
| [2] | Xiao HT, Peng J, Liang Y, et al. Acetylcholinesterase inhibitors from Corydalis yanhusuo[J]. Nat Prod Res , 2011, 25 :1418–1422. DOI:10.1080/14786410802496911 |
| [3] | Yan LL, Shi JW, Wang JF, et al. UPLC/Q-TOF-MS E based analysis of chemical composition of Banxia Xiexin decoction[J]. Acta Pharm Sin (药学学报) , 2013, 48 :526–531. |
| [4] | Chen D, Lin S, Xu W, et al. Qualitative and quantitative analysis of the major constituents in shexiang tongxin dropping pill by HPLC-Q-TOF-MS/MS and UPLC-QqQ-MS/MS[J]. Molecules , 2015, 20 :18597–18619. DOI:10.3390/molecules201018597 |
| [5] | Jastrzebska B. GPCR:G protein complexes-the fundamental signaling assembly[J]. Amino Acids , 2013, 45 :1303–1314. DOI:10.1007/s00726-013-1593-y |
| [6] | Capote LA, Mendez Perez R, Lymperopoulos A. GPCR signaling and cardiac function[J]. Eur J Pharmacol , 2015, 763 :143–148. DOI:10.1016/j.ejphar.2015.05.019 |
| [7] | Walker JK, Fisher JT. Editorial overview:Respiratory:GPCR signaling and the lung[J]. Curr Opin Pharmacol , 2014, 16 :iv–vi. DOI:10.1016/j.coph.2014.05.006 |
| [8] | Overington JP, Al-Lazikani B, Hopkins AL. How many drug targets are there?[J]. Nat Rev Drug Discov , 2006, 5 :993–996. DOI:10.1038/nrd2199 |
| [9] | Wootten D, Christopoulos A, Sexton PM. Emerging paradigms in GPCR allostery:implications for drug discovery[J]. Nat Rev Drug Discov , 2013, 12 :630–644. DOI:10.1038/nrd4052 |
| [10] | Ding B, Zhou T, Fan G, et al. Qualitative and quantitative determination of ten alkaloids in traditional Chinese medicine Corydalis yanhusuo W.T.Wang by LC-MS/MS and LC-DAD[J]. J Pharm Biomed Anal , 2007, 45 :219–226. DOI:10.1016/j.jpba.2007.06.009 |
| [11] | Shi J, Zhang X, Ma Z, et al. Characterization of aromatase binding agents from the dichloromethane extract of Corydalis yanhusuo using ultrafiltration and liquid chromatography tandem mass spectrometry[J]. Molecules , 2010, 15 :3556–3566. DOI:10.3390/molecules15053556 |
| [12] | Li QY, Li KT, Sun H, et al. LC-MS/MS determination and pharmacokinetic study of dehydrocorydaline in rat plasma after oral administration of dehydrocorydaline and Corydalis yanhusuo extract[J]. Molecules , 2014, 19 :16312–16326. DOI:10.3390/molecules191016312 |
| [13] | Zhang J, Jin Y, Dong J, et al. Systematic screening and characterization of tertiary and quaternary alkaloids from Corydalis yanhusuo W.T.Wang using ultra-performance liquid chromatography-quadrupole-time-of-flight mass spectrometry[J]. Talanta , 2009, 78 :513–522. DOI:10.1016/j.talanta.2008.12.002 |
| [14] | Wang C, Wang S, Fan G, et al. Screening of antinociceptive components in Corydalis yanhusuo W.T.Wang by comprehensive two-dimensional liquid chromatography/tandem mass spectrometry[J]. Anal Bioanal Chem , 2010, 396 :1731–1740. DOI:10.1007/s00216-009-3409-1 |
| [15] | Tang DQ, Zheng XX, Chen X, et al. Quantitative and qualitative analysis of common peaks in chemical fingerprint of Yuanhu Zhitong tablet by HPLC-DAD-MS/MS[J]. J Pharm Anal , 2014, 4 :96–106. DOI:10.1016/j.jpha.2013.12.004 |
| [16] | Popova NK, Naumenko VS. 5-HT1A receptor as a key player in the brain 5-HT system[J]. Rev Neurosci , 2013, 24 :191–204. |
| [17] | Stein C. Opioid receptors[J]. Annu Rev Med , 2016, 67 :433–451. DOI:10.1146/annurev-med-062613-093100 |
| [18] | Li F, Shu SY, Bao XM. Structure and function of dopamine receptors[J]. Chin J Neurosc (中国神经科学杂志) , 2003, 19 :405–410. |
| [19] | Litonjua AA, Gong L, Duan QL, et al. Very important pharmacogene summary ADRB2[J]. Pharmacogenet Genomics , 2010, 20 :64–69. DOI:10.1097/FPC.0b013e328333dae6 |
| [20] | Yu HL, Xiao Y, Ai J, et al. Relationship between muscarinic acetylcholine receptor subtypes[J]. Hereditas (遗传) , 2007, 29 :1280–1288. |
| [21] | Fontana P, Gandrille S, Remones V, et al. Identification of fu nctional polymorphisms of the thromboxane A2 receptor gene in healthy volunteers[J]. Thromb Haemost , 2006, 96 :356–360. |
| [22] | Chen J, Xu J, Zhang TJ, et al. Quality control for alkaloids of Corydalis Rhizoma based on quantitative analysis on multi-components with single marker[J]. Chin Tradit Herb Drugs (中草药) , 2016, 47 :493–498. |
 2016, Vol. 51
2016, Vol. 51


