β-受体激动剂和β-受体阻滞剂大都属于氨基醇类手性药物,多以外消旋体上市销售。一般来说,β-受体激动剂只有R-异构体有β-受体激动作用,S-异构体活性很弱甚至没有; 而对于β-受体阻滞剂,通常起药理作用的主要是S-异构体,R-异构体则产生不良反应[1]。因此,建立适于此类药物分析检测的手性分离方法,对保证药物质量和用药的安全有效具有重要意义。
手性药物分离常用的方法有高效液相色谱法 (HPLC)[2, 3]和毛细管电泳法 (CE)[4, 5]。毛细管电泳具有分离效率高、药品和试剂用量少、可供选择的模式多、方法简单等优点,因而在手性药物分离领域应用广泛。近年来,非水毛细管电泳 (nonaqueous capillary electrophoresis,NACE) 作为毛细管电泳的一个重要分支,具有许多优于水相电泳的特点,引起了人们越来越多的重视[6, 7]。NACE中常用的手性选择剂大致可分为以下几种类型: ① 环糊精 (CD) 及其衍生物; ② 大环抗生素类; ③ 离子对手性选择剂; ④ 其他手性选择剂。近几年出现的多羟基化合物-硼酸络合酸类手性选择剂,廉价易得,在HPLC以及NACE中的应用还比较有限[8, 9],本文以D-(+)-葡萄糖酸δ-内酯和硼酸在溶液中的络合反应为基础,在甲醇溶液中原位合成了D-(+)-葡萄糖酸δ-内酯-硼酸络合酸,以其作为手性选择剂,采用NACE法对14种氨基醇类手性药物进行分离,考察手性选择剂的浓度、背景缓冲液的组成以及毛细管温度等因素对手性分离效果的影响,并初步探讨了手性分离机制。
实验部分仪器与试药 TH3100高效毛细管电泳仪 (天慧分离科学研究所,中国),包括进样装置、恒温装置和紫外检测器。所有数据采集和分析均在CXTH色谱工作站 (CXTH-3000) 上完成。
外消旋盐酸普萘洛尔(propranolol hydrochloride)、酒石酸美托洛尔 (metoprolol tartrate)、盐酸艾司洛尔 (esmolol hydrochloride)、富马酸比索洛尔 (bisoprolol fumarate)、盐酸索他洛尔 (sotalol hydrochloride)、阿替洛尔 (atenolol)、盐酸环仑特罗 (cycloclenbuterol hydrochloride)、盐酸克仑特罗 (clenbuterol hydro-chloride)、盐酸班布特罗 (bambuterol hydrochloride)、盐酸妥洛特罗 (tulobuterol hydrochloride) 和盐酸氯丙那林 (clorprenaline hydrochloride) 对照品购自中国食品药品检定研究院,其余消旋体化合物以甲醇为溶剂分别由市售药片卡维地洛 (carvedilol) (巨能®,北京巨能股份责任公司)、普罗帕酮 (propafenone) (鲁明®,山东仁和堂制药有限公司)、硫酸特布他林 (terbutaline sulphate) (博利康尼®,阿斯利康制药有限公司) 中提取得到。
D-(+)-葡萄糖酸δ-内酯[D-(+)-gluconic acid δ- lactone] (阿拉丁®,分析纯,上海晶纯生化科技股份有限公司),硼酸 (boric acid) (分析纯,河北保定化学试剂厂),三乙胺 (triethylamine) (分析纯,天津市科密欧化学试剂有限公司),甲醇 (色谱纯,天津康科德科技有限公司)。
电泳条件 未涂层熔融石英毛细管柱 (55 cm × 50 µm ID,有效长度45 cm) 购自河北永年锐沣色谱器件有限公司。新毛细管在使用前依次用甲醇冲洗10 min,蒸馏水冲洗5 min,1.0 mol·L-1 NaOH溶液 冲洗20 min,蒸馏水冲洗5 min,1.0 mol·L-1 HCl溶 液冲洗20 min,蒸馏水冲洗5 min,甲醇冲洗5 min。每次进样前,毛细管用运行缓冲溶液冲洗2 min。气压进样,进样压力2.9 psi (1 psi ≈ 6.9 kPa),进样时间 2 s,温度25 ± 0.2 ℃。每天实验完毕,毛细管用甲醇冲洗2 min。
溶液配制 缓冲溶液配制: 精密称取适量D-(+)-葡萄糖酸δ-内酯和硼酸溶于甲醇后,加入适量三乙胺,于量瓶中定容。样品溶液配制: 精密称取一定量的各种消旋体化合物,分别溶于甲醇溶液中,配制成浓度为500.0 μg·mL-1的储备液; 并分别稀释至一定浓度 (盐酸普萘洛尔、盐酸环仑特罗、盐酸克仑特罗为25.0 μg·mL-1,其他样品为50.0 μg·mL-1) 作为样品溶液。所有溶液使用前用0.22 µm微孔滤膜过滤,并超声脱气5~10 min。
结果与讨论 1 手性选择剂的浓度对手性分离的影响手性选择剂的浓度是影响手性分离的一个重要因素。本文是以D-(+)-葡萄糖酸δ-内酯和硼酸在溶液中的络合反应为基础,在甲醇溶液中原位合成D-(+)-葡萄糖酸δ-内酯-硼酸络合酸,此络合反应是可逆的,因此D-(+)-葡萄糖酸δ-内酯和硼酸的浓度对络合酸手性选择剂的生成都会有很大影响。实验分别在0~200 mmol·L-1 和0~100 mmol·L-1内,考察了D-(+)-葡萄糖酸δ-内酯浓度和硼酸浓度对手性分离的影响。如图 1A所示,保持其他因素不变,随着D-(+)-葡萄糖酸δ-内酯浓度的增加,多数手性药物的分离度逐渐增大并在200 mmol·L-1时达到最高。由于过高浓度导致D-(+)-葡萄糖酸δ-内酯不能溶解完全,因此实验选择200 mmol·L-1作为多数药物的最佳D-(+)-葡萄糖酸δ-内酯浓度。如图 1B所示,保持其他因素不变,在0~100 mmol·L-1内,随着硼酸浓度的增加,多数手性药物的分离度逐渐增大; 当硼酸浓度为100 mmol·L-1时,分离度呈下降趋势。这可能是由于过高的硼酸浓度导致溶液离子强度增加,手性药物峰形展宽,分离效果变差。因此,实验选择80 mmol·L-1作为多数药物的最佳硼酸浓度。
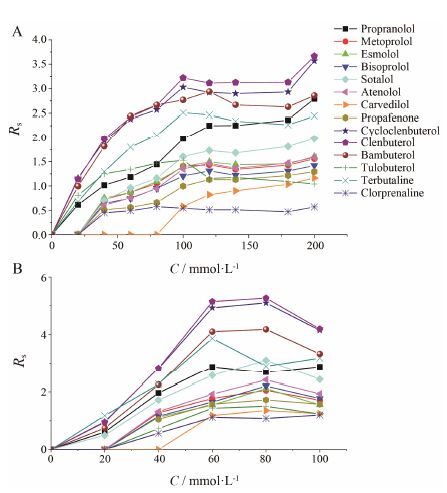
|
Figure 1 Effect of D-(+)-gluconic acid δ-lactone (A) and boric acid (B) concentration on chiral resolution. Running buffer composition A:80 mmol·L-1 boric acid and 57.4 mmol·L-1 triethylamine in methanol; B: 200 mmol·L-1 D-(+)-gluconic acid δ-lactone and 57.4 mmol·L-1 triethylamine in methanol |
NACE中缓冲溶液的酸度一般用表观pH值 (pH) 表示,是影响手性分离的另一个重要参数。它可以影响手性药物和手性选择剂的质子化程度,进而影响二者的相互作用; 还可以改变毛细管内壁的离子状态,进而影响电渗流的大小、方向和分离效果[10]。本文通过在运行缓冲溶液中加入适量的有机碱(三乙胺) 来调节溶液的pH。保持缓冲溶液中D-(+)-葡萄糖酸δ-内酯和硼酸的浓度不变,改变三乙胺的浓度,观察手性药物迁移时间和分离度的变化。当缓冲溶液中未加入三乙胺时,分析物的迁移时间很短,没有手性分离趋势,且高浓度的D-(+)-葡萄糖酸δ-内酯和硼酸在甲醇溶液中不能完全溶解。因此,实验在21.6~64.6 mmol·L-1内考察了三乙胺浓度对手性分离的影响。如图 2所示,随着三乙胺浓度的增加,手性药物迁移时间逐渐延长,分离度增大。当三乙胺浓度为57.4 mmol·L-1时,多数药物的分离度达到最大,继续增加三乙胺浓度,分离度反而减小。因此,实验选择57.4 mmol·L-1作为最佳的三乙胺浓度。
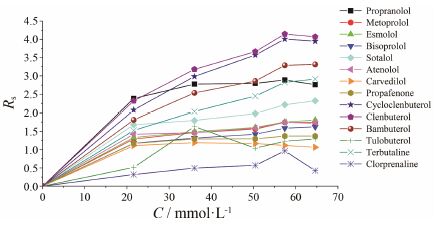
|
Figure 2 Effect of triethylamine concentration on chiral resolu-tion. Running buffer composition in addition to the concentra-tion of triethylamine is 200 mmol·L-1 D-(+)-gluconic acid δ-lactone and 80 mmol·L-1 boric acid in methanol |
毛细管温度对缓冲溶液的黏度有一定影响,可以引起手性药物迁移时间和进样量的变化[11],从而影响手性分离效果。本实验以含200 mmol·L-1 D-(+)-葡萄糖酸δ-内酯、80 mmol·L-1硼酸和57.4 mmol·L-1三乙胺的甲醇溶液为运行缓冲溶液,考察了毛细管温度分别为20、25和30 ℃时14种氨基醇类药物的手性分离情况。结果表明,当毛细管温度为20 ℃时,所有手性药物的迁移时间最长,分离度也最大; 25 ℃时,迁移时间明显缩短,分离度略有下降; 30 ℃时,迁移时间变化不明显,分离度继续下降。综合考虑迁移时间和分离度,实验最终选择25 ℃为最佳的毛细管温度。
4 手性药物最佳分离条件经过实验条件的优化,最终确立手性药物的最佳分离条件为: D-(+)-葡萄糖酸δ-内酯浓度为200 mmol·L-1,硼酸浓度为80 mmol·L-1,背景电解质三乙胺浓度为57.4 mmol·L-1,毛细管温度为25 ℃。如图 3所示,在此条件下,14种氨基醇类手性药物中大部分都获得了良好分离。

|
Figure 3 Electropherograms of enantioseparations of analytes under the optimized conditions with D-(+)-gluconic acid δ-lactone-boric acid complex as the chiral selector |
在毛细管电泳手性分离中对映体出峰顺序的确定是一个很重要的问题。由于缺少其他药物的单一对映体,本研究只对普萘洛尔对映体的出峰顺序进行了考察。实验采用在普萘洛尔消旋体中加入 (S)-普萘洛尔对照品的方式研究其出峰顺序。如图 3所示,普萘洛尔对映体出峰顺序为 (R)-普萘洛尔先出峰,(S)-普萘洛尔后出峰。这可能是由于后者的立体结构比前者更适于和手性选择剂发生相互作用,形成更为稳定的不带电荷的离子对化合物,在毛细管中的迁移速率减慢。
6 手性分离机制的探讨据文献[12]报道,含有顺式-邻或间羟基的手性多羟基化合物可以和硼酸在溶液中发生络合反应,生成具有五元或六元环结构的手性络合酸,固定多羟基化合物的手性中心,从而使其与手性药物的两个对映体在空间匹配方面的差别增大,提高其手性识别作用。D-(+)-葡萄糖酸δ-内酯就是这样一种手性多羟基化合物,其结构中含有一对顺式-间羟基,应该可以和硼酸在溶液中反应生成D-(+)-葡萄糖酸δ-内酯-硼酸络合酸,它在NACE过程中首先解离生成手性络合酸阴离子,再与两个对映体阳离子发生离子对相互作用,由于离子对结合常数不同,导致对映体表观电泳淌度不同,从而实现手性分离。
在手性分离过程中,手性药物的两个对映体和手性选择剂之间会产生相互作用,如氢键、偶极-偶极、静电及空间位阻作用等,手性药物的结构不同必然会导致这些相互作用的不同。因此,手性药物的分子结构对手性分离效果具有重要影响。本文分离的14种氨基醇类手性药物分子结构具有很大的相似性,其手性中心的一端均连接仲胺或叔胺基团,而另一端均连接芳香环部分。因此,影响手性分离效果的极有可能是手性药物的芳香环部分。芳香环上的极性取代基 (尤其是靠近手性中心的极性取代基) 产生的竞争效应可能削弱了手性药物的手性中心与手性选择剂之间的相互作用[13]。在这些手性药物中,环仑特罗和克仑特罗获得了最佳的分离,分离度都达到了5.0以上,这可能是因为它们的芳香环部分具有远离手性中心的弱极性取代基,这对手性中心与手性选择剂之间的相互作用负面影响最小。普萘洛尔、美托洛尔、艾司洛尔、普罗帕酮、比索洛尔、阿替洛尔和卡维地洛的手性中心与芳香环之间均通过-OCH2-相连,或许-OCH2-与手性选择剂之间的相互作用对手性识别产生了不利的影响,致使这几种手性药物的分离效果不如环仑特罗与克仑特罗。普萘洛尔和卡维地洛的芳香环均为体积较大的基团,分别为萘基和咔唑基,可能是空间位阻作用使得它们相对其他药物分离效果差,而卡维地洛的氮原子上连接了其他体积较大的基团,导致分离效果比普萘洛尔更差; 与艾司洛尔和美托洛尔相比,阿替洛尔的芳香环部分存在强极性的酰胺基团,因此分离效果较两者差。特布他林、索他洛尔和班布特罗的苯环上存在较强的极性基团 (酚羟基、磺酰胺基或二甲胺基),这些因素导致了分离效率的下降。妥洛特罗和氯丙那林分子的芳香环部分具有邻位取代的氯,有强极性,且靠近手性中心,削弱了手性中心与手性选择剂之间的静电、氢键和偶极-偶极等相互作用,分离效果最差[9]。妥洛特罗与氯丙那林的结构相比,仅多了一个-CH3,极性稍减弱,分离度增加; 妥洛特罗与克仑特罗的分离相差较大,主要是前者的芳香环部分具有邻位取代的氯,有强极性,而后者具有间位取代的氯,极性次之,分离度有了显著的不同。
小结综上所述,本文建立的以D-(+)-葡萄糖酸δ-内 酯-硼酸络合酸为手性选择剂的非水毛细管电泳法可以实现14种氨基醇类手性药物的分离,手性选择剂廉价易得,方法简单、快速。在今后的研究中,该手性选择剂可以被应用于更多的分离技术 (如HPLC),拓展其应用范围,也为其他类似结构手性药物的分离分析提供了新方法。此外,多羟基化合物的种类很多,包括多羟基醇、多羟基醛、多羟基酮、多羟基羧酸及其衍生物等,均可与硼酸在非水溶液中发生络合反应生成多羟基化合物-硼酸络合酸。因此,本研究也为更多的多羟基化合物-硼酸络合酸手性选择剂的原位合成及其在非水毛细管电泳分离手性药物中的应用提供参考。
| [1] | Xu BJ, Zhang DT, Shen BC, et al. Enantioseparation of seven amino alcohols on teicoplanin chiral column[J]. Chin J Anal Chem (分析化学) , 2007, 35 :55–60. DOI:10.1016/S1872-2040(07)60026-7 |
| [2] | Yang J, Wang LJ, Guo QL, et al. Chiral separation of five β-blockers using di-n-hexyl L-tartrate-boric acid complex as mobile phase additive by reversed-phase liquid chromatography[J]. Chin J Chem (色谱) , 2012, 30 :280–284. |
| [3] | Wang JL, Wang ST. S,R-isomer separation of hydrochloride palonosetron by RP-HPLC with HP-β-CD as chiral additive[J]. China Pharm (中国药师) , 2015, 18 :237–240. |
| [4] | Zhang JJ, Du YX, Zhang Q, et al. Investigation of the synergistic effect with amino acid-derived chiral ionic liquids as additives for enantiomeric separation in capillary electrophoresis[J]. J Chromatogr A , 2013, 1316 :119–126. DOI:10.1016/j.chroma.2013.09.064 |
| [5] | Sun JY, Xing YP, Song JX, et al. Chiral separation of 4 drugs by capillary electrophoresis[J]. J Shenyang Pharm Univ (沈阳药科大学学报) , 2015, 32 :199–203. |
| [6] | Lu YQ, Jia CX, Yao QQ, et al. Analysis of flavonoids by non-aqueous capillary electrophoresis with 1-ethyl-3-methylimidazolium ionic-liquids as background electrolytes[J]. J Chromatogr A , 2013, 1319 :160–165. DOI:10.1016/j.chroma.2013.10.014 |
| [7] | Hou JY, Li G, Wei YQ, et al. Analysis of five alkaloids using surfactant-coated multi-walled carbon nanotubes as the pseudostationary phase in nonaqueous capillary electrophoresis[J]. J Chromatogr A , 2014, 1343 :174–181. DOI:10.1016/j.chroma.2014.03.051 |
| [8] | Wang LJ, Hu SQ, Guo QL, et al. Di-n-amyl L-tartrate-boric acid complex chiral selector in situ synthesis and its application in chiral nonaqueous capillary electrophoresis[J]. J Chromatogr A , 2011, 1218 :1300–1309. DOI:10.1016/j.chroma.2011.01.003 |
| [9] | Zou YN, Wang LJ, Liu Q, et al. Enantioseparations of 11 amino alcohols using di-n-amyl L-tartrate-boric acid complex as chiral mobile phase additive by RP-HPLC[J]. Chromatographia , 2015, 78 :753–761. DOI:10.1007/s10337-015-2891-1 |
| [10] | Gong ZS, Duan LP, Tang AN. Amino-functionalized silica nanoparticles for improved enantiomeric separation in capillary electrophoresis using carboxymethyl-β-cyclodextrin (CM-β-CD) as a chiral selector[J]. Microchim Acta , 2015, 182 :1297–1304. DOI:10.1007/s00604-015-1449-0 |
| [11] | Ibrahim WAW, Wahib SMA, Hermawan D, et al. Separation of selected imidazole enantiomers using dual cyclodextrin system in micellar electrokinetic chromatography[J]. Chirality , 2013, 25 :328–335. DOI:10.1002/chir.v25.6 |
| [12] | Hu SQ, Chen YL, Zhu HD. In situ synthesis of di-n-butyl L-tartrate-boric acid complex chiral selector and its application in chiral microemulsion electrokinetic chromatography[J]. J Chromatogr A , 2009, 1216 :7932–7940. DOI:10.1016/j.chroma.2009.09.036 |
| [13] | Wang LJ, Liu XF, Lu QN, et al. An ion-pair principle for enantioseparations of basic analytes by nonaqueous capillary electrophoresis using the di-n-butyl L-tartrate-boric acid complex as chiral selector[J]. J Chromatogr A , 2013, 1284 :188–193. DOI:10.1016/j.chroma.2013.02.006 |
 2016, Vol. 51
2016, Vol. 51


