2. 天士力研究院, 创新中药关键技术国家重点实验室, 药物分析研究所, 天津 300410
2. State Key laboratory of Core Technology in Innovative Chinese Medicine, Tasly Pharmaceutical Analysis Institute, Tasly Academy, Tianjin 300410, China
安全性、有效性和批次间质量的一致性是中药国际化的3个关键要素。中药质量控制的核心在于评价中药批次间的一致性,而保证药品质量一致性的最终目的是保证药品的安全性和有效性。中药具有化学成分复杂、作用机制复杂且化学成分与药效关系不明确的特点[1, 2]。现有质量控制方法以化学成分分析为主[3-5],其前提假设是可以检测到的成分就是中药的起效成分,因此控制化学组成就可以保障药物的疗效。该方法将化学物质基础和药效物质基础关联,但并没有充足的活性数据作为支撑。为弥补化学质量控制的这一缺陷,研究者们使用生物效价方法辅助评价药物质量,假设测试的生物活性能够反映中药的疗效[6, 7]。但是由于作用机制复杂,该方法难以适用于治疗综合性疾病 (如代谢型疾病、心血管疾病) 的中药[8, 9]。因此,有必要开发能够全面评价中药生物活性一致性的分析方法。
转录组学(transcriptomics),是一门在整体水平上研究细胞中基因转录情况及转录调控规律的学科。狭义的转录组学也称为表达谱,通常采用寡核苷酸芯片技术进行研究,目前已经广泛应用于药物靶点的发现和作用机制的研究[10, 11]。转录组能够反映药 物对生物体系的全部影响,因此可以利用该技术筛选出能够表征中药生物活性的指标mRNA,并用于监测和评价中药批次间生物活性的一致性[12]。使用mRNA作为中药生物活性指标具有稳定性好 (处于生命活动上层)、覆盖度高 (能够检测全部基因)、无偏向性 (对不同生物活性无歧视) 和实用性强 (定量方法成熟且成本合理) 的特点[13]。
复方丹参滴丸是治疗气滞血瘀所致心绞痛、冠心病的药物。现有质量标准主要收录了指纹图谱相似度评价和丹参素含量测定的方法,难以反映复方丹参滴丸批次间生物活性的一致性[14, 15]。本研究以HepG2细胞系模拟肝脏代谢,采用基因表达谱芯片和实时荧光定量PCR技术,初步建立了复方丹参滴丸生物活性一致性的评价方法。
材料与方法药品与试剂 6批复方丹参滴丸样品由天士力制药集团股份有限公司提供,1批复方丹参片购自药房,由广州白云山药业生产。二甲基亚砜 (DMSO) 由上海国药集团生产。DMED培养基、胰酶、胎牛血清均购自Gibco公司。溴化四氮唑蓝 (MTT) 购自北京鼎国生物技术有限责任公司。人基因表达谱芯片GeneChip Primeview human购自美国Affymetrix公司。Trizol试剂盒购自美国Invitrogen公司。dNTPs、RNase抑制剂和M-MLV逆转录酶均购自美国Promega公司。Oligo dT购自上海生工生物工程股份有限公司。SYBR Master Mixture购自日本TaKaRa公司。引物由上海吉凯基因化学技术有限公司合成。色谱级乙腈购自美国Omni公司。色谱级甲酸 (纯度 > 95%) 购自美国Sigma公司。丹参素、原儿茶醛、迷迭香酸、紫草酸、丹酚酸B、丹酚酸A、隐丹参酮、丹参酮I和丹参酮IIA购自中国食品药品检定研究院,丹酚酸D购自天津一方有限公司,丹酚酸T和丹酚酸U由天士力研 究院提供。
基于指标基因的生物活性一致性评价方法建立流程 如图 1所示,以人肝癌细胞HepG2为生物检 测器,使用基因芯片检测药物处理细胞24 h后调节的基因。根据以下标准筛选指标基因: ① 调节倍数 < 0.67或 > 1.5; ② 与疗效具有潜在相关性; ③ 广泛分布在细胞功能通路中; ④ 具有剂量-效应依赖性。使用筛选出来的指标基因开展方法学验证实验。方法经验证后,用于评价样品的生物活性一致性。

|
Figure 1 Workflow of developing bioactive consistency evaluation method using marker genes |
细胞株及培养 人肝癌细胞株HepG2购自中国医学科学院基础医学研究所细胞中心。细胞置于含5% CO2的37 ℃培养箱中,使用含体积分数为10% 灭活小牛血清的低糖DMEM培养液培养。待细胞融合度达到80%~90% 时,用0.25% 胰酶进行消化,以1∶3比例进行传代培养。
MTT法测定细胞活力 取对数生长期的细胞,用胰酶消化后,以5×103个/孔浓度接种于96孔板,24 h后加入含有0、0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0和2.0 mg·mL-1复方丹参滴丸的正常培养基分别培养24 h和72 h,培养终止前4 h加入10 μL5 mg·mL-1的MTT。4 h后,吸取去除培养液,每孔加入DMSO 100 μL终止反应。振荡5 min后,使用酶标仪在波长490 nm条件下测定光密度值 (OD)。使用GraphPad软件计算IC50。
指标mRNA筛选 使用GeneChip PrimeView human人基因表达谱芯片 (美国Affymetrix公司) 分析空白对照组和复方丹参滴丸24 h给药组基因表达谱。对芯片数据进行KEGG pathway分析和GO注释。选择调节倍数 < 0.67或 > 1.5、与疗效潜在相关且覆盖多种细胞功能和分类的基因作为候选基因,进行实时荧光定量PCR实验以考察剂量-效应依赖性。设置5个复方丹参滴丸浓度组,分别为0、0.09、0.27、0.54和0.81 mg·mL-1 (分别对应72 h给药IC50的0、0.33、1、2和3倍)。Trizol法提取样品总RNA。定量PCR反应体系参照SYBR premix Ex Taq Kit (TaKaRa公司) 说明进行,在TP800 Real time PCR仪 (TaKaRa公司) 上进行实验。选择GADPH作为内参基因,使用Primer 5.0程序设计内参基因和候选基因的引物 (表 1)。利用熔解曲线确定目标基因的特异性扩增,使用2-∆∆Ct方法计算目标基因的表达量,每个样品做3个重复。
| Table 1 Primers of detected genes using quantitative real-time polymerase chain reaction. Reference gene |
相似度计算方法 N个数值组成的行 (x1,x2,∙∙∙,xn) 称为N维向量,记为大写字母X。如果存在两个向量X和Y,则X,Y之间的相似度按照夹角余弦计算 (公式1)。cosθ越接近1,两个向量的相似性越高。因此,使用供试品的各个指标基因调节倍数构成样品向量X = (x1,x2,∙∙∙,xn),对照样品的各个指标基因调节倍数构成对照样品向量Y = (y1,y2,∙∙∙,yn),其中x1和y1为各指标基因表达倍数。相似度能够清晰地反应样品生物活性与对照样品生物活性在分布比例上的相似程度。
| $\cos \theta =\frac{\sum\nolimits_{i=1}^{n}{{{x}_{i}}{{y}_{i}}}}{\sqrt{\sum\nolimits_{i=1}^{n}{x_{i}^{2}}}\sqrt{\sum\nolimits_{i=1}^{n}{y_{i}^{2}}}}$ | (1) |
分析方法学验证和样品测定 以20120205批样品为对照样品,考察该分析方法的日内精密度和日间精密度。日内精密度考察: 使用平行制备的6份浓度为0.54 mg·mL-1的样品 (批号: 20120205) 处理HepG2细胞24 h,检测指标基因 (n = 3) 的表达情况,计算相似度及其RSD。日间精密度考察: 连续3天,每天平行制备3份样品处理HepG2细胞24 h,检测指标基因 (n = 3) 的表达情况,计算相似度和RSD。按照以上方法,测定6批复方丹参滴丸样品和1批复方丹参片样品,并计算相似度。
指纹图谱的建立与评价 使用H-Class超高效 液相色谱仪 (Waters公司) 对样品进行指纹图谱分析。采用可变波长检测器,Waters Acquity BEH C18 色谱柱 (1.7 μm,2.1 mm × 100 mm),柱温30 ℃。流 动相使用0.1% 甲酸水 (A)-乙腈 (B) 体系,流速为0.4 mL·min-1。梯度洗脱程度如下: 0 min,8% B;1 min,12% B; 3 min,17% B; 6 min,20% B; 10 min,23% B; 12 min,27% B; 13 min,50% B; 18 min,80% B。进样量3 μL。检测波长281 nm。
结果 1 复方丹参滴丸对于HepG2细胞活力的影响复方丹参滴丸干预HepG2细胞24 h后,当给药剂量小于1.0 mg·mL-1时,与空白对照组相比HepG2细胞活力均大于75%,药物对细胞活力影响较小; 干预HepG2细胞72 h后,细胞活力明显下降 (表 2)。使用GraphPad5.0软件拟合量-效曲线,药物干预72 h的IC50值为0.27 mg·mL-1。
| Table 2 Cell activity of HepG2 after administration of cardiotonic pill. n = 3,x± s |
使用0.27 mg·mL-1的含药培养基处理HepG2细胞24 h并进行基因表达谱芯片检测。以调节倍数 < 0.67或 > 1.5、显著性差异P < 0.05为标准筛选差异表达基因,共发现有65个差异表达基因,其中45个基因上调,20个基因下调。生物信息学分析结果表明,复方丹参滴丸主要影响HepG2细胞的甾体激素合 成、细胞色素P450异生代谢、转化生长因子β信号通路等通路,同时对以DNA结合抑制剂基因(ID2、ID3和ID1) 为代表的生物学过程、细胞过程和核转录过程起到负调节作用。
3 指标mRNA筛选根据指标mRNA筛选的前3条准则,首先从药物干预HepG2细胞24 h的差异表达基因中筛选了 18个候选指标基因 (表 1)。这些候选指标基因具有11种细胞功能,并在聚类分析结果中分为7类。随后考察18个候选指标基因进行剂量-效应关系。结果表明,MMP1、CYP1A1、EPGN、RUNX2、C8orf4、OLR1、CLMP、AKR1C1、IL24和APOL6这10个基因具有明显的剂量-效应依赖性 (表 3)。给药浓度为0.54 mg·mL-1时,基因表达水平趋于稳定(图 2)。在该浓度下,药物对HepG2细胞活力的影响较小。因此在生物活性一致性评价工作中,使用0.54 mg·mL-1复方丹参滴丸样品处理细胞。
| Table 3 Information of 10 marker genes in HepG2 cells |

|
Figure 2 Dose response of marker gene expression. HepG2 cells were treated with cardiotonic pill at various doses of 0×,0.33×,1.0×,2.0× and 3.0× IC50 concentration |
以20120205批次样品对HepG2细胞指标基因的调节水平作为对照计算相似度。相似度的日内精密度RSD < 0.4%,6次测定的相似度均大于0.989; 日间精密度RSD < 0.6%,9次测定的相似度均大于0.981。以上结果表明,方法精密度良好,能够满足中药生物活性一致性评价的要求。
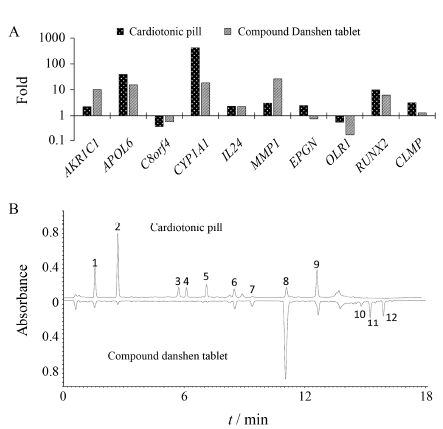
5 样品分析使用指标基因和指纹图谱分别评价7批样品的一致性。以20120205批次样品为对照样品计算其他样品的生物活性和化学成分的相似度。生物活性评价结果见表 4。5批复方丹参滴丸样品的基因表达相似度在0.999~0.992之间,生物活性一致性较好。1批复方丹参片样品的基因表达相似度为0.534,说明其生物活性与复方丹参滴丸差异较大。由图 3A可见,复方丹参滴丸主要上调基因CYP1A1 (429.64倍)、APOL6 (33.84倍) 和RUNX2 (9.07倍),下调基因C8orf4 (29%)和OLR1 (40%); 复方丹参片主要上调基因MMP1 (26.55倍)、CYP1A1 (18.52倍) 和APOL6 (15.65倍),下调基因C8orf4 (58%) 和OLR1 (17%),两者具有较大差异。
| Table 4 Determination results of 7 batches of Compound Danshen samples using HepG2 cells. CP: Cardiotonic pill; CDT: Compound Danshen tablet |
|
Figure 3 Comparison of cardiotonic pill and compound Danshen tablet. A: Fold changes of marker genes; B: Fingerprints at 281 nm. Peaks 1: Danshensu; 2: Protocatechuic aldehyde; 3: Salvianolic acid T; 4: Salvianolic acid U; 5: Salvianolic acid D; 6: Rosmarinic acid; 7: Lithospermic acid; 8: Salvianolic acid B; 9: Salvianolic acid A; 10: Cryptotanshinone; 11: Tanshinone I; 12: Tanshinone ⅡA |
化学指纹图谱共使用对照品指认了12个指纹峰,其中酚酸类化合物包括丹参素、原儿茶醛、丹酚酸T、丹酚酸U、丹酚酸D、迷迭香酸、紫草酸、丹酚酸B和丹酚酸A,丹参酮类化合物包括隐丹参酮、丹参酮I和丹参酮IIA。典型指纹图谱见图 3B。评价结果表明,5批复方丹参滴丸样品的相似度在0.999~0.994之间,化学成分一致性较好; 1批复方丹参片样品的相似度为0.303,说明其化学成分与复方丹参滴丸差异较大。7批样品生物活性与化学成分的评价结果一致性良好。
讨论为模拟口服药物在肝脏内的代谢过程,本研究选择了人肝癌细胞系HepG2作为药物的生物活性检测器。在使用基因芯片筛选指标基因时,需要选择合适的给药浓度处理HepG2细胞,从而更多地反映药物的生物活性而非毒性。参考文献[12]方法,首先确定给药72 h的IC50,随后使用该浓度的药物处理细胞24 h。在该剂量下,细胞生长并没有受到明显影响 (细胞活力大于80%),不会由于给药剂量过大产生毒性调节,也能够充分反应药物本身的活性。
指标基因应该尽可能与药物的疗效相关,同时能够全面反映药物的特征生物活性。指标基因的筛选可分为3个步骤。① 初步筛选。将调节倍数设定为1.5,共从基因表达谱芯片结果中筛选出65个差异表达基因; ② 功能筛选。对差异表达基因进行功能注释和分析,查阅相关文献和数据库,进一步筛选出18个与药物治疗作用潜在相关、具有多种细胞功能的候选基因; ③ 指标验证。为保证指标的灵敏性和代表性,需考察候选指标基因的调节水平与药物浓度是否具有剂量-效应关系,同时确定合适的给药浓度以减小系统变异性。最终,筛选了10个基因作为复方丹参滴丸的生物活性指标。这些基因具有8种不同的细胞功能,且调节水平与药物浓度高度相关。在给药浓度为0.54 mg·mL-1时,指标基因的表达水平达到稳定,故在样品测试时使用该给药浓度处理细胞。
生物体系对于药物的反应容易受到细胞状态、培养条件和操作过程等因素的影响,因此有必要对建立的生物活性评价方法进行分析方法学验证。在本研究中,所有样品均进行3次重复测定。方法学验证初步考察了日内和日间精密度。按照相似度计算,方法的日内和日间精密度均小于0.6%,能够满足质量评价方法的需求。对两种复方丹参方制剂进行生物活性一致性评价,发现复方丹参片与复方丹参滴丸的生物活性相似度仅为0.534,说明建立的方法能够有效区分不同复方丹参制剂的生物活性,具有较好的专属性。
化学成分研究显示,复方丹参滴丸中丹参素、原儿茶醛、丹酚酸D、丹酚酸T和丹酚酸U等低聚体酚酸的含量较高,而复方丹参片中丹酚酸B、丹参酮ⅡA和丹参酮Ⅰ的含量较高。前期研究表明,双萜类丹参酮能够诱导HepG2细胞中CYP1A1 mRNA的表达[16],而三七皂苷对其表达和酶活性均无显著影响[17]。当丹参素、丹酚酸B与低浓度丹参酮类化合物联合处理大鼠肝细胞时,CYP1A2 mRNA的表达提升幅度与高浓度丹参酮类化合物接近,这种差异随着丹参素含量的降低消失[18]。在本研究中,复方丹参滴丸提高CYP1A1表达的幅度明显大于复方丹参片,可能与其含有较多的丹参素有关。MMP-1 (基质金属蛋白酶-1) 是细胞外基质合成和降解调节中的重要因素,能够降解细胞外基质I、III型胶原,从而起到抗纤维化的作用[19]。研究[20]表明,丹参酮ⅡA能够显著提高心肌成纤维细胞中MMP-1 mRNA的表达。OLR1 (氧化低密度脂蛋白受体1) 是一种细胞表面识别和内化氧化低密度脂蛋白的清道夫受体,在动脉粥样硬化病变部位高度表达[21]。Xu等[22]研究显示,丹参酮IIA能够通过降低细胞超氧化物自由基的生成和NF-κB的激活抑制OLR1 mRNA和蛋白的表达。复方丹参片对MMP-1和OLR1 mRNA表达上调较复方丹参滴丸高,可能与两者丹参酮ⅡA的含量差异有关。基于指标基因的生物活性一致性评价方法能够从活性角度反映药品化学成分的变化,可以作为化学成分一致性评价方法的有效补充。
| [1] | Hao HP, Cui N, Wang GJ, et al. Global detection and identification of nontarget components from herbal preparations by liquid chromatography hybrid ion trap time-of-flight mass spectrometry and a strategy[J]. Anal Chem , 2008, 80 :8187–8194. DOI:10.1021/ac801356s |
| [2] | Yang WZ, Ye M, Qiao X, et al. A strategy for efficient discovery of new natural compounds by integrating orthogonal column chromatography and liquid chromatography/mass spectrometry analysis:its application in Panax ginseng,Panax quinquefolium and Panax notoginseng to characterize 437 potential new ginsenosides[J]. Anal Chim Acta , 2012, 739 :56–66. DOI:10.1016/j.aca.2012.06.017 |
| [3] | Zhang JX, Guan SH, Yang M, et al. Simultaneous determination of 24 constituents in Cortex Lycii using high-performance liquid chromatography-triple quadrupole mass spectrometry[J]. J Pharm Biomed Anal , 2013, 77 :63–70. DOI:10.1016/j.jpba.2013.01.014 |
| [4] | Sun GX, Wu Y, Liu ZB, et al. Multiple methods were combined to monitor and evaluate the quality of TCM,and make the results more reliable[J]. Anal Method , 2014, 6 :838–849. DOI:10.1039/C3AY41670D |
| [5] | Ding XP, Qi J, Chang YX, et al. Quality control of flavonoids in Ginkgo biloba leaves by high-performance liquid chromatography with diode array detection and on-line radical scavenging activity detection[J]. J Chromatogr A , 2009, 1216 :2204–2210. DOI:10.1016/j.chroma.2008.08.115 |
| [6] | Kong WJ, Zhao YL, Shan LM, et al. Investigation on the spectrum-effect relationships of EtOAc extract from Radix Isatidis based on HPLC fingerprints and microcalorimetry[J]. J Chromatogr B , 2008, 871 :109–114. DOI:10.1016/j.jchromb.2008.06.053 |
| [7] | Qin Y, Wang JB, Zhao YL, et al. Establishment of a bioassay for the toxicity evaluation and quality control of Aconitum herbs[J]. J Hazardous Mater , 2012 :199–120. |
| [8] | Wang XJ, Zhang AH, Wang P, et al. Metabolomics coupled with proteomics advancing drug discovery toward more agile development of targeted combination therapies[J]. Mol Cell Proteomics , 2013, 12 :1226–1238. DOI:10.1074/mcp.M112.021683 |
| [9] | Jiang P, Dai WX, Yan SK, et al. Potential biomarkers in the urine of myocardial infarction rats:a metabolomic method and its application[J]. Mol Biosyst , 2011, 7 :824–831. DOI:10.1039/C0MB00110D |
| [10] | Wang L, Li Z, Zhao X, et al. A network study of Chinese medicine Xuesaitong injection to elucidate a complex mode of action with multicompound,multitarget,and multipathway[J]. Evid-Based Complement Altern Med , 2013 . DOI:10.1155/2013/652373 |
| [11] | Wu L, Wang Y, Nie J, et al. A network pharmacology approach to evaluating the efficacy of Chinese medicine using genome-wide transcriptional expression data[J]. Evid-Based Complement Altern Med , 2013 . DOI:10.1155/2013/915343 |
| [12] | Rong JH, Tilton R, Shen JG, et al. Genome-wide biological response fingerprinting (BioReF) of the Chinese botanical formulation ISF-1 enables the selection of multiple marker genes as a potential metric for quality control[J]. J Ethnopharmacol , 2007, 113 :35–44. DOI:10.1016/j.jep.2007.01.021 |
| [13] | Tilton R, Paiva A, Guan JQ, et al. A comprehensive platform for quality control of botanical drugs (PhytomicsQC):a case study of Huangqin Tang (HQT) and PHY906[J]. Chin Med , 2010, 5 :1–15. DOI:10.1186/1749-8546-5-1 |
| [14] | Wei YJ, Qi LW, Li P, et al. Improved quality control method for Fufang Danshen preparations through simultaneous determination of phenolic acids,saponins and diterpenoid quinones by HPLC coupled with diode array and evaporative light scattering detectors[J]. J Pharm Biomed Anal , 2007, 45 :775–784. DOI:10.1016/j.jpba.2007.07.013 |
| [15] | Cao J, Qi LW, Chen J, et al. Application of liquid chromatography-electrospray ionization time-of-flight mass spectrometry for analysis and quality control of compound Danshen preparations[J]. Biomed Chromatogr , 2009, 23 :397–405. DOI:10.1002/bmc.v23:4 |
| [16] | Zhang R, Sun JG, Ma LP, et al. Induction of cytochromes P4501A1 and 1A2 by tanshinones in human HepG2 hepatoma cell line[J]. Toxicol Appl Pharmacol , 2011, 252 :18–27. DOI:10.1016/j.taap.2011.01.008 |
| [17] | Chen YJ, Wang YG, Ma ZC, et al. Effect of Panax notoginseng saponins on liver drug metabolic enzyme activity,mRNA and protein expressions in rats[J]. China J Chin Mater Med (中国中药杂志) , 2014, 19 :3824–3828. |
| [18] | Lee W, Zhou XL, Or P, et al. Tanshinone I increases CYP1A2 protein expression and enzyme activity in primary rat hepatocytes[J]. Phytomedicine , 2012, 19 :169–176. DOI:10.1016/j.phymed.2011.07.006 |
| [19] | Chu YX, Zheng Y. Brief introduction and effect of MMP-1 and TIMP-1 in hepatic fibrosis[J]. Int J Dig Dis (国际消化病杂志) , 2006, 26 :109–112. |
| [20] | Ma S, Liu W, Liu P, et al. Tanshinone ⅡA treatment alleviated the rat gingival connective tissue overgrowth induced by cyclosporine A[J]. J Periodontal Res , 2015 . DOI:10.1111/jre.12335 |
| [21] | Li D, Mehta JL. Intracellular signaling of LOX-1 in endothelial cell apoptosis[J]. Circ Res , 2009, 104 :566–568. DOI:10.1161/CIRCRESAHA.109.194209 |
| [22] | Xu SW, Liu ZP, Huang Y, et al. Tanshinone Ⅱ-A inhibits oxidized LDL-induced LOX-1 expression in macrophages by reducing intracellular superoxide radical generation and NF-κB activation[J]. Transl Res , 2012, 160 :114–124. DOI:10.1016/j.trsl.2012.01.008 |
 2016, Vol. 51
2016, Vol. 51


