2. 军事医学科学院放射与辐射医学研究所, 北京 100850 ;
3. 郑州大学药学院, 河南 郑州 450001 ;
4. 军事医学科学院毒物与药物研究所, 北京 100850
2. Beijing Institute of Radiation Medicine, Beijing 100850, China ;
3. School of Pharmaceutical Sciences, Zhengzhou University, Zhengzhou 450001, China ;
4. Beijing Institute of Pharmacology and Toxicology, Beijing 100850, China
反义寡核苷酸 (antisense oligonucleotides,ASONs) 是人工合成的含15~20个碱基的DNA或RNA单链片段,能与特定的靶mRNA或靶DNA以Watson-Crick碱基互补配对结合,专一性地阻止其 转录和翻译,抑制蛋白表达,从而达到疾病治疗的目的[1-4]。作为一类重要的核酸药物,ASONs可用于病毒感染性疾病、心血管系统疾病、代谢类疾病以及 各类肿瘤等多种疾病的治疗,显示了十分强大的功能和诱人的发展前景[5-8],目前,有100多个反义药物进入临床试验 (https://www.clinicaltrials.gov/)。尽管如此,自从1998年第一个反义药物VitraveneTM被FDA批准上市以来[9],仅有Mipomesen在2013年 上市[10]。这是由于天然的寡核苷酸在生理条件下不稳定,会被血清和细胞中大量存在的核酸酶迅速降解,且不能透过生物膜,生物利用度低[11-13]。因此,ASONs要成为有效的治疗药物,必须通过化学修饰,以增强寡核苷酸对核酸酶的稳定性和对靶基因的亲和力和特异性,改善其生物活性和药物代谢性质,减少毒副作用[14-17]。
2'-脱氧-2'-氟-β-D-阿拉伯糖核苷酸 (2'-F-ANA) 修饰是新一代的核酸结构修饰方法[18-20]。由于氟原子的体积小,电负性强,使2'-F-ANA具有一些独特的性质[21-25]: ① 与其他2'位修饰的核酸单体如2'-OMe- RNA、2'-MOE-RNA等,特别是2'-F-RNA相比,2'-F- ANA是一种DNA的结构类似物,阿拉伯糖环主要形成C2' endo/O4' endo (South/East) 优势构象; ② 2'β-F与碱基方向相同,F原子可与碱基形成C-H…F-C假氢键[26],特别是与嘌呤的8-H原子。与类似结构的阿拉伯糖核苷酸 (ANA) 相比,在5'-嘧啶-嘌呤-3'步序 (5'-pyrimidine-purine-3' step) 的2'-F-ANA可与互补的DNA、RNA形成相对更稳定的双链,显示了更好的特异性和亲和力; ③ 2'-F-ANA显示了一定的对核酸酶的稳定性,高于天然RNA及对应的2'-F-RNA。
基于上述氟原子引入产生的独特性质,为发展新型的核酸化学修饰结构,本研究选择以2'-F-araU为起点,在4'-位引入2-甲氧乙氧基 (2-methoxyethoxy,MOE),设计了一种新的2'-F-4'-C-(2-甲氧乙氧基) 阿拉伯糖尿苷单体 (2'-F-4'-C-MOE-araU) (图 1)。据文献[27]报道,在4'-位引入MOE,由于4' 位环外氧原子的异头效应(anomeric effect),糖环将倾向于形成C3' endo (North) 构象,这将非常有利于与互补mRNA的结合; 另外,4'-位修饰的4'-S-RNA[28]、4'-C-HOCH2- DNA(HM)[29]、4'-C-OMe-DNA[30]等均显示了增强的核酸酶耐受性,由此,期待4'-C-MOE修饰可以提高2'-F-araU对靶基因的亲和力及特异性,并能够保持C-H…F-C假氢键作用,以及对核酸酶的稳定性。同 时,基于上述的设计原理,还将以2'-F-尿苷 (2'-F-rU) 为起点,合成并评价2'-F-4'-C-(2-甲氧乙氧基) 尿苷 (2'-F-4'-C-MOE-rU),以便通过与α-F原子取代的比较,考察2'-F-4'-C-MOE-araU中β-F原子取代对相关性质的影响,并为进一步的核酸化学修饰和核酸药物提供支持。
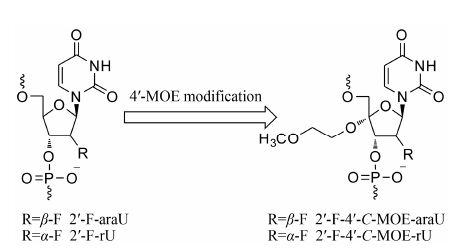
|
Figure 1 The novel building blocks 2'-F-4'-C-MOE-araU and 2'-F-4'-C-MOE-rU for oligonucleotides |
因此,本文合成了2'-F-4'-C-MOE-araU及其亚磷酰胺单体用于核酸结构的修饰,并通过热变性实验 (thermal denaturation experiment)、蛇毒磷酸酯酶水解稳定性实验 (SVPDE hydrolytic stability) 评价2'-F- 4'-C-MOE-araU及2'-F-4'-C-MOE-rU修饰的寡核苷酸分子的杂交性质以及核酸酶稳定性。
结果与讨论 1 化学合成为了实现对2'-F-4'-C-MOE-araU及2'-F-4'-C- MOE-rU修饰的性质评价,首先需在糖基4'-位引入MOE基团并获得相应的亚磷酰胺单体,用于核酸序列的合成。如合成路线1所示,2'-F-4'-C-MOE-araU亚磷酰胺单体8a的合成以2'-F-araU为起始原料,选择性碘化5'-OH,然后在甲醇钠-甲醇溶液中脱碘生成关键性的含双键的中间体3a; 以PbCO3为碱,在过量2-甲氧乙醇存在下,中间体3a通过双键碘化加成反应选择性生成2'-F-4'-C-MOE-araU前体4a,由此顺利实现在4'-位引入MOE基团。此时,为将5'-I转化成所需的5'-OH,先将化合物4a的3'-OH用苯甲酰基 (Bz) 保护,随后在二氯甲烷-水体系下,使用过量的间氯过氧苯甲酸 (m-CPBA) 氧化5'-I并以此实现该I原子的转化。尽管文献[31]报道5'-位主要生成间氯苯甲酸酯 [5'-O(m-Cl)Bz],但在实际反应过程中,发现亦有部分生成5'-OH; 同时,值得注意的是,在后处理过程中,用亚硫酸钠溶液中和过量的氧化剂后,由于大量存在的间氯苯甲酸的干扰,难以实现产物的纯化。因此,在相关产物用二氯甲烷萃取并浓缩后,剩余物直接用氨-甲醇溶液 (NH3-CH3OH) 氨解,经硅胶柱纯化获得目标产物6a。2'-F-4'-C-MOE-araU (6a) 的5'-OH用DMTr保护后,在1H-四唑的作用下,与磷试剂 (2-氰乙基-N,N,N ',N '-四异丙基亚磷酰二胺) 反应生成所需的亚磷酸胺单体8a。为了更好的研究2'位F原子对于核酸结构的影响,以2'-F-rU (1b) 为起始原料,合成了2'-F-4'-C-MOE-rU的亚磷酰胺单体8b (合成路线1)。
以亚磷酰胺单体8a、8b为原料,在DNA自动合成仪上运用标准亚磷酸胺法将8a、8b嵌入了寡核苷酸序列中。由于4'-C-MOE基团的位阻效应,选择5-乙硫基-1H-四唑为活化剂,并将反应时间延长至6 min,以获得合理的收率。所有合成的寡核苷酸序列均在脱保护及从载体上切割下来后使用RP-HPLC纯化至90%以上的纯度,并用MALDI-TOF质谱鉴定 (表 1)。
| Table 1 The mass spectra and HPLC purity of oligonucleotides. X = 2'-F-4'-C-MOE-araU,Y = 2'-F-4'-C-MOE-rU,Z = 2'-F-araU,TS = 3'-phosphothioate-T |
在磷酸盐缓冲液 (110 mmol·L-1,pH 7.2) 中,修饰的DNA序列ON1~ON10分别与单链ssDNA或单链ssRNA形成双螺旋,如表 2所示,在序列中,以X代表 2'-F-4'-C-MOE-araU,Y代表 2'-F-4'-C-MOE-rU,Z代表 2'-F-araU。解链温度Tm值是评价化学修饰的寡核苷酸与相应的互补DNA/RNA的结合亲和力的重要参数,Tm值越高,表明双链结合强度越大。如表 2所示,2'-F-4'-C-MOE-araU (X) 修饰的ON1与互补DNA杂交的Tm值为50.5 ℃,仅低于2'-F-araU (Z) 修饰0.7 ℃,而显著高于对应的2'-F-4'-C-MOE-rU (Y) 修饰的ON2-DNA的Tm值 (仅44.1 ℃)。另一方面,ON1-RNA的Tm值为47.1 ℃,比ON2-RNA和ON3- RNA分别高出2.1和0.8 ℃,显然,以对应的天然序列ON4为参照,与Z修饰相比,X修饰更有利于ON1与互补RNA结合,并保持较高的与互补DNA的亲和力,而与Y修饰比较,则发现X修饰的ON1与互补DNA/RNA的亲和力均优于Y修饰的ON2,相应的Tm值分别提高了6.4和2.1 ℃。由此可见,糖基2'位F原子对修饰的寡核苷酸序列具有显著的影响,2'β-F较2'α-F明显有利于修饰的寡核苷酸与互补的DNA/ RNA结合,增强双链的亲和力; 同时,以对应的天然序列ON4为参照,2'-F-4'-C-MOE-rU修饰的ON2更倾向于保持与互补RNA的亲和力。
| Table 2 Tm values (℃) of duplexes formed by ON1-ON10 with their complementary strands. X = 2'-F-4'-C-MOE-araU,Y = 2'-F-4'-C-MOE-rU,Z = 2'-F-araU; 5'-d(AGCAAAAAACGC)-3' (ssDNA) and 5'-r(AGCAAAAAACGC)-3' (ssRNA) are complementary sequences for ON1-ON4,5'-d(AGCAAATAACGC)-3',5'-r(AGCAAAUAACGC)-3' for ON5-ON7,and 5'-d(AGCAA ACAACGC)-3',5'-r(AGCAAACAACGC)-3' for ON8-ON10,respectively; The experiments are performed in triplicate and the mean data are presented; literature data: Tm(ON4/DNA) = 52 ℃,Tm(ON4/RNA) = 48 ℃[32] |
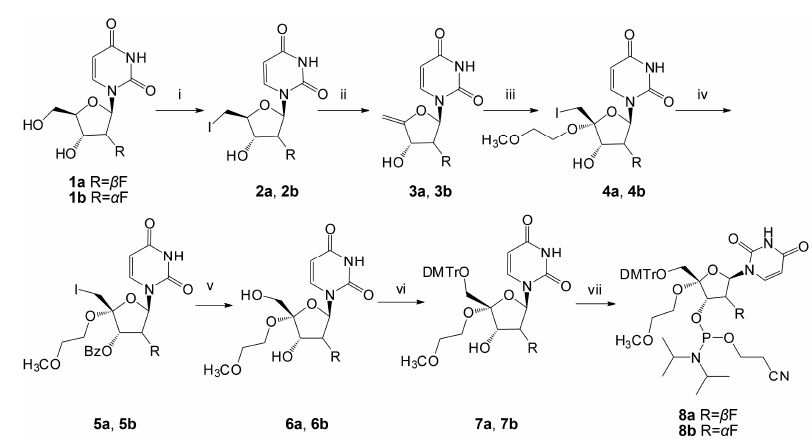
|
Figure 1 The synthesis procedure of phosphoramidites 2'-F-4'-C-MOE-araU (8a) and 2'-F-4'-C-MOE-rU (8b). Reagents and conditions: (i) Imidazole,Ph3P,I2,THF,0 ℃-r.t.,4 h; (ii) NaOMe-MeOH,reflux,3 h; (iii) 2-Methoxyethanol,PbCO3,I2,THF (dry),0 ℃-r.t.,2 h; (iv) BzCl,pyridine (dry),DCM,0 ℃-r.t.,3 h; (v) (a) K2HPO4,m-CPBA,m-CBA,n-Bu4NHSO4,DCM/H2O,0 ℃-r.t.,overnight; (b) NH3/MeOH,r.t.,4 h; (vi) DMTrCl,pyridine (dry),r.t.,12 h; (vii) 2-Cyanoethyl N,N,N',N'-tetraisopropylphosphoramidite,1H-tetrazole,DCM (dry),r.t.,3 h |
考虑到2'-F-araU中F原子可与3'-端相邻的嘌呤 碱基形成C-H…F-C假氢键,具有嘧啶-嘌呤步序 (pyrimidine-purine steps) 的2'-F-ANA可与互补的ssDNA、ssRNA形成相对更稳定的双链,为进一步评价4'-C-MOE修饰对于2'-F的作用的影响,在嘌呤核苷A和G前后分别嵌入X,如寡核苷酸序列ON5~ON10所示(表 2),其中包括用于对照的天然寡核苷酸序列ON7及ON10。从表中结果可以看到,当X 在A和G的5' 端时,含XA和XG的序列ON5和ON8与互补DNA的结合亲和力 (Tm值) 均高于相对应的X在3' 端时的AX和GX序列ON6和ON9,分别高出1.1和3.5 ℃。特别是当与互补RNA链结合时,ON5及ON8显示了显著的增强结合亲和力的能力,其Tm值分别比相应的ON6及ON9提高了5.1及3.6 ℃。总之,无论是与互补DNA还是与互补RNA结合,XA及XG步序均显著优于相应的AX和GX步序,由于2'β-F在双链中指向大沟,与3' 端嘌呤碱基H8靠近,而远离5' 端的嘌呤碱基H8,因此,该结果表明2'-F- 4'-C-MOE-araU修饰确实能够保持氟原子与嘌呤的C8-H之间形成假氢键的能力,在嘧啶-嘌呤步序下,其修饰的寡核苷酸与互补DNA/RNA的亲和力。
含XA及XG的序列ON5及ON8与互补DNA双链的Tm值分别为50.9及57.0 ℃,与对照的含TG的天然序列ON7及ON10相当; 同时,ON5及ON8与互补RNA的双链Tm值均显著高于相应的ON7及ON10,分别提高了4.7及4.2 ℃,考虑到在寡核苷酸序列中T的亲和力一般优于U[33],XA及XG片段进一步显示了2'-F-4'-C-MOE-araU修饰的寡核苷酸与互补DNA良好的结合能力,以及与互补RNA增强的杂交能力,因此,该结果再次表明4'-位MOE修饰的2'-F-ANA具有与互补RNA选择性杂交能力,同时保持与DNA结合时的热稳定性,为进一步拓展该类修饰提供了新的技术基础。
在糖基的2'-位或者4'-位引入取代基,均会对核苷糖基构象产生显著的影响,进而影响新修饰的寡核苷酸与互补DNA/RNA的亲和力。运用Discovery studio 3.0软件对2'-F-4'-C-MOE-araU和2'-F-4'-C- MOE-rU进行低能量构象搜索,并进一步使用PROSIT程序 (http://cactus.nci.nih.gov/prosit/) 对获得的低能量构象计算了二面角ϕ2 (C1'-C2'-C3'-C4') 及假旋转相位角P (pseudorotational phase angle)。发现2'-F-4'- C-MOE-araU和2'-F-4'-C-MOE-rU的低能量构象均主要处在North/East构象,并接近C4'-exo (4E,P = 54o) 构型,两者P值分别为51.67o和60.49o,由于2'-F-araU的优势构象是South/East,这与ON1和ON2更倾向于保持与互补RNA杂交能力的结果一致,该结果表明,在4'-位的MOE确可改变糖环的构象,并倾向于呈现C3' endo (North) 构象(图 2)。
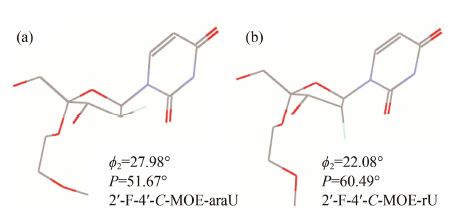
|
Figure 2 The low energy conformations of 2'-F-4'-C-MOE- araU (a) and 2'-F-4'-C-MOE-rU (b) showing the dihedral angle ϕ2 (C1'-C2'-C3'-C4') and pseudorotational phase angle P |
在2'-F-4'-C-MOE-rU低能量构象中,由于2'α-F与4'-MOE朝向相同,F原子可与MOE上的C-H靠近并形成C-H…F假氢键,同时,F2'-C2'-C1'-O4'扭转形成的旁式效应 (gauche effect) 可进一步降低五元糖环的环内扭曲柔性,使其低能量构象更加稳定[34],这与ON2与互补DNA结合时亲和力相对更低相关; 而2'-F-4'-C-MOE-araU则不存在此类似作用,该五元糖环具有更好的环内扭曲柔性,因此,它倾向于适应与互补DNA的结合。此外,2'-F-4'-C-MOE-araU的低能量构象清晰地显现了2'β-F与尿嘧啶环方向相同,当嘧啶环与3'端嘌呤环发生堆砌时,2'β-F仍将朝向嘌呤环,并与嘌呤环的C8-H之间形成假氢键。总之,糖环上的2'-F-取代对寡核苷酸杂交性质具有显著的影响,而且,4'-C-MOE修饰后的2'-F-araU仍可保持2'β-F的假氢键作用,显著增强双链热稳定性。
2.2 热变性实验—错配识别能力评价(mismatch discrimination) 错配识别能力是用来评价化学修饰后的寡核苷酸对靶基因 (RNA或DNA) 的特异性结合能力的,一般用寡核苷酸序列与完全配对和含有一个错配碱基的寡核苷酸之间杂交形成双链时的ΔTm来评估。由于2'-F-4'-C-MOE-araU修饰的寡核苷酸ON1可增强与互补RNA的结合能力,因此首先评价了2'-F-4'-C-MOE-araU (X)、2'-F-4'-C-MOE-rU (Y)、2'F-araU (Z) 修饰的ON1~ON3与单链RNA结合时的错配识别能力,并以天然序列ON4为参照。如表 3所示: ① 由于U/T与G之间可形成wobble配对,因此,X、Y、Z以及T对于G的错配识别能力均显著低于相应的C和U; ② X显示了最好的对鸟嘌呤G的错配识别能力,相应的ΔTm值为 -8.1 ℃; ③ 与Z和T比较,X、Y对于错配碱基C、U均具有相当或更好的识别能力。因此,在与ssRNA结合时,2'-F-4'-C-MOE-araU提高了对G的错配识别能力,同时具有对C、U良好的错配识别能力,因而总体上显示了相对最好的对互补配对碱基A的结合特异性。
| Table 3 Tm and ΔTm values (℃) of duplexes formed by ON1-ON4 with matched or mismatched RNA/DNA complements. X = 2'-F- 4'-C-MOE-araU,Y = 2'-F-4'-C-MOE-rU,Z = 2'-F-araU; The sequences of ssRNA,ssDNA are 5'-r(AGCAAAMAACGC)-3',5'-d(AGCAA AMAACGC)-3',M = A/G/C/U/T; ΔTm = Tm(mismatch) - Tm(match),Tm(mismatch) are not shown |
为进一步评价2'-F-4'-C-MOE-araU对互补DNA的特异性,还测定了与单链DNA杂交时解链温度之间的ΔTm值 (表 3),结果显示,X对G、C、T的错配识别能力与相应的Z和T相当,均差不超过1 ℃,而对于G的错配识别能力较T稍差 (1.4 ℃)。另外,Y对于碱基G、C及T的错配识别能力均明显低于X、Z及T; 考虑到2'-F-4'-C-MOE-araU/rU的低能量构象均倾向于North/East构象,而Z和T则倾向于South/ East构象,推测化学修饰的核苷酸对DNA和RNA的错配识别能力与糖基的优势构象相关。
总体而言,与2'-F-araU相比,修饰后的2'-F-4'-C- MOE-araU对完全配对的RNA具有相对更好的结合特异性和识别能力,同时能够保持对完全配对DNA的良好的识别能力,而2'-F-4'-C-MOE-rU仅显示了较好的对互补RNA的杂交能力。
3 酶稳定性实验天然的寡核苷酸极易被核酸酶水解,核酸化学修饰的一个重要目标就是希望能够增强修饰后的反义寡核苷酸对酶水解的稳定性。使用5'-d(TTTTTT TTUT)-3'序列为模板,合成了修饰的DNA序列ON11~ON13,评价它们对3'-外切酶蛇毒磷酸二酯酶(SVPDE) 的酶水解稳定性,并与3'-硫代修饰 (Ts) 序列ON14以及天然序列ON15作比较 (图 3)。从图 3中可以看到相对于天然序列ON15,X修饰确实能够增加寡核苷酸ON11对核酸酶水解的稳定性,40 min后仍有15% 以上的ON11未被水解。不过,感 到意外的是X对酶的耐受性效果不如2'-F-araU (Z)。同时,2'-F,4'-C-MOE-rU (Y) 显示了良好的酶耐受性,优于Z。鉴于通常2'-F-ANA对酶水解的稳定性高于2'-F-RNA[18],这个结果表明4'-位引入位阻基团并不必然会增强对核酸酶水解的稳定性,2'-F和4'-取代基相结合可产生不同的核酸酶稳定性效果,这可能与2'-F和4'-取代基对糖基构象的影响有关,末端残基的构象可能会影响到核酸酶的识别和水解能力。构效关系仍待进一步深入的研究。
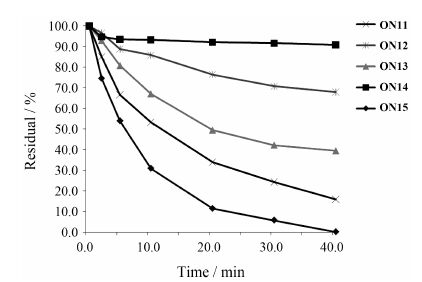
|
Figure 3 Enzymatic stability of 5'-d(TTTTTTTTUT)-3' against snake venom phosphodiesterase (SVPDE). U = 2'-F-4'-C-MOE- araU (X,ON11),2'-F-4'-C-MOE-rU (Y,ON12),2'-F-araU (Z,ON13),3'-phosphorothioate-T (Ts,ON14),natural DNA-dT (ON15) |
本研究合成了2'-F-4'-C-MOE-araU并通过亚磷酰胺合成法成功地将其嵌入了寡核苷酸序列,在dsDNA和DNA-RNA双螺旋体系中,评价了2'-F-4'-C-MOE- araU的错配识别能力和它对于热稳定性和核酸酶稳定性的贡献,并与2'-F-4'-C-MOE-rU和2'-F-araU进行了比较。与2'-F-araU相比,2'-F-4'-C-MOE-araU修饰可以增强寡核苷酸ON1对互补RNA结合的亲和 力和特异性; 同时相对于2'-F-4'-C-MOE-rU,可保持较高的与互补DNA结合的亲和力和特异性,而且,2'-F-4'-C-MOE-araU的F原子仍可与3'-端嘌呤碱基形成C-H…F-C假氢键作用,显著增强含5'-嘧啶-嘌呤-3'步序的寡核苷酸对互补DNA/RNA结合亲和力,为2'-F-4'-C-MOE-araU修饰的应用提供了新的技术基础。此外,2'-F-4'-C-MOE-araU修饰可增加寡核苷酸对核酸酶水解的稳定性,不过,其对酶的耐受性效果不如2'-F-araU以及2'-F-4'-C-MOE-rU,4'-位引入位阻基团并不必然会增强对核酸酶水解的稳定性,对核酸酶的稳定性与糖基2'-和4'-位取代基之间的构效关系仍待进一步考察。总之,这一研究为进一步的核酸化学修饰和寡核苷酸药物的开发提供了一个新的核苷修饰策略。
实验部分本文中所用试剂除一些单独提到的化学试剂以外,其他所有化学试剂均从试剂公司购买,直接使用。无水无氧反应在氮气保护下进行,利用薄层色谱 (TLC) GF254硅胶板监测反应进程。进一步的纯化 是利用快速柱色谱的方法,在Teledyne IscoInc.的Combiflash Rf 200仪器进行。质谱的结构确证使用 安捷伦1260-G6230A质谱仪进行测定。1H NMR (400 MHz)、31P NMR (162 MHz) 和19F NMR (376 MHz)使用JEOL JNM-ECA-400光谱仪,分别用四甲基硅烷 (TMS) 作为内标、85% H3PO4作为外标。寡核苷酸的合成在自动化的DNA合成仪 (K&A H-8) 进行。寡核苷酸链的质谱结构用MALDI-TOF质谱仪进行确证。CD谱在Bio-logic MOS-450分光偏振计进行。Tm值测定使用日本岛津公司UV-1800光谱仪进行紫外检测。寡核苷酸的纯化使用反相高效液相色谱,Kromasil 100-5 C18柱 (250 mm × 4.6 mm),流动相(A相: 100 mmol·L-1六氟异丙醇,31.6 mmol·L-1三乙胺,10% V/V甲醇; B相: 甲醇)
1 化合物的合成 1.1 5'-I化合物2a、2b的合成通法2',5'-双脱氧-2'-氟代-5'-碘代-β-D-阿拉伯糖基尿嘧啶(2a),灰黑色粉末,收率78%; 1H NMR (400 MHz,CD3OD) δ 7.72 (dd,J = 8.1,1.7 Hz,1H,H-4),6.23 (dd,J = 19.9,3.4 Hz,1H,H-5),5.71 (d,J = 8.2 Hz,1H,H-1'),5.07~5.06 (m,1H,H-4'),4.31~4.27 (m,1H,H-2'),3.91~3.90 (m,1H,H-3'),3.76~3.74 (m,2H,H-5'); ESI-MS m/z 357 [M+H]+,379 [M+Na]+。
2',5'-双脱氧-2'-氟代-5'-碘代-α-D-核糖基尿嘧啶 (2b),灰黑色粉末,收率89%; 1H NMR (400 MHz,CD3OD) δ 7.72 (d,J = 8.0 Hz,1H,H-4),5.92 (d,J = 20.9 Hz,1H,H-5),5.72 (d,J = 8.0 Hz,1H,H-1'),5.24~4.80 (m,1H,H-4'),4.13~4.00 (m,1H,H-2'),3.82~3.80 (m,1H,H-3'),3.67~3.30 (m,2H,H-5'); ESI-MS m/z 357 [M+H]+,379 [M+Na]+。
1.2 4',5'-双键化合物3a、3b的合成通法2',5'-双脱氧-2'-氟代-4'-亚甲基-β-D-阿拉伯糖 基尿嘧啶 (3a),黄色粉末,收率85%; 1H NMR (400 MHz,CD3OD) δ 7.48 (dd,J = 8.4,2.0 Hz,1H,H-6),6.52 (dd,J = 19.6,3.2 Hz,1H,H-10),5.72 (d,J = 8.0 Hz,1H,H-5),5.10~4.96 (m,1H,H-2'),4.67 (d,J = 10.0,2.8 Hz,2H,H-5'),4.46 (d,J = 2.4 Hz,1H,3'-OH); ESI-MS m/z 229 [M+H]+。
2',5'-双脱氧-2'-氟代-4'-亚甲基-α-D-核糖基尿嘧啶 (3b),黄色粉末,收率77%; 1H NMR (400 MHz,DMSO-d6) δ 11.47 (s,1H,NH),7.54 (dd,J = 7.8,1.1 Hz,1H,H-4),6.04~5.97 (m,2H,H-5'),5.63 (d,J = 8.1 Hz,1H,H-5),5.32 (dd,J = 53.0,5.0 Hz,1H,H-1'),4.86~4.80 (m,1H,H-2'),4.45 (s,1H,H-3'),4.22 (s,1H,3'-OH); ESI-MS m/z 229 [M+H]+。
1.3 4'-(2-甲氧乙氧基)-2',5'-双脱氧-2'-氟代-5'-碘代尿苷4a、4b的合成通法向三口烧瓶中加入3 (1 mmol)、2-甲氧基乙醇 (5 mmol)、碳酸铅 (2.5 mmol) 和10 mL四氢呋喃,冰浴下滴加10 mL四氢呋喃溶解的单质碘 (2 mmol),2 h后向反应液中加入无水亚硫酸钠溶液,将不溶物用硅藻土滤除,滤液用乙酸乙酯萃取,饱和亚硫酸钠溶液洗,饱和食盐水洗,无水硫酸钠干燥,过滤,浓缩,快速柱色谱纯化 (流动相: 二氯甲烷-甲醇=10∶1,梯度洗脱) 得化合物4。
4'-(2-甲氧乙氧基)-2',5'-双脱氧-2'-氟代-5'-碘代- β-D-阿拉伯糖基尿嘧啶 (4a),黄褐色固体,收率45%; 1H NMR (400 MHz,CDCl3) δ 8.84 (s,1H,NH),7.50 (dd,J = 5.9,2.2 Hz,1H,H-4),6.49 (dd,J =17.6,3.9 Hz,1H,H-5),5.78 (dd,J = 10.4,2.2 Hz,1H,H-1'),5.14~5.00 (m,1H,H-2'),4.55 (dd,J = 20.7,4.8 Hz,1H,H-3'),3.94~3.89 (m,1H,3'-OH),3.80~3.74 (m,6H,H-5' & -CH2-CH2-),3.42~3.39 (m,3H,OCH3); ESI-MS m/z 431 [M+H]+,453 [M+Na]+。
4'-(2-甲氧乙氧基)-2',5'-双脱氧-2'-氟代-5'-碘代- α-D-核糖基尿嘧啶 (4b),黄褐色固体,收率57%; 1H NMR (400 MHz,CDCl3) δ 9.08 (s,1H,NH),7.29~7.25 (m,2H,H-4,H-5),5.83~5.77 (m,2H,H-1' & H-2'),5.22~5.06 (m,1H,H-3'),4.70~4.64 (m,1H,3'-OH),3.91~3.40 (m,9H,H-5' & CH3); ESI-MS m/z 448 [M+NH4]+,453 [M+Na]+。
1.4 3'-OBz保护化合物5a、5b的合成通法将4 (1 mmol) 溶解于10 mL干燥的二氯甲烷中,向其中加入干燥的吡啶2 mL,冰浴冷却后滴加苯甲酰氯 (1.2 mmol),室温反应3 h,向反应液中加入少量的甲醇猝灭反应,乙酸乙酯萃取,饱和食盐水洗,无水硫酸钠干燥,过滤,浓缩,快速柱色谱纯化 (流动相: 二氯甲烷-甲醇=10∶1,梯度洗脱) 得化合物5。
4'-(2-甲氧乙氧基)-2',5'-双脱氧-2'-氟代-3'-氧代-苯甲酰基-5'-碘代-β-D-阿拉伯糖基尿嘧啶 (5a),黄白色固体,收率74%; 1H NMR (400 MHz,CDCl3) δ 9.34 (s,1H,NH),8.11 (s,1H,H-4),8.09~7.62 (m,5H,OBz),6.66 (dd,J = 15.4,4.5 Hz,1H,H-5),5.93~5.81 (m,2H,H-1' & H-2'),5.53~5.37 (m,1H,H-3'),3.88~3.44 (m,6H,H-5' & -CH2-CH2-),3.33 (s,3H,OCH3); ESI-MS m/z 535 [M+H]+。
4'-(2-甲氧乙氧基)-2',5'-双脱氧-2'-氟代-3'-氧代-苯甲酰基-5'-碘代-α-D-核糖基尿嘧啶 (5b),黄色固体,收率79%; 1H NMR (400 MHz,CDCl3) δ 8.66 (s,1H,NH),8.15 (s,1H,H-4),8.15~8.13 (m,5H,OBz),6.02 (dd,J = 20.4,2.0 Hz,1H,H-5),5.82 (dd,J = 8.2 Hz,1H,H-1'),5.66~5.55 (m,2H,H-2'& H-3'),3.96~3.41 (m,9H,H-5' & CH3); ESI-MS m/z 552 [M+NH4]+,557 [M+Na]+。
1.5 4'-(2-甲氧乙氧基)-2'-脱氧-2'-氟代-尿苷6a,6b的合成通法 将化合物5(1 mmol) 溶于20 mL二氯甲烷中,加入10 mL水,依次加入K2HPO4 (2 mmol)、(n-Bu)4NHSO4 (1.1 mmol) 和m-CBA (1.1 mmol),冰浴冷却至0 ℃,分批加入m-CPBA (4 mmol),冰浴下反应2 h后室温反应过夜,向反应液中加入亚硫酸钠溶液,反应液颜色变浅,乙酸乙酯萃取,氯化钠溶液洗,无水硫酸钠干燥,过滤,浓缩,减压抽干后,向其中加入氨甲醇溶液10 mL,室温反应8 h后,将反应液浓缩,快速柱色谱纯化 (流动相: 二氯甲烷-甲醇=10∶1,梯度洗脱) 得产物6。
4'-(2-甲氧乙氧基)-2'-脱氧-2'-氟代-β-D-阿拉伯糖基尿嘧啶(6a),浅黄色固体,收率84%; 1H NMR (400 MHz,CD3OD) δ 7.80 (t,J = 9.5,1.4 Hz,1H,H-4),6.39 (t,J = 8.1,5.9 Hz,1H,H-5),5.71 (t,J = 14.0,5.9 Hz,1H,H-1'),5.25~5.10 (m,1H,H-2'),4.49 (dd,J = 24.6,18.8 Hz,1H & H-3'),3.85~3.82 (m,6H,H-5',-CH2-CH2-),3.29 (d,J = 4.8 Hz,3H,OCH3); ESI-MS m/z 321 [M+H]+,343 [M+Na]+。
4'-(2-甲氧乙氧基)-2'-脱氧-2'-氟代-α-D-核糖基尿嘧啶 (6b),浅黄色固体,收率38%; 1H NMR (400 MHz,CD3OD) δ 7.65 (d,1H,H-4),5.94 (d,1H,H-5),5.53 (d,1H,H-1'),4.95 (dd,J = 53.8,5.6 Hz,1H,H-2'),4.40 (dd,J = 22.7,5.6 Hz,1H,H-3'),3.75~3.14 (m,9H,H-5' & OCH3); ESI-MS m/z 321 [M+H]+,338 [M+ NH4]+。
1.6 5'-ODMTr保护化合物7a、7b的合成通法向化合物6 (1 mmol) 中加入3 mL吡啶,再加入4,4'-双甲基三苯甲基氯 (1.2 mmol),用氮气保护,室温反应12 h,用甲醇淬灭反应,将吡啶尽量浓缩后加入少量水,乙酸乙酯萃取,饱和食盐水洗,无水硫酸钠干燥,过滤,浓缩,快速柱色谱纯化 (流动相: 二氯甲烷-甲醇-三乙胺=10∶1∶0.005,梯度洗脱) 得化合物7。
4'-(2-甲氧乙氧基)-2'-脱氧-2'-氟代-5'-氧代-(4,4'-二甲氧基三苯甲氧基)-β-D-阿拉伯糖基尿嘧啶的合成 (7a),淡黄色泡沫状固体,收率54%; 1H NMR (400 MHz,CDCl3) δ 7.59 (t,J = 1.4 Hz,1H,H-4),7.39~7.25 (m,11H,ArH),6.45 (dd,J = 11.2,5.0 Hz,1H,H-5),5.46 (s,1H,NH),5.21~5.06 (m,1H,H-1'),4.65 (d,J = 22.4 Hz,1H,H-2'),3.79~3.73 (m,8H,OCH3),3.44~3.37 (m,6H,H-5'& -CH2-CH2-); ESI-MS m/z 645 [M+Na]+。
4'-(2-甲氧乙氧基)-2'-脱氧-2'-氟代5'-氧代-(4,4'-二甲氧基三苯甲氧基)-α-D-核糖基尿嘧啶的合成 (7b),淡黄色泡沫状固体,收率88%; 1H NMR (400 MHz,CDCl3) δ 7.70 (d,J = 8.1 Hz,1H,NH),7.37~7.25 (m,12H,ArH),6.20 (d,J = 17.9 Hz,1H,H-4),5.32 (d,J = 8.2 Hz,1H,H-1'),5.01 (dd,J = 53.0,5.6 Hz,1H,H-2'),4.73 (dd,J = 21.6,5.6 Hz,1H,H-3'),3.80 (s,6H,OCH3),3.78~3.73 (m,1H,3'-OH),3.50~3.44 (m,6H,CH2),3.33 (s,3H,4'-CH3); ESI-MS m/z 645 [M+Na]+。
1.7 亚磷酰胺化合物8a、8b的合成通法氮气保护下,向化合物7 (1 mmol)、1H-四氮唑 (1 mmol) 注射加入干燥的二氯甲烷5 mL,搅拌均匀后注射加入4 mL干燥的二氯甲烷溶解的氰乙基-N,N,N',N'-四异丙基亚磷酰胺 (1.5 mmol),室温反应5 h,向反应液中加入少量的水,二氯甲烷萃取,饱和碳酸氢钠水溶液、饱和氯化钠溶液洗,无水氯化镁干燥,过滤,浓缩,快速柱色谱纯化 (流动相: 二氯甲烷-甲醇=10∶1,梯度洗脱) 得化合物8。
4'-(2-甲氧乙氧基)-2'-脱氧-2'-氟代-5'-氧代-(4,4'-二甲氧基三苯甲基)-β-D-阿拉伯糖基尿嘧啶-3'-氧代- (2-氰乙基-N,N-二异丙基) 磷酰胺 (8a),淡黄色泡沫状固体,收率58%; 31P NMR (162 MHz,CDCl3) δ 153.54,152.26; 19F NMR (376 MHz,Methanol-d4) δ -107.84,-120.56。ESI-MS m/z 823 [M+H]+,845 [M+Na]+。
4'-(2-甲氧乙氧基)-2'-脱氧-2'-氟代-5'-氧代-(4,4'-二甲氧基三苯甲基)-α-D-核糖基尿嘧啶-3'-氧代-(2-氰乙基-N,N-二异丙基) 磷酰胺 (8b),淡黄色泡沫状固体,收率96%; 31P NMR (162 MHz,CDCl3) δ 153.10,151.54; 19F NMR (376 MHz,Methanol-d4) δ -193.24,-193.26。ESI-MS m/z 823 [M+H]+,845 [M+Na]+。
2 寡核苷酸链的合成RNA均从广州RiboBio公司购买,其他的寡核苷酸链在DNA自动合成仪 (K&A H-8) 进行。采用标准的 1 μmol量合成程序。所有的亚磷酰胺单体制备成最终浓度为0.11 mol·L-1的乙腈溶液,修饰的亚磷酰胺单体的最终浓度是0.15 mol·L-1的乙腈溶液。当合成修饰的碱基单体时,进行两次偶合,且每次偶合时间延长至6 min,当合成结束后,用28% 的浓氨水在55 ℃下处理8至12 h,将寡核苷酸从固相载体上切割下来,同时除去碱基和磷酸上的保护基。将DMTr保护基团脱掉并将寡核苷酸从固相载体上切割下来是通过氢氧化铵溶液 (28% 氨水) 在55 ℃条件下8至12 h进行。采用RP-HPLC对寡核苷酸粗品进行纯化。得到的纯品寡核苷酸通过HPLC色谱法进行纯度分析,寡核苷酸链的质谱结构用MALDI-TOF质谱仪进行确证 (表 1)。
3 热变性实验 (Tm值)退火缓冲液: 10 mmol·L-1 Na3PO4、100 mmol·L-1 NaCl,pH 7.2。两条寡核苷酸单链用退火缓冲液稀释,使其终浓度均为2 μmol·L-1,95 ℃水浴加热5 min,缓慢冷却至室温,在4 ℃冰箱中放置过夜。在比色皿中加入100 μL待测样品,用热隔离盖子盖牢。选用15 ℃作为起始测定温度,90 ℃作为终止温度,温度的上升速率为0.5 ℃·min-1,A260读取速率为每度1次,最后由仪器给出Tm值。每个样品重复测定3次,取平均值作为最终结果。
4 核酸酶稳定性实验在37 ℃生理条件下,对寡核苷酸进行酶解。在不同时间点 (0、2、5、10、20、30、40 min) 取出孵育液,用HPLC对其进行定量分析,得到相应的含量-时间曲线。
缓冲体系: 50 mmol·L-1 Tris-HCl、10 mmol·L-1 MgCl2、pH 8.0。HPLC分析条件: Waters型HPLC,流速: 1 mL·min-1; 进样量: 10 μL; 流动相A: 水,流动相B: 甲醇; 梯度设定为在0~8 min内由A ∶B = 98∶2 (V/V) 到A∶B = 92∶8 (V/V); 紫外检测器波长: 260 nm。酶稳定性测定: 取0.017 5 nmol·L-1样品溶 于适量缓冲液中 (280 μL),同时加入0.02 μg·mL-1的SVPDE 2.5 mL蛇毒磷酸二酯酶 (SVPDE),37 ℃孵育。在0、2、5、10、20、30、40 min取出50 μL孵育液,150 μL甲醇沉淀蛋白,离心10 min后取150 μL上清液抽干后加入150 μL水,用HPLC法检测样品的含量。根据测出的未降解的样品的百分含量,绘制出样品的含量−时间曲线。
5 构象搜索方法采用Discovery Studio 3.0 (Accelrys,Inc.) 软件进行构象搜索。整个过程使用软件默认的原子和化学键参数。化合物使用软件中的‘prepare ligands’工具进行结构优化,随后在CHARMm力场下用‘generate conformations’工具进行构象搜索,所得最低能量构象以‘.mol’文件在线输入至PROSIT程序 (http://cactus.nci.nih.gov/prosit/) 计算,获得最低能量构象相应的二面角ϕ2 (C1'-C2'-C3'-C4') 及假旋转相位角P值。
| [1] | Crooke ST. Molecular mechanisms of action of antisense drugs[J]. Biochim Biophys Acta (BBA)-Gene Struct Expression , 1999, 1489 :31–43. DOI:10.1016/S0167-4781(99)00148-7 |
| [2] | Stephenson ML, Zamecnik PC. Inhibition of Rous sarcoma viral RNA translation by a specific oligodeoxyribonucleotide[J]. Proc Natl Acad Sci USA , 1978, 75 :285–288. DOI:10.1073/pnas.75.1.285 |
| [3] | Askari FK, Mcdonnell WM. Antisense-oligonucleotide therapy[J]. N Eng J Med , 1996, 334 :316–318. DOI:10.1056/NEJM199602013340508 |
| [4] | Crooke ST. Molecular mechanisms of antisense drugs:RNase H[J]. Antisense Nucleic Acid Drug Dev , 1998, 8 :133–134. DOI:10.1089/oli.1.1998.8.133 |
| [5] | Pirollo KF, Rait A, Sleer LS, et al. Antisense therapeutics:from theory to clinical practice[J]. Pharmacol Ther , 2003, 99 :55–77. DOI:10.1016/S0163-7258(03)00053-6 |
| [6] | Crooke ST. Therapeutic applications of oligonucleotides[J]. Ann Rev Pharm , 1995, 10 :329–376. |
| [7] | Zheng SJ, Ren H, Wang SQ. The development of antisense oligonucleotides[J]. Int J Lab Med (国际检验医学杂志) , 2004 (6) :506–509. |
| [8] | Aboul-Fadl T. Antisense oligonucleotides:the state of the art[J]. Curr Med Chem , 2005, 12 :2193–2214. DOI:10.2174/0929867054864859 |
| [9] | Crooke ST. Vitravene——another piece in the mosaic[J]. Antisense Nucleic Acid Drug Dev , 1998, 8 :vii–viii. DOI:10.1089/oli.1.1998.8.vii |
| [10] | Hair P, Cameron F, Mckeage K. Mipomersen sodium:first global approval[J]. Drugs , 2013, 73 :487–493. DOI:10.1007/s40265-013-0042-2 |
| [11] | Burnett JC, Rossi JJ. RNA-based therapeutics:current progress and future prospects[J]. Chem Biol , 2012, 19 :60–71. DOI:10.1016/j.chembiol.2011.12.008 |
| [12] | Rosazza C, Deschout H, Buntz A, et al. Endocytosis and endosomal trafficking of DNA after gene electrotransfer in vitro[J]. Mol Ther Nucleic Acids , 2016 :e286. |
| [13] | Sahay G, Querbes W, Alabi C, et al. Efficiency of siRNA delivery by lipid nanoparticles is limited by endocytic recycling[J]. Nat Biotechnol , 2013, 31 :653–658. DOI:10.1038/nbt.2614 |
| [14] | Dirin M, Winkler J. Influence of diverse chemical modifications on the ADME characteristics and toxicology of antisense oligonucleotides[J]. Expert Opin Biol Ther , 2013, 13 :875–888. DOI:10.1517/14712598.2013.774366 |
| [15] | Deleavey GF, Damha MJ. Designing chemically modified oligonucleotides for targeted gene silencing[J]. Chem Biol , 2012, 19 :937–954. DOI:10.1016/j.chembiol.2012.07.011 |
| [16] | Stein CA, Cheng YC. Antisense oligonucleotides as therapeutic agents-is the bullet really magical?[J]. Science , 1993, 261 :1004–1012. DOI:10.1126/science.8351515 |
| [17] | Englisch U, Gauss DH. Chemically modified oligonucleotides as probes and inhibitors[J]. Angew Chem Int Ed , 1991, 30 :613–629. DOI:10.1002/(ISSN)1521-3773 |
| [18] | Watts JK, Damha MJ. 2'F-Arabinonucleic acids (2'F-ANA)-History,properties,and new frontiers[J]. Can J Chem , 2008, 86 :641–656. DOI:10.1139/v08-049 |
| [19] | Kalota A, Karabon L, Swider C, et al. 2'-Deoxy-2'-fluoro-β-D-arabinonucleic acid (2'F-ANA) modified oligonucleotides (ON) effect highly efficient,and persistent,gene silencing[J]. Nucleic Acids Res , 2006, 34 :451–461. DOI:10.1093/nar/gkj455 |
| [20] | Muthiah M, Akin A, Pandey RK, et al. Unique gene-silencing and structural properties of 2'-fluoro-modified siRNAs[J]. Angew Chem Int Ed , 2011, 50 :2284–2288. DOI:10.1002/anie.201006519 |
| [21] | Michal M, Alena I, Leumann CJ. Synthesis and properties of 6'-fluoro-tricyclo-DNA[J]. J Org Chem , 2015, 80 :3556–3565. DOI:10.1021/acs.joc.5b00184 |
| [22] | Wang J, Liu H. Application of fluorine in drug design[J]. Chin J Org Chem (有机化学) , 2011, 31 :1785–1798. |
| [23] | Stergaard ME, Timothy D, Andres B, et al. Comparison of duplex stabilizing properties of 2'-fluorinated nucleic acid analogues with furanose and non-furanose sugar rings[J]. J Org Chem , 2014, 79 :8877–8881. DOI:10.1021/jo501381q |
| [24] | Martín-Pintado N, Yahyaee-Anzahaee M, Deleavey GF, et al. Dramatic effect of furanose C2'substitution on structure and stability:directing the folding of the human telomeric quadruplex with a single fluorine atom[J]. J Am Chem Soc , 2013, 135 :5344–5347. DOI:10.1021/ja401954t |
| [25] | Seth PP, Yu J, Jazayeri A, et al. Synthesis and antisense properties of fluoro cyclohexenyl nucleic acid (F-CeNA),a nuclease stable mimic of 2'-fluoro RNA[J]. J Org Chem , 2012, 77 :5074–5085. DOI:10.1021/jo300594b |
| [26] | Anzahaee MY, Watts JK, Alla NR, et al. Energetically important C-H…F-C pseudohydrogen bonding in water:evidence and application to rational design of oligonucleotides with high binding affinity[J]. J Am Chem Soc , 2011, 133 :728–731. DOI:10.1021/ja109817p |
| [27] | Radek L, Jan SE, Ivan B, et al. 4'-Alkoxy oligodeoxynucleotides:a novel class of RNA mimics[J]. Org Biomol Chem , 2011, 9 :8261–8267. DOI:10.1039/c1ob06148h |
| [28] | Hoshika S, Minakawa N, Matsuda A. Synthesis and physical and physiological properties of 4'-thioRNA:application to post-modification of RNA aptamer toward NF-κB[J]. Nucleic Acids Res , 2004, 32 :3815–3825. DOI:10.1093/nar/gkh705 |
| [29] | Fensholdt J, Thrane H, Wengel J. Synthesis of oligodeoxynucleotides containing 4'-C-(hydroxymethyl) thymidine:novel promising antisense molecules[J]. Tetrahedron Lett , 1995, 36 :2535–2538. DOI:10.1016/0040-4039(95)00301-R |
| [30] | Wang G, Seifert WE. Synthesis and evaluation of oligodeoxynucleotides containing 4'-C-substituted thymidines[J]. Te trahedron Lett , 1996, 37 :6515–6518. DOI:10.1016/0040-4039(96)01432-3 |
| [31] | Wang Q, Hu WD, Wang SY, et al. Synthesis of new 2'-deoxy-2'-fluoro-4'-azido nucleoside analogues as potent anti-HIV agents[J]. Eur J Med Chem , 2011, 46 :4178–4183. DOI:10.1016/j.ejmech.2011.06.020 |
| [32] | Masaru N, Takeshi B, Tetsuya K, et al. Synthesis,RNA selective hybridization and high nuclease resistance of an oligonucleotide containing novel bridged nucleic acid with cyclic urea structure[J]. Chem Commun , 2010, 46 :5283–5285. DOI:10.1039/c0cc00154f |
| [33] | Freier SM, Altmann KH. The ups and downs of nucleic acid duplex stability:structure-stability studies on chemically-modified DNA:RNA duplexes[J]. Nucleic acids Res , 1997, 25 :4429–4443. DOI:10.1093/nar/25.22.4429 |
| [34] | Gore KR, Harikrishna S, Pradeepkumar P. Influence of 2'-fluoro versus 2'-O-methyl substituent on the sugar puckering of 4'-C-aminomethyluridine[J]. J Org Chem , 2013, 78 :9956–9962. DOI:10.1021/jo4012333 |
| [35] | Martínez-Montero S, Deleavey GF, Dierker-Viik A, et al. Synthesis and properties of 2'-deoxy-2',4'-difluoroarabinosemodified nucleic acids[J]. J Org Chem , 2015, 80 :3083–3091. DOI:10.1021/jo502948t |
| [36] | Saúl MM, Deleavey GF, Anupriya K, et al. Rigid 2',4'-difluororibonucleosides:synthesis,conformational analysis,and incorporation into nascent RNA by HCV polymerase[J]. J Org Chem , 2014, 79 :5627–5635. DOI:10.1021/jo500794v |
 2016, Vol. 51
2016, Vol. 51


