2. 上海中医药大学附属曙光医院, 肝病研究所, 上海 201203 ;
3. 上海高校中医内科学E-研究院, 上海 201203
2. Institute of Liver Diseases, Shuguang Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China ;
3. E-institute of TCM Internal Medicine, Shanghai Municipal Education Commission, Shanghai 201203, China
肝纤维化的发生、发展与异常血管生成和重构密切相关[1],肝窦损伤及其肝窦毛细血管化是肝血管新生的主要形式,其发生于纤维化之前[2],是纤维化病理的特殊形式及组成部分。肝窦内皮细胞是这一病理变化的重要细胞学基础[3]。病理性肝血管新生会加重肝纤维化活动性,物质交换产生障碍,进一步影响肝细胞功能,使肝纤维化更加难以逆转。动物实验表明,采用血管新生抑制剂索拉非尼后,能有效减缓肝硬化的发展[4, 5]。抗肝窦毛细血管化是防治肝纤维化、肝硬化及其并发症的重要治疗策略,因此,本实验采用索拉非尼作为阳性对照药。
丹参为中国传统中药材,具有活血祛瘀、通经止痛和凉血消痈等功效。研究发现,其可通过抗过氧化、抑制炎性因子释放和改善肝脏微循环达到抗肝纤维化的作用[6]; 还能调节血管内皮生长因子 (vascular endothelial growth factor,VEGF) 及其受体 (vascular endothelial growth factor receptor 2,VEGFR2)、基质金属蛋白酶 (matrix metalloproteinases) 和NO等调节血管新生[7]。其脂溶性成分隐丹参酮可改善肝功能和抗肝纤维化[8, 9],并可从多途径调节血管新生[10],对肿瘤血管[11]、鸡胚尿囊膜的血管生成[12]、人脐静脉内皮细胞和人胃癌SGC-7901细胞等具有抑制作用[13-15]。本研究采用人肝窦内皮细胞 (human hepatic sinusoidal endothelial cells,HHSEC) 增殖模型,观察药物对细胞增殖、表型、NO水平及生成血管能力的影响,并通过斑马鱼血管新生模型在整体水平上进行验证,进一步对隐丹参酮抗肝纤维化血管新生的活性进行评价,探讨其抑制血管新生作用是否与调节肝窦内皮细胞功能有关。
材料与方法药物与试剂 隐丹参酮 (CAS#35825-57-1,上海融禾医药科技发展有限公司,纯度≥98%); 索拉非尼 (sorafenib,Bayer公司); 内皮细胞培养液 (ECM,Cat#1001)、胎牛血清 (Cat#0025)、内皮细胞生长因子 (ECGS,Cat#1052) (Scinecell公司); DMSO (Cat #0231,Sigma公司); 胞内血管性血友病因子 (vWF) 抗体(Cat#ab6994,Abcam公司); 5-乙炔基-2'-脱氧尿苷 (EdU) 细胞增殖试剂盒 (Cat#C10310,广州锐博生物科技有限公司); CCK8 (Cat#C0037)、一氧化氮 (NO) 荧光探针 (Cat#S0019) (碧云天生物技术研究所); Matrigel (Cat#356234,BD Biosciences公司)。
细胞培养 HHSEC购自Sciencell公司,以含5% 胎牛血清 (FBS) 和5% ECGS的ECM培养液37 ℃培养,每3~4天传代1次。
斑马鱼模型 转基因斑马鱼 (VEGFR:GFP) 由山东省科学院提供。
细胞模型 2% (v/v) ECGS诱导HHSEC增殖,以不添加ECGS为对照。
细胞毒性 HHSEC以每孔6 000个接种于96孔板中,待生长至亚单层,弃原细胞培养液,分别加入2.5、5、10、20和40 μmol·L-1隐丹参酮条件培养基,每组设6个复孔,孵育24 h后弃培养液,每孔加入CCK8溶液100 μL,孵育2 h后于450处检测吸收度值 (A)。
细胞增殖 HHSEC以每孔7 500个接种于96孔板中,待生长至亚单层,弃原细胞培养液,除对照组外,各组加入2% ECGS诱导细胞增殖,以2.5 μmol·L-1索拉非尼与10 μmol·L-1隐丹参酮组孵育24 h, 每组设 4个复孔,孵育后弃原培养液,每孔加入50 μmol·L-1 EdU溶液100 μL,孵育2 h,弃上清,4% 多聚甲醛4 ℃固定15 min,0.2% 甘氨酸孵育10 min,磷酸盐缓冲 液(PBS) 洗涤5 min×2次,0.5% Triton X-100透膜 10 min,PBS洗涤5 min,EdU染色反应液避光孵育 30 min,PBS洗涤5 min,Hoechst (1∶2 000) 避光孵育5 min,PBS洗涤5 min×2次,Thermo scientific varioskan flash采集图像并分析。CCK8法检测细胞活力,方法同细胞毒性。
免疫荧光法检测vWF表达 取对数生长期HHSEC,除对照组外,各组加入2% ECGS诱导细胞增殖,以2.5 μmol·L-1索拉非尼与10 μmol·L-1隐丹 参酮孵育24 h,每组设4个复孔,孵育后弃原培养液,多聚甲醛固定15 min,PBS洗2次,2.5%小牛血清白蛋白室温封闭1 h,一抗4 ℃孵育过夜,PBS洗3次,二抗37 ℃避光孵育1 h,Hoechst染核5 min,PBS洗 涤3次,50% 甘油封片,激光共聚焦观察并采集图像,Image-Pro Plus6.0对vWF荧光表达进行半定量分析,计算积分光密度值 (integrated option density,IOD)。
荧光探针法检测胞内NO水平 取对数生长期HHSEC,除对照组外,各组加入2% ECGS诱导细胞增殖,以2.5 μmol·L-1索拉非尼与10 μmol·L-1隐丹参酮组孵育24 h,每组设3个复孔,孵育后弃培养液,每孔加入NO探针100 μL,孵育20 min后,PBS洗涤3次。Thermo scientific varioskan flash (激发波长495 nm,发射波长515nm) 读板并计算平均荧光强度。
管腔形成 96孔板中每孔预先加入Matrigel Matrix 100 μL,37 ℃聚合1 h; 调节HHSEC数至1×105/mL,2.5 μmol·L-1索拉非尼组与10 μmol·L-1隐丹参酮组培养液中预先加入2% ECGS,与细胞悬液按1∶1混合,每孔200 µL铺在基质胶上,每组设3复孔,孵育8 h,Olympus倒置显微镜下观察管腔形成情况并采集图像,并统计完整管腔数。
斑马鱼实验 转基因斑马鱼 (VEGFR:GFP) 受精卵发育24 h,96孔板中培养,每孔预加入100 μmol·L-1索拉非尼与10 μmol·L-1隐丹参酮,以不含药物胚胎培养用水为对照,每组10条,置于光照培养箱 (28 ℃) 内继续发育24 h,显微镜下观察,记录节间血管的血流数。采用三卡因甲磺酸盐麻醉,荧光显微镜下对节间血管进行计数并拍照。观察结束后,4%多聚甲醛中固定,甲醇脱水,丙酮透化,碱性磷酸酶染色,显微镜下拍照。
统计学处理 计量资料用x± s表示,所有数据均使用SPSS 17.0软件包进行统计学分析,组间比较使用单因素方差分析,以P < 0.05为差异具有统计学意义。
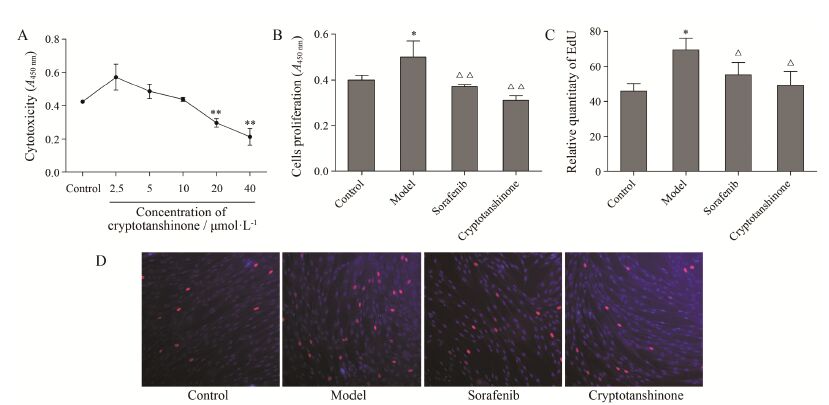
结果 1 隐丹参酮对HHSEC毒性测定采用CCK8法检测结果显示,隐丹参酮浓度超过10 μmol·L-1后细胞数量显著减少 (P < 0.01,图 1A),具有明显毒性。故后续实验设定药物剂量小于10 μmol·L-1。
|
Figure 1 Effects of cryptotanshinone on the proliferation of human hepatic sinusoidal endothelial cells (HHSEC) induced by endothelial cell growth supplements (ECGS). Cells were treated for 24 h. A: Cytotoxicity (CCK8,A450 nm),n = 6,x± s; B: Cell proliferation (CCK8,A450 nm),n = 4,x± s; C: The quantitative results of the mean fluorescence intensity detected by EdU; D: Cell proliferation (5-ethynyl-2'-deoxyuridine,EdU,x100). Model: 2% ECGS; Sorafenib: 2.5 μmol·L-1; Cryptotanshinone: 10 μmol·L-1. P < 0.05,**P < 0.01 vs control; △P < 0.05,△△P < 0.01 vs model |
采用CCK8法检测结果显示,与空白对照组比 较,ECGS诱导的HHSEC活力和细胞增殖明显 (P < 0.05); 2.5 μmol·L-1索拉非尼和10 μmol·L-1隐丹参酮使细胞活力和增殖显著下降 (P < 0.01) (图 1B)。EdU法检测结果显示,与空白对照组比较,ECGS诱导的 HHSEC胞内平均荧光强度显著增高 (P < 0.05); 与模型组相比,2.5 μmol·L-1索拉非尼组与10 μmol·L-1隐丹参酮组平均荧光强度显著下降 (P < 0.05) (图 1C,D)。结果表明隐丹参酮能够显著抑制ECGS诱导的HHSEC增殖。
3 隐丹参酮对ECGS诱导的HHSEC细胞vWF表达及NO水平的影响vWF免疫荧光染色显示,与空白对照组相比,ECGS诱导的HHSEC中vWF平均荧光强度显著升 高 (P < 0.01); 与模型组相比,2.5 μmol·L-1索拉非尼和10 μmol·L-1隐丹参酮组平均荧光强度显著降低 (P < 0.01) (图 2A,B)。荧光探针法检测NO水平显示,与空白对照组相比,ECGS诱导的HHSEC平均荧光强度显著升高 (P < 0.05); 与模型组相比,2.5 μmol·L-1索拉非尼组与10 μmol·L-1隐丹参酮组平均荧光强度显著降低 (P < 0.05) (图 2C)。结果表明,隐丹参酮对HHSEC表型标志物vWF表达及胞内NO水平具有调节作用。

|
Figure 2 Effects of cryptotanshinone on von willebrand factor (vWF) expression and nitric oxide (NO) levels in HHSEC induced by ECGS. Cells were treated for 24 h. A: Immunofluorescence staining of vWF (x100); B: The quantitative results of vWF expression analyzed by integrated option density (IOD); C: The quantitative results of NO levels analyzed by mean fluorescence intensity,n = 3,x± s. Model: 2% ECGS; Sorafenib: 2.5 μmol·L-1; Cryptotanshinone: 10 μmol·L-1. P < 0.05,**P < 0.01 vs control; △P < 0.05,△△P < 0.01 vs model |
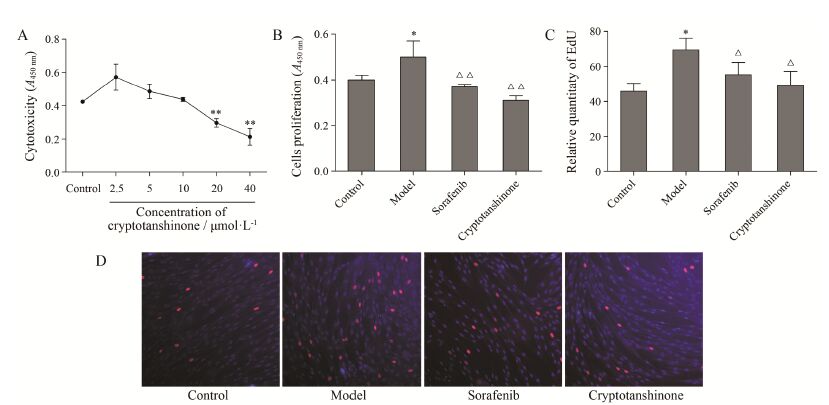
管腔形成实验结果显示,ECGS诱导的HHSEC在底物胶作用下形成管腔样结构,在2.5 μmol·L-1索拉非尼、10 μmol·L-1隐丹参酮作用下HHSEC形成的管腔结构显著减少 (P < 0.01) (图 3A、C)。斑马鱼实验结果显示,与空白对照组相比,100 μmol·L-1索拉非尼组与10 μmol·L-1隐丹参酮组斑马鱼功能血管数显著减少 (P < 0.01) (图 3B、D)。结果表明,隐丹参酮在细胞和整体水平对血管新生具有抑制作用。
|
Figure 3 Effects of cryptotanshinone onthe tube formation of HHSEC induced by 2% ECGS,n = 3. A: Tube formation in Matrigel (x40). B: Observation of the intersegmental vessels of transgenic zebrafish. C: The tube formation numbers of HHSEC were quantified by manual counting. D: The quantitative results of numbers of function vessels in transgenic zebrafish. n = 10,x± s. **P < 0.01 vs control |
肝纤维化是多种慢性肝病引起的损伤修复反应,缺氧或肝脏微环境改变在肝纤维化发生中起到重 要作用[16]。肝窦内皮细胞对缺氧十分敏感,而血管 增生常常是缺氧的代偿性反应。肝组织缺氧时,缺氧诱导因子-1α (hypoxia-inducible factor-1α,HIF-1α)/ VEGF/丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK) 等信号通路激活可导致肝窦内皮细胞增殖。在体外模型筛选中,本研究选用含VEGF因子的ECGS诱导HHSEC增殖,预实验中探索了2.5、5和10 μmol·L-1浓度下隐丹参酮的药效,最后以 10 μmol·L-1为实验药物浓度。EdU检测结果显示隐丹参酮对细胞增殖具有显著抑制作用。
同时,在ECGS刺激下,HHSEC中的内皮型一氧化氮合酶 (endothelial nitric oxide synthasee,eNOS)活性增强,催化更多的NO产生,引起内皮细胞通透性及窗孔结构发生改变[17-19],在加入索拉非尼、隐丹参酮干预后,胞内NO水平随之显著降低,表明药物对细胞增殖时合成NO的能力具有调节作用。肝窦内皮细胞在增殖和迁移过程中表型也同时发生改变: 窗孔减少或消失、内皮下连续性基底膜形成,同时第八因子相关抗原 (factor Ⅷrelated antigen)/vWF等肝窦内皮细胞标志物重新表达[20],最终导致肝窦毛细血管化与新血管芽生。因此,选择vWF作为观察肝窦内皮细胞表型变化的标记物,结果显示,在HHSEC增殖的同时,细胞vWF平均荧光强度显著升高,隐丹参酮可以显著降低vWF的表达,对细胞表型具有一定的调节作用。
HHSEC是血管生成的理想的细胞载体,本实验通过管腔形成模拟体外血管形成过程。血管荧光标 记的转基因斑马鱼作为一种新型的模式生物,在鉴定新生血管上具有直观性强和定量简便等优势[21, 22],广泛应用于血管活性药物的筛选。本研究采用以上两种模型,分别从细胞和整体水平上验证药物。结果表明,ECGS诱导的HHSEC在底物胶作用下可形成管腔样结构,隐丹参酮可显著抑制HHSEC管腔形成,并对斑马鱼功能血管数具有显著抑制作用。
综上所述,隐丹参酮能够抑制HHSEC增殖,下调vWF表达及胞内NO水平,抑制HHSEC形成管腔样结构及斑马鱼功能血管数,以调节肝窦内皮细胞功能从而抑制血管新生。本研究仅观察了隐丹参酮对肝窦毛细血管化所相关的细胞增殖、表型、NO水平及成血管能力等指标的影响,有关涉及更深层次的信号通路尚待后续研究进一步完善。
| [1] | Wu XX, Zhang CZ, Wang X, et al. Targeting angiogenesis and vascular remodeling as a novel therapeutic approach to liver fibrosis[J]. Acta Pharm Sin (药学学报) , 2015, 50 :535–540. |
| [2] | Straub AC, Stolz DB, Ross MA, et al. Arsenic stimulates sinusoidal endothelial cell capillarization and vessel remodeling in mouse liver[J]. Hepatology , 2007, 45 :205–212. DOI:10.1002/(ISSN)1527-3350 |
| [3] | Wang BY, Fu BY, Zhang J, et al. The influence of alcohol on the liver sinusoids endothelial cell fenestrae of rats[J]. Chin J Hepatol (中华肝脏病杂志) , 2004, 12 :479–481. |
| [4] | Tugues S, Fernandez-Varo G, Munoz-Luque J, et al. Antiangiogenic treatment with sunitinib ameliorates inflammatory infiltrate,fibrosis,and portal pressure in cirrhotic rats[J]. Hepatology , 2007, 46 :1919–1926. DOI:10.1002/hep.21921 |
| [5] | Mejias M, Garcia-Pras E, Tiani C, et al. Beneficial effects of sorafenib on splanchnic,intrahepatic,and portocollateral circulations in portal hypertensive and cirrhotic rats[J]. Hepatology , 2009, 49 :1245–1256. DOI:10.1002/hep.22758 |
| [6] | Tao YY, Liu CH. Progress of research on mechanism of salvia miltiorrhiza and its chemical ingredients against liver fibrosis[J]. J Chin Integr Med (中西医结合学报) , 2004, 2 :145–148. DOI:10.3736/jcim |
| [7] | Chi XX, Gao XY. Progress on Radix Salviae Miltiorrhiae modulating angiogenesis and its mechanisms[J]. Strait Pharm J (海峡药学) , 2010, 22 :3–6. |
| [8] | Fang Y, Zhu BL, Zhang Y. Improvement of cryptotanshinone on hepatic encephalopathy in rats with cirrhosis induced by lipopolysaccharide[J]. Drugs Clin (现代药物与临床) , 2016, 31 :11–16. |
| [9] | Xu JK, Kurihara H, Zheng JJ, et al. Protective effect of tanshinones against liver injury in mice loaded with restraint stress[J]. Acta Pharm Sin (药学学报) , 2006, 41 :631–635. |
| [10] | Zhuang Q, Mao W. Research Advances in mechanism of bioactive tanshinones in Salviae Miltiorrhiae regulating angiogenesis[J]. J Zhejiang Chin Med Univ (浙江中医药大学学报) , 2014, 38 :506–510. |
| [11] | Ye H, Ruan JS, Wang SM. Research progress on anti-tumor metastasis of cryptotanshinone[J]. Chin Pharmacol Bull (中国药理学通报) , 2014, 30 :893–896. |
| [12] | Bian WP, Xu Y, Wang J, et al. The antiangiogenesis effect of cryptotanshinone on chick embryo chorioallantoic membrane[J]. J Chin Microcirc (中国微循环) , 2007, 11 :23–26. |
| [13] | Fan XM, Ren GX, Liang QL, et al. Study on inhibitory effects and mechanism of lipophilic components in Salvia miltiorrhiza on angiogenesis in vitro[J]. China J Chin Mater Med (中国中药杂志) , 2014, 39 :744–747. |
| [14] | Zhu ZJ.The Effect and Mechanism of Cryptotanshinone on Angiogenesis (基于生物网络调控下丹参抗肿瘤血管生成研究——隐丹参酮对血管生成的影响及机制研究)[D].Jiangsu:Nanjing University of Chinese Medicine,2014. |
| [15] | Deng FC, Yu ZJ, Yang Y, et al. Effect of cryptotanshinone on the proliferation and vascular endothelial growth factor mRNA expression in human gastric cancer cell line SGC-7901[J]. China Med Her (中国医药导报) , 2015, 12 :7–10. |
| [16] | Liu CH, Lv J. Liver fibrosis project meeting report of AASLD[J]. Chin Hepatol (肝脏) , 2007, 12 :138–142. |
| [17] | Zhang ZL, Zhang F, Lu Y, et al. Update on implications and mechanisms of angiogenesis in liver fibrosis[J]. Hepatol Res , 2015, 45 :162–178. DOI:10.1111/hepr.12415 |
| [18] | Iwakiri Y, Grisham M, Shah V. Vascular biology and pathobiology of the liver:report of a single-topic symposium[J]. Hepatology , 2008, 47 :1754–1763. DOI:10.1002/hep.22203 |
| [19] | Deleve LD. Liver sinusoidal endothelial cells in hepatic fibrosis[J]. Hepatology , 2015, 61 :1740–1746. DOI:10.1002/hep.27376 |
| [20] | Lee JS, Semela D, Iredale J, et al. Sinusoidal remodeling and angiogenesis:a new function for the liver-specific pericyte?[J]. Hepatology , 2007, 45 :817–825. DOI:10.1002/(ISSN)1527-3350 |
| [21] | Ding LL, Liu M, Zhang SH, et al. Lidamycin inhibits angiogenesis of zebrafish embryo via down-regulation of VEGF[J]. Acta Pharm Sin (药学学报) , 2010, 45 :456–461. |
| [22] | Cross LM, Cook MA, Lin S, et al. Rapid analysis of angiogenesis drugs in a live fluorescent zebrafish assay[J]. Arterioscler Thromb Vasc Biol , 2003, 23 :911–912. DOI:10.1161/01.ATV.0000068685.72914.7E |
 2016, Vol. 51
2016, Vol. 51


