脑胶质瘤 (glioma) 是最常见的颅内恶性肿瘤,约占所有恶性脑肿瘤的80%,具有发病率高、复发率高、死亡率高和治愈率低等特点。胶质瘤的治疗是手术、放疗和化疗为主的综合治疗[1, 2]。替莫唑胺是新一代口服烷化剂,能透过血脑屏障,是目前治疗胶质瘤疗效最好的一线药物[3, 4],但是其临床有效率不足45%。究其原因,是因为肿瘤细胞对替莫唑胺反应性差或具有原发或继发性耐药作用[5-7]。由于目前治疗脑胶质瘤的抗肿瘤药物单一,因此开发新型可透过血脑屏障的抗肿瘤药物,对于脑胶质瘤的治疗具有重要的临床意义。
抗肿瘤药物开发的临床前研究中,通常采用动物肿瘤移植瘤模型和人肿瘤异体移植模型评价药物的有效性,肿瘤移植部位主要在皮下。然而,对于需要通过血脑屏障治疗脑胶质瘤药物的体内药效学评价而言,皮下移植瘤模型并不能充分反映药物的特性和疗效。随着技术的发展,影像技术已成为肿瘤研究、临床试验和临床诊断必不可少的工具[8-11]。而动物影像技术也逐步应用到基础研究中,其包括结构成像和功能成像,具体技术有B超、小动物活体三维多模式成像系统 (PE IVIS Spectrum CT)、NMR、PET以及体内光学成像等[12]。体内光学成像主要采用生物发光和荧光两种技术在活体动物内进行生物标记,通过成像系统来监测动物体内被标记的分子及细胞的发展过程[13, 14]。因此,本文拟利用荧光素酶和红色荧光蛋白双标记的人脑胶质瘤细胞U87MG-mCherry-luc,建立脑胶质瘤原位移植瘤动物模型,通过整合多种影像技术监测原位肿瘤大小,为验证化合物的抗脑胶质瘤作用提供有效而直观的评价方法。
材料与方法细胞与试剂 人胶质瘤细胞系U87MG-mCherry- luc、荧光素购自上海科远迪生物科技有限公司。替莫唑胺购自百灵威公司。BALB/c裸鼠,体重17~19 g,SPF级,雌性,由北京华阜康生物科技股份有限公司提供,动物合格证号: 11401300029929。裸鼠包饲养。
仪器 小动物活体成像系统Berthold LB983 (德国),小动物活体三维多模式成像系统PE IVIS Spectrum CT (美国),小动物核磁共振成像仪BRUKER PharmaScan 7.0T/16 US (德国)。
细胞培养 U87MG-mCherry-luc细胞于含5% CO2的37 ℃培养箱中培养传代。培养基为含10% 胎牛血清、100 u·mL-1 青霉素、100 μg·mL-1链霉素和200 μg·mL-1潮霉素的DMEM; 待细胞密度达到90% 时,0.25% 胰酶-EDTA消化传代。
造模 裸鼠用50 mg·kg-1戊巴比妥钠腹腔注射麻醉后,将动物俯卧位固定于小鼠脑立体定位仪上。用酒精消毒裸鼠头皮后,手术刀矢状切开裸鼠头皮,3% H2O2清洁切口,暴露颅骨。延前囟后2 mm,旁开右侧1.5 mm,牙科钻打孔。26号微量注射器手动注射5 μL细胞悬液 (1×106个细胞),进针深度3 mm,退针0.5 mm,注射时间约30 s。停针5 min后,缓慢拔针,消毒缝合切口。腹腔注射5万单位青霉素抗感染。待手术后进行活体成像 (IVI) 和磁共振成像 (MRI) 检测。
药物治疗 原位移植U87MG-mCherry-luc的荷瘤小鼠造模5天后开始给予药物,替莫唑胺组每天口服给予50 mg·kg-1,连续给药5天; 模型组每天口服给予生理盐水,连续给药5天。
IVI检测 裸鼠用50 mg·kg-1戊巴比妥钠麻醉 后,腹腔注射150 mg·kg-1的荧光素,5 min后利用小动物活体成像系统进行IVI化学发光检测。
Micro-CT检测 裸鼠用异氟烷麻醉后,腹腔注射150 mg·kg-1荧光素,5 min后利用小动物活体三维多模式成像系统进行Micro-CT检测。
MRI检测 裸鼠用异氟烷麻醉后,利用小动物核磁共振成像仪进行MRI检测。检测参数为: T2_ TurboRARE,TR/TE = 5 000/40,6 Averages,20 × 20视野,0.5 mm层厚。肿瘤体积 = Lmax × W × T,其中Lmax为肿瘤最大直径,W为肿瘤最大直径垂直对应的短 径,T为MRI扫描到的肿瘤断层数乘以层厚0.5 mm。
统计学分析 实验结果用x± s表示,用Graph Pad Prism 5统计软件进行统计分析。两组间数据比较采用Student’s t检验。
结果 1 裸鼠原位移植模型建立为了避免人脑胶质瘤U87MG-mCherry-luc细胞在动物体内接种后化学发光信号丢失影响检测结果,接种前通过荧光显微镜确认U87MG-mCherry-luc细胞。图 1A为可见光视野,由图 1B可见细胞呈现红色荧光,将荧光视野与可见光视野利用Image J软件合并后 (图 1C),可见荧光比例大于60%。由于mCherry和Luciferase基因 (Luc) 共用同一启动子,因此通过检测含有荧光信号的比例可以预测Luciferase基因的比例。在细胞中加入底物荧光素后,通过活体成像系统观察到U87MG-mCherry-luc高表达的Luciferase迅速催化其底物 (图 1D)。
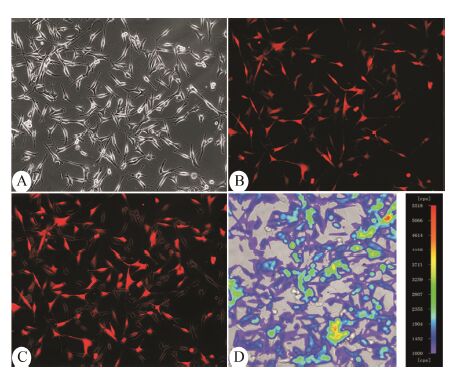
|
Figure 1 U87MG-mCherry-luc cell. A: Optical image (10×); B: Red fluorescence (10×); C: Merge image of optical image and red fluorescence; D: Bioluminescence,exposure time 1 s |
通过活体成像系统观察到裸鼠颅内原位接种U87MG-mCherry-luc细胞后第5天具有明显的化学发光信号 (图 2A)。由于接种肿瘤细胞后仅5天,脑内肿瘤细胞数较少,MRI检测未能观察到明显的肿瘤影像。但造模后第13天,MRI检测可见明显肿瘤影像 (图 2B)。利用小动物活体三维多模式成像系统对荷瘤小鼠进行三维重构,可见脑部肿瘤 (图 2C)。不同影像检测结果均表明裸鼠原位移植瘤模型建立成功。

|
Figure 2 U87MG-mCherry-luc in orthotopic xenograft model. A: Bioluminescence of U87MG-mCherry-luc in day 5,exposure time 60s; B: MRI image of U87MG-mCherry-luc in day 13; C: 3D optical tomography for micro-CT and bioluminescence of U87MG-mCherry-luc in day 13,exposure time 60 s |
由图 3A可见造模后第13天,替莫唑胺组化学发光信号强度低于模型组,结果表明替莫唑胺可抑制裸鼠颅内肿瘤,其化学发光信号强度与模型组比较具有统计学差异 (图 3B)。荷瘤裸鼠的MRI影像结果可见,模型组有明显肿瘤,而替莫唑胺组未见肿瘤 (图 4),其中图 4A为每只动物MRI影像的第9张断层扫描图,每组共5只动物; 图 4B为每组取1只代表性动物的全部MRI影像断层扫描图。通过MRI软件测量每只动物肿瘤最大长径及垂直对应的短径,进行肿瘤体积统计,模型组瘤体积为202.0 ± 120.4 mm3。造模后第13天的活体成像和MRI结果均表明替莫唑胺可有效抑制裸鼠颅内肿瘤的生长。

|
Figure 3 Bioluminescence of U87MG-mCherry-luc in orthotopic xenograft model after temozolomide (TMZ) treatment in day 13. A: Bioluminescence of U87MG-mCherry-luc,exposure time 60 s,n = 5; B: Overall photon count. n = 5,x± s. P < 0.05 vs control group |
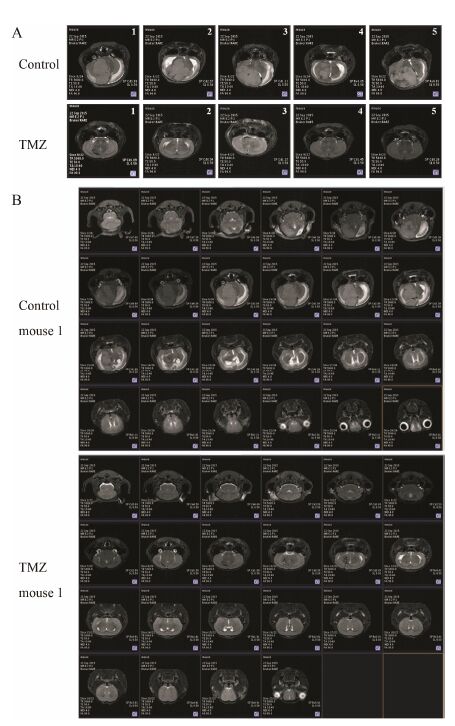
|
Figure 4 Magnetic resonance imaging (MRI) of U87MG- mCherry-luc in orthotopic xenograft model after TMZ treatment in day 13. A: MRI at slice 9 of all 5 mice in each group; B: Representative MRI for one mouse in each group |
造模后第13天,替莫唑胺组MRI结果未见肿瘤,但活体成像结果仍可检测到残留的肿瘤细胞,提示替莫唑胺并未完全消除肿瘤细胞; 模型组动物由于颅内肿瘤增大,体重明显降低,出现死亡,而替莫唑胺组状态良好。第20天,MRI检测仍未见肿瘤。第37天替莫唑胺组MRI检测可观察到明显肿瘤,对应的活体成像化学发光信号显著增强。第40天后替莫唑胺组开始出现动物死亡 (图 5)。动态结果表明,在肿瘤不同发展阶段联合活体成像与MRI影像技术对原位脑瘤进行检测,可全面而直观地评价替莫唑胺体内的抗肿瘤活性。

|
Figure 5 In vivo monitoring of tumor growth in orthotopic xenograft model. A: In vivo imaging (IVI) monitoring of tumor growth,exposure time 60s; B: MRI monitoring of tumor growth; C: Life curve in orthotopic xenograft model |
近年来脑胶质瘤发病率逐渐升高,而临床上用于治疗脑胶质瘤一线化疗药物仅有替莫唑胺,且替莫唑胺容易产生耐药,因此,开发新型的抗脑胶质瘤药物对于脑胶质瘤的临床治疗具有重要的临床意义。目前,抗肿瘤药物的临床前药效学评价通常采用皮下移植瘤模型,因为血脑屏障的缘故,该模型不能准确评价药物的抗脑瘤作用,也不能有效反映体内肿瘤的生物学进展,如血管生成、浸润和转移。随着影像技术的发展,原位移植瘤模型已逐渐用于评价能透过血脑屏障的抗肿瘤药物。
小动物核磁共振成像系统可直观观察体内肿瘤的形状和大小,并计算肿瘤体积,但在原位接种肿瘤细胞初期,由于肿瘤细胞较少,MRI并不能观察到肿瘤。在本研究中,荷瘤裸鼠接受替莫唑胺药物治疗后第20天,通过MRI并未检测到肿瘤。
小动物活体成像系统是采用生物发光和荧光两种技术在活体动物内进行生物标记,通过成像系统来监测动物体内被标记的分子及细胞的发展过程。其具有高灵敏度,在原位移植瘤模型初期或药物治疗后,可有效观察监测体内的肿瘤细胞,进一步结合Micro-CT,考察体内肿瘤的转移。本研究中,荷瘤裸鼠接受替莫唑胺治疗后,MRI并未检测到肿瘤,而活体成像可检测到残存的肿瘤细胞,但由于小动物活体成像系统是通过光学强度进行评价,因此不能像MRI一样精确计算肿瘤体积。此外,在利用荧光进行检测时,活体动物自身会有荧光的背景干扰,而生物发光可以避免这种状况。在双标记的胶质瘤细胞进行体内动物实验前,通过检测含有荧光信号的比例可以预测Luciferase基因的比例,防止动物体内接种后化学发光信号的丢失。
本研究建立的脑胶质瘤裸鼠原位模型,系统整合了IVI和MRI影像技术,通过发挥各种影像技术的优势,可实时监测在肿瘤发生发展及不同的治疗阶段体内肿瘤细胞,考察肿瘤的行为学特性,有效地评价药物疗效。此技术将改变抗脑瘤药物药效学评价方式,解决肿瘤药物临床前研发过程中的关键问题,有利于肿瘤药物的开发。
| [1] | Glioma Guidelines Working Party. Chinese Clinical Practice Guidelines for diagnosis and treatment of gliomas (2012)[J]. Nat Med J China (中华医学杂志) , 2012, 92 :2309–2313. |
| [2] | Ziu M, Kalkanis SN, Gilbert M, et al. The role of initial chemotherapy for the treatment of adults with diffuse low grade glioma:a systematic review and evidence-based clinical practice guideline[J]. J Neurooncol , 2015, 125 :585–607. DOI:10.1007/s11060-015-1931-x |
| [3] | Taal W, Bromberg JE, van den Bent MJ. Chemotherapy in glioma[J]. CNS Oncol , 2015, 4 :179–192. DOI:10.2217/cns.15.2 |
| [4] | van den Bent MJ. Chemotherapy for low-grade glioma:when,for whom,which regimen?[J]. Curr Opin Neurol , 2015, 28 :633–938. DOI:10.1097/WCO.yxxb-51-8-124500257 |
| [5] | Perazzoli G, Prados J, Ortiz R, et al. Temozolomide resistance in glioblastoma cell lines:implication of MGMT,MMR,P-glycoprotein and CD133 expression[J]. PLoS One , 2015, 10 :e0140131. DOI:10.1371/journal.pone.0140131 |
| [6] | St-Coeur PD, Poitras JJ, Cuperlovic-Culf M, et al. Investigating a signature of temozolomide resistance in GBM cell lines using metabolomics[J]. J Neurooncol , 2015, 125 :91–102. DOI:10.1007/s11060-015-1899-6 |
| [7] | Auffinger B, Spencer D, Pytel P, et al. The role of glioma stem cells in chemotherapy resistance and glioblastoma multiforme recurrence[J]. Expert Rev Neurother , 2015, 15 :741–752. DOI:10.1586/14737175.2015.1051968 |
| [8] | Sancey L, Dufort S, Josserand V, et al. Drug development in oncology assisted by noninvasive optical imaging[J]. Int J Pharm , 2009, 379 :309–316. DOI:10.1016/j.ijpharm.2009.05.034 |
| [9] | Leblond F, Davis SC, Valdés PA, et al. Pre-clinical wholebody fluorescence imaging:review of instruments,methods and applications[J]. J Photochem Photobiol B , 2010, 98 :77–94. DOI:10.1016/j.jphotobiol.2009.11.007 |
| [10] | Kim HL. Optical imaging in oncology[J]. Urol Oncol , 2009, 27 :298–300. DOI:10.1016/j.urolonc.2008.10.028 |
| [11] | Tichauer KM, Wang Y, Pogue BW, et al. Quantitative in vivo cell-surface receptor imaging in oncology:kinetic modeling and paired-agent principles from nuclear medicine and optical imaging[J]. Phys Med Biol , 2015, 60 :R239–R269. DOI:10.1088/0031-9155/60/14/R239 |
| [12] | Condeelis J, Weissleder R. In vivo imaging in cancer[J]. Cold Spring Harb Perspect Biol , 2010, 2 :a003848. |
| [13] | Licha K, Olbrich C. Optical imaging in drug discovery and diagnostic applications[J]. Adv Drug Deliv Rev , 2005, 57 :1087–1108. DOI:10.1016/j.addr.2005.01.021 |
| [14] | Kaijzel EL, van der Pluijm G, Löwik CWGM. Whole-body optical imaging in animal models to assess cancer development and progression[J]. Clin Cancer Res , 2007, 13 :3490–3497. DOI:10.1158/1078-0432.CCR-07-0402 |
 2016, Vol. 51
2016, Vol. 51


