2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
药物的代谢及药代动力学与药物的生物利用度、安全性及有效性密切相关,特别是具有多种成分的中药口服入药后,其复杂的体内过程会对其药效产生重要的影响。如何利用现代分析技术,阐明中药复杂体系的体内过程,是中药药效物质基础及作用机制研究的关键环节。现代质谱技术的发展解决了中药成分复杂、药效成分浓度低、干扰成分多等分析难点,极大地推动了中药代谢及药代动力学的相关研究。
中药代谢研究通常包括体内、体外两个方面,体外研究主要以肝微粒体、肠内菌等为实验材料,研究主要成分在模拟体内环境下的代谢产物及途径,为体内过程的研究提供依据。而体内研究是寻找并发现中药成分在动物或人体内的代谢产物,推测其代谢途径,并对其药代动力学过程及其规律进行深入研究。本文扼要介绍了质谱技术的发展与基本原理,并从体内和体外两个方面总结了质谱技术在中药代谢及药动学研究中的主要应用。
1 质谱技术简介自1912年第一台质谱仪器出现,经过100多年的发展,质谱技术已经发生了翻天覆地的变化。不断出现的质谱离子化及质量分析技术,极大地推进了质谱仪器更新换代的进程,同时也使质谱技术的应用范围不断扩展。例如,20世纪80年代末出现的两种软电离质谱技术—电喷雾电离及基质辅助激光解吸电离质谱技术,由于解决了生物大分子的电离难题,获得了2002年诺贝尔化学奖。其中,电喷雾电离技术由于电离效率高、分析范围宽、稳定性好、灵敏度高等优点,一跃成为最佳的液相色谱-质谱联用接口,并被广泛应用于生命科学、医药学、天然产物化学等诸多领域。电喷雾电离的主要原理如下: 流入毛细管的样品溶液在电场作用下雾化形成带电小液滴,在雾化气流作用下溶剂逐渐蒸发,表面电荷密度不断增加,并发生“爆裂”,反复循环直至形成待测物离子[1]。该电离方式对样品破坏程度小,不容易形成碎片离子,适用于极性及热不稳定化合物的分析。而由于电喷雾电离可以使生物大分子带上多电荷,从而大大扩展了质谱仪器的质量扫描范围,满足了生物大分子的分析需求[2-6]。电喷雾电离质谱与液相色谱联用时,比较合适的流速在0.5 mL·min-1左右。而对于极性较小、热不稳定化合物的分析,可以采用20世纪80年代出现的大气压化学电离技术与液相色谱联用进行分析。大气压化学电离源的原理如下: 样品溶液通过进样毛细管进入加热管中被加热气化,在加热管出口处放置电晕放电针,使挥发的溶剂分子电离,形成等离子体,样品分子与等离子体反应,实现样品离子化,得到样品的单电荷准分子离子[7]。大气压化学电离适用的流速范围为0.5~2 mL·min-1。而作为质谱仪器核心部件的质量分析器,自1918年出现单聚焦磁质谱质量分析器,到20世纪40年代出现的双聚焦磁质谱及飞行时间质量分析器,50年代出现的离子阱及60年代的离子回旋共振质量分析器,以及90年代末出现的轨道阱质量分析器,质谱的质量分析技术随着科学技术的进步得以完善和创新,不断有新的惊喜带给人们。尤其是高分辨质量分析技术 (离子回旋共振及轨道阱) 及串联质谱技术的发展,极大地推进了生命科学及医药学领域相关研究的进展。
在药物代谢及药代动力学研究领域,具有多反应监测功能的三级四极杆质谱是不可或缺的分析工具[8-12]。而离子阱质谱的多级串联功能及四极杆-飞行时间质谱的高分辨及串联质谱能力,可以为代谢物的结构表征提供有用的信息。此外,具有超高分辨能力的离子回旋共振及轨道阱质谱得到的精确质量的高精度测定结果,将提供代谢物及其特征碎片准确的元素组成信息,为未知物的结构鉴定起到进一步确证的作用[13, 14]。
除上述质谱电离及质量分析技术外,近年来为满足各领域研究的需求,出现了常压电离技术及质谱成像技术。常压电离质谱技术可以实现敞开式环境中的质谱分析,具有实时、原位、高通量分析等特点。自2004年美国普渡大学Cooks小组提出解吸电喷雾电离 (desorption electrospray ionization,DESI)[15]的概念以来,短短几年内出现了包括DART[16]、ELDI[17]、ASAP[18]、EESI[19]、DAPCI[20]、DBDI[21]等多种新型敞开式离子化技术。而质谱成像技术(MSI) 是一种结合质谱与影像可视化的分子成像技术,一般对生物组织样品进行多点检测从而得到多维数据,实现了不同分子的同时检测,能够获取目标样品的空间分布和分子结构信息。目前,按照电离方式不同,MSI技术主要可分为在真空条件下进行离子化的二次离子质谱 (secondary ion mass spectrometry,SIMS)[22]、基质辅助激光解吸电离(MALDI)[23]质谱,以及以DESI[15, 24, 25]离子源为代表的常压敞开式离子化质谱成像技术。
2 现代质谱及其联用技术在体外代谢研究中的应用与体内代谢研究相比,中药体外研究方法具有一定优势: 排除体内多种因素的干扰而直接对代谢过程进行监测,实验操作步骤简单,重现性好,可以为整体药理实验提供数据支持。其中,肝微粒体细胞色素P450 (CYP450) 和肠内菌体外培养是药物体外代谢研究的两种重要模型。
2.1 细胞色素P450代谢肝脏是药物代谢的主要器官,而肝微粒体中大量存在的CYP450是最大的药物代谢酶蛋白超家族之一,催化药物的Ⅰ相反应。近年来,以质谱为分析手段的CYP450研究主要集中在代谢产物、代谢路径分析,以及药物对CYP450主要亚型酶活性的抑制或活性评价等方面。科研人员[26-29]对生物碱类成分在大鼠及人的肝微粒体CYP450中的代谢进行了研究,并应用液相色谱-串联质谱技术对代谢产物进行分析,推断出它们的代谢路径,同时还研究了对各药物进行代谢的主要亚型,为临床安全用药提供了科学依据。有研究[30]应用超高效液相色谱-质谱建立了一种高效、快速、灵敏的分析方法,其特点是选择了质谱检测的单离子反应监控 (selective ion reaction monitor) 模式,有效排除了其他干扰峰,并利用该方法对丹皮酚在人及3种动物肝微粒体中的O-去甲基代谢进行了研究,评价了种属间酶活性的不同。液相色谱-质谱联用技术除了用于药物在CYP450酶中的代谢研究,还被用于中药提取物或中药单体成分对CYP450酶中主要亚型的抑制作用研究,预测药物间的相互作用[31, 32]。Yu等[33]应用高效液相色谱-质谱对泽泻醇A在人、大鼠肝微粒体和重组细胞色素P450 (3A4) 中的代谢产物进行研究,结果表明: 泽泻醇A主要由细胞色素P450 (3A4) 代谢产生。He等[34]对黄酮类化合物6种CYP450亚型酶的体外抑制活性进行了研究 比较,通过建立的LC-MS/MS方法发现33种黄酮类化合物对CYP450的6种亚型酶 (CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A4) 有不同程度的抑制,为预测中药-中药间的相互作用提供了理论依据。Song等[35-41]应用超高效液相色谱-串联 质谱技术研究了刺五加叶、川乌等多种中药提取物 及单体成分在CYP450酶中的代谢产物,结合主要CYP450亚型酶的特异性抑制剂及底物,对其代谢途径及其对CYP450亚型酶活性的影响进行了深入研究。以乌头类中药中主要的双酯型生物碱类成分— 次乌头碱为例 (图 1),利用UPLC-MS/MS及高分 辨质谱 (HRMS) 分析出了次乌头碱在大鼠肝微粒 体CYP450中的7种代谢产物,并选取了CYP2C、CYP1A2、CYP2D、CYP3A和CYP2E1的5种特异性抑制剂来确定各代谢产物的CYP450的代谢亚型。上述研究结果为相关中药的新药研发和临床合理配伍提供了依据。
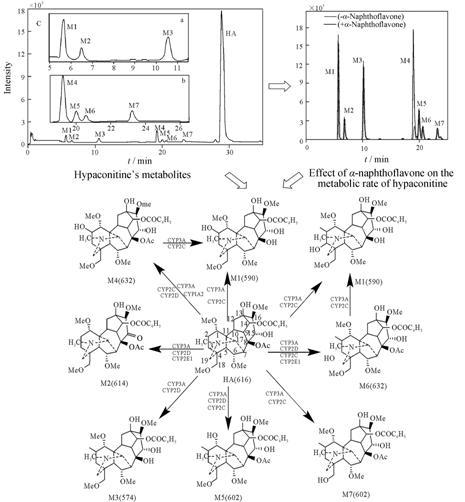
|
Figure 1 The flowchart of hypaconitine’s metabolites in rat liver microsomes by UPLC-MS/MS[35] |
中药口服入药后,首先在消化道被肠内菌代谢。因此,中药的肠内菌代谢研究对其代谢机制、药理活性研究都具有重要的意义。国内外在应用质谱及色 谱-质谱联用的方法进行中药肠内菌代谢的研究,主要是对中药单体成分的代谢产物进行分离鉴定,推断其代谢路径[42, 43]。随着现代质谱技术的发展及液相色谱-质谱联用技术分离度及灵敏度的提高,使中药复杂体系肠内菌代谢的研究成为可能。Zhao等[44-46]利用多级串联质谱,结合高分辨质谱技术鉴定了乌头碱的87种肠内菌代谢产物 (图 2)。利用多级串联质谱及电喷雾相对定量分析方法对乌头类中药的单体成分、单味药、药对及复方中生物碱的肠内菌代谢生物转化进行了深入研究[47, 48]。将UPLC-MSn技术应用于川乌提取物的肠内菌代谢研究中,发现中药提取物的代谢存在不同组分的竞争效应,得到了川乌提取物的整体肠内菌代谢轮廓[49,50]。上述研究结果表明,液相色谱-质谱联用技术具有其他分析方法不可替代的优势,尤其适合于新的痕量代谢产物的发现及其结构鉴定。

|
Figure 2 Biotransformation of 16-O-demethylaconitine in human intestine and electrospray ionization tandem mass spectrometry[46] |
微透析 (MD) 是一种以透析原理为基础的新型生物取样技术。在基本不干扰生物正常生命活动的前提下,具有半透膜结构的探针被插入动物体液或组织间隙液中,待测物沿着膜内外的浓度梯度逐渐扩散至膜内并达到一种动态平衡,灌流液将待测物源源不断带出体外从而达到取样的目的。近年来微透析取样技术正逐步应用于中药药代动力学的研究中。
3.1.1 药代动力学研究微透析技术应用于药物代谢动力学研究,不仅能够排除大分子物质,简化样品前处理过程,并且可以实现单个或多个特定部位的连续实时采样,提高实验效率,降低动物使用数量以及减少个体差异对结果的干扰[51, 52]。在整个采样过程中,实验动物基本没有体液的损失,有效避免了传统采样方式中由于体内血量减少对药物分布消除带来的影响。Wei等[53]利用微透析结合超快速液相色谱-串联质谱联用技术 (UFLC-MS/MS) 探究了五味子中6个木脂素类成分穿过血脑屏障的能力及其在脑内的药代动力学情况。Yu等[54]利用微透析技术-超高效液相色谱-质谱方法研究了大鼠皮层、海马、下丘脑和纹状体中冰片对栀子苷药代动力学的影响,发现冰片能够显著促进栀子苷在海马及下丘脑区域的转运,但对皮质区的转运有轻微的抑制作用。Wang等[55, 56]研发了微透析在线联用接口装置,实现了微透析取样技术与超高效液相色谱-质谱的在线联用,并利用该装置研究了刺五加叶提取物中主要成分金丝桃苷、1,5-二咖啡酰奎宁酸和槲皮素在假手术大鼠和缺血大鼠脑内的药代动力学。同时,研究了大鼠脑
内神经递质类成分的变化,以探究刺五加叶提取物主要成分透过血脑屏障的能力及对脑缺血大鼠的神经保护作用 (图 3)。该方法可以同时研究内源性及 外源性物质的变化规律,有效避免了离线采样保存过程中对样品的影响,实现了内源性及外源性物质的实时监测。除了时间上的连续取样外,微透析取样技术还不受空间约束,可以实现多个组织器官位点的同时采样。Huang等[57]利用双位点微透析取样及超高效液相色谱-串联质谱 (UPLC-MS/MS) 方法同时测定了静脉给药后黄芩苷在大鼠血液及脑组织间隙液中的药代动力学情况,研究中还发现在抗凝枸橼酸葡萄糖溶液 (ACD) 以及人工脑脊液 (aCSF) 中添加EDTA-Na2 (0.04%) 和L-半胱氨酸 (0.02%) 将有效改善黄芩苷在灌流液中不稳定的情况,增加实验结果的准确度。

|
Figure 3 Diagram of the online microdialysis-LC-MS/MS method [38] |
相比于传统的取样方式,微透析技术具有组织损伤轻和保持机体完整性的优点,可以在一只动物体内采集多个时间点样品,实现代谢产物的动态观测。Liu等[58]在大鼠灌胃给药知母皂苷提取物后,采用微透析技术取样,液相色谱四级杆-飞行时间质谱联用 (UPLC-Q-TOF/MS) 方法获得精确质量数及碎片信息,鉴定血液中的知母活性成分及代谢产物。Wen等[59]采用微透析动态取样技术,结合LC-DAD-TOF/MS方法研究了毛异黄酮和芒柄花素在大鼠肝微粒体中的代谢产物,分析鉴定出毛异黄酮的两个羟基化的代谢产物和芒柄花素的3个代谢产物。Cao等[60]建立了微透析取样联合LTQ-MSn技术快速灵敏检测山茱萸在大鼠体内代谢物的方法,并研究了山茱萸炮制前后母体化合物及代谢物的变化,7个母体化合物和3个新代谢产物被首次发现。
3.2 液相色谱-质谱联用技术近年来,质谱技术与其他分离分析技术的联用,特别是液相色谱-质谱联用为中药样品及其代谢物的复杂体系的分离分析提供了有效手段。而质谱与其他分析技术的联用还包括紫外光谱、核磁共振、圆二色谱等,不同的分析方法之间信息相互补充,为中药及其代谢产物的定性定量分析提供了强有力的手段。
3.2.1 代谢物分析中药经过体内代谢后成分变得更加复杂,有些代谢产物含量较低,给代谢物定性分析带来了一定困难,而液/气相色谱-质谱联用技术不仅可以将代谢物从复杂的体系中分离,还能够排除血、尿等基质的干扰,实现微量代谢物的分析。Han等[61]利用UPLC-QTOF/MS研究了龙胆苦苷在人体 内的代谢产物。人口服 给药后采集尿液样品,利用UPLC-QTOF/MS方法鉴定出了尿液中龙胆苦苷的15种代谢产物; 并且结合核磁共振 (NMR) 和圆二色谱 (ECD) 技术对鉴定出的代谢物进行立体结构确认,发现龙胆苦苷在人体内经过氧化、环化、葡醛酸结合和去糖基化反应等一些新颖的代谢转化,结合相关活性实验证明了具有肝脏保护作用的活性代谢产物— G05和G06,为新药研发提供了科学数据的支持。由于中药的整体调节作用,相比单一成分,复方和中药提取物的代谢研究也越来越受到关注。有研 究[62, 63]利用液相色谱-高分辨质谱分析技术分别对复方丹参片剂及蟾酥的原形成分及血液、尿液中代谢产物进行了鉴定分析,为中药活性组分的筛选及新药研发提供了有效的化学信息。
3.2.2 药代动力学中药成分众多,其药理作用往往是多种成分共同作用的效果。因此,中药的药代 动力学应该对其中的多种成分同时进行研究。研究 者[64-66]应用高效液相色谱-串联质谱 (LC-MS/MS) 技术首次建立了两种相互补充的中药多成分药代动力学研究方法,并将低浓度电解质效应及脉冲梯度洗脱色谱技术应用到药代动力学研究中,显著提高了液-质联用技术作为中药多成分体内微量分析方法的可测性和可用性[67, 68]。Li等[69]建立了血浆中穿心莲内酯琥珀酸盐的LC-MS/MS检测方法,并用此方法进行了人血浆中穿心莲内酯琥珀酸盐的药代动力学研究,该方法大大提高了检测的灵敏度,加快了分析速度。
超高效液相色谱的出现使样品分析分离进入了一个新的高度,超高效液相色谱-质谱的联用也成为了药物代谢产物分析的最佳选择。Cheng等[70]应用超高效液相色谱/四级杆-飞行时间质谱方法快速对灵芝粗提物在大鼠的代谢产物进行了分离鉴定,每个样品分析时间仅用30 min,在胆汁内发现并鉴定了90种代谢产物。Sun等[71]建立了RRLC-QTOF/MS方法,将高分辨串联质谱应用于人参皂苷Rc及其代谢产物的药代动力学研究中,并发现人参皂苷在大鼠体内以去糖基化为主要代谢途径,结合药代动力学结果,有利于更好地了解人参的生物活性。Zhu等[72]利用高灵敏度超快速液相色谱-串联质谱方法 (UFLC-MS/ MS) 考察了中药复方栀子大黄汤中2种环烯醚萜苷、2种蒽醌类和4种黄酮苷类化合物在正常大鼠和胆汁淤积性肝损伤大鼠血液中的药代动力学特征,通过四级杆-离子阱串联质谱 (QTRAP-MS/MS) 中多反应离子监控模式 (MRM) 实现了多种化合物的同时检测,并通过方法学的验证证明了该方法的可靠性。
3.3 常压离子化质谱新技术的应用常压离子化技术是近年来出现的质谱电离新技术。由于其样品前处理过程简单,可以进行实时、原位分析,以解吸电喷雾电离 (DESI) 及实时直接分析 (DART) 为代表的常压敞开式离子化质谱新技术自从出现以来,已经成为近年来质谱研究的热点之一。这些不断出现的质谱新技术凭借其独特的优势也越来越广泛地应用到医药学、生命科学、食品安全等各个领域。
作为一种较早商品化的敞开式离子化方法,DART-MS由于特别适合小分子化合物的原位、实时分析,在中药代谢领域正逐渐被人们所认知。Li等[73]利用DART-MSn方法研究乌头类生物碱经过大鼠肠内菌代谢后的代谢产物轮廓,共鉴定出来自3种乌头类双酯型生物碱的36种代谢产物,并且该方法还能满足原形及代谢物的定量分析要求。相比于传统的ESI-MS及LC-MS方法,DART-MSn实现了高通量、快速的代谢物原位检测; Le Pogam等[74]利用DART- MS研究了一种藻类化合物的代谢产物,其原位分析结果与溶剂提取后的分析结果相比能够提供更多有用的代谢物组分信息,并在对二级代谢产物的检测过程中发现了DART离子过程中的热传导,从而建立了脱水反应的阿仑尼乌斯曲线。由此可以看出,DART- MS方法已经不仅仅局限于提供质量数方面的信息,其探究化学生态学及植物分布规律等更多信息的可能性也逐渐被人们所发现。
DESI-MS作为近年来出现的一种新型常压离子化技术,在药代动力学、新药研发、治疗药物检测方面显示出了诸多优势。Siebenhaar等[75]将DESI-MS与干血纸片 (DBS) 采样方式结合,监测了水杨酸在人体血液中的含量变化,有望成为一种临床治疗药物监测的有效方法; Lubin等[76]建立了一种基于DESI-MS技术鉴定药物代谢物的生物分析方法,该方法简便省时,只需一步的样品衍生化即可使研究者推断其功能基团存在与否,可在新药研发过程中提供关键数据以便于获得该化合物毒理学及药理学的信息。尽管常压离子源与传统离子化方式相比显示了一定的优势,但是其灵敏度、重现性等性能 方面还不尽人意,这也限制了其在药物代谢领域的应用,尤其是对于更加复杂的中药体系,其代谢方面的研究还鲜有报道。相信随着常压离子源性能的提高及相关分析新方法的开发,其研究范围将不断扩展。
3.4 质谱成像技术质谱成像技术是一种结合质谱分析和影像可视化的分子成像技术,可实现不同分子或多种分子、高灵敏度的同时检测,并能够直接提供目标化合物的空间分布和分子结构信息[77]。能够检测内源性物质 (基因、蛋白及生物小分子) 及外源性物质 (药物或干扰物) 在不同组织、器官等的分布。研究药物在动物体内的空间分布及其靶向信息,在药物研发、药理、药剂及临床医学等领域具有重要意义。质谱成像技术不仅可以获得组织切片中的药物与代谢物的空间分布信息,并能区分两者,获得分子结构信息。Mahoney等[78]利用二次离子质谱 (secondary ion mass spectrometry,SIMS) 成像技术对药物西罗莫西进行了成像分析,该技术无需基质及样品修饰,实现了药物及代谢物在体内各个器官及组织中的同时检测,其分布状况及代谢途径也得以阐释。Abliz等[79, 80]提出了常压敞开式空气动力辅助离子化 (air flow assisted ionization,AFAI) 技术,并利用该技术对整体动物体内分子进行成像,该技术可同时获得药物及其代谢物在动物体内的整体分布特征及动态变化信息,为进一步研究药物的靶点、药物代谢及药效学提供了一种新颖 的方法。
4 结语现代质谱技术已经成为中药体内外代谢及体内过程研究的一大利器。软电离质谱、串联质谱以及色谱-质谱联用技术,结合高分辨质谱,在中药药物代谢及药代动力学研究方面发挥了其他技术不可比拟的优势。近年来不断出现的质谱新技术为中药代谢及体内过程研究提供了更多的选择。但是中药代谢及药动学研究是一个复杂工程,涉及到中药化学、药理学、药剂学、生物化学、分析化学及临床医学等诸多领域的知识,需要多学科的共同努力。相信随着现代科学技术的不断发展,人们对中药复杂体系的认识将不断加深,中药代谢及药代动力学的研究将取得新的丰硕成果。
| [1] | Fenn J, Mann M, Meng C, et al. Electrospray ionization for mass spectrometry of large biomolecules[J]. Science , 1989, 246 :46–49. |
| [2] | Van Berkel G. Electrolytic deposition of metals on to the high-voltage contact in an ESI emitter:implications for gasphase ion formation[J]. J Mass Spectrom , 2000, 35 :773–783. DOI:10.1002/(ISSN)1096-9888 |
| [3] | Cole R. Some tenets pertaining to ESI-MS[J]. J Mass Spectrom , 2000, 35 :763–772. DOI:10.1002/(ISSN)1096-9888 |
| [4] | Fenn J, Mann M, Meng C, et al. Electrospray ionization:principles and practice[J]. Mass Spectrom Rev , 1990, 9 :37–70. DOI:10.1002/(ISSN)1098-2787 |
| [5] | Amad M, Cech N, Jackson G, et al. Importance of gas-phase proton affinities in determining the electrospray ionization response[J]. J Mass Spectrom , 2000, 35 :784–789. DOI:10.1002/(ISSN)1096-9888 |
| [6] | Gamero-Castano M, de la Mora J. Kinetics of small ion evaporation from the charge and mass distribution of multiply charged clusters in electrosprays[J]. J Mass Spectrom , 2000, 35 :790–803. DOI:10.1002/(ISSN)1096-9888 |
| [7] | MitchumI RK, Moler GF, Korfmache WA. Combined capillary gas chromatography/atmospheric pressure negative chemical ionization/mass spectrometry for the determination of 2,3,7,8-tetrachlorodibenzo-p-dioxin in tissue[J]. Anal Chem , 1980, 52 :2278–2282. DOI:10.1021/ac50064a011 |
| [8] | Li HL, Zhang WD, Liu RH, et al. Simultaneous determination of four active alkaloids from a traditional Chinese medicine Corydalis saxicola Bunting.(Yanhuanglian) in plasma and urine samples by LC-MS-MS[J]. J Chromatogr B , 2006, 831 :140–146. DOI:10.1016/j.jchromb.2005.11.049 |
| [9] | Li HL, Zhang WD, Zhang C, et al. Bioavailabilty and pharmacokinetics of four active alkaloids of traditional Chinese medicine Yanhuanglian in rats following intravenous and oral administration[J]. J Pharm Biomed Anal , 2006, 41 :1342–1346. DOI:10.1016/j.jpba.2006.03.029 |
| [10] | Liang MJ, Zhang WD, Zhang C, et al. Quantitative determination of the anticancer agent tubeimoside I in rat plasma by liquid chromatography coupled with mass spectrometry[J]. J Chromatogr B , 2007, 845 :84–89. DOI:10.1016/j.jchromb.2006.07.053 |
| [11] | Zhang W, Zhang C, Liu R, et al. Quantitative determination of astragaloside IV,a natural product with cardioprotective activity,in plasma,urine and other biological samples by HPLC coupled with tandem mass spectrometry[J]. J Chromatogr B , 2005, 822 :170–177. DOI:10.1016/j.jchromb.2005.05.034 |
| [12] | Cheng CR, Yang M, Yu K, et al. Metabolite identification of crude extract from Ganoderma lucidum in rats using ultraperformance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. J Chromatogr B , 2013, 941 :90–99. DOI:10.1016/j.jchromb.2013.10.006 |
| [13] | Oikawa A, Ogura T, Kimura A, et al. Clarification of metabolic disorders and identification of marker metabolites by FT-ICR MS[J]. Plant Cell Physiol , 2006, 47 :246. |
| [14] | Hiba A, Carine A, Haifa AR, et al. Monitoring of twenty-two sulfonamides in edible tissues:investigation of new metabolites and their potential toxicity[J]. Food Chem , 2016, 192 :212–227. DOI:10.1016/j.foodchem.2015.06.093 |
| [15] | Takats Z, Wiseman JM, Gologan B, et al. Mass spectrometry sampling under ambient conditions with desorption electrospray ionization[J]. Science , 2004, 306 :471–473. DOI:10.1126/science.1104404 |
| [16] | Cody RB, Laramee JA, Durst HD. Versatile new ion source for the analysis of materials in open air under ambient conditions[J]. Anal Chem , 2005, 77 :2297–2302. DOI:10.1021/ac050162j |
| [17] | Shiea J, Huang MZ, Hsu HJ, et al. Electrospray-assisted laser desorption/ionization mass spectrometry for direct ambient analysis of solids[J]. Rapid Commun Mass Spectrom , 2005, 19 :3701–3704. DOI:10.1002/(ISSN)1097-0231 |
| [18] | McEwen CN, McKay RG, Larsen BS. Analysis of solids,liquids,and biological tissues using solids probe introduction at atmospheric pressure on commercial LC/MS instruments[J]. Anal Chem , 2005, 77 :7826–7831. DOI:10.1021/ac051470k |
| [19] | Takats Z, Cooks RG. Thermal formation of serine octamer ions[J]. Chem Commun , 2004, 4 :444–445. |
| [20] | Chen H, Zheng J, Zhang X, et al. Surface desorption atmospheric pressure chemical ionization mass spectrometry for direct ambient sample analysis without toxic chemical contamination[J]. J Mass Spectrom , 2007, 42 :1045–1056. DOI:10.1002/(ISSN)1096-9888 |
| [21] | Na N, Zhang C, Zhao M, et al. Direct detection of explosives on solid surfaces by mass spectrometry with an ambient ion source based on dielectric barrier discharge[J]. J Mass Spectrom , 2007, 42 :1079–1085. DOI:10.1002/jms.v42:8 |
| [22] | Colliver TL, Brummel CL, Pacholski ML, et al. Atomic and molecular imaging at the single-cell level with TOF-SIMS[J]. Anal Chem , 1997, 69 :2225–2231. DOI:10.1021/ac9701748 |
| [23] | Stoeckli M, Chaurand P, Hallahan DE, et al. Imaging mass spectrometry:a new technology for the analysis of protein expression in mammalian tissues[J]. Nat Med , 2001, 7 :493–496. DOI:10.1038/86573 |
| [24] | Wiseman JM, Ifa DR, Song Q, et al. Tissue imaging at atmospheric pressure using desorption electrospray ionization (DESI) mass spectrometry[J]. Angew Chem Int Ed , 2006, 45 :7188–7192. DOI:10.1002/(ISSN)1521-3773 |
| [25] | Wiseman JM, Ifa DR, Venter A, et al. Ambient molecular imaging by desorption electrospray ionization mass spectrometry[J]. Nat Protoc , 2008, 3 :517–524. DOI:10.1038/nprot.2008.11 |
| [26] | Wang Y, Wang S, Liu Y, et al. Characterization of metabolites and cytochrome P450 isoforms involved in the microsomal metabolism of aconitine[J]. J Chromatogr B , 2006, 844 :292–300. DOI:10.1016/j.jchromb.2006.07.059 |
| [27] | Ye X, Wang Y, Yang M, et al. Investigating the in vitro metabolism of veratridine:characterization of metabolites and involved cytochrome P450 isoforms[J]. J Chromatogr B , 2009, 877 :141–148. DOI:10.1016/j.jchromb.2008.11.041 |
| [28] | Tang L, Ye L, Lv C, et al. Involvement of CYP3A4/5 and CYP2D6 in the metabolism of aconitine using human liver microsomes and recombinant CYP450 enzymes[J]. Toxicol Lett , 2011, 202 :47–54. DOI:10.1016/j.toxlet.2011.01.019 |
| [29] | Ye L, Wang T, Yang C, et al. Microsomal cytochrome P450-mediated metabolism of hypaconitine,an active and highly toxic constituent derived from Aconitum species[J]. Toxicol Lett , 2011, 204 :81–91. DOI:10.1016/j.toxlet.2011.04.015 |
| [30] | Liu HX, Hu Y, He YQ, et al. Ultra-performance liquid chromatographic-electrospray mass spectrometric determination (UPLC-ESI-MS) of O-demethylated metabolite of paeonol in vitro:assay development,human liver microsome activities and species differences[J]. Talanta , 2009, 79 :1433–1440. DOI:10.1016/j.talanta.2009.06.018 |
| [31] | Yuan F, Chen J, Wu WJ, et al. Effects of matrine and oxymatrine on catalytic activity of cytochrome P450s in rats[J]. Basic Clin Pharmacol Toxicol , 2010, 107 :906–913. |
| [32] | Han YL, Yu HL, Li D, et al. In vitro inhibition of Huanglian Rhizoma Coptidis (L.) and its six active alkaloids on six cytochrome P450 isoforms in human liver microsomes[J]. Phytother Res , 2011, 25 :1660–1665. DOI:10.1002/ptr.3475 |
| [33] | Yu Y, Liu Z, Ju P, et al. In vitro metabolism of alisol A and its metabolites'identification using high-performance liquid chromatography-mass spectrometry[J]. J Chromatogr B , 2013, 941 :31–37. DOI:10.1016/j.jchromb.2013.09.029 |
| [34] | He F, Zhong GP, Zhao LZ, et al. Flavonoids inhibit six cytochrome CYP450 enzymes from human liver microsomes as analyzed by LC-MS/MS method[J]. Chin J New Drugs (中国新药杂志) , 2009, 18 :2340–2348. |
| [35] | Bi YF, Li X, Pi ZF, et al. Analysis of hypaconitines metabolites and related metabolic CYP isoforms in rat liver microsomal by UPLC-MS/MS[J]. J Chin Mass Spec Soc (质谱学报) , 2013, 34 :330–337. |
| [36] | Bi YF, Liu S, Zhang RX, et al. Metabolites and metabolic pathways of mesaconitine in rat liver microsomal investigated by using UPLC-MS/MS method in vitro[J]. Acta Pharm Sin (药学学报) , 2013, 48 :1823–1828. |
| [37] | Bi YF, Zhu HB, Xing JP, et al. Effects of six kinds of Chinese herb extracts on the activities of rat liver microsomes in vitro[J]. Acta Pharm Sin (药学学报) , 2013, 48 :1131–1135. |
| [38] | Bi YF, Liu S, Li X, et al. Metabolic fingerprint and effects of aconite alkaloid components on the activities of CYP450 isozymes in rat liver microsomes[J]. Chem J Chin Univ (高等学校化学学报) , 2013, 34 :2084–2089. |
| [39] | Bi YF, Zhu HB, Pi ZF, et al. Effects of flavonoides from the leaves of Acanthopanax on the activity of CYP450 isozymes in rat liver microsomes by a UPLC-MS/MS and cocktail probe substrates method[J]. Chem J Chin Univ (高等学校化学学报) , 2013, 34 :1067–1071. |
| [40] | Bi YF, Zhu HB, Zheng Z, et al. Studies on in vitro metabolites and cytochrome P450 isoforms involved in microsomal metabolism of isofraxidin by LC-MSn and specific inhibitor probes[J]. Chin J Anal Chem (分析化学) , 2013, 41 :1391–1395. |
| [41] | Bi Y, Zhuang X, Zhu H, et al. Studies on metabolites and metabolic pathways of bulleyaconitine A in rat liver microsomes using LC-MSn combined with specific inhibitors[J]. Biomed Chromatogr , 2015, 29 :1027–1034. DOI:10.1002/bmc.3388 |
| [42] | Fu J, Ma JY, Zhang XF, et al. Identification of metabolites of FR429,a potential antitumor ellagitannin,transformed by rat intestinal bacteria in vitro,based on liquid chromatography-ion trap-time of flight mass spectrometry analysis[J]. J Pharm Biomed Anal , 2012, 71 :162–167. DOI:10.1016/j.jpba.2012.07.028 |
| [43] | Yang J, Qian D, Jiang S, et al. Identification of rutin deglycosylated metabolites produced by human intestinal bacteria using UPLC-Q-TOF/MS[J]. J Chromatogr B , 2012, 898 :95–100. DOI:10.1016/j.jchromb.2012.04.024 |
| [44] | Zhao YF, Song FR, Yue H, et al. Studies on the biotransformation of 16-O-demethyldeoxyaconitine of the metabolite of aconitine in human intestinal bacteria[J]. Chin J Anal Chem (分析化学) , 2007, 35 :1711–1715. |
| [45] | Zhao YF, Song FR, Yue H, et al. Biotransformation of deoxyaconitine of metabolite of aconitine by human intestinal bacteria and electrospray ionization tandem mass spectrometry[J]. Chem J Chin Univ (高等学校化学学报) , 2007, 28 :2051–2055. |
| [46] | Zhao YF, Song FR, Guo XH, et al. Studies on the biotransformation of aconitine in human intestinal bacteria using softionization mass spectrometry[J]. Chem J Chin Univ (高等学校化学学报) , 2008, 29 :55–59. |
| [47] | Wang XY, Pi ZF, Song FR, et al. Studies on the biotransformation of licorice and aconite accessory root decoction and Atractylodes macrocephala and aconite accessory root decoction under rat intestinal bacteria[J]. Acta Chim Sin (化学学报) , 2011, 69 :1368–1374. |
| [48] | Wang XY, Pi ZF, Liu WL, et al. Biotransformation of aconitum alkaloids before and after the combination of Radix Aconiti Preparata by rat intestinal flora using semiquantitative analysis method of electrospray ionization mass spectrometry[J]. Chem J Chin Univ (高等学校化学学报) , 2011, 32 :1526–1531. |
| [49] | Wang XY, Pi ZF, Liu WL, et al. Effect of pH on the metabolism of aconitine under rat intestinal bacteria and analysis of metabolites using HPLC/MS-MSn technique[J]. Chin J Chem (中国化学) , 2010, 28 :2494–2500. DOI:10.1002/cjoc.v28.12 |
| [50] | Han Tj, Wang Q, Song FR, et al. Intestinal transport and biotransformation of resibufogenin and cinobufagin in Chan Su via HPLC/APCI-MSn[J]. Chem Res Chin Univ , 2011, 27 :380–384. |
| [51] | Mantovani V, Kennergren C, Bugge M, et al. Myocardial metabolism assessed by microdialysis:a prospective randomized study in on-and off-pump coronary by pass surgery[J]. Int J Cardiol , 2010, 143 :302–308. DOI:10.1016/j.ijcard.2009.03.033 |
| [52] | Muller M. Microdialysis in clinical drug delivery studies[J]. Adv Drug Deliver Rev , 2000, 45 :255–269. DOI:10.1016/S0169-409X(00)00113-7 |
| [53] | Wei B, Li Q, Fan R, et al. UFLC-MS/MS method for simultaneous determination of six lignans of Schisandra chinensis (Turcz.) Baill.in normal and insomniac rats brain microdialysates and homogenate samples:towards an in-depth study for its sedative-hypnotic activity[J]. J Mass Spectrom , 2013, 48 :448–458. DOI:10.1002/jms.3176 |
| [54] | Yu B, Ruan M, Cui XB, et al. Effects of borneol on the pharmacokinetics of geniposide in cortex,hippocampus,hypothalamus and striatum of conscious rat by simultaneous brain microdialysis coupled with UPLC-MS[J]. J Pharm Biomed Anal , 2013, 77 :128–132. DOI:10.1016/j.jpba.2013.01.017 |
| [55] | Wang QQ.Studies on Mechanisms and Pharmacokinetics of Chinese Herbs by Using On-Line Microdialysis Coupled with Mass Spectrometry (基于微透析-质谱在线方法的中药作用机制及体内过程研究)[D].Changchun:University of Chinese Academy of Sciences,2015. |
| [56] | Wang Q, Zhang J, Pi Z, et al. Application of online microdialysis coupled with liquid chromatography-tandem mass spectrometry method in assessing neuroprotective effect of Rhizoma coptidis on diabetic rats[J]. Anal Methods , 2015, 7 :45–52. |
| [57] | Huang H, Zhang Y, Yang R, et al. Determination of baicalin in rat cerebrospinal fluid and blood using microdialysis coupled with ultra-performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B , 2008, 874 :77–83. DOI:10.1016/j.jchromb.2008.09.005 |
| [58] | Liu Z, Liu M, Qi Y, et al. Plasma pharmacochemistry combined with microdialysis to screen potential bioactive components and their metabolites in Anemarrhena asphodeloides saponin extract using ultrahigh-performance liquid chromatography/quadrupole-time-of-flight mass spectrometry[J]. J Sep Sci , 2013, 36 :1659–1666. DOI:10.1002/jssc.201201116 |
| [59] | Wen XD, Qi LW, Li B, et al. Microsomal metabolism of calycosin,formononetin and drug-drug interactions by dynamic microdialysis sampling and HPLC-DAD-MS analysis[J]. J Pharm Biomed Anal , 2009, 50 :100–105. DOI:10.1016/j.jpba.2009.03.038 |
| [60] | Cao G, Cai H, Zhang Y, et al. Identification of metabolites of crude and processed Fructus Corni in rats by microdialysis sampling coupled with electrospray ionization linear quadrupole ion trap mass spectrometry[J]. J Pharm Biomed Anal , 2011, 56 :118–125. DOI:10.1016/j.jpba.2011.04.013 |
| [61] | Han H, Xiong AZ, He CY, et al. Combination of UHPLC/Q-TOF-MS,NMR spectroscopy,and ECD calculation for screening and identification of reactive metabolites of gentiopicroside in humans[J]. Anal Bioanal Chem , 2014, 406 :1781–1793. DOI:10.1007/s00216-013-7572-z |
| [62] | Lv Y, Zhang X, Liang X, et al. Characterization of the constituents in rat biological fluids after oral administration of Fufang Danshen tablets by ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. J Pharm Biomed Anal , 2010, 52 :155–159. DOI:10.1016/j.jpba.2009.12.013 |
| [63] | Xia X, Jin H, Yan S, et al. Analysis of the bioactive constituents of ChanSu in rat plasma by high performance liquid chromatography with mass spectrometric detection[J]. J Pharm Biomed Anal , 2010, 53 :646–654. DOI:10.1016/j.jpba.2010.05.009 |
| [64] | Lu T, Yang J, Gao X, et al. Plasma and urinary tanshinol from Salvia miltiorrhiza (Danshen) can be used as pharmacokinetic markers for cardiotonic pills,a cardiovascular herbal medicine[J]. Drug Metab Dispos , 2008, 36 :1578–1586. DOI:10.1124/dmd.108.021592 |
| [65] | Liu H, Yang J, Du F, et al. Absorption and disposition of ginsenosides after oral administration of Panax notoginseng extract to rats[J]. Drug Metab Dispos , 2009, 37 :2290–2298. DOI:10.1124/dmd.109.029819 |
| [66] | Li L, Zhao Y, Du F, et al. Intestinal absorption and presystemic elimination of various chemical constituents present in GBE50 extract,a standardized extract of Ginkgo biloba leaves[J]. Curr Drug Metab , 2012, 13 :494–509. DOI:10.2174/1389200211209050494 |
| [67] | Li Y, Sun Y, Du F, et al. Pulse gradient,large-volume injection,high-throughput ultra-performance liquid chromatographic/tandem mass spectrometry bioanalysis for measurement of plasma amrubicin and its metabolite amrubicinol[J]. J Chromatogr A , 2008, 1193 :109–116. DOI:10.1016/j.chroma.2008.04.014 |
| [68] | Niu W, Zhu X, Yu K, et al. Nebulizing conditions of pneumatic electrospray ionization significantly influence electrolyte effects on compound measurement[J]. J Mass Spectrom , 2012, 47 :370–380. DOI:10.1002/jms.2050 |
| [69] | Li S, Yang D, Zhang M, et al. Determination of dehydroandrographolide succinate in human plasma by liquid chromatography tandem mass spectrometry (LC-MS/MS):method development,validation and clinical pharmacokinetic study[J]. J Chromatogr B , 2010, 878 :2274–2279. DOI:10.1016/j.jchromb.2010.06.030 |
| [70] | Cheng CR, Yang M, Yu K, et al. Metabolite identification of crude extract from Ganoderma lucidum in rats using ultraperformance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. J Chromatogr B , 2013, 941 :90–99. DOI:10.1016/j.jchromb.2013.10.006 |
| [71] | Sun J, Wu W, Guo Y, et al. Pharmacokinetic study of ginsenoside Rc and simultaneous determination of its metabolites in rats using RRLC-Q-TOF-MS[J]. J Pharm Biomed Anal , 2014, 88 :16–21. DOI:10.1016/j.jpba.2013.08.015 |
| [72] | Zhu H, Bi K, Han F, et al. Simultaneous determination of two iridoid glycosides,two anthraquinones and four flavonoid glycosides of Zhi-Zi-Da-Huang decoction in rat plasma by UFLC-MS/MS:application to a comparative pharmacokinetic study in normal and cholestatic liver injury rats[J]. J Chromatogr B , 2014, 960 :116–125. DOI:10.1016/j.jchromb.2014.04.031 |
| [73] | Li X, Hou G, Xing J, et al. Direct analysis in real time-mass spectrometry for the rapid detection of metabolites of aconite alkaloids in intestinal bacteria[J]. J Am Soc Mass Spectrom , 2014, 25 :2181–2184. DOI:10.1007/s13361-014-0991-z |
| [74] | Le Pogam P, Legouin B, Le Lamer AC, et al. Analysis of the cyanolichen Lichina pygmaea metabolites using in situ DART-MS:from detection to thermochemistry of mycosporine serinol[J]. J Mass Spectrom , 2015, 50 :454–462. DOI:10.1002/jms.3549 |
| [75] | Siebenhaar M, Küllmer K, Fernandes NM, et al. Personalized monitoring of therapeutic salicylic acid in dried blood spots using a three-layer setup and desorption electrospray ionization mass spectrometry[J]. Anal Bioanal Chem , 2015, 407 :7229–7238. DOI:10.1007/s00216-015-8887-8 |
| [76] | Lubin A, Cabooter D, Augustijns P, et al. One drop chemical derivatization-DESI-MS analysis for metabolite structure identification[J]. J Mass Spectrom , 2015, 50 :871–878. DOI:10.1002/jms.3604 |
| [77] | Luo Z, He J, Liu Y, et al. Advances in mass spectrometry imaging and its application[J]. Sci Sin Chim (中国科学:化学) , 2014, 44 :795–800. DOI:10.1360/N032014-00036 |
| [78] | Mahoney CM, Fahey AJ. Three-dimensional compositional analysis of drug eluting stent coatings using cluster secondary ion mass spectrometry[J]. Anal Chem , 2008, 80 :624–632. DOI:10.1021/ac701644j |
| [79] | He J, Tang F, Luo Z, et al. Air flow assisted ionization for remote sampling of ambient mass spectrometry and its application[J]. Rapid Commun Mass Spectrom , 2011, 25 :843–850. DOI:10.1002/rcm.4920 |
| [80] | Luo Z, He J, Chen Y, et al. Air flow-assisted ionization imaging mass spectrometry method for easy whole-body molecular imaging under ambient conditions[J]. Anal Chem , 2013, 85 :2977–2982. DOI:10.1021/ac400009s |
 2016, Vol. 51
2016, Vol. 51


