2. 第二军医大学海洋生物医药研究中心, 上海 200433 ;
3. 第二军医大学生物化学与分子生物学教研室, 上海 200433 ;
4. 中国科学院上海有机化学研究所, 上海 200032
2. Marine Biopharmaceutical Institute, Second Military Medical University, Shanghai 200433, China ;
3. Department of Biochemistry and Molecular Biology, Second Military Medical University, Shanghai 200433, China ;
4. Shanghai Institute of Organic Chemistry, Chinese Academy of Sciences, Shanghai 200032, China
化学药物治疗和抗体疗法作为肿瘤治疗的常用手段,因其对靶标缺乏选择性、产生毒副作用或对 肿瘤杀伤作用小疗效低,极大地限制了临床效果的发挥,所以寻找能有效杀伤肿瘤而不损伤正常细胞组织的药物是肿瘤治疗的主要任务。抗体偶联药物 (antibody drug conjugates,ADCs) 兼具化学药物和抗体药物各自的优点,将单克隆抗体 (mAb) 和强效毒性药物通过连接基 (linker) 偶联而成。ADC可通过高效特异的抗原抗体反应,携带抗肿瘤药物直达靶标,经抗体内吞进入细胞,在溶酶体内经降解释放出毒素达到杀伤肿瘤细胞的目的[1]。
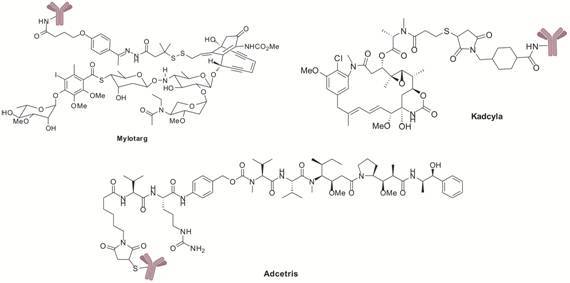
2000年第一个经FDA批准的Mylotarg® (gemtuzumab ozogamicin,图 1) 是以CD33为靶标用于急性髓系白血病 (AML) 的ADC治疗药物,后由于治疗窗窄、疗效低等问题被撤回[2]。2011年,ADC药物研究有了突破性进展,第二个成功的ADC药物Adcetris® (brentuximab vedotin,图 1) 经FDA批准 上市用于治疗霍奇金淋巴瘤 (HL) 和间变性大细胞淋巴瘤 (ALCL)[3],在2012年第一个季度收益就已达3 450万美元。相继而来,另一个ADC药物Kadcyla® (trastuzumab emtansine,图 1) 在2013年2月获得FDA批准上市,用于治疗HER2阳性的转移性乳腺 癌[4],成为首个治疗实体瘤的ADC药物,预计年销售额可达20~50亿美元。随着各大制药公司对ADCs药物的青睐,该类药物近年来获得迅速发展,越来越多的ADCs药物进入临床研究。
|
Figure 1 Three FDA-approved ADCs |
ADCs药物由单克隆抗体、连接基及细胞毒性药物3部分组成,而一个成功的ADC药物要同时具备合适的靶点、高度特异性的抗体、理想的连接基以及高效的药物这4个条件。
1.1 靶标的选择选择合适的靶标对ADCs的疗效和安全性至关重要。理想的靶点抗原首先应该在肿瘤细胞表面过量表达,而在正常组织细胞中无表达或者极少表达[5, 6]; 其次在ADCs药物中的抗体识别靶点抗原后,可有效内化进入细胞。作为ADCs药物的识别靶标,这些肿瘤标记物表达于各种肿瘤细胞表面,与潜在的适应症息息相关 (表 1)。其中一些肿瘤相关抗原具有极高特异性,如表达于霍奇金淋巴瘤上的CD30、卵巢癌上的MUC16; 而其他一些抗原如CD74表达于多种肿瘤细胞表面[7]。
| Table 1 Tumors and specific antigens |
目前临床研究的50多种ADCs药物中首选的治疗领域仍然集中于白血病、淋巴瘤等非实体瘤,同时也有向乳腺癌、卵巢癌等实体瘤过度的趋势。已上市药物Adcetris选择的是在霍奇金淋巴瘤上特异性表达的CD30; 而Kadcyla则具有HER2靶向,将主要视线放到了实体瘤上。
1.2 单克隆抗体抗体对ADCs药物的作用在于精确“制导”,是决定ADCs药物靶向的源泉。随着细胞工程、抗体工程、基因工程等技术的飞速发展,单克隆抗体从早期的鼠源性单克隆抗体、嵌合性单克隆抗体逐渐发展为人源化单克隆抗体和全人源单克隆抗体[8],大大降低了抗体的免疫原性问题,有效延长了在血液中的半衰期,为ADCs的发展奠定了基础; 越来越多的单抗药被批准也推进了ADCs研究。
抗体是属于免疫蛋白超家族的一种可识别特定抗原的糖蛋白,治疗用的单抗多是半衰期长的IgG同种型; IgG又分为IgG1、IgG2、IgG3和IgG4四种亚型,目前用于ADCs药物设计的主要是IgG1、IgG2和IgG4。抗体和靶抗原的高亲和力是ADC有效起到靶向杀伤的核心所在,一般认为亲和力指数Kd = 10 nmol·L-1是对抗体的基本要求。在这基础上进一步筛选免疫原性低、半衰期长、在血液中稳定且内吞性好的抗体[9]。
1.3 连接基连接基 (linker) 是连接抗体与药物的桥梁,决定了药物在细胞内的释放,对药物整体的动力学性质、疗效等都有着重要的影响。根据作用方式的不同,连接基可分为可断裂 (cleavable) 和非可断裂(non-cleavable) 两种模式。可断裂式是利用肿瘤细胞的固有性质选择性释放药物,主要有3种机制,首先是酸敏感型,利用细胞溶酶体内低pH值的特点触发linker 中酸依赖性基团的水解而释放药物,如腙类基团[10]; 第二种是谷胱甘肽敏感型,与血浆中相比,细胞内的谷胱甘肽浓度更高,含有二硫键的linker在到达细胞内后被谷胱甘肽还原断裂释放药物[11]; 最后一种是蛋白酶敏感型,是利用肿瘤细胞溶酶体中的一些蛋白酶如组织蛋白酶B识别并断裂linker中特定的肽而释放药物,现在临床研究中最常用的是缬氨酸-瓜氨酸 (v-c)[12],已上市药物Adcetris即采用这种linker将MMAE与抗体相连。还有一些ADCs药物采用苯丙氨酸-赖氨酸 (p-l) 和缬氨酸-丙氨酸 (v-a),如labetuzumab-SN-38和SGN-CD70A。非断裂式是依赖于ADC内化后对抗体的降解作用,常采用MC、MCC和硫醚键等。已上市药物Kadcyla即采用该种方式将美登醇与trastuzumab相连[13, 14]。相比于可断裂式在血液中更稳定,并且不会扩散到邻近细胞造成损伤。
连接基是决定ADCs药物发挥作用最重要的一部分,研究发现,以CD19、CD20、CD21、CD22、CD79b和CD180为靶标采用可断裂连接基时可以起到有效的效果; 而在采用非可断裂连接基时只有CD22和CD79b抗原可以与抗体结合,将ADC转运至溶酶体并把药物释放出来,杀 伤靶细胞。因此在决定连接基时必须结合靶点的自身性质进行选择。
1.4 细胞毒性药物细胞毒性药物作为弹头是决定ADC治疗效果重要的一部分。ADCs属于蛋白类药 物,肿瘤内的高间隙压、内皮、基质和上皮屏障都会影响ADC的吸收,最后只有极少量的药物能进入肿瘤部位[15],因此需要药物对靶细胞具有高效、高灵敏的杀伤作用,并且在血液循环和溶酶体中稳定,半衰期长,可经过修饰与linker相连等。
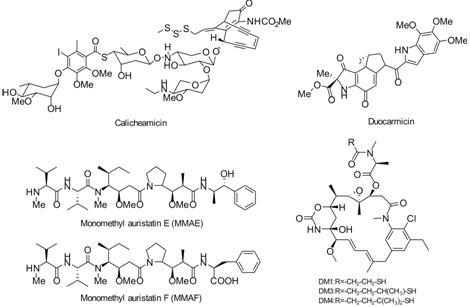
现在ADCs药物中的毒素主要通过结合到微管干扰肿瘤细胞的有丝分裂过程或通过裂解及烷基化损害DNA这两种机制发挥作用。目前上市及临床上研究的ADCs药物所采用的细胞毒性药物都是一些达到纳摩尔级或更高效能的天然产物衍生分子,其中最主要有4种: 结合DNA的毒素卡奇霉素 (calicheamicin)和倍癌霉素 (duocarmicin)、微管抑制剂海兔毒素 (monomethy lauristatin E,MMAE; monomethyl auristatin F,MMAF) 和美登素 (maytansinoid,DM1,DM3,DM4)[16, 17] (图 2)。
|
Figure 2 Several representative cytotoxinic drugs used as payloads in ADCs |
连接位点即单克隆抗体上能与linker一端相连的作用位点,临床研究中的ADCs药物常用的连接位点主要是赖氨酸位点和半胱氨酸位点两种。单克隆抗体表面的赖氨酸ε-氨基容易裸露出来,且具有化学反应活性良好、水溶性强的特点; 位于单克隆抗体表面的另一个连接位点是半胱氨酸的巯基,半胱氨酸的巯基是以二硫键形式存在,包括链内和链间,在不影响抗体识别位点折叠构象的情况下,控制链间二硫键还原可得到巯基用于连接linker[18, 19]。
目前已上市及临床研究中的ADCs药物大多使用传统的偶联技术,即常用的赖氨酸和半胱氨酸位点; 而传统连接位点最大的缺点就是最后得到的是每个抗体载有不同药物分子数的混合物[20]。ADCs药物制备的非均一性不仅对药物的生产、质量控制造 成很大挑战,而且还会影响药物的体内分布与代谢。为了解决这一问题,科学家已提出了多种定向偶联 (site-specific) 的方式,使用定向偶联技术可以使每个抗体上携带相同数目的药物分子数,得到均一性的ADC药物。例如,可以通过基因工程定点引入额外的半胱氨酸或非天然氨基酸,如采用丝氨酸、对乙酰基苯丙氨酸代替半胱氨酸用于定点突变; 或采用化学酶催化的方式,对单抗特定序列进行定点修饰引入活性官能团作为化学反应位点[21-23],如Bertozzi团队利用一种甲酰甘氨酸生成酶 (FGE) 通过对CXPXR序列的识别,采用甲酰甘氨酸代替半胱氨酸,从而将正交的活性甲酰基团引入单抗,作为特定化学反应位点[23]。
2 批准上市的ADCs 2.1 Gemtuzumab ozogamicin (Mylotarg)辉瑞曾开发的以CD33为靶标的Mylotarg,采用人源化单抗IgG4通过酸敏感型腙类linker连接卡奇霉素,曾是第一个被FDA批准上市的用于治疗六十岁以上CD33阳性急性髓系白血病患者的ADCs药物,但由于肝毒性、药效和总存活率等问题在2010年被撤回[24, 25]。之后继续进行了开放性试验AML15和AML16,随 机化选择2 228名患者接受诱导治疗,给药剂量改为3 mg·m-2,两个试验都显示患者可耐受毒副作用,给药组存活率明显高于未给药组; 一系列的临床 Ⅲ 期结果显示gemtuzumab ozogamicin适于治疗轻中度AML患者[26-28]。现针对急性早幼粒细胞白血病的治疗正在进行Ⅱ期临床研究[29]。
2.2 Brentuximab vedotin (Adcetris)Adcetris以CD30为靶标,采用嵌合型单抗IgG1通过缬氨酸-瓜氨酸二肽链连接毒素MMAE,平均每个抗体上接有 4个药物分子。Brentuximab vedotin临床前研究显示出良好的抗肿瘤活性,针对复发性或难治性霍奇金淋巴瘤和间变性大细胞淋巴瘤也取得良好的临床研究结果[30]。患者在每3周给药剂量为1.8 mg·kg-1下显示出良好的耐受性,主要为外周神经系统不良反应[31],2011年经FDA批准上市。Adcetris现仍在进行各种临床研究,扩大对霍奇金淋巴瘤及其他肿瘤的治疗范围,如针对治疗经过干细胞移植的高危霍奇金淋巴瘤残留患者的临床Ⅲ期研究,同时还开展了针对非霍奇金淋巴瘤治疗的临床研究[32, 33]。
2.3 Trastuzumab emtansine (T-DM1,Kadcyla)罗氏开发的Kadcyla,采用抗-HER2抗体曲妥珠单抗 (赫赛汀) 通过非断裂式硫醚linker (SMCC) 与美登素DM1相连,平均每个抗体接有3.5个药物分子。曲妥珠单抗和T-DM1都可结合到HER2胞外区域IV,通过非配体依赖性方式抑制HER2功能。T-DM1仍然能够保持原单抗的性质及ADCC作用。临床前,T-DM1表现出有效的体外抗增殖活性,与曲妥珠单抗对比体内测试中表现出更优良的抗肿瘤活性[34, 35],经过一系列的临床研究,2013年被批准上市。Kadcyla在HER2阳性转移性乳腺癌的治疗中优势显著。为了更好地发挥其作用,达到更有效的治疗,有研究尝试将Kadcyla与其他化疗药物如紫杉醇或单抗药物如帕妥珠单抗进行联合辅助治疗探究其可行性[36]。另一方面,Kadcyla治疗剂量的优化对其发挥药效也有着重要的影响。Kadcyla主要针对的是乳腺癌的治疗,而对其他HER2阳性肿瘤的治疗有待进一步确证; Bang等[37, 38]将Kadcyla与化疗联合进行针对HER2阳性胃癌进行了临床Ⅲ期研究。
3 进入临床阶段的ADCs由于ADCs药物具有靶向性和高效低毒等优势,现已成为开发肿瘤治疗药物的热点研究方向,目前已进入临床研究的ADCs药物累计已达50余种 (表 2),且越来越多的ADCs药物已进入Ⅱ期临床研究。由我国烟台荣昌生物工程有限公司研发的ADC抗肿瘤新药RC48经SFDA批准现也进入临床研究,成为中国首个进入临床阶段的ADC药物。前期研究结果显示,RC48对HER2阳性的肿瘤细胞有良好的抗肿瘤活性,临床试验将在HER2阳性的乳腺癌、胃癌、食管癌、卵巢癌、肺癌等多种肿瘤开展。早期研究的ADCs药物主要针对的是非实体瘤,而现处于临床阶段的ADCs中,已经有越来越多的针对实体瘤治疗,这也预示着将有更多的ADCs药物被相继开发和研究。
| Table 2 ADCs in the clinical research |
CMC-544是以主要在非霍奇金淋巴瘤和急性淋巴细胞白血病中表达的CD22为靶标,与Mylotarg相同,也采用 卡奇霉素衍生物,通过腙类linker连接人源化IgG4单抗。与曾上市的Mylotarg相比,均一性更好,且CMC-544与CD22有更好的亲和力,在和抗原结合后能够快速内在化,对急性淋巴细胞白血病的体外杀伤作用更显著。最早在不适合高剂量化疗的复发性或难治性CD22+侵袭性非霍奇金淋巴瘤 (NHL) 患者中开展的 Ⅲ 期临床研究,因与现在的治疗相比并没有明显的优势,于2013年5月被宣布终止。而临床Ⅱ期结果表明,复发性急性淋巴细胞白血病 (ALL) 患者对其有良好的耐受性,可得到持久的缓解作用[39]。基于这些数据,进一步进行针对复发性或难治性ALL的Ⅲ期临床研究,以证明CMC-544在治疗复发性或难治性B细胞癌上相比于现有的治疗方法有更好的临床效果[40]。
3.2 Glembatumumab vedotin (CDX-011)Celldex Therapeutics公司以一种在黑素瘤和乳腺癌中高度表达的新型糖蛋白GPNMB为靶点,将全人源单抗IgG2 CR011与MMAE通过蛋白酶敏感型linker相连得到CDX-011,平均每个抗体接有4.5个药物分子[41]; 研究表明,CDX-011对过度表达GPNMB的三阴性乳腺癌患者,不可切除的Ⅲ级或Ⅳ级黑色素瘤都有良好的活性[42]; 现仍在进行针对各种转移性黑色素瘤及乳腺癌的Ⅰ期Ⅱ期临床研究。此外,GPNMB也可作为其他恶性肿瘤如肝细胞癌和恶性胶质瘤的潜力靶标; 近期,针对复发性或难治性骨肉瘤正在开展Ⅱ期临床研究[43]。
3.3 Lorvotuzumab mertansine (IMGN-901)Immuno Gen公司开发的ADC药物lorvotuzumab mertansine,由靶向CD56的人源化单抗通过稳定有位阻的二硫键SPP连接美登素DM-1。CD56是属于免疫球蛋白超家族的糖蛋白,存在于各种实体瘤中,如小细胞肺癌 (SCLC)、Merkel细胞癌和卵巢癌等。在大多数多发性骨髓瘤细胞中也有高度表达,Tassone等[44, 45]已证明IMGN-901对CD56表达的多发性骨髓瘤细胞体内体外的活性,临床试验中IMGN-901对CD56表达的实体瘤也表现出良好的活性。已完成针对小细胞肺癌等的临床Ⅰ期、Ⅱ期研究,现正针对各类白血病开展开放式临床Ⅱ期研究[46, 47]。
3.4 抗-PSMA ADCPSMA是存在于前列腺腺上皮细胞膜的一种Ⅱ型固有膜蛋白,特异表达于前列腺上皮,可作为前列腺组织的标记,在其他组织只有少量表达。PSMA具有高选择性,不仅在90% 的前列腺癌上表达,而且在85% 的实体瘤新生血管上也有表达,并且与抗体结合后可在受体介导的内吞作用下迅速内化,可成为ADCs药物的一个优良靶标[48, 49]。最初的抗-PSMA ADC是采用单抗J591通过二硫键连接DM1完成了临床Ⅰ期Ⅱ期研究,尽管J591可以特异性靶向肿瘤细胞,但二硫键不稳定会快速降解释放DM1,导致神经毒性,治疗窗窄[50]。而另一种可结合到PSMA外部区域的单抗通过更稳定的硫醚键连接毒素的抗-PSMA ADC现已完成针对转移性去势抵抗性前列腺癌的Ⅱ期临床研究[51]。
3.5 MDX-1203CD70高度表达于各种实体瘤和血液瘤的表面,并且能够迅速被内化,是一种很具潜力的免疫治疗靶标。Medarex/BMS公司以CD70为靶标,以一种与DNA小沟结合为机制的前药CC-1065为弹头,通过蛋白酶敏感型linker与单抗相连; 抗体抗原结合内化后前药部分被释放活化,结合到双链DNA小沟中的腺嘌呤N3位置烷基化破坏DNA。临床前研究中,低剂量MDX-1203在人类移植瘤模型中就已表现出强有效的抗肿瘤活性,对淋巴瘤和肾细胞癌 (RCC) 模型治疗窗大,以高于移植瘤模型有效剂量的药物浓度给药于动物显示仍有良好的毒副作用耐受性[52, 53]。已完成针对CD70过度表达的晚期复发性RCC和难治性复发性B细胞NHL开展的多通道、开放式、多剂量、剂量递增临床Ⅰ期研究[54]。
4 展望近年来抗体偶联药物发展迅速,自Adcetris (brentuximab vedotin) 和Kadcyla (trastuzumab emtansine) 被批准上市以来,越来越多的制药公司投入到ADCs药物的研发之中。RC48作为我国批准的首个进入人体临床试验的ADC药物,不仅填补了我国在该领域临床研究的空白,也标志着我国在ADC药物研发和产业化能力方面获得了突破性的进展。连接基现在已处于一个比较成熟的时期,研究人员更希望能利用化学生物学等合成手段设计出一些新型的linker,不止在肿瘤治疗方面发挥作用,更能应用到免疫学等领域。目前临床研究中约有20多种ADC药物都是以海兔毒素MMAE和MMAF这两种为毒素,研究发现很多海洋毒素都充分显示了海洋药物存在的巨大潜力,同时也掀起了一股海洋药物研究的浪潮。而更多不同来源毒素分子的发现也将加快ADCs药物的发展。当前ADCs药物开发的最大瓶颈仍然是药物的不均一性问题,这给ADCs药品生产、质量控制都带来巨大困扰。而定向偶联技术在一定程度上不仅解决了不均一性的问题,而且偶联技术的成熟将推进多价药物的发展,成为现今各大制药公司追逐的热点,为ADCs药物的进一步发展指明了方向。
| [1] | Scotti C, Iamele L, Vecchia L, et al. Antibody-drug conjugates:targeted weapons against cancer[J]. Antibody Te chnol J , 2015, 5 :1–13. |
| [2] | Teicher BA, Chari RV. Antibody conjugate therapeutics:challenges and potential[J]. Clin Cancer Res , 2011, 17 :6389–6397. DOI:10.1158/1078-0432.CCR-11-1417 |
| [3] | Senter P, Sievers EL. The discovery and development of brentuximabvedotin for use in relapsed Hodgkin lymphoma and systemic anaplastic large cell lymphoma[J]. Nat Biotechnol , 2012, 30 :631–637. DOI:10.1038/nbt.2289 |
| [4] | Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer[J]. New Engl J Med , 2012, 367 :1783–1791. DOI:10.1056/NEJMoa1209124 |
| [5] | Beck A, Haeuw JF, Wurch T, et al. The next generation of antibody-drug conjugates comes of age[J]. Discov Med , 2010, 10 :329–359. |
| [6] | Ritter A. Antibody-drug conjugates:looking ahead to an emerging class of biotherapeutic[J]. Pharm Technol , 2012, 36 :42–47. |
| [7] | Perez HL, Cardarelli PM, Deshpande S, et al. Antibody-drug conjugates:current status and future directions[J]. Drug Discov Today , 2014, 19 :869–881. DOI:10.1016/j.drudis.2013.11.004 |
| [8] | Buss NA, Henderson SJ, McFarlane M, et al. Monoclonal antibody therapeutics:history and future[J]. Curr Opin Pharmacol , 2012, 12 :615–622. DOI:10.1016/j.coph.2012.08.001 |
| [9] | Natsume A, In M, Takamura H, et al. Engineered antibodies of IgG1/IgG3 mixed isotype with enhanced cytotoxic activities[J]. Cancer Res , 2008, 68 :3863–3872. DOI:10.1158/0008-5472.CAN-07-6297 |
| [10] | Ritchie M, Tchistiakova L, Scott N. Implications of recep-tormediated endocytosis and I ntracellular trafficking dynamics in the development of antibody drug conjugates[J]. MAbs , 2013, 5 :13–21. DOI:10.4161/mabs.22854 |
| [11] | Ducry L, Stump B. Antibody-drug conjugates:linking cytotoxic payloads to monoclonal antibodies[J]. Bioconjug Chem , 2010, 21 :5–13. DOI:10.1021/bc9002019 |
| [12] | Dubowchik GM, Firestone RA, Padilla L, et al. Cathepsin B-labile dipeptide linkers for lysosomal release of doxorubicin from internalizing immunoconjugates:model studies of enzymatic drug release and antigen-specific in vitro anticancer activity[J]. Bioconjug Chem , 2002, 13 :855–869. DOI:10.1021/bc025536j |
| [13] | Doronina SO, Toki BE, Torgov MY, et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy[J]. Nat Biotechnol , 2003, 21 :778–784. DOI:10.1038/nbt832 |
| [14] | Doronina SO, Bovee TD, Meyer DW, et al. Novel peptide linkers for highly potent antibody-auristatin conjugate[J]. Bioconjug Chem , 2008, 19 :1960–1963. DOI:10.1021/bc800289a |
| [15] | Kamath AV, Iyer S. Preclinical pharmacokinetic considerations for the development of antibody drug conjugates[J]. Pharm Res , 2014, 32 :3470–3479. |
| [16] | Flygare JA, Pillow TH, Aristoff P. Antibody-drug conjugates for the treatment of cancer[J]. Chem Biol Drug Des , 2013, 81 :113–121. DOI:10.1111/cbdd.2012.81.issue-1 |
| [17] | Gerber HP, Koehn FE, Abraham RT. The antibody-drug conjugate:an enabling modality for natural product-based cancer therapeutics[J]. Nat Prod Rep , 2013, 30 :625–639. DOI:10.1039/c3np20113a |
| [18] | Acchione M, Kwon H, Jochheim CM, et al. Impact of linker and conjugation chemistry on antigen binding,Fc receptor binding and thermal stability of model antibody-drug conjugates[J]. MAbs , 2012, 4 :362–372. DOI:10.4161/mabs.19449 |
| [19] | Sun MMC, Beam KS, Cerveny CG, et al. Reduction-alkylation strategies for the modification of specific monoclonal antibody disulfides[J]. Bioconjug Chem , 2005, 16 :1282–1290. DOI:10.1021/bc050201y |
| [20] | Panowksi S, Bhakta S, Raab H, et al. Site specific antibody drug conjugates for cancer therapy[J]. MAbs , 2014, 6 :34–45. DOI:10.4161/mabs.27022 |
| [21] | Lyons A, King DJ, Owens RJ, et al. Site-specific attachment to recombinant antibodies via introduced surface cysteine residues[J]. Protein Eng , 1990, 3 :703–708. DOI:10.1093/protein/3.8.703 |
| [22] | Axup JY, Bajjuri KM, Ritland M, et al. Synthesis of sitespecific antibody-drug conjugates using unnatural amino acids[J]. Proc Natl Acad Sci USA , 2012, 109 :16101–16106. DOI:10.1073/pnas.1211023109 |
| [23] | Drake PM, Albers AE, Baker J, et al. Aldehyde tag coupled with hips chemistry enables the production of ADCs conjugated site-specifically to different antibody regions with distinct in vivo efficacy and PK outcomes[J]. Bioconjug Chem , 2014, 25 :1331–1341. DOI:10.1021/bc500189z |
| [24] | Jackson D, Stover D. Using the lessons learned from the clinic to improve the preclinical development of antibody drug conjugates[J]. Pharm Res , 2014, 32 :3458–3469. |
| [25] | Bross PF, Beitz J, Chen G, et al. Approval summary:gemtuzumab ozogamicin in relapsed acute myeloid leukemia[J]. Clin Cancer Res , 2001, 7 :1490–1496. |
| [26] | Burnett AK, Hills RK, Milligan D, et al. Identification of patients with acute myeloblastic leukemia who benefit from the addition of gemtuzumab ozogamicin:results of the MRC AML15 trial[J]. J Clin Oncol , 2011, 29 :369–377. DOI:10.1200/JCO.2010.31.4310 |
| [27] | Ravandi F. Gemtuzumab ozogamicin:one size does not fit all-the case for personalized therapy[J]. J Clin Oncol , 2011, 29 :349–351. DOI:10.1200/JCO.2010.32.2693 |
| [28] | Burnett AK, Hills RK, Hunter AE, et al. The addition of gemtuzumab ozogamicin to intensive chemotherapy in older patients with AML produces a significant improvement in overall survival:results of the UK NCRI AML16 randomized trial[J]. Blood , 2011, 118 :268–268. |
| [29] | Clinical Trials.gov Identifier:NCT01409161.https://www.clinicaltrials.gov/ct2/show/NCT01409161?term=NCT01409161&rank=1.2015. |
| [30] | Tian ZG, Longo DL, Funakoshi S, et al. In vivo antitumor effects of unconjugated CD30 monoclonal antibodies on human anaplastic large-cell lymphoma xenografts[J]. Cancer Res , 1995, 55 :5335–5341. |
| [31] | Younes A, Bartlett NL, Leonard JP, et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas[J]. N Engl J Med , 2010, 363 :1812–1821. DOI:10.1056/NEJMoa1002965 |
| [32] | Clinical Trials.gov Identifier:NCT01100502.https://www.clinicaltrials.gov/ct2/show/NCT01100502?term=Brentuximab+Vedotin+Stem+Cell+Transplantation&rank=6.2015 |
| [33] | Clinical Trials.gov Identifier:NCT01421667.https://www.clinicaltrials.gov/ct2/show/NCT01421667?term=Brentuximab+Vedotin&rank=5.2015. |
| [34] | Krop IE, Beeram M, Modi S, et al. Phase I study of trastuzumab-DM1,an HER2 antibody-drug conjugate,given every 3 weeks to patients with HER2-positive metastatic breast cancer[J]. J Clin Oncol , 2010, 28 :2698–2704. DOI:10.1200/JCO.2009.26.2071 |
| [35] | Lewis Phillips GD, Li G, Dugger DL, et al. Targeting HER2-positive breast cancer with trastuzumab-DM1,an antibodycytotoxic drug conjugate[J]. Cancer Res , 2008, 68 :9280–9290. DOI:10.1158/0008-5472.CAN-08-1776 |
| [36] | Clinical Trials.gov Identifier:NCT01120184.https://www.clinicaltrials.gov/ct2/show/NCT01120184?term=phase+III+MARIANNE+study&rank=1.2015. |
| [37] | Bang YJ, Cutsem EV, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastrooesophageal junction cancer (ToGA):a phase 3,open-label,randomized controlled trial[J]. Lancet , 2010, 376 :687–697. DOI:10.1016/S0140-6736(10)61121-X |
| [38] | Nishiyama M, Eguchi H. Pharmacokinetics and pharmacogenomics in gastric cancer chemotherapy[J]. Adv Drug Deliv Rev , 2009, 61 :402–407. DOI:10.1016/j.addr.2008.09.004 |
| [39] | Kebriaei P, Wilhelm K, Ravandi F, et al. Inotuzumab ozogamicin (IO) is an effective salvage therapy that allows for allogeneic hematopoietic stem cell transplantation (HSCT) in remission in patients with advanced acute lymphoblastic leukemia (ALL)[J]. Blood , 2011, 118 :1340–1341. DOI:10.1182/blood-2011-02-335448 |
| [40] | Clinical Trials.gov Identifier:NCT01564784.https://www.clinicaltrials.gov/ct2/show/NCT01564784?term=NCT01564784&rank=1.2016. |
| [41] | Tse KF, Jeffers M, Pollack VA, et al. CR011,a fully human monoclonal antibody-auristatin E conjugate,for the treatment of melanoma[J]. Clin Cancer Res , 2006, 12 :1373–1382. DOI:10.1158/1078-0432.CCR-05-2018 |
| [42] | Hamid O, Sznol M, Pavlick AC, et al. Frequent dosing and GPNMB expression with CDX-011(CR011-vcMMAE),an antibody-drug conjugate (ADC),in patients with advanced melanoma[J]. J Clin Oncol , 2010, 28 (15s) :8525. |
| [43] | Clinical Trials.gov Identifier:NCT02487979.https://www.clinicaltrials.gov/ct2/show/NCT02487979?term=CDX-011&rank=3.2016. |
| [44] | Tassone P, Gozzini A, Goldmacher V, et al. In vitro and in vivo activity of the maytansinoid immunoconjugate huN901-N2'-deacetyl-N2'-(3-mercapto-1-oxopropyl)-maytansine against CD56+multiple myeloma cells[J]. Cancer Res , 2004, 64 :4629–4636. DOI:10.1158/0008-5472.CAN-04-0142 |
| [45] | Woll P,Lorigan PJ,O'Brien M.Clinical experience of IMGN901(BB-10901,huN901-DM1) in patientswith Merkel cell carcinoma (MCC)[C].Boston:AACR-NCI-EORTC International Conference on Molecular Targets and Cancer Therapeutics,2009. |
| [46] | Clinical Trials.gov Identifier:NCT01237678.https://www.clinicaltrials.gov/ct2/show/NCT01237678?term=IMGN-901&rank=2.2015. |
| [47] | Clinical Trials.gov Identifier:NCT02420873.https://www.clinicaltrials.gov/ct2/show/NCT02420873?term=IMGN-901&rank=1.2015. |
| [48] | Haffner MC, Kronberger IE, Ross JS, et al. Prostate-specific membrane antigen expression in the neovasculature of gastric and colorectal cancers[J]. Hum Pathol , 2009, 40 :1754–1761. DOI:10.1016/j.humpath.2009.06.003 |
| [49] | Liu H, Moy P, Kim S, et al. Monoclonal antibodies to the extracellular domain of prostate-specific membrane antigen also react with tumor vascular endothelium[J]. Cancer Res , 1997, 57 :3629–3634. |
| [50] | Milowsky MI, Galsky M, George DJ, et al. Phase I/Ⅱ trial of the prostate-specific membrane antigen (PSMA)-targeted immunoconjugate MLN2704 in patients (pts) with progressive metastatic castration resistant prostate cancer (CRPC)[J]. J Clin Oncol , 2006, 24 (18s) :4500. |
| [51] | Petrylak D, Smith D, Appleman L, et al. A phase Ⅱ trial of prostate specific membrane antigen antibody drug conjugate in taxane-refractory metastatic castration-resistant prostate cancer[J]. J Clin Oncol , 2014, 32 (5s) :5023. |
| [52] | Cardarelli P,King D,Terrett J,et al.Efficacy and safety of a human anti-CD70 antibody-MGBA conjugate[C].AACR Annual Meeting,2008. |
| [53] | Terrett J,Gangwar S,Rao-Naik C,et al.Single,low dose treatment of lymphoma and renal cancer xenografts with human anti-CD70 antibody-toxin conjugates,results in long term cures[C].AACR Annual Meeting,2007. |
| [54] | Clinical Trials.gov Identifier:NCT00944905.https://www.clinicaltrials.gov/ct2/show/NCT00944905?term=MDX-1203&rank=1.2013. |
 2016, Vol. 51
2016, Vol. 51


