2. 复旦大学上海医学院药理学系, 上海 200032 ;
3. 复旦大学上海医学院神经生物学系, 上海 200032
2. Department of Pharmacology, Shanghai Medical College of Fudan University, Shanghai 200032, China ;
3. Department of Neuronbiology, Shanghai Medical College of Fudan University, Shanghai 200032, China
人为什么需要睡眠?这一困惑人类几千年的问题至今仍是一个谜。尽管到目前为止,对睡眠的原因和功能了解仍十分匮乏,但是科学工作者们已经在揭示调控睡眠-觉醒行为的大脑神经环路和机制方面取得重大突破。研究发现,睡眠-觉醒行为的发生和维持涉及脑内多个核团多种类型神经元的共同参与和调节。其中参与唤醒大脑皮层进入觉醒状态的相关神经核团组成上行激活系统,包括外侧下丘脑 (lateral hypothalamus,LHA)、结节乳头核 (tuberomammillary nucleus,TMN)、臂旁核 (parabrachial nucleus,PB)、蓝斑(locus coeruleus,LC) 和基底前脑 (basal forebrain,BF) 等[1, 2]。下丘脑腹外侧视前区 (ventrolateral preoptic area,VLPO)[3]和延髓面神经外背侧面旁区 (parafacial zone,PZ)[4, 5]为已知的主要睡眠相关核团。Saper等[1]发现了睡眠-觉醒相关神经核团之间的相互抑制作用,提出睡眠-觉醒调控的“跷跷板模型”,认为睡眠与觉醒并不是两个独立的过程,二者相互遏制,此消彼长。
基底前脑作为上行网状激活系统在腹侧部的最后一站[6],在皮层促觉醒、睡眠-觉醒时相转换、觉醒状态维持和睡眠内稳态调节中发挥重要作用。本文综述了基底前脑在睡眠-觉醒调控中的作用和机制,并重点讨论基底前脑中不同递质类型神经元在睡眠-觉醒调控中的研究进展。
1 基底前脑目前国内外对基底前脑并无严格的定义,绝大多数文献中描述的基底前脑是指在大脑半球前端腹侧面,位于下丘脑前侧,基底神经节腹侧的前脑底侧的一组结构[7],通常包括内侧隔核 (medial septum,MS)、基底部巨细胞核 (nucleus basalis magnocellularis,NBM)、无名质区 (substantia innominate,SI)、斜角带垂直部(vertical division of diagonal band,VDB)、斜角带水平部 (the level of division of diagonal band,HDB) 和巨细胞视前区 (magnocellular preoptic nucleus,MCPO)[8]。现阶段研究提示SI、HDB和MCPO区与觉醒行为密切相关[9, 10] (图 1)。
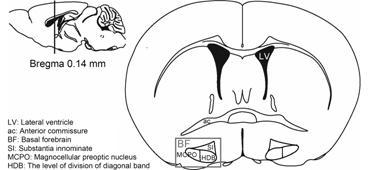
|
Figure 1 The schematic diagram of the location of basal forebrain[10]. HDB: The level of division of diagonal band; MCPO: mangocellular preoptic nucleus; SI: substantia innominate |
按照神经元递质类型划分,基底前脑中主要存在合成胆碱能 (5%)、GABA能(35%) 和谷氨酸能 (55%) 3种经典递质的神经元[11]。大量实验证据显示,基底前脑中的这3种神经元在睡眠-觉醒行为的调控中相互协作,发挥着重要作用。
2 基底前脑与睡眠-觉醒行为早期在体动物实验研究用红藻氨酸 (kainic acid) 非特异性毁损大鼠单侧基底前脑神经元后,发现同侧大脑皮层慢波活动增多,其中以delta波 (1~4 Hz) 谱能增强为主,而对侧大脑皮层活动无影响[12]。向猫基底前脑灌流腺苷 (adenosine) 抑制其神经元活性后,动物觉醒量也减少,表现为delta波谱能的增强和theta波 (6 ~9 Hz)、alpha波(9~15 Hz)、beta波 (15~30 Hz) 以及gamma波 (30~60 Hz) 谱能的减弱[13]。另外,用orexin-saporin (OX-SAP) 非选择性大面积毁损大鼠基底前脑几乎所有神经元后,动物在术后第10天突然陷入一种“类似昏迷”的状态,表现为单调的低频慢波的脑电图 (electroencephalogram,EEG),即EEG谱能一直以sub-delta波 (< 1.0 Hz) 为主,且一直伴有无目的运动[14]。这些结果表明基底前脑功能受损会降低动物的觉醒量和觉醒度,提示基底前脑在皮层唤醒和觉醒的维持中发挥重要作用。然而这些非神经元特异性的损毁和药理学抑制实验无法说明基底前脑中不同类型的神经元在睡眠-觉醒调节中发挥何种作用。
为了进一步研究基底前脑在生理性睡眠-觉醒调节中的作用。2004年,Lee等[15]运用在体细胞外记录方法记录了大鼠基底前脑神经元在睡眠-觉醒各时相中的放电频率。结果显示,基底前脑中62% 神经元在觉醒 (wakefulness) 期与快速动眼 (rapid eyemovement,REM) 睡眠期同时表现出最强发放特性,并且放电频率分别与gamma波和theta波幅度呈正相关; 12%在觉醒期最强,与肌电图 (elecromyograph,EMG) 活动程度正相关; 16% 在非快速动眼 (non-rapid eye movement,NREM) 睡眠期最强,与delta波幅度正 相关,而剩余10% 的放电频率与睡眠-觉醒行为无相关性,表明基底前脑中同时存在与睡眠相关 (sleep- active) 和觉醒相关 (wake-active) 的神经元。鉴于基底前脑中存在多种类型神经元,这些结果提示基底前脑中不同类型的神经元可能在睡眠-觉醒的调节中发挥不同的作用。
2.1 基底前脑胆碱能神经元与睡眠-觉醒行为皮层的乙酰胆碱 (acetylcholine,ACh) 主要来源于基底前脑胆碱能神经元[7],在觉醒期与REM睡眠期基底前脑胆碱能神经元放电强,皮层ACh水平高; 在NREM睡眠期基底前脑胆碱能神经元放电弱,皮层ACh水平低[16, 17]。利用神经降压素 (neurotensin) 特异性激活基底前脑胆碱能神经元可引起大鼠觉醒量和REM睡眠量增多,NREM睡眠量减少; 皮层gamma波与theta波谱能增强,delta波谱能减弱[17, 18]。光遗传学技术 (optogenetics) 是将光学和分子遗传学结合而产生的一门新兴技术。该方法通过将光敏感的阳离子或阴离子通道蛋白表达在特定的神经元中,然后用特定波长的光刺激激活该通道,从而实现对特定神经元的激活或抑制。由于光刺激控制离子通道的开放和关闭速度可达到毫秒级,因此在一定程度上可以模拟生理条件下神经元的放电[19]。近年来,多位学者利用该方法特异性激活基底前脑胆碱能神经元均可以引起小鼠的觉醒量增多,NREM睡眠量减少,REM睡眠量不改变。其中,Han等[20]研究结果显示: 光刺激小鼠基底前脑胆碱能神经元使小鼠由NREM睡眠期直接进入觉醒期或REM睡眠期; 在觉醒期或REM睡眠期给予刺激可延长时相的持续时间。而Xu和Irmak等[21, 22]研究结果则显示光刺激小鼠基底前脑胆碱能神经元可引起动物由NREM睡眠期向觉醒期的转换和觉醒期的延长,但并未见NREM睡眠期向REM睡眠期发生转换。另外,在动物处于清醒状态下光刺激激活基底前脑MS区的胆碱能神经元可引起皮层theta波节律增强,而频率低于和高于theta波的波段活动均被抑制[23]。遗传药理学中“被特定配体活化的受体” (designer receptors exclusively activated by designer drug,DREADD) 技术是将药理学和分子遗传学结合的一种新兴技术。该技术的原 理是将体内毒蕈碱受体突变,使其不能被内源性乙酰胆碱识别,但可被人工合成的氯氮平-N-氧化物 (clozapine-N-oxide,CNO) 激活。研究时,先将突变的毒蕈碱受体表达在特定的神经元中,再腹腔注射一定浓度的CNO即可实现对特定神经元的激活或抑 制[24]。Anaclet等[25]利用该方法特异性激活基底前脑胆碱能神经元后发现,小鼠的觉醒时相和NREM睡眠时相片段增多,表明睡眠-觉醒时相转换的次数增多; 且delta波谱能减弱,REM睡眠的发生出现延迟,但睡眠-觉醒量无变化。这些结果表明基底前脑碱能神经元的激活具有促觉醒作用。而实验结果的差异可能是由于不同学者对基底前脑的定位标准不统一,对EEG谱能的判定标准不同,以及光遗传学实验方案和使用的神经元激活方法不同所致。
此外,有学者利用IgG 192-saporin (SAP) 特异性毁损大鼠基底前脑胆碱能神经元以研究在基底前脑胆碱能神经元缺失的情况下动物睡眠-觉醒行为的变化,结果显示毁损基底前脑胆碱能神经元后大鼠NREM睡眠量仅在短期内 (术后第8~16天) 增多,第17天反弹至术前水平[14, 26, 27]。而毁损实验中对EEG谱能变化的研究结果并不一致: Berntson等[27]的实验结果显示损毁后高频EEG活动减弱,EEG谱能降低,然而在Fuller和Kaur等[14, 26]的研究中毁损并未引起大鼠EEG谱能的变化。另外,也有文献[28]报道仅毁损基底前脑MS区胆碱能神经元会引起动物皮层theta波活动减弱。这些实验结果的差异可能是因为实验 中使用的药物浓度和局部注射位置不同,导致主要毁损区域和毁损的胆碱能神经元数目之间存在差异所致。
综合上述动物实验的结果可以发现,基底前脑胆碱能神经元在睡眠-觉醒行为中主要发挥皮层唤醒作用,同时也能促进睡眠时相由NREM睡眠向觉醒或REM睡眠转换,并具有一定的觉醒维持作用。
临床研究表明阿尔兹海默症 (Alzheimer’s disease,AD) 的发病机制与基底前脑胆碱能神经元病变有关[29]。AD患者亦有睡眠-觉醒行为异常,主要表现为夜间睡眠过程中觉醒次数增多和时间延长,慢波睡眠量明显减少[30]; 白天小憩时间延长和次数增多[31, 32],表明在人类基底前脑胆碱能神经元病变亦可引起睡眠-觉醒行为的改变。但临床研究和动物实验结果的不一致可能是因为AD患者不是只有基底前脑胆碱能神经元发生病变,患者的其他脑区亦可能同时有病变发生,如视交叉上核 (suprachiasmatic nucleus,SCN)[33]。
2.2 基底前脑GABA能神经元与睡眠-觉醒行为研究[34]显示大鼠在生理性睡眠-觉醒周期中基底前脑GABA能神经元放电特性并不一致: 其中36% 在觉醒期和REM睡眠期高频放电,与皮层gamma波正相 关; 28%在NREM睡眠期高频放电,与皮层delta波 正相关; 剩余36% 在REM睡眠期放电最强,与EMG活动负相关。此外,Modirrousta等[35, 36]的研究还发现大鼠基底前脑中一些GABA能神经元上有肾上腺素α2受体 (α2-adrenergic receptors,α2-AR) 分布,这类GABA能神经元在睡眠反弹时的c-Fos蛋白表达明显多于断眠时。推测这类GABA能神经元在动物觉醒时可能受到LC的抑制,很可能为睡眠相关型GABA能神经元。而Hermanstyne等[37, 38]则发现大鼠及小鼠基底前脑MCPO和HDB区中一些GABA能神经元上有电压门控型钾离子通道 (voltage-gated potassium,Kv) Ⅱ型蛋白分布 (Kv2.2-GABA能神经元),这类GABA能神经元却在断眠时表达c-Fos蛋白,睡眠反弹时不表达,很可能为觉醒相关型GABA能神经元。这些研究表明基底前脑GABA能神经元与睡眠-觉醒行为的关系十分复杂,不同亚型的GABA能神经元在睡眠-觉醒行为中很可能发挥不同的作用。因此,对基底前脑GABA能神经元不能一概而论,需分别研究不同亚型的GABA能神经元在睡眠-觉醒行为中的作用。
早期研究显示小清蛋白 (parvalbumin,PV) 和生长激素抑制素(somatostatin,SOM) 可分别特异性标记基底前脑中不同亚型的GABA能神经元[39, 40]。2013年,McKenna等[41]又根据神经元的解剖学特征将基底前脑GABA能神经元分为皮层投射型与非皮层投射型两种亚型 (包括中间型和尾侧投射型),其中约1/4的皮层投射型GABA能神经元为小清蛋白阳性 (parvalbummin-postive,PV+) 神经元。Anaclet等[25]利用DREADD方法的研究结果表明: 在不区分GABA能神经元亚型的情况下,激活基底前脑GABA能神经元可引起小鼠觉醒量明显增多,NREM和REM睡眠量减少,以及皮层gamma波活动增强; 而抑制基底前脑GABA能神经元引起动物觉醒量减少和NREM睡眠量增多,该实验现象可能与基底前脑不同亚型GABA能神经元的分布特点有关。McKenna等[41]研究结果显示,基底前脑皮层投射型GABA能神经元主要分布在基底前脑尾侧,非皮层投射型GABA能神经元则更多地分布于基底前脑喙侧。而Anaclet等[25]激活GABA能神经元的基底前脑区域主要位于基底前脑尾侧,故绝大多数被激活的神经元可能为皮层投射型GABA能神经元。进一步研究显示,基底前脑胆碱能神经元对其附近的皮层投射型GABA能神经元具有兴奋作用,而基底前脑生长激素抑制素阳性 (somatostatin-postive,SOM+) 神经元则对该区域其他类型的神经元具有抑制作用[21, 42]。利用光遗传学技术特异性激活小鼠基底前脑PV+神经元可引起皮层gamma波活动增强[43],以及小鼠觉醒量增多和NREM睡眠量减少,而基底前脑SOM+神经元的激活则引起小鼠NREM睡眠增多和觉醒量减少[21]。
由此可以推断,在觉醒期,除了基底前脑胆碱能神经元释放ACh直接兴奋皮层神经元外,基底前脑皮层投射型GABA能神经元可能释放GABA抑制皮层中间型GABA能神经元的活动,间接发挥中枢促觉醒和觉醒维持的作用。而到了NREM睡眠期,随着蓝斑活动减弱,基底前脑处中间型GABA能神经元很有可能是α2-AR-GABA能神经元或SOM+神经元活动增强,局部GABA水平升高,抑制附近胆碱能和皮层投射型GABA能神经元活动; 进而使皮层ACh水平降低和GABA水平升高,皮层活动同步化。但目前对α2-AR-GABA能神经元、Kv2.2-GABA能神经元、SOM+神经元以及皮层投射型、非皮层投射型GABA能神经元相互之间联系尚无相关报道。
2.3 基底前脑谷氨酸能神经元与睡眠-觉醒行为部分研究显示,大鼠在生理性睡眠周期中,基底前脑中46% 非胆碱能和GABA能神经元在觉醒期和REM 睡眠期均高频放电,17% 在NREM睡眠期放电最强,17% 在REM睡眠期放电最强,14% 在觉醒期放电最强,且放电频率与EEG活动正相关。在这些神经元中82% 为谷氨酸能神经元[34],提示基底前脑中谷氨酸能神经元与睡眠-觉醒行为的关系也十分复杂。而现阶段对基底前脑谷氨酸能神经元亚型的具体分类和鉴别并无相关报道,可能与谷氨酸能神经元投射不明确、缺乏特异性标记物等原因有关。
谷氨酸受体在基底前脑中亦有表达[34, 44]。早期研究发现基底前脑谷氨酸能神经元的轴突末梢与附近的胆碱能神经元之间有突触连接[45],向大鼠基底前脑灌注谷氨酸受体激动剂可引起动物皮层ACh水平升高,EEG高频活动增强[46]。最新研究结果显示,利用光遗传学技术[21]特异性激活小鼠基底前脑谷氨酸能神经元可使小鼠由NREM睡眠期直接进入觉醒期,并可引起动物觉醒量增多和NREM睡眠量减少; 而利用DREADD方法[25]特异性激活小鼠基底前脑谷氨酸能神经元则主要引起动物NREM睡眠期delta波和beta波谱能减弱,而对其睡眠-觉醒量没有影响。实验结果的差异除了来自于研究方法的不同外,可能同样来自于对EEG谱能的判定标准不同,以及对基底前脑的定位标准不统一,使得激活的谷氨酸能神经元分布存在差异。
离体电生理研究显示基底前脑谷氨酸能神经元对附近的胆碱能和GABA能神经元具有兴奋作用[21],基底前脑谷氨酸能神经元很可能作为“兴奋中转站”,通过激活局部其他类型的神经元发挥作用。此外,亦有文献[47, 48]报道基底前脑谷氨酸能神经元直接向内嗅皮层和前额叶皮层投射,提示其还可能直接释放谷氨酸对兴奋皮层神经元产生兴奋作用。
3 小结及展望基底前脑在调控睡眠-觉醒行为中发挥着重要的作用,其中胆碱能神经元从被发现就一直是关注的热点。经过几十年的努力,现阶段对基底前脑中胆碱能神经元、GABA能神经元和谷氨酸能神经元在睡 眠-觉醒行为中的作用有了一定的认识。特别是近年来各种新的技术手段,如DREADD方法、光遗传学方法以及各种转基因动物的出现,为特定类型神经元的研究提供了极大的便利,这也使得GABA能神经元与谷氨酸能神经元成为近几年来的研究热点。此外,基底前脑中还分布了一些肽能神经元,对于它们是否参与睡眠-觉醒行为仍需要进一步探索。相信随着科技的发展以及新方法新技术的应用,对基底前脑不同类型的神经元在睡眠-觉醒行为中的具体作用将有更加全面和深刻的了解。
| [1] | Saper CB, Fuller PM, Pedersen NP, et al. Sleep state switching[J]. Neuron , 2010, 68 :1023–1042. DOI:10.1016/j.neuron.2010.11.032 |
| [2] | Saper CB, Scammell TE, Lu J. Hypothalamic regulation of sleep and circadian rhythms[J]. Nature , 2005, 437 :1257–1263. DOI:10.1038/nature04284 |
| [3] | Scammell TE, Gerashchenko DY, Mochizuki T, et al. An adenosine A2a agonist increases sleep and induces Fos in ventrolateral preoptic neurons[J]. Neuroscience , 2001, 107 :653–663. DOI:10.1016/S0306-4522(01)00383-9 |
| [4] | Anaclet C, Ferrari L, Arrigoni E, et al. The GABAergic parafacial zone is a medullary slow wave sleep-promoting center[J]. Nat Neurosci , 2014, 17 :1217–1224. DOI:10.1038/nn.3789 |
| [5] | Anaclet C, Lin JS, Vetrivelan R, et al. Identification and characterization of a sleep-active cell group in the rostral medullary brainstem[J]. J Neurosci , 2012, 32 :17970–17976. DOI:10.1523/JNEUROSCI.0620-12.2012 |
| [6] | Moruzzi G, Magoun HW. Brain stem reticular formation and activation of the EEG[J]. Electroencephalogr Clin Neurophysiol , 1949, 1 :455–473. DOI:10.1016/0013-4694(49)90219-9 |
| [7] | Mesulam MM, Mufson EJ, Levey AI, et al. Cholinergic innervation of cortex by the basal forebrain:cytochemistry and cortical connections of the septal area,diagonal band nuclei,nucleus basalis (substantia innominata),and hypothalamus in the rhesus monkey[J]. J Comp Neurol , 1983, 214 :170–197. DOI:10.1002/(ISSN)1096-9861 |
| [8] | Semba K. Multiple output pathways of the basal forebrain:organization,chemical heterogeneity,and roles in vigilance[J]. Behav Brain Res , 2000, 115 :117–141. DOI:10.1016/S0166-4328(00)00254-0 |
| [9] | Szymusiak R, Alam N, McGinty D. Discharge patterns of neurons in cholinergic regions of the basal forebrain during waking and sleep[J]. Behav Brain Res , 2000, 115 :171–182. DOI:10.1016/S0166-4328(00)00257-6 |
| [10] | Franklin KBJ, Paxinos G. The Mouse Brain in Stereotaxic Coordinates[M].2nd ed.. New York: Academic Press, 2001 . |
| [11] | Gritti I, Henny P, Galloni F, et al. Stereological estimates of the basal forebrain cell population in the rat,including neurons containing choline acetyltransferase,glutamic acid decarboxylase or phosphate-activated glutaminase and colocalizing vesicular glutamate transporters[J]. Neuroscience , 2006, 143 :1051–1064. DOI:10.1016/j.neuroscience.2006.09.024 |
| [12] | Vanderwolf CH, Raithby A, Snider M, et al. Effects of some cholinergic agonists on neocortical slow wave activity in rats with basal forebrain lesions[J]. Brain Res Bull , 1993, 31 :515–521. DOI:10.1016/0361-9230(93)90118-U |
| [13] | Portas CM, Thakkar M, Rainnie DG, et al. Role of adenosine in behavioral state modulation:a microdialysis study in the freely moving cat[J]. Neuroscience , 1997, 79 :225–235. DOI:10.1016/S0306-4522(96)00640-9 |
| [14] | Fuller PM, Sherman D, Pedersen NP, et al. Reassessment of the structural basis of the ascending arousal system[J]. J Comp Neurol , 2011, 519 :933–956. DOI:10.1002/cne.v519.5 |
| [15] | Lee MG, Manns ID, Alonso A, et al. Sleep-wake related discharge properties of basal forebrain neurons recorded with micropipettes in head-fixed rats[J]. J Neurophysiol , 2004, 92 :1182–1198. DOI:10.1152/jn.01003.2003 |
| [16] | Lee MG, Hassani OK, Alonso A, et al. Cholinergic basal forebrain neurons burst with theta during waking and paradoxical sleep[J]. J Neurosci , 2005, 25 :4365–4369. DOI:10.1523/JNEUROSCI.0178-05.2005 |
| [17] | Jones BE. Activity,modulation and role of basal forebrain cholinergic neurons innervating the cerebral cortex[J]. Prog Brain Res , 2004, 145 :157–169. DOI:10.1016/S0079-6123(03)45011-5 |
| [18] | Cape EG, Manns ID, Alonso A, et al. Neurotensin-induced bursting of cholinergic basal forebrain neurons promotes γ and θ cortical activity together with waking and paradoxical sleep[J]. J Neurosci , 2000, 20 :8452–8461. |
| [19] | Zhang F, Wang LP, Brauner M, et al. Multimodal fast optical interrogation of neural circuitry[J]. Nature , 2007, 446 :633–639. DOI:10.1038/nature05744 |
| [20] | Han Y, Shi YF, Xi W, et al. Selective activation of cholinergic basal forebrain neurons induces immediate sleep-wake transitions[J]. Curr Biol , 2014, 24 :693–698. DOI:10.1016/j.cub.2014.02.011 |
| [21] | Xu M, Chung S, Zhang S, et al. Basal forebrain circuit for sleep-wake control[J]. Nat Neurosci , 2015, 18 :1641–1647. DOI:10.1038/nn.4143 |
| [22] | Irmak SO, de Lecea L. Basal forebrain cholinergic modulation of sleep transitions[J]. Sleep , 2014, 37 :1941–1951. |
| [23] | Vandecasteele M, Varga V, Berenyi A, et al. Optogenetic activation of septal cholinergic neurons suppresses sharp wave ripples and enhances theta oscillations in the hippocampus[J]. Proc Natl Acad Sci U S A , 2014, 111 :13535–13540. DOI:10.1073/pnas.1411233111 |
| [24] | Nawaratne V, Leach K, Suratman N, et al. New insights into the function of M4 muscarinic acetylcholine receptors gained using a novel allosteric modulator and a DREADD (designer receptor exclusively activated by a designer drug)[J]. Mol Pharmacol , 2008, 74 :1119–1131. DOI:10.1124/mol.108.049353 |
| [25] | Anaclet C, Pedersen NP, Ferrari LL, et al. Basal forebrain control of wakefulness and cortical rhythms[J]. Nat Commun , 2015, 6 :8744. DOI:10.1038/ncomms9744 |
| [26] | Kaur S, Junek A, Black MA, et al. Effects of ibotenate and 192IgG-saporin lesions of the nucleus basalis magnocellularis/substantia innominata on spontaneous sleep and wake states and on recovery sleep after sleep deprivation in rats[J]. J Neurosci , 2008, 28 :491–504. DOI:10.1523/JNEUROSCI.1585-07.2008 |
| [27] | Berntson GG, Shafi R, Sarter M. Specific contributions of the basal forebrain corticopetal cholinergic system to electroencephalographic activity and sleep/waking behaviour[J]. Eur J Neurosci , 2002, 16 :2453–2461. DOI:10.1046/j.1460-9568.2002.02310.x |
| [28] | Gerashchenko D, Salin-Pascual R, Shiromani PJ. Effects of hypocretin-saporin injections into the medial septum on sleep and hippocampal theta[J]. Brain Res , 2001, 913 :106–115. DOI:10.1016/S0006-8993(01)02792-5 |
| [29] | Baloyannis SJ. Brain capillaries in Alzheimer's disease[J]. Hell J Nucl Med , 2015, 18 (Suppl 1) :152. |
| [30] | Vitiello MV, Prinz PN, Williams DE, et al. Sleep disturbances in patients with mild-stage Alzheimer's disease[J]. J Gerontol , 1990, 45 :M131–M138. DOI:10.1093/geronj/45.4.M131 |
| [31] | Weissová K, Bartoš A, Sládek M, et al. Moderate changes in the circadian system of Alzheimer's disease patients detected in their home environment[J]. PLoS One , 2016, 11 :e0146200. DOI:10.1371/journal.pone.0146200 |
| [32] | Lee JH, Bliwise DL, Ansari FP, et al. Daytime sleepiness and fu nctional impairment in Alzheimer disease[J]. Am J Geriatr Psychiatry , 2007, 15 :620–626. DOI:10.1097/JGP.0b013e3180381521 |
| [33] | Swaab DF, Fliers E, Partiman TS. The suprachiasmatic nucleus of the human brain in relation to sex,age and senile dementia[J]. Brain Res , 1985, 342 :37–44. DOI:10.1016/0006-8993(85)91350-2 |
| [34] | Hassani OK, Lee MG, Henny P, et al. Discharge profiles of identified GABAergic in comparison to cholinergic and putative glutamatergic basal forebrain neurons across the sleep-wake cycle[J]. J Neurosci , 2009, 29 :11828–11840. DOI:10.1523/JNEUROSCI.1259-09.2009 |
| [35] | Modirrousta M, Mainville L, Jones BE. Gabaergic neurons with α2-adrenergic receptors in basal forebrain and preoptic area express c-Fos during sleep[J]. Neuroscience , 2004, 129 :803–810. DOI:10.1016/j.neuroscience.2004.07.028 |
| [36] | Manns ID, Lee MG, Modirrousta M, et al. Alpha 2 adrenergic receptors on GABAergic,putative sleep-promoting basal forebrain neurons[J]. Eur J Neurosci , 2003, 18 :723–727. DOI:10.1046/j.1460-9568.2003.02788.x |
| [37] | Hermanstyne TO, Subedi K, Le WW, et al. Kv2.2:a novel molecular target to study the role of basal forebrain GABAergic neurons in the sleep-wake cycle[J]. Sleep , 2013, 36 :1839–1848. |
| [38] | Kihira Y, Hermanstyne TO, Misonou H. Formation of heteromeric Kv2 channels in mammalian brain neurons[J]. J Biol Chem , 2010, 285 :15048–15055. DOI:10.1074/jbc.M109.074260 |
| [39] | Zaborszky L, Duque A. Local synaptic connections of basal forebrain neurons[J]. Behav Brain Res , 2000, 115 :143–158. DOI:10.1016/S0166-4328(00)00255-2 |
| [40] | Duque A, Balatoni B, Detari L, et al. EEG correlation of the discharge properties of identified neurons in the basal forebrain[J]. J Neurophysiol , 2000, 84 :1627–1635. |
| [41] | McKenna JT, Yang C, Franciosi S, et al. Distribution and intrinsic membrane properties of basal forebrain GABAergic and parvalbumin neurons in the mouse[J]. J Comp Neurol , 2013, 521 :1225–1250. DOI:10.1002/cne.23290 |
| [42] | Yang C, McKenna JT, Zant JC, et al. Cholinergic neurons excite cortically projecting basal forebrain GABAergic neurons[J]. J Neurosci , 2014, 34 :2832–2844. DOI:10.1523/JNEUROSCI.3235-13.2014 |
| [43] | Kim T, Thankachan S, McKenna JT, et al. Cortically projecting basal forebrain parvalbumin neurons regulate cortical gamma band oscillations[J]. Proc Natl Acad Sci U S A , 2015, 112 :3535–3540. DOI:10.1073/pnas.1413625112 |
| [44] | Fremeau RT Jr, Troyer MD, Pahner I, et al. The expression of vesicular glutamate transporters defines two classes of excitatory synapse[J]. Neuron , 2001, 31 :247–260. DOI:10.1016/S0896-6273(01)00344-0 |
| [45] | Hur EE, Edwards RH, Rommer E, et al. Vesicular glutamate transporter 1 and vesicular glutamate transporter 2 synapses on cholinergic neurons in the sublenticular gray of the rat basal forebrain:a double-label electron microscopic study[J]. Neuroscience , 2009, 164 :1721–1731. DOI:10.1016/j.neuroscience.2009.09.042 |
| [46] | Fournier GN, Materi LM, Semba K, et al. Cortical acetylcholine release and electroencephalogram activation evoked by ionotropic glutamate receptor agonists in the rat basal forebrain[J]. Neuroscience , 2004, 123 :785–792. DOI:10.1016/j.neuroscience.2003.10.021 |
| [47] | Manns ID, Mainville L, Jones BE. Evidence for glutamate,in addition to acetylcholine and GABA,neurotransmitter synthesis in basal forebrain neurons projecting to the entorhinal cortex[J]. Neuroscience , 2001, 107 :249–263. DOI:10.1016/S0306-4522(01)00302-5 |
| [48] | Henny P, Jones BE. Projections from basal forebrain to prefrontal cortex comprise cholinergic,GABAergic and glutamatergic inputs to pyramidal cells or interneurons[J]. Eur J Neurosci , 2008, 27 :654–670. DOI:10.1111/ejn.2008.27.issue-3 |
 2016, Vol. 51
2016, Vol. 51


