2. 沈阳药科大学 中韩分子生药学研究室, 辽宁 沈阳 110016;
3. 沈阳药科大学 生命科学与生物制药学院, 辽宁 沈阳 110016
2. Laboratory of China-Korea Molecular Pharmacognosy, Shenyang Pharmaceutical University, Shenyang 110016, China;
3. School of Life Science and Biopharmaceutics, Shenyang Pharmaceutical University, Shenyang 110016, China
中华大蟾蜍 (B. bufo gargarizans) 耳后腺的干燥分泌物,即蟾酥,为我国传统贵重中药材[1, 2],其化学成分复杂,主要含蟾蜍毒素类 (bufotoxins)、蟾毒配基类 (bufogenins) 和蟾毒色胺类(bufotenines) 化合物[3]。有文献报道蟾毒色胺类化合物蟾蜍丁酸 (bufobutanoic acid) 和蟾蜍吡嗪酰胺 (bufopyramide) 能够抑制小鼠P388淋巴细胞性白血病细胞[4],蟾蜍噻宁 (bufothionine) 能够显著抑制人肝癌细胞系SMMC-7721、BEL-7402和H22的生长,并具有良好的肝损伤修复作用[5, 6]。此外,蟾毒色胺 (bufotenin) 能引起肾上腺素释放并能增加肾上腺素对其受体敏感性,静脉注射可升高血压; 并具有显著的致幻作用[7, 8],5-羟色胺 (serotonin) 更是重要的神经递质,具有重要的生理功能。可见蟾毒色胺类成分也是蟾酥的重要活性成分之一,并与蟾酥的安全用药密切相关,但关于其生物合成机制的研究还未见报道。
蟾毒色胺类 (bufotenines) 化合物均包含一个吲哚母核,是一系列5-羟色胺的衍生物。5-羟色胺由色氨酸经色氨酸羟化酶 (tryptophan hydroxylase,TPH) 和芳香族氨基酸脱羧酶 (aromatic-L-amino-acid decarboxylase,AAADC) 催化合成而来,其中TPH为该反应的限速酶[9, 10]。
目前已报道的TPH亚型有两种,TPH1为最早发现的基因亚型,主要在外周组织表达,而TPH2主要在神经中枢表达[11]。TPH1作为5-羟色胺生物合成中的关键酶,迄今为止的研究多集中在其改善精神疾病方面的作用[12],而对于TPH1是否参与蟾酥中蟾毒色胺类化合物的生物合成尚无明确结论。
本研究室构建了中华大蟾蜍耳后腺cDNA文库,测序获得了TPH1的cDNA序列,本文运用生物信息学软件分析了BbgTPH1的性质、结构及功能,并构建了原核重组融合表达载体pMAL-BbgTPH1,经IPTG诱导表达,获得重组融合蛋白BbgTPH1,为进一步深入研究BbgTPH1以及蟾蜍中蟾毒色胺类化合物的生物合成分子机制和次生代谢调控等奠定科学基础。
材料与仪器成体中华大蟾蜍由沈阳药科大学实验动物中心提供,经沈阳药科大学中药学院王东副教授鉴定为中华大蟾蜍 (B. bufo gargarizans); RNAiso Plus和Recombinant DNase I (RNase-free)、限制性内切酶Nde I和Not I、pMD19-T Simple Vector购自大连宝生物公司; RNA inhibitor购自上海生工生物有限公司; pMAL-c5E表达载体、TB1表达菌株购自NEB公司; 蛋白Marker购自Fementas公司; Tris、丙烯酰胺、甲叉双丙烯酰胺、甘氨酸、EDTA、SDS、考马斯亮蓝、过硫酸铵、溴酚蓝、DTT购自Biosharp公司; β-巯基乙醇、TEMED、L-色氨酸、5-羟色氨酸、BH4 (四氢生物蝶呤)、过氧化氢酶、Hepes (4-羟乙基哌嗪乙磺酸) 购自Sigma公司; 蛋白胨、酵母粉购自Oxoid公司; 琼脂糖购自Biowest公司; IPTG、x-gal、MOPS购自Amresco公司; PIPES购自Solarbio; 氨苄青霉素购自天根生化科技有限公司; 琼脂粉购自天津科密欧化学试剂有限公司; 无水乙醇 (95%)、分析乙醇、氯仿、异丙醇购自国药集团化学试剂有限公司; 氢氧化钠、氯化锰、氯化钙、氯化钾购自天津博迪化工股份有限公司。
SW-CJ-1D超净台 (苏州净化设备有限公司),Life Pro PCR仪 (杭州博日科技有限公司),Mupid-2 Plus电泳仪 (日本TaKaRa公司),CT-14RD台式高速冷冻离心机 (上海天美生化仪器设备工程有限公司),UPW-50S超纯水机 (北京历元电子仪器公司),RAININ移液器 (美国梅特勒−托利多公司),Nano Drop 2000分光光度计 (赛默飞世尔科技公司),Waters-2695高效液相色谱仪配备474荧光检测器 (美国沃特世公司),LCQ FLEETLC-MS质谱仪 (赛默飞世尔科技公司)。
方法 1 BbgTPH1基因cDNA的获得及其序列分析称取新鲜耳后腺组织约30 mg,置于装有液氮的研钵中迅速研磨、粉碎,按操作说明采用RNAiso Plus提取总RNA,经Oligotex-Dt30 < Super > mRNA Purification Kit纯化,由3’In-fusion SMARTer Directional cDNA Library Construction Kit构建中华大蟾 蜍耳后腺cDNA文库,并通过EST测序筛选获得BbgTPH1[13]。
通过NCBI (http://www.ncbi.nim.nih.gov/) 的ORF Finder预测开放阅读框; 利用ProtParam程序 (http:// cn.expasy.org/tools/protparam.html) 统计BbgTPH1基因中各种氨基酸含量,并预测理论分子量和等电点; 应用ProtScale程序 (http://expasy.org/cgibin/protscale.pl) 进行蛋白质的疏水性分析; ExPASy PROSITE (http:// www.expasy.ch/prosite/) 分析蛋白质保守结构域; 采用同源模型服务软件SWISS-MODE[14, 15]对BbgTPH1二级结构分析并预测三维结构; 使用MEGA6.0软件的Neighbor-Joining法构建系统进化树。其中重复抽样次数选择1 000,确保所构建进化树分支的稳定性。
2 BbgTPH1原核表达 2.1 BbgTPH1基因的克隆以BbgTPH1 ORF序列为基础,用Primer 5.0软件设计引物,并在其上下游引入酶切位点Nde I和Not I: Forward primer: 5'-GG AATTCCATATGTACAGCCCGCCAAGCAGACAGA- 3'; Reverse primer: 5'-GGAACCGCGGCCGCTCAGA CACCGAGCTGCTTCA-3'。PCR反应条件为: 95 ℃预变性1 min; 98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸 3 min,30个循环; 72 ℃再延伸2 min。纯化后的PCR产物经TA克隆于pMD19-T载体并进行蓝白斑筛选,挑取白色单菌落提取质粒,经双酶切验证获得阳性克隆,由北京三博远志公司测序,验证基因序列。
2.2 感受态细胞的制备和转化从新鲜的LB平板培养基上挑取E. coli单菌落,转移至5 mL LB培养 基中,37 ℃、200 r·min−1震荡培养过夜。转移250 μL上述菌液至25 mL SOB培养基中,30 ℃培养约4 h 至OD600 = 0.55~0.6。2 500×g、4 ℃离心10 min,弃 去培养液,重悬于10 mL冰预冷的ITB (55 mmol·L−1 MnCl2、15 mmol·L−1 CaCl2、250 mmol·L−1 KCl、0.5 mmol·L−1哌嗪-1,4-二乙磺酸) 中,2 500×g、4 ℃离心 10 min,弃去上清液,重悬于5 mL冰预冷的ITB中,加入400 μL DMSO后冰浴10 min,分取100 μL,加入预冷的待转化质粒5 μL,轻轻混匀后冰浴30 min,42 ℃热激90 s,快速转移至冰浴,冷却5 min。加入900 μL预热至37 ℃的LB培养基,37 ℃、150 r·min−1振荡培养1 h。取100 μL已转化的感受态细胞涂布于带抗性的LB培养基平板上,37 ℃倒置培养。
2.3 BbgTPH1表达载体的构建克隆所得BbgTPH1基因和pMAL-c5E分别通过NdeⅠ和NotⅠ双酶切,经琼脂糖凝胶电泳后,回收目的片段,16 ℃连接过夜后转化E. coli TOP10感受态细胞,挑取阳性克隆,培养后提取质粒经特异性引物 (TPH1-F: GATTTACAA TCCGCCCTGTT,pMAL-R: TGTCCTACTCAGGAGA GCGTTCAC) PCR扩增,并测序验证,得到重组表达质粒pMAL-BbgTPH1。
2.4 BbgTPH1重组蛋白的诱导表达及条件优化将重组质粒pMAL-BbgTPH1转化至E. coli TB1感受 态细胞,获得BbgTPH1表达型重组大肠杆菌TB1/ pMAL-TPH1。挑取TB1/pMAL-TPH1平板单菌落,接种于5 mL含100 μg·mL−1氨苄西林的LB培养基,37 ℃、200 r·min−1过夜培养。取1 mL培养菌液接种于100 mL含100 μg·mL−1氨苄西林LB培养基中,37 ℃、200 r·min−1培养至菌液OD600 = 0.6~1.0,加入异丙基硫代半乳糖苷 (IPTG) 诱导表达8 h。对诱导表达条件IPTG浓度(0.1、0.5、1.0 mmol·L−1)、诱导温度 (20、27、37 ℃) 进行优化。取1 mL菌液 4 ℃条件下4 000×g离心20 min,弃上清,菌体重悬于100 μL缓冲液 (20 mmol·L−1 Tris-HCl、20 mmol·L−1 NaCl、1 mmol·L−1 EDTA、1 mmol·L−1叠氮化钠、 10 mmol·L−1 β-巯基乙醇) 中。重悬液加入5×loading buffer 25 μL混匀,沸水浴5 min,12 000×g离心5 min,取15 μL上清液经10% SDS-PAGE电泳检测。并对不同IPTG诱导浓度,20 ℃诱导8 h条件下表达的目 的蛋白进行可溶性蛋白检测,方法如下: 取菌液1 mL,4 ℃条件下4 000×g离心20 min,弃上清,菌体重悬 于上述缓冲液,冰水浴中超声破碎2 min (200 W,每次3 s, 间隔5 s),12 000 r·min−1离心5 min,上清和 沉淀(用100 μL 8 mol·L−1尿素溶解) 分别进行10% SDS-PAGE电泳检测。
3 酶促反应检测[16]取1 LBbgTPH1诱导表达菌液,离心收集菌体 并重悬于100 mL 2.4缓冲液中,超声破碎,4 ℃条 件下12 000×g离心20 min,上清液即为BbgTPH1 粗酶液。配制含有40 mmol·L−1 Na-Hepes (pH 7.0)、50 μmol·L−1色氨酸、0.05 mg·mL−1过氧化氢酶、 10 μmol·L−1硫酸亚铁铵、2.5 mmol·L−1 DTT和&nbs p; 250 μmol·L−1 BH4反应液,然后分别加入BbgTPH1粗酶液,高温变性BbgTPH1粗酶液和pMAL-c5E同等 表达条件下的蛋白粗提物,混合均匀,在37 ℃孵育30 min,加入等体积冰醋酸/乙醇 (体积比1∶100) 在冰浴上终止反应。反应结束后12 000×g离心10 min,分别取上清液进行HPLC分析以检测是否产生5-羟色氨酸,检测条件如下: 色谱柱: Ultimate Polar-RP (250 mm × 4.6 mm,5 μm); 流动相: 甲醇−水 (体积 比10∶90 ); 流速: 1.0 mL·min−1; 进样量: 10 μL; 柱温: 室温; 荧光检测器: 激发波长290 nm,输出 波长340 nm。并采用LC-MS/MS法鉴定反应产物,LC-MS条件如下: 色谱柱: Kinetex 2.6 μ XB-C18 100A (50 mm × 2.1 mm),以甲醇−水 (体积比5∶95) 为流动相,流速为0.2 mL·min−1,分流比为30%,柱温为35 ℃,进样量为2 μL。采用APCI离子源检测扫描方式正离子模式检测。
结果与分析 1 BbgTPH1基因cDNA序列BbgTPH1基因cDNA序列全长为1 984 bp (GenBank登录号为: JQ768313)。ORF Finder结果显示,BbgTPH1的ORF长为1 443 bp,编码480个氨 基酸。BbgTPH1的cDNA序列及编码蛋白序列如图 1所示。利用BLAST P程序将BbgTPH1蛋白序列于GenBank蛋白数据库中进行同源比对,发现BbgTPH1与其他物种TPH1同源性都很高,相似度均能达到70% 以上。表明所得BbgTPH1为TPH1家族成员,且TPH1家族在进化过程中高度保守。

|
Figure 1 ORF and deduced amino acid sequence of BbgTPH1. The biopterin-dependent aromatic amino acid hydroxylase family profile is underlined. The leucine zipper involved in multimerization is shown with short underline. The biopterin-dependent aromatic amino acid hydroxylases signature is marked by white dots,and iron ligands aremarked by triangle |
ProtParam软件推测BbgTPH1编码480个氨基酸,蛋白分子质量为55.2 kDa,理论等电点为5.58,分子式为C2457H3814N664O745S21,带负电残基总数 (Asp + Glu) 为70,带正电残基总数 (Arg+Lys) 为57。不稳定系数 (instability index) 为48.49,属于不稳定蛋白,脂肪系数为78.96,亲水性系数为 −0.477。经ExPASy PROSITE分析,结果显示BbgTPH1编码的蛋白在129~475位点具有一段生物蝶呤依赖的芳香族氨基酸羟化酶家族序列 (biopterin-dependent aromatic amino acid hydroxylase family profile)。在304~315位点具有一段保守的生物蝶呤依赖的芳香族氨基酸羟化酶结构域模式 (biopterin-dependent aromatic amino acid hydroxylases signature),其家族共有模式为 : P-D-X(2)-H-[DE]-[LIVF]-[LIVMFY]-G-H-[LIVMC]- [PA],其中H为Fe2+结合位点 (图 1)。SWISS-MODEL
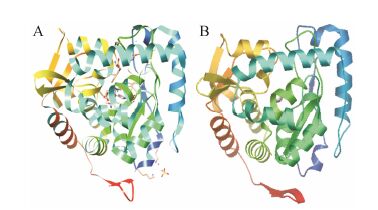
对BbgTPH1进行二级结构分析,其中α-螺旋结构占45.4%、β-折叠占15.4%、无规则卷曲占39.2%。目前仅家鸡TPH1 (3E2T) 蛋白催化域的晶体结构用X射线衍射法确定,因此选用家鸡TPH1作为参考蛋白对BbgTPH1进行同源建模,结果显示模拟的BbgTPH1保守结构域三维结构与家鸡TPH1保守结构域三维结构基本一致 (图 2),说明二者应具有相似的生物功能。
|
Model information: modeled residue range: 140 to 446; based on template: 3e2tA (1.90 A); sequence identity [%]: 91.205; evalue: 2.94928e−171; QMEAN: −0.05; GMQE: 0.71 Figure 2 Three-dimensional structure for the conserved catalytic domain of 3E2T (A) and BbgTPH1 (B) |
选取GenBank数据库中17个物种的TPH1蛋白序列与BbgTPH1蛋白序列进行比对,以东方果实蝇TPH1为根建系统进化树。结果显示,BbgTPH1与其他物种TPH1氨基酸序列均有很高的相似性。系统进化树分析 (图 3) 表明两栖类动物与鱼类、鸟类动物处于一分支中,哺乳类动物独居一支,说明BbgTPH1 与哺乳类动物的TPH1遗传关系较远,而与鱼类动物的TPH1遗传关系较近,其中BbgTPH1与两栖类非洲爪蟾的TPH1亲缘关系最近,处于一分支中。

|
Figure 3 Phylogenetic analysis of BbgTPH1 and TPH1 from other species using N-J method. The GenBank accession number were represented in parentheses |
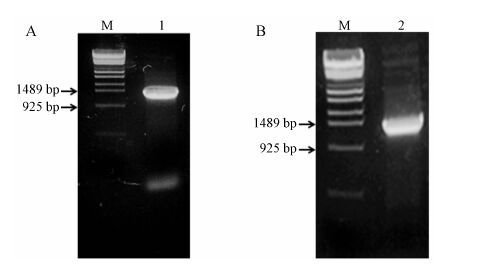
通过PCR方法扩增BbgTPH1的ORF,扩增产物经琼脂糖凝胶电泳分析,约1 500 bp处可见目的基因片段 (图 4A),该片段大小与预期长度一致,说明已成功扩增出目的基因。连接pMD19-T载体后的重组质粒经DNA测序验证无突变、无移码。将BbgTPH1基因克隆于pMAL-c5E载体NdeⅠ和NotⅠ位点,构建重组表达质粒pMAL-BbgTPH1。将pMAL-BbgTPH1导入E.coli TB1,提取质粒并经琼脂糖凝胶电泳验证可见一条约7 000 bp的DNA条带。重组质粒经PCR扩增,琼脂糖凝胶电泳检测,可见约1 500 bp目的基因片段 (图 4B),并经测序验证序列,成功获得BbgTPH1表达型重组大肠杆菌TB1/pMAL-TPH1。
|
Figure 4 (A) The PCR product of target gene on agarose gel. (B) The PCR product of recombinant plasmid of pMAL- BbgTPH1. M: λ-EcoT14Ⅰdigest DNA marker; 1 and 2: PCR products |
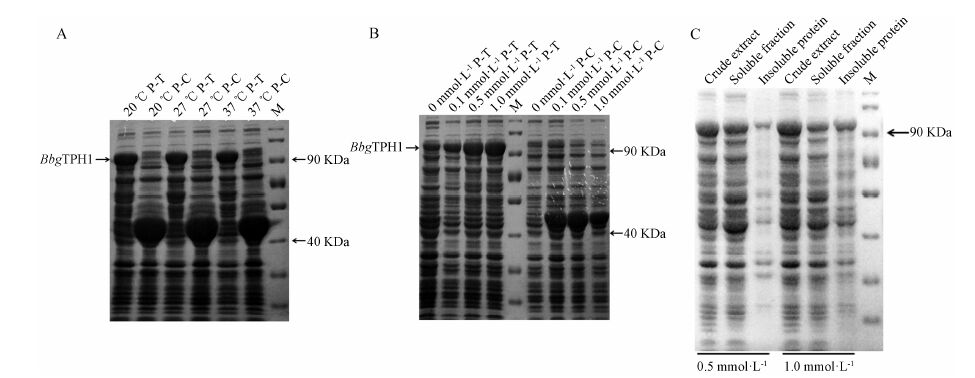
对诱导培养条件进行优化,SDS-PAGE电泳结 果表明,所获重组融合蛋白分子质量约为97 kDa,与理论值相符。诱导培养温度对表达量无较大影响 (图 5A),但表达量随IPTG浓度增高而增加 (图 5B)。一般来说,培养温度较高则菌体生长速度过快容易造成重组蛋白表达量过高、折叠不完全等而形成包涵体,因此选择较低的表达温度20 ℃。对不同IPTG 诱导浓度下可溶性重组蛋白进行检测,结果表明表达温度为20 ℃,IPTG浓度为0.5 mmol·L−1时不溶性重组蛋白较少 (图 5C),故选择诱导温度20 ℃、IPTG浓度0.5 mmol·L−1、诱导表达8 h进行重组融合蛋白的表达。
|
Figure 5 10% SDS-PAGE analysis of the expression of recombinant protein of BbgTPH1 and empty vector protein. M: Protein ladder; P-T: pMAL-BbgTPH1; P-C: Empty vector. (A) Induced by 0.5 mmol·L−1 IPTG under different temperature; (B) Induced by different IPTG concentration at 20 ℃; (C) The detection of soluble recombinant protein induced by 0.5 mmol·L−1 and 1.0 mmol·L−1 IPTG at 20 ℃ |
酶促反应结果显示,重组表达质粒组与空载体质粒对照组相比,在5-羟色氨酸对照品相应保留时间处可见一色谱峰,且该催化产物经LC-MS/MS分析,给出5-羟色氨酸 (5-hydroxytryptophan) 的准分子离子峰m/z 221.18[M+H]+,进一步确认该产物为5-羟色氨酸。本研究所得BbgTPH1重组蛋白具有生物学活性,可催化L-色氨酸生成5-羟色氨酸。
讨论蟾毒色胺类化合物是蟾酥的重要活性成分,但关于它们的生物合成机制目前还不清楚。日本学者Takeda[17]曾通过研究日本蟾蜍 (B. bufo japonicus) 与黑斑蛙 (Rana nigromaculata) 胚胎发育和变态阶段脑内化学成分的变化,推测蟾毒色胺类是由5-羟色胺转化成的N-甲基五羟色胺再经过一系列代谢而生成的。因此可以推测TPH1在蟾酥色胺类化合物的生 物合成中应具有重要作用,但迄今为止,尚未见蟾蜍属动物 TPH的相关报道。本研究通过构建中华大蟾蜍耳后腺cDNA文库,筛选得到了中华大蟾蜍TPH1的全长cDNA序列,使用便捷的原核表达系统成功表达中华大蟾蜍TPH1,并首次证实了中华大蟾蜍色氨酸羟化酶的功能,将为今后揭示蟾蜍中蟾毒色胺类化合物的生物合成分子机制以及调控相关生物合成途径等奠定科学基础。5-羟色胺是人体的重要神经递质,在人体中起减轻忧郁、失眠、食欲不振、体重失调等症状的作用,其前体物质即为5-羟色氨酸[18, 19]。药品百忧解 (Prozac) 的作用机制即是减慢人体对5-羟色氨酸的消耗,从而使人体持续产生5-羟色胺,保持患者情绪愉快、睡眠正常,也不会使患者产生抗忧郁药物引发的口干、性欲减退等作用[20]。另外5-羟色氨酸还可以提高饮食中枢的敏感性,可以作为减肥药物,在美国等已作为药品上市,受到人们越来越多的关注[21]。因此,5-羟色氨酸具有非常广泛的利用价值和应用前景。目前医药业所用的5-羟色氨酸多 从加纳籽中提取[22],但随着人类对环境的过度开发与污染,非洲加纳树的存在也越来越稀少,这对于5-羟色氨酸的生产行业无疑是难以解决的困难。采用 合成生物学的方法,构建可高效表达高活力的色氨酸羟化酶的工程菌,以色氨酸为底物,采用工业发酵法生产5-羟色氨酸将为5-羟色氨酸工业化生产另开一条蹊径。
| [1] | Chinese Pharmacopoeia Commission. The Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 ed. Part I. Beijing:China Medical Science Press, 2015:360. |
| [2] | Lou ZC, Qin B. Species Systematizationand Quality Evaluation of Commonly Used Chinese Traditional Drugs. North-China Edition Vol. Ⅱ (常用中药材品种整理和质量研究, 北方编第2册)[M]. Beijing:Beijing Medical University and Peking Union Medical College Joint Press, 1995:1134-1200. |
| [3] | Xu BJ, Xia HL. Effects of processing on venenumbufonislactone of the Chinese traditional drug Ch'an Su[J]. China J Chin Mater Med (中国中药杂志), 1998, 23:722-723. |
| [4] | Yoshiaki K, Hiroshi M, Rui T, et al. Bufobutanoic acid and bufopyramide, two new indole alkaloids from the Chinese traditional drug Ch'an Su[J]. Heterocycles, 1999, 50:499-503. |
| [5] | Xie RF, Li ZC, Gao B, et al. Bufothionine, a possible effecttive component in cinobufocini injection for hepatocellular carcinoma[J]. J Ethnopharmacol, 2012, 141:692-700. |
| [6] | Xie RF, Li ZC, Chen PP, et al. Bufothionine induced the mitochondria-mediated apoptosis in H22 liver tumor and acute liver injury[J]. Chin Med, 2015, 10:1-11. |
| [7] | Zhou F, Yang J. The research progress of bufonids' medicinal value[J]. Hunan J Tradit Chin Med (湖南中医杂志), 2015, 31:203-204. |
| [8] | Ott J. Pharmañopo-psychonautics:human intranasal, sublingual, intrarectal, pulmonary and oral pharmacology of bufotenine[J]. J Psychoactive Drugs, 2011, 33:273-281. |
| [9] | Lovenberg W, Jequier E, Sjoerdsma A. Tryptophan hydroxylation:measurement in pineal gland, brainstem, and carcinoid tumor[J]. Science, 1967, 155:217-219. |
| [10] | Kuhn DM, Rosenberg RC, Lovenberg W. Determination of some molecular parameters of tryptophan hydroxylase from rat midbrain and murine mast-cell[J]. Neurochem, 1979, 33:15-21. |
| [11] | Jones BJ, Blackburn TP. The medical benefit of 5-HT research[J]. Pharmacol Biochem Behav, 2002, 72:555-568. |
| [12] | Kim YK, Yoon HK. Effect of serotonin-related gene polymorphisms on pathogenesis and treatment response in Korean schizophrenic patients[J]. Behav Genet, 2011, 41:709-715. |
| [13] | Chen X, Zhou YJ, Wang D, et al. Construction of full length cDNA library from venom gland of Bufo bufo gargarizans[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2012, 12:975-980. |
| [14] | Arnold K, Bordoli L, Kopp J, et al. The SWISS-MODEL work space:a web-based environment for protein structure homology modelling[J]. Bioinformatics, 2006, 22:195-201. |
| [15] | Kiefer F, Arnold K, Kunzli M, et al. The SWISS-MODEL repository and associated resources[J]. Nucleic Acids Res, 2009, 37:D387-D392. |
| [16] | Jeffrey M, Knut T, Nils A. Conformation of the substrate and pterin cofactor bound to human tryptophan hydroxylase. important role of Phe313 in substrate specificity[J]. Biochem, 2001, 40:15591-15601. |
| [17] | Takeda N. The metabolism of biogenic monoamines during embryogenesis and metamorphosis in two anuran species[J]. General Comparative Endocrinol, 1997, 106:361-373. |
| [18] | Turner EH, Loftis JM, Blackwell AD. Serotonin a la carte:supplementation with the serotonin precursor 5-hydroxytryptophan[J]. Pharmacol Ther, 2006, 109:325-338. |
| [19] | Watanabe T, Sadamoto H, Aonuma H. Identification and expression analysis of the genes involved in serotonin biosynthesis and transduction in the field cricket Gryllus bimaculatus[J]. Insect Mol Biol, 2011, 20:619-635. |
| [20] | De Benedittis G, Massei R. Serotonin precursors in chronic primary headache:a double-blind cross-over study with L-5-hydroxytryptophan vs. placebo[J]. J Neurosurg Sci, 1985, 29:239-248. |
| [21] | Li JD, Liu SH, Tang M. Recent progress on study of 5-hydroxytryptophan[J]. Fine Special Chem, 2014, 22:36-39. |
| [22] | Feng JG. Isolation and purification of 5-hydroxytryptophan in extract from seeds of Griffonia simplicifolia by ionexchange resin[J]. Chin Tradit Herb Drugs (中草药), 2013, 44:2410-2415. |
 2016, Vol. 51
2016, Vol. 51


