葛根总黄酮对心脑血管疾病有显著的治疗作用。口服用药是中药治疗的主要手段,但由于葛根总黄酮溶解度低 (仅为0.86%),不易通过生物膜,口服吸收差,生物利用度不高,给药后一般需要2~3周甚至2~3个月方能起效,这在一定程度上影响葛根总黄酮口服剂型在临床上的使用。目前,葛根总黄酮的市售制剂主要包括片剂、胶囊等普通制剂,其中临床应用最广泛的是愈风宁心片,由葛根药材原粉和葛根浸膏制成,给药剂量大,生物利用度低。生物黏附漂浮制剂为胃滞留制剂中的一种,主要目的是实现胃中的长效滞留,其进入胃内后,黏附于胃黏膜上,未黏附的则漂浮在胃中,胃黏膜会不断脱落更新,随着胃黏膜脱落下来的微丸则又漂浮在胃中,从而实现长久滞留于胃内的效果[1, 2, 3],从而增加药物的吸收,提高药物的生物利用度。本课题组前期研究[4, 5, 6]表明葛根总黄酮在胃和小肠上段吸收较好,因此为了提高葛根总黄酮的口服生物利用度,本实验制备葛根总黄酮生物黏附漂浮微丸,以期延长其在胃肠道的滞留时间。
Caco-2细胞在培养条件下可形成完整致密的极性单细胞层,将其接种到聚碳酸酯膜基质后,可分化出肠腔侧 (apical,AP侧) 和肠内壁侧 (basolate,BL侧),具有类小肠上皮微绒毛等类似人体小肠上皮细胞刷状缘侧的分化特性,能够表达多种细胞代谢酶,且许多转运系统也在Caco-2细胞内被发现。药物透过Caco-2细胞的体外过程与药物口服后在体内的吸收和代谢有良好的相关性,可作为药物吸收研究的一种快速筛选工具[7, 8, 9]。目前也有研究者将Caco-2细胞模型应用于中药复杂体系的化学成分的吸收研究中[10, 11, 12]。
药物制剂的体内研究是评价制剂的最基本可靠的方法[13, 14, 15]。本课题以葛根素为指标 (占葛根总黄 酮17.93%),筛选了以卡波姆和羟丙基甲基纤维素 (HPMC) 为组合黏附材料,以十八醇和碳酸氢钠为组合漂浮材料的葛根总黄酮胃肠道生物黏附漂浮制剂,考察新剂型能否有效提高葛根总黄酮的口服生物利用度。
材料与方法主要仪器
LC-10AT高效液相色谱仪 (日本岛津公司): SPD-10AVP紫外检测器,控制器,CTO-1OASVP柱温箱,CLASS-VP工作站; 高速离心机 (TGL-16H,珠海黑马医学仪器有限公司); pH计(美国Thermo 公司)。
试药细胞株: Caco-2细胞株 (北京协和医学院基础所细胞中心,实验用30代至40代); 葛根素对照品: 中国食品药品检定研究院,批号110752-200511; 葛根总黄酮: 自制,批号: 040120; 葛根总黄酮胃肠道生物黏附漂浮制剂: 自制,批号: 140425,其中所用葛根总黄酮批号: 040120; 甲醇、乙腈为色谱纯,无水乙醇为国产分析纯。胎牛血清 (LONZA,Australia),双抗(InvitrogenTM,UK); DMSO (Logan,USA); 碱性磷酸酶 (AKP) 试剂盒 (南京建成生物工程研究所); 胰蛋白酶 (0.25%,w/v); MEM培养基 (HyClone,Thermo,USA); 细胞培养池 (BD; USA); 12孔培养板 (Corning公司);甲醇: HPLC级,Fisher公司,其余试剂、试药均为分析纯。
动物健康SD大鼠,雄性,周龄10周,体重为 (340 ± 10) g,北京市维通利华实验动物技术有限公司,动物合格证号: SDXK (京) 2014-0001。
葛根总黄酮胃肠道生物黏附漂浮微丸制备及评价分别取葛根总黄酮2 g、微晶纤维素6 g、黏附材料3 g、密度型漂浮材料1.5 g和产气型漂浮材料1.5 g等按等量递加法混合,过筛,加润湿黏合剂不断捏合,制成丸状颗粒,干燥,即得葛根总黄酮胃肠道黏附漂浮颗粒[16]。所制备的葛根总黄酮胃肠道生物黏附漂浮微丸的胃组织黏附百分率为 (80.3 ± 0.3) %,起漂时间为0 s,持续漂浮时间为12 h,达到了体外胃组织黏附性和漂浮性好的目标。
Caco-2细胞模型的建立[17, 18]Caco-2细胞培养于37 ℃、5% CO2环境中,采用MEM培养基,隔天换一次培养液,每4天按1∶3的比例传代。取对数生长期细胞按细胞数2×105 mL-1接种到12孔Transwell板上,接种后隔天换液,7天后每日换液,培养至21天。
碱性磷酸酶活性检测分别取AP和BL两侧 培养基100 μL,按照AKP试剂盒方法,测其AKP 活性。
各孔跨膜电阻检测将干燥电极放入磷酸盐缓冲液 (PBS,pH 7.4) 内平衡24 h,先测定两个未接种细胞的Transwell膜电阻,再测样品电阻,相减为样品的实际电阻 (R)。
TEER = R×A (A: Transwell insert有效面积,cm2; R: 实际电阻,Ω)。
Caco-2细胞通透性考察本实验采用酚红和普萘洛尔作为探针药物评价接种在Transwell板上的Caco-2单层细胞的完整性,为下一步药物转运实验提供依据。
试药配制精密称取葛根总黄酮,用pH 7.4的D-Hanks液配成1 mg·mL-1溶液。精密称取葛根黄酮胃肠道黏附漂浮微丸适量,用pH 7.4的D-Hanks液配成1 mg·mL-1微丸混悬液。
转运实验实验前,将培养好的Caco-2细胞单层用37 ℃、pH 7.4的D-Hanks液轻轻洗涤2次 (在30 min内完成),测量其跨膜电阻,选择符合实验要求的细胞单层膜,加入D-Hanks液于37 ℃、5% CO2培养箱中孵育30 min,取出,弃去D-Hanks液。考察药物从apical (顶端面,AP) 到basolateral (基底面,BL)的转运: 将药液 (葛根总黄酮溶液和葛根总黄酮胃肠道黏附漂浮微丸混悬液) 500 μL加入到AP侧作为供给池,同时BL侧加入1.5 mL相应pH的D-Hanks液作为接收池。将Transwell板置于37 ℃水浴振荡 器中,转速100 r·min-1,分别于给药后30、60、90和 120 min于BL侧采样200 μL,并于采样侧加入200 μL Hanks液,实验设3组平行对照。将BL侧待测药液于13 000 r·min-1离心10 min,取出上清液进样分析。
色谱条件Diamonsil C18色谱柱 (150 mm × 4.6 mm,5 μm),流动相A-乙腈∶B-水 (0.05% 醋 酸) = 10∶90,波长为254 nm,柱温为40 ℃,流速为1.0 mL·m in-1,进样量为20 μL。
数据处理Caco-2细胞模型中的表观渗透系数 (Papp) 计算公式: Papp = (dQ/dt) / (A×C0)。其中,dQ/dt (μg·s-1) 表示单位时间药物的转运量; A (cm2) 为转运膜的表面积; C0 (μg·mL-1) 是药物在供给池的初始质量浓度。用SPSS 19.0软件进行统计学数据分析,one-way ANOVA检验比较显著性差异。
血浆样品处理取健康SD大鼠全血,置于预先加入肝素钠的离心管中,13 000 r·min-1离心10 min,取上清液,即血浆。取血浆100 μL置离心管中,加入6% 高氯酸100 μL,涡旋1.5 min,13 000 r·min-1离心15 min,吸取上清液20 μL,进样。
方法专属性考察在上述色谱条件下,对空白血浆、空白血浆加葛根素对照品溶液以及口服给予葛根总黄酮后的血浆样品进行检测。
标准曲线的建立 精密量取空白血浆90 μL,置离心管中,分别精密加入质量浓度为0.57、1.14、2.28、4.56、9.125、18.25和36.5 μg·mL-1的葛根素对照品溶液10 μL,涡旋混合1 min,精密加入6% 高氯酸100 μL,涡 旋混合1.5 min,13 000 r·min-1离心15 min,吸取上清液20 μL,进样,记录色谱图。
精密度实验 精密量取空白血浆90 μL,按血浆样品处理方法操作,精密加入质量浓度为0.57、4.56和36.5 μg·mL-1的葛根素对照品溶液10 μL,配制成低、中、高浓度分别为0.057、0.456和3.65 μg·mL-1的血浆样品溶液,进样,记录色谱图,根据标准曲线计算测得浓度。每个浓度1日内重复测定3次,计算日内精密度,每个浓度连续测定3天,计算日间精密度。
相对回收率和绝对回收率实验 精密量取空白血浆90 μL,按血浆样品处理方法操作,精密加入不同浓度的葛根素对照品溶液10 μL,配制成低、中、高浓度分别为0.057、0.456和3.65 μg·mL-1的血浆样品溶液,进样,记录色谱图,另取同样浓度标准品直接进样,记录色谱图。平行测定3份,计算相对回收率与绝对回收率。
| $相对回收率 = 处理后测得量/加入量 \times 100\% $ |
| $绝对回收率 = \frac{处理后测得峰面积}{直接测得峰面积} \times 100\% $ |
大鼠给药及采血方案根据Caco-2细胞转运实验结果,可知生物黏附材料为HPMC和卡波姆复合黏附材料时,其微丸在Caco-2细胞模型转运最好,故选择HPMC-卡波姆复合材料微丸进行药代动力学考察。
实验前给SD大鼠腹腔注射巴比妥钠麻醉,麻 醉后将大鼠置于鼠板上。在大鼠颈侧切开2 cm左右小口,行颈静脉插管,最后将插管从背部由穿刺针穿出,在大鼠背部固定管子,缝合伤口。
健康SD大鼠12只,实验前禁食12 h,前一天颈静脉插管备用,第2天按100 mg·kg-1清晨灌胃给药 2 mL (采用自制大鼠微丸灌胃装置,保证微丸以完整剂型到达大鼠胃部)。随机分为两组,分别给予葛根总黄酮胃肠道黏附漂浮和葛根总黄酮原料药,于服药后0.25、0.5、0.75、l、l.5、2、3、4、6、12和24 h于颈静脉取血0.5 mL,肝素钠抗凝,10 000 r·min-1离心10 min,分离血浆,冷藏备用。
样品测试按前述标准曲线制备方法操作,测得血浆中葛根素浓度。以葛根素浓度为纵坐标,采血时间为横坐标,绘制测试制剂和参比制剂的血药浓度-时间曲线图。
药代动力学参数计算采用非房室模型法,利用WinNonlin 6.0数据统计软件分别计算测试制剂和参比制剂中葛根素的药-时曲线下面积和平均驻留时间 (MRT) 等药代动力学参数。相对生物利用度 (Fr) 计算公式如下:
| ${F_{\rm{r}}}{\rm{ = }}\frac{{{\rm{AU}}{{\rm{C}}_{0 \to t({\rm{test}})}} \times {D_{{\rm{s}}\tan {\rm{dard}}}}}}{{{\rm{AU}}{{\rm{C}}_{0 \to t({\rm{s}}\tan {\rm{dard}})}} \times {D_{{\rm{test}}}}}} \times 100\% $ |
其中,AUC0→t(test): 测试制剂的药时曲线下面积 (μg·mL-1·h); AUC0→t(standard): 参比制剂的药时曲线下面积 (μg·mL-1·h); Dstandard: 测试制剂的剂量 (mg·kg-1); Dtest: 参比制剂的剂量 (mg·kg-1)。
结果 1 葛根总黄酮生物黏附漂浮微丸在Caco-2细胞模型转运研究 1.1 Caco-2细胞模型的建立 1.1.1 Caco-2细胞TEER值测定Caco-2细胞接种于Transwell板21天后,其TEER值达到了 (1 663 ± 25) Ω,且趋于平稳,说明形成了致密的细胞单层,在本研究中采用生长了21天的Caco-2细胞单层膜用于实验。
1.1.2 Caco-2细胞AKP测定当细胞生长到10天后,AP和BL两侧的AKP数量差值明显 (P < 0.01),至20天时,AKP(AP) = 2.1AKP(BL),参考文献[1, 2],AKP(AP) > 2AKP(BL) 时,表明Caco-2细胞两侧的极化基本形成。
1.1.3 Caco-2细胞通透性考察酚红Papp为 (3.92 ± 0.60)×10-7 cm·s-1,小于1×10-6 cm·s-1,说明酚红未从A面漏入B面,膜的完整性良好; 普萘洛尔Papp为 (20.30 ± 0.61)×10-6 cm·s-1,大于10×10-6 cm·s-1,膜通透性正常。
1.2 葛根总黄酮生物黏附漂浮微丸在Caco-2细胞模型转运
以卡波姆和HPMC为生物黏附材料葛根总黄酮生物黏附微丸经Caco-2细胞模型转运效果最好。选用卡波姆934P与HPMC K15M复合材料制备葛根总黄酮生物黏附微丸经Caco-2细胞模型转运效果最好,结果见图 1。

|
Figure 1 The effect on puerarin’s transport across Caco-2 cell monolayer of bio-adhesive and floating pellets with different bio-adhesive materials. PTF: Pueraria flavonoids. n = 3, ± s. **P < 0.01 vs PTF; ##P < 0.01 vs PTF+HPMC K15M ± s. **P < 0.01 vs PTF; ##P < 0.01 vs PTF+HPMC K15M
|
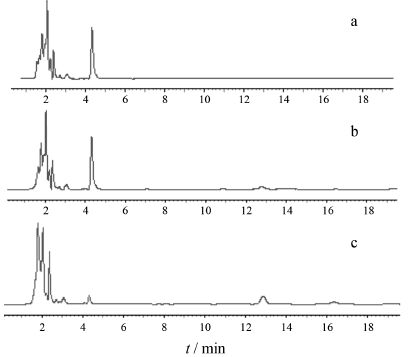
由图 2可见,葛根素对照品溶液的HPLC保留时间为12.763 min,口服给药后血浆样品的HPLC保留时间为12.757 min,空白血浆对葛根素的测定无干扰。说明该方法专属性强,可以满足实验样品的测定要求。
|
Figure 2 Chromatogram of HPLC blank plasma (a),blank plasma spiked with puerarin (b),plasma sample (c) after oral administration of pellets for 45 min |
以葛根素的浓度 (C) 对峰面积 (A) 进行线性回归,得回归方程: A = 13 363 C + 208.35 (r2 = 0.999 7),结果表明在0.057~3.65 μg·mL-1内的线性关系良好。
2.3 精密度及回收率考察低、中和高质量浓度 (0.057、0.456和3.65 μg·mL-1) 的日内精密度分别为3.11、2.77和5.89; 日间精密度分别为7.17、3.83和1.68; 相对回收率分别为 (103.03 ± 8.68) %、(104.47 ± 2.90) % 和(107.24 ± 6.32) %; 绝对回收率分别为 (79.76 ± 5.76) %、(84.83 ± 3.39) % 和 (80.01 ± 8.15) %。结果表明其精密度和回收率均符合要求。
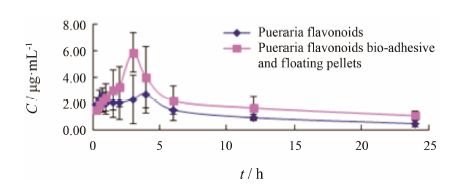
3 葛根总黄酮生物黏附漂浮制剂的药代动力学研究测定葛根总黄酮原料药组和葛根总黄酮生物黏附漂浮微丸组中各大鼠血浆中葛根素浓度的平均药物血浆浓度-时间曲线,见图 3。主要药动学参数见 表 1。由表 1可知,葛根总黄酮胃肠道黏附漂浮微丸组与葛根总黄酮原料药组相比,生物利用度增加了1.79倍 (P < 0.05)。其中tmax延长到1.9倍 (P < 0.05),Cmax提高到1.8倍 (P < 0.01),有一定的研究意义。
|
Figure 3 The puerarin concentration-time curves of pueraria flavonoids bio-adhesive and floating pellets with HPMC-cabomer and pueraria flavonoids in plasma via oral administration of rats. n = 3, ± s ± s
|
|
|
Table 1 The pharmacokinetics parameters of pueraria flavonoids bio-adhesive and floating pellets with HPMC-cabomer and pueraria flavonoids in plasma via oral administration of rats. n = 6, ± s. P < 0.05 vs pueraria flavonoids ± s. P < 0.05 vs pueraria flavonoids
|
对于中药有效部位的药动学研究多以指标性成分药动学参数代表有效部位[19]。本实验所用葛根总黄酮的纯度较高(73.6%),本课题组曾对葛根总黄酮做指纹图谱,发现其在1 h内共出现23个峰[20],主要有效成分葛根素所占比例为17.93% 以上。有文献[21]报道,葛根素作为葛根总黄酮中主要成分和活性成分,它的药代动力学可以反映与之化学结构相似的其他成分的药动学,因而在一定程度上反映葛根总黄酮的体内过程。因此,可以葛根素药动学参数代表葛根总黄酮的药动学过程。
本实验的目的是研究葛根总黄酮微丸的转运效果,故微丸未被破碎而配成混悬液进行实验。由不同黏附材料制备的葛根总黄酮胃肠道黏附漂浮微丸中葛根素的释放动力学结果可知,各组释放无显著性差异,且释放迅速,5 min时即释放60% 以上,其中以卡波姆为黏附材料时释放最快 (90%,另文发表),故推测葛根素从微丸中的释放不会影响葛根素经Caco-2细胞转运。
葛根总黄酮胃肠道生物黏附漂浮制剂体内药动学结果如表 1所示,葛根总黄酮胃肠道生物黏附漂浮制剂与葛根总黄酮原料药相比,tmax延长到1.9倍,Cmax提高到1.8倍,可见葛根总黄酮胃肠道生物黏附漂浮制剂在体内吸收时间延长,峰浓度提高。葛根总黄酮胃肠道生物黏附漂浮制剂与原料药相比,其相对生物利用度为179.4%,可见该制剂达到了提高葛根总黄酮口服生物利用度的目的。
卡波姆是聚烷基蔗糖或聚烷基季戊四醇与丙稀酸交联聚合物的共聚物,为引湿性很强的白色松散粉末[4, 22, 23]。分子中存在大量羧酸基团 (52%~68%),当卡波姆被碱性物质 (三乙醇胺、氢氧化钠等) 中和后,随大分子逐渐溶解,黏度也逐渐上升。羧基离子化后,由于负电荷的相互排斥作用,使分子链弥散伸展,呈极大的膨胀状态,形成凝胶。卡波姆是一种新型的聚酰胺树脂类化合物,具有良好的生物黏附性,是制备黏附制剂的主要材料。但卡波姆干颗粒水化易溶胀形成凝胶,容易从组织脱落,影响其黏附力,而HPMC相对溶胀性较低,本实验将两者混合使用能达到更好的黏附效果[24, 25, 26]。因此选用卡波姆和HPMC作为组合黏附材料,通过延长在胃肠道内的滞留时间,从而促进葛根总黄酮的吸收[18, 19]。
| [1] | Zhou A, Lu T, Wang L, et al. Lymphatic transport of puerarin occurs after oral administration of different lipid-based formulations to unconscious lymph duct-cannulated rats[J]. Pharm Dev Technol, 2014, 19:743-747. |
| [2] | Jiang L, Dai J, Huang Z, et al. Simultaneous determination of gastrodin and puerarin in rat plasma by HPLC and the application to their interaction on pharmacokinetics[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2013, 915-916:8-12. |
| [3] | Tao HQ, Meng Q, Li MH, et al. HP-β-CD-PLGA nanoparticles improve the penetration and bioavailability of puerarin and enhance the therapeutic effects on brain ischemia-reperfusion injury in rats[J]. Naunyn Schmiedebergs Arch Pharmacol, 2013, 386:61-70. |
| [4] | Lin WH, Zhu CY, Chen W, et al. Studies on absorption kinetics of puerariae flavones in rats intestine[J]. China J Chin Mater Med (中国中药杂志), 2008, 33:164-168. |
| [5] | Zhu CY, Wang XL, Shi F. Pharmacokinetics of sustained release total puerariae flavones[J]. World Sci Technol Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2007, 9:58-60. |
| [6] | Shi F, Zhu CY. Drug release of sustained-released tablets of total puerariae flavones[J]. China J Chin Mater Med (中国中药杂志), 2008, 33:1396-1398. |
| [7] | Motz SA, Schaefer UF, Balbach S, et al. Permeability assessment for solid oral drug formulations based on Caco-2 monolayer in combination with a flow through dissolution cell[J]. Eur J Pharm Biopharm, 2007, 66:286-295. |
| [8] | Volpe DA, Faustino PJ, Ciavarella AB, et al. Classification of drug permeability with a Caco-2 cell monolayer assay[J]. Clin Res Regul Aff, 2007, 24:39-47. |
| [9] | Press B, Di Grandi D. Permeability for intestinal absorption:Caco-2 assay and related issues[J]. Curr Drug Metabol, 2008, 9:893-900. |
| [10] | Liao XH, Wang JJ, Gao MY, et al. Effect of major components of Maijunan tablets on the transport of hydrochlorothiazide in Caco-2 cell monolayer model[J]. Acta Pharm Sin (药学学报), 2010, 45:104-108. |
| [11] | Wang JJ, Liao XH, Ye M, et al. In vitro absorption mechanism of strychnine and the transport interaction with liquiritin in Caco-2 cell monolayer model[J]. Acta Pharm Sin (药学学报), 2010, 45:1160-1164. |
| [12] | Liang XL. The Effect and Mechanism Study of Radix Angelicae Dahuricae on the Biopharmaceutical Properties-Membrane Permeability of the Active Components of Radix Puerariae, Radix Scutellariae, Rhizoma Ligustici Chuanxiong (白芷提取物对葛根、黄苓、川芎中活性成分生物药剂学性质——膜透过性的影响及机制研究)[D]. Chengdu:Chengdu University of Traditional Chinese Medicine, 2013:28-51. |
| [13] | Kim SB, Yoon IS, Kim KS, et al. In vitro and in vivo evaluation of the effect of puerarin on hepatic cytochrome p450-mediated drug metabolism[J]. Planta Med, 2014, 80:561-567. |
| [14] | Zhao L, Qian X, Li W, et al. An LC-MS/MS method for the simultaneous determination and pharmacokinetic studies of bergenin, chlorogenic acid and four flavonoids in rat plasma after oral administration of a QingGanSanJie decotion extract[J]. Biomed Chromatogr, 2014, 28:1670-1678. |
| [15] | Liao D, Liu X, Dai W, et al. N-Trimethyl chitosan (TMC)-modified microemulsions for improved oral bioavailability of puerarin:preparation and evaluation[J]. Drug Deliv, 2015, 22:516-521. |
| [16] | Song YQ, Zhang Y. Preparation of gastrointestinal bioadhesive and floating pellets for pueraria flavonoids[J]. J Med Res (医学研究杂志), 2014, 43:25-29. |
| [17] | Zhao LJ, Liao ZG, Liao XL, et al. Transport mechanism of puerarin and the influence of Angelica dahurica extracts on absorption of puerarin in Caco-2 cell model[J]. Chin Pharm J (中国药学杂志), 2012, 47:1638-1642. |
| [18] | Sum MJ, Sheng X, Hu YQ. Establishment and validation of Caco-2 cell lines for intestinal epithelial permeability[J]. Chin Pharm J (中国药学杂志), 2006, 41:1431-1434. |
| [19] | Jia XB, Cai Y, Chen Y, et al. Pharmacokinetics of pueraria flavonoids from Pueraria lobata by anti-oxidant pharmacodynamics effect method[J]. China J Chin Mater Med (中国中药杂志), 2007, 32:2370-2373. |
| [20] | Shi F, Si CT, Chen W, et al. Study on fingerprints of Radix Puerariae and its extract by HPLC[J]. Chin Pharm J (中国药学杂志), 2006, 41:820-823. |
| [21] | Song W, Gao WH. The pharmacological action and clinical use of puerarin[J]. China Foreign Med (中外医疗), 2011, (04):139. |
| [22] | Yu XG. Studies on Therapeutic Basis and Co-pharmacokinetics of Traditional Chinese Medicinal Naodesheng (脑得生药效物质基础及相关指标成分的药代动力学研究)[D]. Shenyang:Shenyang Pharmaceutical University, 2006:38-69. |
| [23] | Tian JZ, Wei FH. In vivo pharmacokinetic study of Pueraria lobata flavone sustained-release capsules[J]. J Shandong Univ TCM (山东中医药大学学报), 2003, 27:454-456. |
| [24] | Guo JP, Li GD, Zhao TY, et al. Linear determination of puerarin and isoflavones in Radix Puerariae in plasma[J]. J Pharm Pract (药学实践杂志), 2003, 21:219-221. |
| [25] | Yan B, Sun H, He XH, et al. Studies on pharmacokinetics of pueraria flavonoid in normal and cerebral ischemia-reperfusion rats[J]. China J Chin Mater Med (中国中药杂志), 2004, 39:48-51. |
| [26] | Guo JP, Cheng GX, Sun QR, et al. Pharmacokinetics of Gegen Huangtong dripping pills in rabbits[J]. China J Chin Mater Med (中国中药杂志), 2004, 39:51-52. |
 2016, Vol. 51
2016, Vol. 51


