2. 中国药科大学药物分析教研室, 江苏 南京 210009
2. Department of Pharmaceutical Analysis, China Pharmaceutical University, Nanjing 210009, China
牛黄解毒片 (NHJDP) 作为家庭常备泻火解毒的中成药,历经数百年的流传应用,发展成为目前中国药典收载的由牛黄、雄黄、石膏、大黄、黄芩、桔梗、冰片、甘草8味药物组成的成方[1],其配方中的雄黄为硫化物类矿物,主含二硫化二砷 (As2S2)。砷是公认的有毒元素,由于剂量的不合理或用药时间过长导致服用牛黄解毒片的不良事件时有发生[2]。因此,对服用含砷中成药后砷在体内的吸收、分布和清除过程进行研究,可为临床用药的安全性提供科学依据。
目前,雄黄及其复方中药制剂的药代动力学研究多以总砷为测定对象[3]。然而,元素的生理活性和毒性依赖于它的化学形态。不同价态、形态的砷,毒性差别很大,无机砷酸盐和亚砷酸盐具有强烈的毒性,但其甲基化产物一甲基砷酸 (MMA) 和二甲基砷酸 (DMA) 的毒性则相对较弱[4, 5]。因此,砷形态分析测定比砷总量测定具有更重要的意义。关于口服给药后体内砷形态的研究,仅Koch等[6]在一名受试者服用牛黄解毒片后针对尿液中的亚砷酸盐 [As(III)]、MMA、DMA和砷甜菜碱 (AsB) 进行了测定研究。牛黄解毒片给药后血液中砷形态分析尚未见报道。
砷形态分析可以通过各种联用技术实现,目前常用于形态分析的分离手段包括HPLC、GC、CE等[7],常用的检测手段有: 电感偶合等离子体质谱 (ICP- MS)[8]、等离子体发射光谱 (ICP-AES)[9]、原子吸收光谱 (AAS)[10]、原子荧光光谱 (AFS)[11]等。氢化物发生−原子荧光 (HG-AFS) 具有与 ICP-MS 相当的灵敏度,而操作更简便,耐用性良好。高效液相色谱-氢化物发生−原子荧光联用技术 (HPLC-HG-AFS) 将高分离效率与高灵敏度相结合,成为砷形态分析的重要工具。本文利用HPLC-HG-AFS同时测定血浆中As(III)、MMA、DMA和砷酸盐 [As(V)] 4种形态的砷化合物,并用于大鼠灌胃雄黄和牛黄解毒片后砷形态的药动学比较研究。
材料与方法 仪器岛津LC-2010C HT高效液相色谱仪 (日本岛津公司),AF-610D氢化物发生-原子荧光检测器 (北京瑞利分析仪器公司)。所有玻璃仪器均用6 mol·L−1硝酸浸泡24 h以上,并用超纯水洗净。
药品与试剂牛黄解毒片 (批号: 2010060,江西汇仁药业有限公司) 经AAS和HPLC-HG-AFS法测定总砷、As(III) 和As(V) 的含量分别为75 ± 4、0.115 ± 0.102和0.070 ± 0.005 mg·g−1; 水飞雄黄 (批号: 17031110,海南千层蘑野生灵芝开发有限公司),经AAS和HPLC-HG-AFS法测定,总砷、As(III) 和As(V) 的含量分别为465 ± 26、1.0 ± 0.4和0.34 ± 0.04 mg·g−1; 各种形态的砷化合物的含量均以砷元素计。三氧化 二砷标准物质 (中国计量科学院,纯度99.96%); 二甲基砷酸钠 (北京华迈科生物技术有限责任公司,纯度99.0%); 砷单元素溶液标准物质 (中国计量科学院,1 000 μg·mL−1); 一甲基砷酸钠 (Laboratories of Dr. Ehrenstorfer GmbH,Augsbrug,Germany,纯度98.5%)。盐酸和硝酸为优级纯; 甲醇为色谱纯 (TEDIA company,Inc.); 水为超纯水 (18.3 MΩ cm,Millipore,USA),其余试剂均为市售分析纯。
牛黄解毒片和水飞雄黄灌胃溶液取牛黄解毒片及水飞雄黄各适量,研成细粉,以0.5% CMC-Na为溶剂制成含总砷浓度分别为3.65和1.45 mg·mL−1的混悬液,给药前充分振摇分散均匀。
贮备液制备As(III): 取三氧化二砷约0.13 g,精密称定,置100 mL量瓶中,加2.5 mol·L−1氢氧化钠溶液1 mL溶解后,用0.3 mol·L−1盐酸溶液稀释至刻度,摇匀,得以砷元素计质量浓度为1.0 mg·mL−1的溶液。经HPLC-HG-AFS测定,砷元素形态为As(III)。As(V): 取三氧化二砷约0.13 g,精密称定,加15 mol·L−1硝酸5 mL,置电热板上缓缓加热1 h (不得 蒸干,温度不超过110 ℃),然后用水定量稀释制成 以砷元素计质量浓度为0.8 mg·mL−1溶液。经HPLC- HG-AFS测定,砷元素形态为As(V)。MMA和DMA: 分别取MMA和DMA适量,精密称定,加水溶解并定量稀释制成以砷元素计质量浓度分别为0.086和1.0 mg·mL−1的溶液。所有贮备液置4 ℃保存,临用 前用超纯水稀释得到标准工作液。1.2 mol·L−1 HCl溶液和0.37 mol·L−1 KBH4 (加KOH使其终浓度为 36 mmol·L−1,以保证碱性环境) 溶液临用前现配。流动相使用前经0.45 μm滤膜过滤。
动物SPF级Wistar大鼠,雌雄各半,体重200 ± 20 g,扬州大学比较医学中心提供,实验动物生产许可证: SYXK (苏) 2007-0001。实验室温度控制在20~25 ℃,湿度在50%~60%。换气次数: 每小时20次以上,12 h照明。实验前禁食过夜 (12 h),自由饮水。
色谱和原子荧光条件HPLC-HG-AFS砷元素形态测定装置和条件参照本课题组前期文献[12]进行。色谱条件: 采用Hamilton PRP-X 100阴离子交换色谱柱 (250 mm × 4.1 mm,10 μm),15 mmol·L−1磷酸二氢钾 (用氢氧化钾溶液调至pH 5.9) 为流动相,流速1.0 mL·min−1,柱温30 ℃,进样体积100 μL。原子荧光条件: 以1.2 mol·L−1 HCl溶液为载流; 0.37 mol·L−1硼氢化钾溶液 (含36 mmol·L−1氢氧化钾) 为还原剂; 载气流量200 mL·min−1; 辅助气流量900 mL·min−1。负高压320 V,主灯电流50 mA,辅助灯电流30 mA。
血浆样品的处理精密量取血浆样品0.2 mL,加入甲醇0.6 mL,涡旋混匀1 min,12 000 r·min−1 离心10 min,取上清液减压挥干,残留物精密加流动相200 μL复溶,10 000 r·min−1离心10 min,取上清 液100 μL进样。
动物实验Wistar大鼠48只,随机分为2组 (每组24只),分别灌胃水飞雄黄混悬液和牛黄解毒片混悬液,每组于给药前及给药后10 min、20 min、0.5、1、1.5、2、2.5、3、4、6、8、12、24、36和48 h各取6只大鼠眼内眦静脉丛取血0.8 mL,置肝素化离心管中,4 000 r·min−1,离心10 min,分离血浆,置−80 ℃保存待测。采用随行标准曲线外标法测定血浆中各形态的砷化合物的浓度,并设置低、中、高浓度的质控样品 (DMA浓度分别为6.2、25和100 ng·mL−1)。
药动学研究采用Drug and Statistics of Windows 2.0 (DAS 2.0) 统计软件处理血药浓度数据,达峰浓度 (Cmax) 和达峰时间 (tmax) 采用实测值。运用SPSS 21.0软件对tmax、t1/2和MRT进行Mann-Whitney U检验,对Cmax/dose、AUC/dose、CLz/F和Vz/F进行t检验。
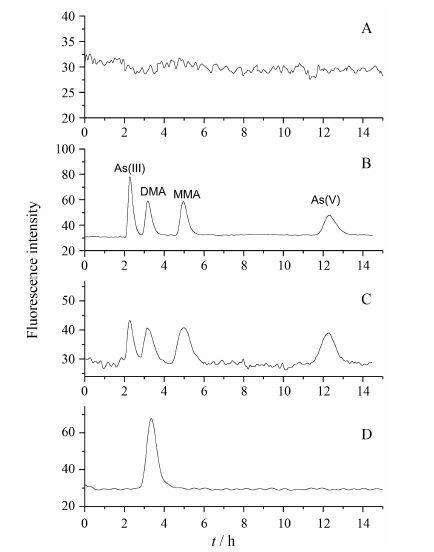
结果 1 方法学验证 1.1 专属性空白血浆,As(III)、MMA、DMA和As(V) 混合液,空白血浆添加定量下限浓度的As(III)、MMA、DMA和As(V) 和大鼠灌胃牛黄解毒片混悬液2 h后,血浆样品的色谱图见图 1。As(III)、DMA、MMA和As(V) 的保留时间分别约为2.3、3.2、5.4和12.3 min。血浆中内源性物质不干扰测定。
|
Figure 1 HPLC-HG-AFS chromatograms. A: Blank plasma; B: Mixed standard solution of As(III) (10 ng·mL−1),dimethylarsinic acid (DMA,10 ng·mL−1),monomethylarsonic acid (MMA,8.6 ng·mL−1) and As(V) (10 ng·mL−1); C: Blank plasma spiked with As(III),DMA,MMA and As(V) at LLOQs; D: Plasma sample collected 2.0 h after oral administration of Niu Huang Jie Du Pian (NHJDP,equivalent to 36.5 mg As·kg−1) |
取As(III)、DMA、MMA和As(V) 标准贮备液,分别用空白血浆定量稀释制成质量浓度分别在2.5~125、3.1~125、2.7~107.5和5.0~125 ng·mL−1的系列标准血浆样品。以各砷形态的峰面积 (Y) 对血药浓度 (C,ng·mL−1) 进行权重回归 (1/C)。上述浓度范围血浆中As(III)、DMA、MMA和As(V) 的线性响应良好,回归方程分别为: Y = 54.1 C + 3.01 (r = 0.993 0),Y = 36.5 C + 3.12 (r = 0.995 7),Y = 54.8 C + 3.83 (r = 0.998 3),Y = 35.0 C + 4.72 (r = 0.995 6) ; 检测限分别为1.2、1.6、1.3和2.5 ng·mL−1,定量下限分别为2.5、3.1、2.7和5.0 ng·mL−1。
1.3 回收率、精密度和准确度考察了As(III) (5.0、25和100 ng·mL−1)、DMA (6.2、25和100 ng·mL−1)、MMA (5.4、22和86 ng·mL−1) 和As(V) (6.2、25和 100 ng·mL−1) 的低、中、高浓度血浆样品的提取回收率 (n = 5)。结果均大于80%。HPLC-HG-AFS测定的批内和批间精密度良好,RSD分别在0.94%~7.95% 和1.84%~10.69%; 准确度良好,RE在 −5.10%~6.15% (表 1)。
|
|
Table 1 Precision,accuracy and recoveries of As (III),DMA,MMA and As (V) in plasma by HPLC-HG-AFSmethod. n = 5, ± s ± s
|
考察了As(III) (5.0和100 ng·mL−1)、DMA (6.2和100 ng·mL−1)、MMA (5.4和86 ng·mL−1) 和As(V) (6.2和100 ng·mL−1) 的血浆样品的稳定性 (n = 3)。结果表明,血浆样品在−80 ℃冷冻保存60天,反复冻融3次,室温放置6 h,处理后的样品室温放置6 h,4 ℃进样器放置12 h的条件下,稳定性均良好。
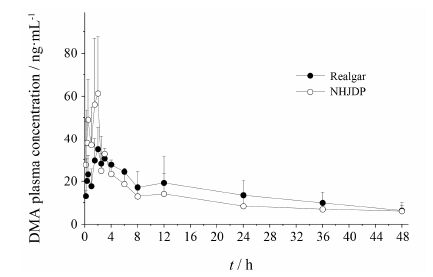
2 砷形态分析自然界中可检出的砷化物化学形态有几十种,其中以无机化学形态三价砷和五价砷的毒性最强,而五价甲基砷 (MMA和DMA) 的毒性相对较弱,大鼠口服As(III)、As(V)、MMA和DMA的LD50分别为: 15、112~175、700和2 600 mg∙kg−1[13, 14]。大多数哺乳动物能通过甲基化过程将无机砷代谢成MMA和DMA[15]。本实验发现,大鼠灌胃雄黄或牛黄解毒片后血浆样品检测到的砷形态为DMA,其他砷形态 [As(III)、MMA和As(V)] 在各时间点均未检测到 (低于LLOQ)。雄黄和牛黄解毒片中均主要含As2S2,表明无机砷进入体内后被迅速甲基化。DMA在达到峰值后消除缓慢,在48 h后降至定量限以下,其血药浓度−时间曲线如图 2,主要药动学参数见表 2。
|
Figure 2 Plasma concentration-time profiles of DMA in Wistar rats after a single oral dose of realgar (equivalent to 14.5 mg As·kg−1) and NHJDP (equivalent to 36.5 mg As·kg−1). n = 6, ± s ± s
|
|
|
Table 2 Pharmacokinetic parameters of DMA in Wistar rats after single oral administration of realgar (equivalent to 14.5 mg As·kg−1) and NHJDP (equivalent to 36.5 mg As·kg−1). n = 6, ± s. P < 0.05,**P < 0.01 vs realgar group ± s. P < 0.05,**P < 0.01 vs realgar group
|
本实验给药剂量系按照中国药典中的用量经过体表面积折算所得。虽然换算而来的剂量低于文献[16]中能测得As(III)、MMA和As(V) 时的给药剂量,有可能测不出As(III)、MMA和As(V) 这些形态,但雄黄或牛黄解毒片中的其他化学成分对砷的存在形式和体内代谢过程是否有影响尚不明确,因此在建立方法时,对As(III)、MMA、DMA和As(V) 均进行了验证, 结果未测得As(III)、MMA和As(V),因此在正式实验中仅对DMA进行了定量测定。
文献[17, 18]报道,大鼠口服雄黄后总砷的Cmax、AUC均与剂量成正比,在较宽的剂量范围内 (临床等效剂量到毒性剂量),总砷呈现线性动力学特征,因此,在某种程度上,可通过总砷给药剂量对牛黄解毒片和雄黄的Cmax和AUC进行校正,本实验对这两项相关的参数所进行的统计学比较均是基于校正后的结果。虽然实验动物的个体差异会导致一些药动学参数的标准偏差较大,但各组的药动学参数Cmax、AUC、CLz/F和Vz/F均符合方差齐性,适合进行比较。与单味雄黄相比,大鼠灌胃牛黄解毒片后,DMA的Cmax/dose显著降低 (P < 0.01),tmax显著延长 (P < 0.05),表明吸收速度降低。清除率和表观分布容积显著增加 (P < 0.01,P < 0.05),表明雄黄经牛黄解毒片复方配伍后,DMA更容易从中央室向周边室分布,且清除加速。鉴于雄黄和牛黄解毒片给药后无机砷被迅速二甲基化,血浆中未测得其他形态的砷化合物,推测DMA的AUC/dose显著降低 (P < 0.05) 的原因可能是由于复方配伍导致进入体循环的砷相对量减小。表明在临床用量下,牛黄解毒片复方中其他药味对砷的药动学的影响可能是降低雄黄毒性作用的途径之一。
文献[19]报道小鼠给药雄黄后,粪便是主要的砷排泄途径。牛黄解毒片处方中的大黄的主要成分蒽醌苷具泻下功效,可能对雄黄中砷的排泄产生影响。桔梗主要成分桔梗皂苷具有表面活性,可影响细胞膜的通透性及其他药物的吸收和分布[20]。冰片在许多中成药中常作为使药影响其他药物成分的药动学行为,可增加As(III) 给药后大鼠血清和脑中砷浓度[21],且对肝脏微粒体药物代谢酶有诱导作用,可能会对砷的代谢转化产生影响。复方中其他成分对肝脏药物代谢酶的作用也可能是影响雄黄药动学的一个重要原因。此外,配伍后血细胞中砷的含量以及可能存在的其他形态 (三甲基砷氧化物、硫代砷化物) 也有可能受到影响,导致血浆中DMA的浓度变化,此部分内容以及复方配伍对砷的排泄的影响正在进一步研究中。
本课题组前期对Beagle犬经口给予雄黄和牛黄解毒片后血浆中砷化学形态进行了研究,测得主要砷形态为DMA,并有少量As(V),未测得As(III) 或MMA,与雄黄单味药给药相比,牛黄解毒片给药后DMA的Cmax和AUC显著增加,tmax无明显变化,t1/2显著减小[12]。而本实验中DMA的Cmax和AUC显著降低。表明牛黄解毒片复方配伍对砷的药动学影响在啮齿类动物大鼠与非啮齿类动物Beagle犬体内药动学存在差异。这可能与药物的吸收、蛋白结合与分布以及代谢酶的种属差异[22]以及三价砷甲基转移酶 (As3mt) 的差异表达和多态性[23]有关。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing:China Medical Science Press, 2015:661-662. |
| [2] | Tong YY, Zhang L, Yang JS, et al. Retrospective study of adverse reactions of Niuhuang Jiedu tablet (pill) and risk control based on literature analysis[J]. China J Chin Mater Med (中国中药杂志), 2010, 35:1342-1345. |
| [3] | Zhang J, Tang YS, Liu QD. Toxicokinetics and tissue distribution study of arsenic in realgar[J]. China J Chin Mater Med (中国中药杂志), 2010, 35:1750-1753. |
| [4] | Zhang W, Yu BY, Kou JP, et al. Studies on the correlation between toxicity and activities of realgar[J]. Chin Nat Med (中国天然药物), 2004, 2:123-125. |
| [5] | Sharma VK, Sohn M. Aquatic arsenic:Toxicity, speciation, transformations, and remediation[J]. Environ Int, 2009, 35:743-759. |
| [6] | Koch I, Sylvester S, Lai VWM, et al. Bioaccessibility and excretion of arsenic in Niu Huang Jie Du Pian pills[J]. Toxicol Appl Pharm, 2007, 22:357-364. |
| [7] | Sadee B, Foulkes ME, Hill SJ. Coupled techniques for arsenic speciation in food and drinking water:a review[J]. J Anal Atom Spectrom, 2015, 30:102-118. |
| [8] | Zhang QL, Wu Q, Xie YY, et al. Tissue distribution of arsenic of Liushen pills and realgar[J]. Acta Pharm Sin (药学学报), 2011, 46:701-706. |
| [9] | Zhang JH, Fan Q, Li HY. Pharmacokinetics of bacteria bioleaching solution of realgar in rat[J]. Acta Pharm Sin (药学学报), 2010, 45:1279-1284. |
| [10] | Bühl V, Álvarez C, Kordas K, et al. Development of a simple method for the determination of toxicologically relevant species of arsenic in urine using HG-AAS[J]. J Environ Pollut Hum Health, 2015, 3:46-51. |
| [11] | Cao Y, Duan J, Guo J, et al. Pharmacokinetic properties of arsenic species after oral administration of Sargassum pallidum extract in rats using an HPLC-HG-AFS method[J]. J Pharm Biomed Anal, 2014, 96:213-219. |
| [12] | Zhang YJ, Qiang SP, Sun J, et al. Liquid chromatographyhydride generation-atomic fluorescence spectrometry determination of arsenic species in dog plasma and its application to a pharmacokinetic study after oral administration of realgar and Niu Huang Jie Du Pian[J]. J Chromatogr B, 2013, 917-918:93-99. |
| [13] | Buchet JP, Lauwerys R, Roels H. Comparison of the urinary excretion of arsenic metabolites after a single oral dose of sodium arsenite, monomethylarsonate, or dimethylarsinate in man[J]. Int Arch Occup Environ Health, 1981, 48:71-79. |
| [14] | Kaise T, Yamauchi H, Horiguchi Y, et al. A comparative study on acute toxicity of methylarsonic acid, dimethylarsinic acid and trimethylarsine oxide in mice[J]. Appl Organomet Chem, 1989, 3:273-277. |
| [15] | Vahter M. Mechanisms of arsenic biotransformation[J]. Toxicology, 2002, 181-182:211-217. |
| [16] | Chen B, Lu X, Shen S, et al. Arsenic speciation in the blood of arsenite-treated F344 rats[J]. Chem Res Toxicol, 2013, 26:952-962. |
| [17] | Bai B, Li XF, Yang K, et al. Pharmacokinetics and toxicokinetics of arsenic after oral administration of realgar in rat[J]. China Pharm (中国药师), 2010, 13:626-629. |
| [18] | Wang XB, Qiu RG, Yang XL, et al. Pharmacokinetics of arsenic in the compound nano·realgar in rats[J]. Chin J New Drug (中国新药杂志), 2007, 16:1758-1761. |
| [19] | Wen L, Lou YQ, Jiang B, et al. Pharmacokinetics of tetraarsenic tetra-sulfide in mice.[J]. China J Chin Mater Med (中国中药杂志), 2006, 41:619-623. |
| [20] | Lin YJ, Zhang JM. Discussion on the research thought and method of the meridian guiding theory of Platycodon root[J]. Pharm Clin Mater Med (中药与临床), 2011, 02:50-52. |
| [21] | Xiao YQ, Zhang LY, Tang HT, et al. Study on the role of borneol in improving permeability of arsenic through blood brain barrier[J]. Chin J Neurosurg Dis Res (中华神经外科疾病研究杂志), 2007, 6:244-246. |
| [22] | Lin JH. Species similarities and differences in pharmacokinetics[J]. Drug Metab Dispos, 1995, 23:1008-1021. |
| [23] | Drobná Z, Walton FS, Harmon AW, et al. Interspecies differences in metabolism of arsenic by cultured primary hepatocytes[J]. Toxicol Appl Pharm, 2010, 245:47-56. |
 2016, Vol. 51
2016, Vol. 51


