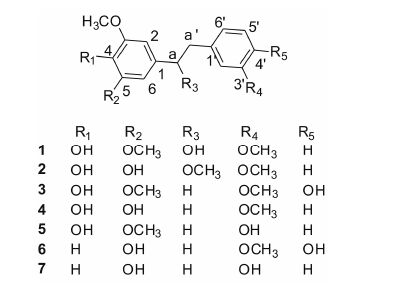
金钗石斛 (Dendrobium nobile Lindl.) 又名吊兰花、扁金钗、小黄草,为兰科石斛属植物,是我国传统名贵中药,贵州道地药材。金钗石斛主要生长于海拔800~1 700米的山坡林中树上或路边岩石上,多为栽培,分布于西南及台湾、湖北、广东、海南、广西。金钗石斛以茎入药,味甘,性微寒,益胃生津,滋阴清热,用于阴伤津亏、口干烦渴、食少干呕、病后虚热、目暗不明[1]。研究表明,石斛属植物具有抗肿瘤、增强机体免疫能力、抗氧化、抗血小板凝集及降血糖等作用[2, 3]。该类植物含有的化学成分复杂多样,主要有生物碱、芳香类和倍半萜类化合物[4, 5]。为了进一步阐明黔产金钗石斛的化学成分,作者对采自遵义赤水的金钗石斛进行了研究,从其乙醇提取物非生物碱部位中分离得到7个联苄类化合物 (图 1),通过波谱技术鉴定了它们的结构,其中化合物1为新化合物,化合物4为首次从该植物中分离得到。
|
Figure 1 Structures of compounds 1−7 |
化合物1为浅黄色胶状物。HR-ESI-MS给出其准分子离子峰 [M+Na]+ 峰m/z: 327.120 0 (计算值C17H20O5Na+: 327.120 3),确定其分子式为C17H20O5,有8个不饱和度。紫外光谱 (UV) 显示在280 nm处有最大吸收。红外光谱 (IR) 显示3 470 cm−1处有羟基伸缩振动。1H NMR (CDCl3,400 MHz) (表 1) 显示低场区有一个间位取代的苯环体系: 7.22 (1H,t,J = 7.9 Hz,H-5')、6.78 (2H,br d,J = 7.9 Hz,H-4',6')、6.73 (1H,br s,H-2') 及一组单峰的芳香氢信号: 6.57 (2H,s,H-2,6)。13C NMR (CDCl3,100 MHz) 谱中显示有 14个碳信号,包括两个甲氧基信号δC 55.4、56.5; 10个芳香碳信号: δ C 102.7、112.2、115.3、122.0、129.7、134.1、135.2、139.8、147.1、159.8; 1个连氧碳信号δC 75.6和一个高场碳信号δC 46.5。通过HMQC谱结合分子式可以推出化合物1中存在局部对称结构,再仔细分析化合物1的NMR数据,发现其和已知化 合物2和5都比较相似,为典型的联苄类化合物[5, 6]。HMBC谱中H-2 (H-6) 和C-α、C-3、C-4有相关,H-α和C-1、C-2 (C-6)、C-1'、C-α' 有相关,可以确定羟基处在C-α位上,而非C-α'位上,对称的甲氧基处在C-3和C-5上,而非C-2和C-6上; OCH3-3' 和C-3' 有相关,H-2'、H-4'、H-5' 和C-3都有相关,可以确证另一个甲氧基处于C-3' 上而非C-4上。综上,化合物1的结构确定为4,α-二羟基-3,5,3'-三甲氧基联苄。
|
|
Table 1 NMR spectral data of compounds 1−7 (CDCl3,400/100 MHz) |
Finnigan LCQDECA型质谱仪 (美国Thermo公司); Agilent DD2400-MR型核磁共振仪,TMS为内标 (美国Agilent公司); Bruker BiOTOF Q型质谱仪 (德国Bruker公司); UV3600紫外可见近红外分光光度计 (日本岛津公司); Varian 1000红外光谱仪,KBr压片 (美国Varian公司); Sepacore中压制备系统 (瑞士BÜCHI公司); LC3000型高效液相色谱仪 (中国北京创新通恒公司); C18 (5 μm,10 mm × 250 mm) 半制备HPLC柱 (日本YMC公司); 20~45 μm ODS填料 (日本Fuji Silysia公司); 薄层色谱硅胶GF 254和柱色谱硅胶 (100~200,300~400目,青岛海洋化工公司); MCI树脂 (日本Mitsubishi公司)。
金钗石斛茎于2014年9月购自遵义赤水,由遵义医学院生药学教研室杨建文教授鉴定为金钗石斛 (Dendrobium nobile Lindl.),样品标本 (No.20141011) 保存在本实验室。
1 提取分离金钗石斛干重50 kg,粉碎后用乙醇回流提取3次,减压浓缩提取液得乙醇提物4.8 kg,将其分散于2.0% 盐酸水溶液中,减压过滤得酸水不溶物。该酸水不溶物用乙醇溶解后拌入100~200目硅胶,挥干溶剂后先用石油醚提取 (3 L) 脱脂后以石油醚−乙酸乙酯1∶1 (3 L) 和乙酸乙酯 (3 L) 分别提取3次,减压 浓缩得石油醚−乙酸乙酯1∶1浸膏350 g。该部位浸膏经中压硅胶柱色谱 (70 mm × 460 mm,石油醚−乙酸乙酯梯度洗脱) 分为8个部分 (Fr.1~8)。第3部分(Fr.3) 经MCI柱 (90% 甲醇水洗脱) 除去色素后经ODS柱色谱 (甲醇−水梯度洗脱) 分为7个部分Fr.3.1~7。Fr.3.1经半制备HPLC分离 (C18,乙腈−水,50∶50,V/V,4 mL·min−1) 得到化合物4 (40 mg,tR = 25.5 min); Fr.3.3经半制备HPLC分离(C18,乙 腈−水,45∶55,V/V,3.5 mL·min−1) 得到化合物6 (74 mg,tR = 24.1 min) 和7 (60 mg,tR = 25.8 min); Fr.3.4经半制备HPLC分离 (C18,乙腈−水,45∶55,V/V,3.5 mL·min−1) 得到化合物5 (14 mg,tR = 20.7 min)。第7部分Fr.7经MCI柱(甲醇−水,9∶1,V/V) 洗 脱除去色素后过中压硅胶柱色谱 (36 mm × 460 mm,二氯甲烷−甲醇100∶1~50∶1,V/V) 分为8个部分Fr.7.1~8; Fr.7.1经ODS柱色谱 (甲醇−水梯度洗脱) 分为6个部分Fr.7.1.1~6; Fr.7.1.6经半制备HPLC分离 (C18,乙腈−水,66∶34,V/V,3 mL·min−1) 得到化合物1 (9 mg,tR = 11.8 min) 和3 (35 mg,tR = 17.1 min); Fr.7.3经ODS柱色谱 (甲醇−水梯度洗脱) 分为4个部分Fr.7.3.1~4; Fr.7.3.4经半制备HPLC分离 (C18,乙腈−水,48∶52,V/V,3.5 mL·min−1) 得到化合物2 (6 mg,tR = 19.9 min)。
2 结构鉴定化合物1 黄色胶状物; C17H20O5; [α]+5 (c 0.06,MeOH); UV (MeOH) λmax (logε) 280 (2.49) nm。IR (KBr) νmax: 3 470,2 930,1 610,1 523,1 431 cm-1 ; 1H NMR (CDCl3,400 MHz) 和13C NMR (CDCl3,100 MHz) 见表 1; ESI-MS m/z 327 [M+Na]+,HR-ESI-MS m/z [M+ Na]+ 327.120 0 (计算值C17H20O5Na+: 327.120 3)。
化合物2 黄色胶状物; ESI-MS m/z 327 [M+ Na]+; 1H NMR (CDCl3,400 MHz) δ: 7.16 (1H,t,J = 7.8 Hz,H-5'),6.73 (1H,d,J = 7.8 Hz,H-6'),6.71 (1H,d,J = 7.8 Hz,H-4'),6.67 (1H,br s,H-2'),6.51 (1H,br s,H-2),6.35 (1H,br s,H-6),4.20 (1H,t,J = 6.5 Hz,H-α),3.82 (3H,s,3-OCH3),3.75 (3H,s,3'-OCH3),3.19 (3H,s,α-OCH3),3.05 (1H,dd,J = 13.7,7.6 Hz,H-α'),2.83 (1H,dd,J = 13.6,5.6 Hz,H-α'); 13C NMR (CDCl3,100 MHz) 见表 1。经波谱数据和文献[7]对照鉴定化合物2为4,5-二羟基-3,3',α-三甲氧基联苄。
化合物3 红色胶状物; 1H NMR (CDCl3,400 MHz) δ: 6.84 (1H,d,J = 8.0 Hz,H-5'),6.68 (1H,dd,J = 8.0,1.8 Hz,H-6'),6.61 (1H,d,J = 1.8 Hz,H-2'),6.36 (2H,s,H-2,6),3.84 (6H,s,3,5-OCH3),3.84 (3H,s,3'-OCH3),2.81 (4H,s,H-α,α'); 13C NMR (CDCl3,100 MHz) 见表 1。经波谱数据和文献[8]对照鉴定化合物3为4,4'-二羟基-3,5,3'-三甲氧基联苄。
化合物4 黄色胶状物; 1H NMR (CDCl3,400 MHz) δ: 7.20 (1H,t,J = 7.6 Hz,H-5'),6.78 (1H,d,J = 7.6 Hz,H-6'),6.75 (1H,d,J = 7.6 Hz,H-4'),6.73 (1H,br s,H-2'),6.47 (1H,br s,H-6),6.25 (1H,br s,H-2),3.82 (3H,s,3-OCH3),3.79 (3H,s,3'-OCH3),2.83 (4H,m,H-α,α'); 13C NMR (CDCl3,100 MHz) 见表 1。经波谱数据和文献[9]对照鉴定化合物4为4,5-二羟基-3,3'-二甲氧基联苄。
化合物5 黄色胶状物; 1H NMR (CDCl3,400 MHz) δ: 7.14 (1H,t,J = 7.6 Hz,H-5'),6.74 (1H,d,J = 7.6 Hz,H-6'),6.67 (1H,d,J = 7.6 Hz,H-4'),6.64 (1H,br s,H-2'),6.35 (2H,s,H-2,6),3.84 (6H,m,3,5-OCH3),2.83 (4H,br s,H-α,α'); 13C NMR (CDCl3,100 MHz) 见表 1。经波谱数据和文献[10]对照鉴定化合物5为4,3'-二羟基-3,5-二甲氧基联苄。
化合物6 红色胶状物; 1H NMR (CDCl3,400 MHz) δ: 6.84 (1H,d,J = 8.0 Hz,H-5'),6.68 (1H,br d,J = 8.0 Hz,H-6'),6.63 (1H,br s,H-2'),6.32 (1H,br s,H-2),6.26 (2H,br s,H-4,6),3.84 (3H,s,3'-OCH3),3.75 (3H,s,3-OCH3),2.80 (4H,br s,H-α,α'); 13C NMR (CDCl3,100 MHz) 见表 1。经波谱数据和文献[11]对照鉴定化合物6为5,4'-二羟基-3,3'-二甲氧基联苄。
化合物7 浅黄色胶状物; ESI-MS m/z 267 [M+Na]+; 1H NMR (CD3OD,400 MHz) δ: 7.05 (1H,t,J = 7.6 Hz,H-5'),6.65 (1H,br d,J = 7.6 Hz,H-6'),6.62 (1H,br s,H-2'),6.59 (1H,br d,J = 7.6 Hz,H-4'),6.24 (1H,br s,H-2),6.22 (1H,br s,H-6),6.18 (1H,br s,H-4),3.69 (3H,s,3-OCH3),2.76 (4H,m,H-α,α'); 13C NMR (CD3OD,100 MHz) 见表 1。经波谱数据和文献[12]对照鉴定化合物7为5,3'-二羟基-3-甲氧基 联苄。
| [1] | Zhang HY, Zhang ZY. Records of Chinese Traditional Medicine Resource (中国中药资源志要)[M]. Beijing:Science Press, 1994:1535. |
| [2] | Xu J, Han QB, Li SL, et al. Chemistry, bioactivity and quality control of Dendrobium, a commonly used tonic herb in traditional Chinese medicine[J]. Phytochem Rev, 2013, 12:341-367. |
| [3] | Zhang XM, Sun ZR, Chen L, et al. Advances of studies on chemical constituents and pharmacological effect of Dendrobium nobile[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2014, 31:895-899. |
| [4] | Yang H, Sung SH, Kim YC. Antifibrotic phenanthrenes of Dendrobium nobile stems[J]. J Nat Prod, 2007, 70:1925-1929. |
| [5] | Zhang X, Xu JK, Wang J, et al. Bioactive bibenzyl derivatives and fluorenones from Dendrobium nobile[J]. J Nat Prod, 2007, 70:24-28. |
| [6] | Hu JM, Chen JJ, Yu H, et al. Five new compounds from Dendrobium longicornu[J]. Planta Med, 2008, 74:535-539. |
| [7] | Zhang X, Gao H, Wang NL, et al. Three new bibenzyl derivatives from Dendrobium nobile[J]. J Asian Nat Prod Res, 2006, 8:113-118. |
| [8] | Li MF, Hirata Y, Xu GJ, et al. Studies on the chemical constituents of Dendrobium loddogesii Rolfe[J]. Acta Pharm Sin (药学学报), 1991, 26:307-310. |
| [9] | Ye QH, Zhao WM. New alloaromadendrane, cadinene and cyclocopacamphane type sesquiterpene derivatives and bibenzyls from Dendrobium nobile[J]. Planta Med, 2002, 68:723-729. |
| [10] | Juneja RK, Sharma SC, Tandon JS. Two substituted bibenzyls and a dihydrophenanthrene from Cymbidium aloifolium[J]. Phytochemistry, 1987, 26:1123-1125. |
| [11] | Guan HJ, Zhang X, Tu FJ, et al. Chemical constituents of Dendrobium officinale[J]. Chin Tradit Herb Drugs (中草药), 2009, 40:1873-1876. |
| [12] | Zhang F, Zhao MB, Li J, et al. Chemical constituents from Pleione bulbocodioides[J]. Chin Tradit Herb Drugs (中草药), 2013, 44:1529-1533. |
 2016, Vol. 51
2016, Vol. 51


