2. 华侨大学生物医学学院, 福建 泉州 362000;
3. 泉州师范学院, 福建 泉州 362000;
4. 海南卫康制药 (潜山) 有限公司, 安徽 潜山 246300
2. School of Biomedical Sciences, Huaqiao University, Quanzhou 362000, China;
3. Quanzhou Normal University, Quanzhou 362000, China;
4. Hainan Weikang Pharmaceutical(Qianshan) Co., Ltd., Qianshan 246300, China
溃疡性结肠炎 (ulcerative colitis,UC) 为炎症性肠炎(inflammatory bowel disease,IBD) 的一种类型,是一种原因不明的非特异性慢性肠道炎症性疾病[1]。目前,其发病机制和病因还未完全阐明,但大多数研究者认为该病由多种因素相互作用所致,患者免疫系统异常反应是造成组织损伤的内在因素,而感染、遗传以及环境因素等在UC发病发展中起着重要作用[2, 3]。UC病变范围广、病程长、病情易反复、治愈率低,甚至有癌变倾向,严重危害人体健康[4, 5] 。近几年的研究显示,UC在我国的发病率和患病率呈现增 长的趋势[6],然而至今却未有根治UC的特异性药物及方法,因此开发高效低毒的抗UC药物,已经成为迫切的需求。人组织激肽释放酶结合蛋白 (kallistatin,Kal) 是一种丝氨酸蛋白酶抑制剂,也是一种肝磷脂结合蛋白[7]。其最早被认为是一种组织激肽释放酶结合蛋白(kallikrein-binding protein,KBP),也被称作丝氨酸 (半胱氨酸) 蛋白酶抑制剂A4 (serpin A4)、PI4、Kal、KIST及KST[8]。近年来许多研究表明,Kal在调节血压、抗血管生成、抗肿瘤及抗炎中起到了重要的作用[8, 9]。
基于目前的研究成果,本研究采用毕赤酵母 表达并纯化得到的重组人Kal,通过腹腔注射给药 的方式治疗由葡聚糖硫酸钠 (dextran sulfate sodium,DSS) 诱导的UC模型小鼠,并监测小鼠体重、结肠长度、髓过氧化物酶 (myeloperoxidase,MPO)、超 氧化物歧化酶 (superoxide dismutase,SOD)、丙二 醛 (malondialdehyde,MDA)、炎症因子白介素-10 (interleukin-10,IL-10) 、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α) 水平变化、组织学分析及 组织学指数 (histological index,HI) 评估等[10, 11],以期评价重组人Kal治疗UC的小鼠实验效果,为将 重组人Kal开发为UC治疗的候选药物提供实验依 据和参考。
材料与方法 实验材料重组人Kal由本实验室通过毕赤酵母摇瓶发酵方法高效发酵生产并纯化得到[12]; 昆明 (KM) 小鼠 (合格证号: 2015000507832) 及饲料均购自吴氏实验动物中心; DSS (MW: 36 000~50 000) 购自MP生物医药公司; SASP购自上海信谊嘉华药业有限公司 (批号: 22120112); 隐血试剂盒、MPO/SOD/ MDA检测试剂盒购自南京建成; IL-10/TNF-α酶联免疫检测试剂盒购自R&D Systems生物技术公司。
急性UC动物模型与分组选用雄性KM小鼠60只,体重 (21 ± 2) g。KM小鼠在恒温 (23 ± 1) ℃,湿度50%~60% 的动物房中饲养,12 h光照,12 h避光,自由进食与饮水。将小鼠随机分成两组: 正常组 (n = 10),给予普通饮食; 急性UC动物模型组 (n = 50),参照Cooper等[13, 14]方法建立急性UC动物模型,KM小鼠连续自由饮用4% (w/v) DSS溶液7天,随后改 为连续自由饮用去离子水4天。再将成模的小鼠随机分成5组: 模型组,腹腔注射10 mL·kg-1·d-1的生理盐水; Kal高、中、低剂量组,分别腹腔注射0.2、1.0和2.0 mg·kg-1·d-1蛋白; SASP阳性对照组,每天腹腔注射SASP混悬液 (10 mg·mL-1) 1 mL。每组10只。以上小鼠连续给药9天,每天观察各组小鼠一般情况及称量体重。
组织标本的采集及处理给药结束第2天,用盐酸氯胺酮 (10 mg·kg-1) 腹腔注射麻醉各组小鼠,分离结肠,沿小鼠肠系膜纵轴剪开,等渗盐水冲洗干净,并立即肉眼观察记录结肠病变程度及范围,测量结肠长度[15]; 在远端结肠或横结肠随机取1块组织,置于中性甲醛固定,石蜡包埋、切片、HE染色,高倍显微镜下观察病理学改变并按照Kim等[16]所列标准进行HI评估; 同时取一部分结肠,称重后按1∶9的质量体积比 (g·mL-1) 加预冷生理盐水,冰浴并充分匀浆,于4 ℃、3 000 r·min-1离心10 min,收集上清,作为待检测样品用于各种参数的检测。
结肠组织中MPO、SOD和MDA的测定取检测样品,参照南京建成MPO、SOD、MDA检测试剂盒说明书的实验步骤进行操作,分别检测各组小鼠结肠组织中MPO、SOD和MDA的含量。
结肠组织TNF-α和IL-10的测定ELISA测定小鼠结肠组织中TNF-α和IL-10的水平,具体检测步骤参照TNF-α和IL-10酶联免疫检测试剂盒说明书进行,单位以pg·mL-1表示。
统计学分析
所有数据采用SPSS19.0统计学软件分析处理,计量数据以 ± s表示,组间比较单因素方差分析,P < 0.01为显著差异,P < 0.05为差异有统计学意义。
± s表示,组间比较单因素方差分析,P < 0.01为显著差异,P < 0.05为差异有统计学意义。
正常组小鼠饮食、精神状态、活动及大便性状均正常,体重不同程度的增加,毛发紧密且有光泽。模型组小鼠在造模第1~2天,各组小鼠体重正常增长,饮水和进食正常; 第3~4天,体重增长减慢或未增长,大便不同程度隐血,不成形或糊状; 第5~7天,小鼠体重持续下降,小鼠倦怠,活动减少,毛发散而凌乱,扎堆懒动,饮水进食进一步减少,大便隐血程度加深。给药后Kal治疗组和SASP治疗组中,大便隐血显著减少,毛发紧密,饮水饮食增加,活动量增多,体重回升,结果见图 1。
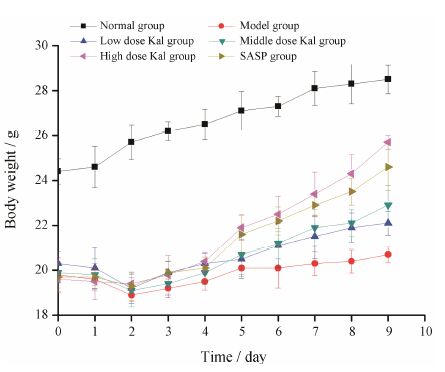
|
Figure 1 Effects of different doses of Kal (0.2,1.0 and 2.0 mg·kg-1) on body weight change in mice with DSS-induced colitis (DSS,4% w/v). Treatments were administered 12 h after DSS instillation and daily thereafter for 9 consecutive days,normal control and model control groups received saline in an equal volume. n = 10, ± s. Kal: Kallistatin; DSS: Dextran sodium suffate; SASP: Salazosulfapyridine ± s. Kal: Kallistatin; DSS: Dextran sodium suffate; SASP: Salazosulfapyridine
|
肉眼观察UC小鼠结肠显示,结肠浅表性溃疡,肠壁增厚,粪便阶段性充满肠道,肠管炎性渗出、出血和伤疤愈合,炎症严重,结肠变短变形严重。各组小鼠结肠长度测量结果如图 2所示,其中模型组小鼠结肠均有不同程度的变短,与正常组相比差异有统计学意义 (P < 0.05)。
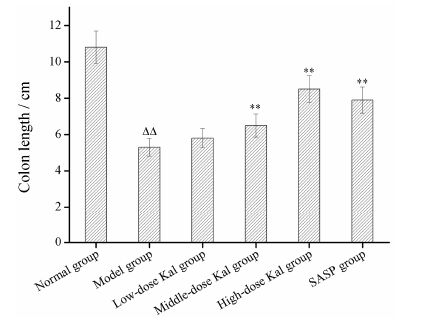
|
Figure 2 ffects of different doses of Kal (0.2,1.0 and 2.0 mg·kg-1) on colon length of mice with DSS-induced colitis. n = 10, ± s. ΔΔP < 0.01 vs normal group; **P < 0.01 vs model group ± s. ΔΔP < 0.01 vs normal group; **P < 0.01 vs model group
|
各组小鼠结肠病理切片HE染色结果如图 3所示。正常组小鼠结肠的结膜完整,腺体排列规则,结构清楚,无炎症细胞浸润,无溃疡产生。模型组小鼠结肠上皮及腺体完全破坏,隐窝杯状细胞消失。Kal低、中、高治疗组和SASP组结肠修复程度接近,黏膜炎性病变明显减轻,结肠组织趋于正常,与模型组相比,黏膜充血水肿减轻,杯状细胞减少,有炎 症细胞浸润病变面积减少。各组小鼠HI评分结果如图 4所示,正常组HI评分显著低于模型组,而Kal治疗组和SASP组HI评分较模型组显著降低 (P < 0.01),其中Kal高剂量组HI评分显著低于SASP组 (P < 0.05)。
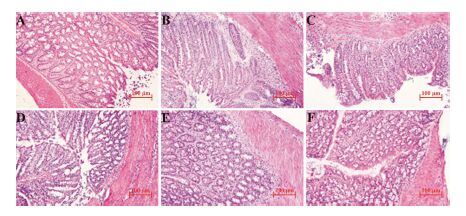
|
Figure 3 Effects of different doses of Kal (0.2,1.0 and 2.0 mg·kg-1) on the colonic histological of mice with DSS-induced colitis. (×100). A: Normal group; B: Model group; C: Low- dose Kal group; D: Middle-dose Kal group; E: High-dose Kal group; F: SASP group |
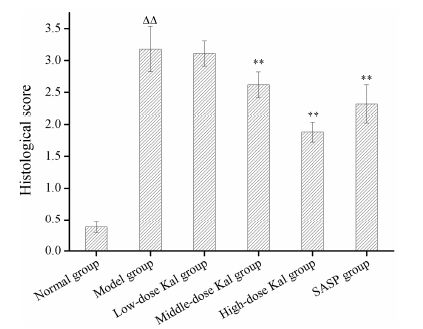
|
Figure 4 Effects of different doses of Kal (0.2,1.0 and 2.0 mg·kg-1) on histological (HI) score of mice with DSS-induced colitis. n = 10, ± s. ΔΔP < 0.01 vs normal group; **P < 0.01 vs model group ± s. ΔΔP < 0.01 vs normal group; **P < 0.01 vs model group
|
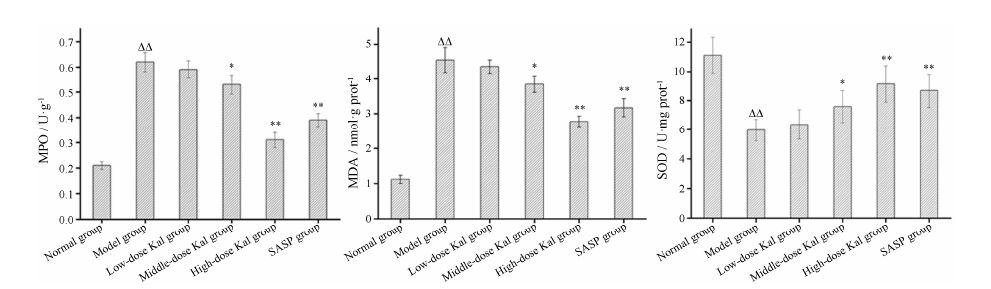
各组小鼠结肠组织中MPO、SOD和MDA水平测定结果如图 5所示。与正常组相比,模型组MPO和MDA水平显著高于正常组 (P < 0.01),而模型组SOD水平显著低于正常组 (P < 0.01); 高剂量Kal治疗组MPO和MDA水平显著低于模型组 (P < 0.01),与SASP治疗组相比差异无统计学意义,趋近于正常组; 中剂量Kal治疗组MPO和MDA水平略低于 模型组 (P < 0.05),与SASP治疗组比较差异无统计学意义; 低剂量Kal治疗组MPO和MDA水平与 模型组比较差异无统计学意义; 高剂量Kal治疗组SOD水平显著高于模型组 (P < 0.01),略高于SASP治疗组,趋近于正常组; 中剂量Kal治疗组SOD水平略高于模型组 (P < 0.05),与SASP治疗组比较差异无统计学意义; 低剂量Kal治疗组SOD水平与模型组相比差异不明显。
|
Figure 5 Effects of different doses of Kal (0.2,1.0 and 2.0 mg·kg-1) on level of myeloperoxidase (MPO),malondialdehyde (MDA) and superoxide dismutase (SOD) in colon tissue of mice with DSS-induced colitis. n = 10, ± s. ΔΔP < 0.01 vs normal group; P < 0.05,**P < 0.01 vs model group ± s. ΔΔP < 0.01 vs normal group; P < 0.05,**P < 0.01 vs model group
|
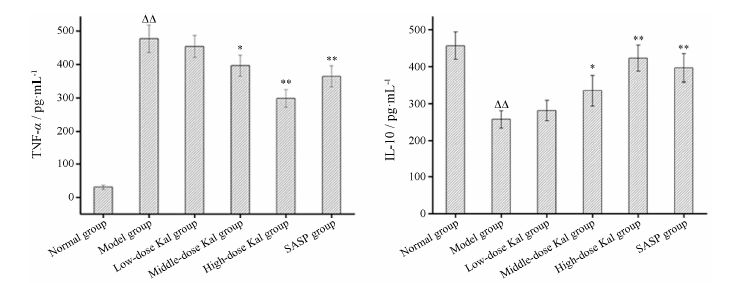
各组小鼠结肠组织中TNF-α和IL-10水平测定结果如图 6所示。模型组TNF-α水平显著高于正常组 (P < 0.01),Kal治疗组和SASP组TNF-α水平不同程度低于模型组,Kal治疗组呈剂量依赖性,从低到高剂量组TNF-α水平逐渐趋近于正常组,且高剂量组TNF-α水平低于SASP组; 模型组IL-10水平则显著低于正常组 (P < 0.01),Kal治疗组和SASP组IL-10水平不同程度高于模型组,趋近于正常组,Kal治疗组也呈剂量依赖性,高剂量组IL-10水平显著高于模型组,与SASP组相比差异无统计学意义。
|
Figure 6 Effects of different doses of Kal (0.2,1.0 and 2.0 mg·kg-1) on the level of TNF-α and IL-10 in colon tissue of mice with DSS-induced colitis. n = 10, ± s. ΔΔP < 0.01 vs normal group; P < 0.05,**P < 0.01 vs model group ± s. ΔΔP < 0.01 vs normal group; P < 0.05,**P < 0.01 vs model group
|
UC病因复杂、病程缓慢,常反复发作并逐渐加重,病程可分为持续性、呈慢性或发作期交替的慢性过程和偶尔呈急性暴发。病程期表现为腹泻及腹部 隐痛,黏液血便,可伴有发热、乏力等; 严重者有高热、大量血便、进行性消瘦[13, 14]。其病变主要位于结肠黏膜下层,以溃疡为主,呈连续性弥漫性分布,多累及直肠和远端结肠,也可遍布整个结肠。迄今,UC治疗方法一般有药物治疗、营养治疗、心理治疗以及手术治疗,其中以药物治疗为主,氨基水杨酸、肾上腺皮质激素类、免疫抑制剂、益生菌、生物制剂以及中药等[4, 17],但这些药物治疗尚仅能缓解症状,无法根除,且不良反应较多、易产生耐药,寻找新型的可有效治疗结肠炎的药物是解决这一关键医学问题的重要方式。
本研究采用4% DSS制造小鼠UC模型,小鼠饮用4% DSS第2天后,体重开始下降,大便性状改变,有潜血甚至血便,体质量下降等均为DSS结肠炎模型肠道病状及全身性表现之一。小鼠一般观察发现结肠充血明显,结肠显著缩短; 显微镜下可见黏膜损害累及远端结肠,病变主要累及黏膜和面膜下层,血管增生、扩张,黏膜出现多发性糜烂或浅表性溃疡; 切片观察有炎症细胞浸润,结肠隐窝变形,隐窝脓肿形成。
Kal是一种单链负性急性期内源性蛋白,成熟的Kal有401个氨基酸组成[18],其中包括两个功能域,即激肽释放酶 (kallilrein) 结合域和肝素结合域。Kal具有多种生物学功能,如抗肿瘤作用、抗氧化、抗炎和抗血管生成等[8, 9, 19, 20]。在抗炎方面,Kal有着重要的作用,通过其肝素结构域的作用阻止TNF-α介导的NF-κB激活及促炎症基因的表达来抑制内皮细胞炎症[21, 22]。而研究表明,细胞因子在肠道免疫反应的调节中起到重要作用,促炎因子与抗炎因子失衡被认为UC的发病机制之一[23],而TNF-α是UC发病发展机制中的重要促炎因子,它可以通过激活NF-κB通路上调IL-6和IL-8等促炎性细胞因子的表达,使炎症级联反应进一步放大,导致炎症迁延。IL-10是一种抗炎和免疫抑制性的细胞因子,在稳定正常肠道黏膜免疫调节起到重要作用,它可以抑制促炎细胞因子TNF-α、IL-1β、IL-6以及IL-8的释放,从而终止和抑制炎症反应[23, 24]。一般情况下,促炎细胞因子和抑炎性细胞因子二者之间始终平衡,这对维持肠内环境稳定起到关键作用,一旦打破促炎细胞和抗炎细胞因子之间的平衡将导致UC发病。本研究发现阳性药SASP组和Kal各剂量组小鼠外观体征均 有所改善,病变明显减轻,说明Kal对UC模型小鼠具有显著的治疗作用。通过细胞因子TNF-α和IL-10的测定结果显示,重组人Kal均可显著下调炎症结 肠组织中致炎因子TNF-α水平,并可上调抗炎因子IL-10水平,结果表明,重组Kal可能通过上调抗炎因子和下调致炎因子促进UC小鼠模型免疫功能逐渐恢复正常,控制炎症反应而达到治疗作用,从而提高机体的免疫能力,降低结肠黏膜的损伤。
研究表明氧自由基也在UC发病过程中起着十分重要作用,它可以直接破坏结肠黏膜细胞的结构和功能,同时又引起脂质过氧化反应而产生多种炎症介质,如白三烯、趋化因子和前列腺样物质等,参与和加重UC的炎症反应。而SOD是体内清除自由基的首要物质,它阻断因氧自由基对细胞造成的损害并及时修复受损细胞,减弱炎症侵入性损伤,进而减轻UC临床症状[25]。同时多项研究证明,Kal可以通过多条细胞通路提高NO合成酶和NO的水平,发挥抗氧化应激的作用,从而避免氧化应激引起的组织损伤以及炎症反应[26, 27, 28]。本研究对MPO、MDA和SOD等炎性因子及氧化性指标的检测结果显示,高剂量重组人Kal明显下调炎症结肠组织中MPO及MDA水平,可促进机体对炎性细胞的吸收,减少炎性细胞人浸润和缓解组织损伤; 同时提高了体内SOD活性,可以有效抑制机体脂质过氧化反应,增强SOD活性和较强的抗氧化 和抗炎作用。这说明Kal可以通过抑制脂质过氧化反应降低结肠黏膜损伤达到治疗UC的作用。
综上所述,本研究通过4% DSS诱导出与人类 UC疾病相似的病理模型,使用重组人Kal对比SASP阳性治疗结果表明,重组人Kal具有一定抗氧化能 力,可以上调抗炎细胞因子IL-10,同时下调炎性细胞因子TNF-α,从而使致炎因子和抗炎因子在损伤组织中得以平衡,进而减少组织的损失程度,达到有效治疗UC疾病作用。因此,本研究为重组人Kal开发成治疗UC疾病的蛋白药物提供了重要的理论依据和参考。
| [1] | Abraham C, Cho JH. Inflammatory bowel disease[J]. N Engl J Med, 2009, 361:2066-2078. |
| [2] | Pineton de Chambrun G, Body-Malapel M, Frey-Wagner I, et al. Aluminum enhances inflammation and decreases mucosal healing in experimental colitis in mice[J]. Mucosal Immunol, 2014, 7:589-601. |
| [3] | Kaistha A, Levine J. Inflammatory bowel disease:the classic gastrointestinal autoimmune disease[J]. Curr Probl Pediatr Adolesc Health Care, 2014, 44:328-334. |
| [4] | Feagan BG, Rutgeerts P, Sands BE, et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis[J]. N Engl J Med, 2013, 369:699-710. |
| [5] | Sandborn WJ, Feagan BG, Marano C, et al. Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis[J]. Gastroenterology, 2014, 146:85-95. |
| [6] | Yang H, Li Y, Wu W, et al. The incidence of inflammatory bowel disease in northern China:a prospective populationbased study[J]. PLoS One, 2014, 9:e101296. |
| [7] | Zhou GX, Chao L, Chao J, et al. Kallistatin:a novel human tissue kallikrein inhibitor. Purification, characterization, and reactive center sequence[J]. J Biol Chem, 1992, 267:25873-25880. |
| [8] | Duan XW, Chen SY, Wang F, et al. Adeno-associated vector mediated intracellular biological activity of human kallistatin[J]. Acta Pharm Sin (药学学报), 2014, 49:993-999. |
| [9] | Wang NQ, Zou J, Diao Y, et al. Plasmid-mediated expression of kallistatin and its biological activity in lung cancer related cells[J]. Acta Pharm Sin (药学学报), 2013, 48:359-365. |
| [10] | Ouyang W, Rutz S, Crellin NK, et al. Regulation and functions of the IL-10 family of cytokines in inflammation and disease[J]. Ann Rev Immunol, 2011, 29:71-109. |
| [11] | Zhao DS, Jin M, Zhang L, et al. Effect of Shenbaiheji on disease activity index and SOD, MDA of experimental ulcerative colitis mice[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2012, 19:38-39. |
| [12] | Zhang Q, Xing YM, Liu J, et al. Expression of recombinant human kallistatin in Pichia pastoris by high density cell culture, and its purification and characterization[J]. Acta Pharm Sin (药学学报), 2013, 48:1107-1112. |
| [13] | Cooper HS, Murthy SN, Shah RS, et al. Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J]. Lab Invest, 1993, 69:238-249. |
| [14] | Raup-Konsavage WM, Cooper TK, Yochum GS. A role for MYC in lithium-stimulated repair of the colonic epithelium after DSS-induced damage in mice[J]. Dig Dis Sci, 2015, 61:410-422. |
| [15] | Wagner S, Lynch NJ, Walter W, et al. Differential expression of the murine mannose-binding lectins A and C in lymphoid and nonlymphoid organs and tissues[J]. J Immunol, 2003, 170:1462-1465. |
| [16] | Kim YS, Son M, Ko JI, et al. Effect of DA-6034, a derivative of flavonoid, on experimental animal models of inflammatory bowel disease[J]. Arch Pharm Res, 1999, 22:354-360. |
| [17] | Wang YW, Zhang HH, Wang YL, et al. Effect of huangqin tang on the regulatory NF-κB p65 signal pathway in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报), 2015, 50:21-27. |
| [18] | Chai KX, Chen LM, Chao J, et al. Kallistatin:a novel human serine proteinase inhibitor. Molecular cloning, tissue distribution, and expression in Escherichia coli[J]. J Biol Chem, 1993, 268:24498-24505. |
| [19] | Huang XP, Wang X, Lv YH, et al. Protection effect of kallistatin on carbon tetrachloride-induced liver fibrosis in rats via antioxidative stress[J]. PLoS One, 2014, 9:e88498. |
| [20] | Wu XX, Zhang CZ, Wang X, et al. Targeting angiogenesis and vascular remodeling as a novel therapeutic approach to liver fibrosis[J]. Acta Pharm Sin (药学学报), 2015, 50:535-540. |
| [21] | Yin H, Gao L, Shen B, et al. Kallistatin inhibits vascular inflammation by antagonizing tumor necrosis factor-α-induced nuclear factor κB activation[J]. Hypertension, 2010, 56:260-267. |
| [22] | Huang KF, Huang XP, Xiao GQ, et al. Kallistatin, a novel anti-angiogenesis agent, inhibits angiogenesis via inhibition of the NF-κB signaling pathway[J]. Biomed Pharmacother, 2014, 68:455-461. |
| [23] | Guerra GCB, Araújo AA, Lira GA, et al. Telmisartan decreases inflammation by modulating TNF-α, IL-10, and RANK/RANKL in a rat model of ulcerative colitis[J]. Pharmacol Rep, 2015, 67:520-526. |
| [24] | Wang J, Kuang YX, Zhang HY, et al. Therapeutic effect of heat-clearing and dampness-removing therapy combined with bifico for ulcerative coltis and its influence on tumor necrosis factor alpha and interleuk-10 in rats[J]. J Guangzhou Univ Trandit Chin Med (广州中医药大学学报), 2014, 31:756-761, 845. |
| [25] | Li B, Gu S. The effect on SOD and MDA in colonic mucosal tissue of ulcerative colitis rat treated by Wumei Pill and its disassembled prescriptions[J]. J Liaoning Univ TCM (辽宁中医药大学学报), 2015,17:48-50. |
| [26] | Shen B, Hagiwara M, Yao YY, et al. Salutary effect of kallistatin in salt-induced renal injury, inflammation, and fibrosis via antioxidative stress[J]. Hypertension, 2008, 51:1358-1365. |
| [27] | Zhou SQ, Sun YY, Zhuang YG, et al. Effects of kallistatin on oxidative stress and inflammation on renal ischemiareperfusion injury in mice[J]. Curr Vasc Pharmacol, 2015, 13:265-273. |
 2016, Vol. 51
2016, Vol. 51


