2. 军事医学科学院放射与辐射医学研究所, 北京 100850
2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China
适配子是通过指数富集的配体系统进化技术 (systematic evolution of ligands by exponential enrichment,SELEX) 从单链寡核苷酸文库中筛选获得的,能与靶标高特异性、高亲和力结合的配体。此文库一般采用寡核苷酸链两端的固定序列及中间为20~60 bp的随机序列组成。由于中间序列核苷酸存在大量不同的排列组合,可形成不同的空间构象,从而模拟了自然界存在的几乎所有可能与靶物质互相作用的空间结构。自1990年Tuerk[1]和Ellington[2]等首次发表该研究以来,适配子逐渐成为靶向治疗药物的研发热点之一。其独特优势[3]主要表现在: ① 靶分子范围广泛,靶点可以从金属离子等小分子到蛋白质大分子乃至整个细胞; ② 高特异性与亲和性,适配子能够识别出靶分子结构上如甲基与羟基这样的细微区别,且与靶分子结合后的解离常数处于纳摩尔和皮摩尔水平; ③ 体外筛选,与靶分子的结合条件可调控,易人工合成,可以通过SELEX技术的自动化进行大批量低成本生产,且批间差异较小,同时也能针对毒素及免疫原性较弱的物质进行筛选; ④ 稳定性好,易修饰,可以在适配子寡核苷酸的精确位点进行修饰,避免其被体内核酸酶降解; ⑤ 分子小,空间位阻小,可以单独成药,也可以连接各种标记分子进行临床诊断; 或者与一个甚至多个靶分子高效绑定,实现细胞内药物运送与治疗。作为低免疫原性[4]的“抗体类似物”,适配子类靶向治疗药物应用于多种癌症、黄斑变性、血管性血友病和糖尿病等疾病的治疗,有些药物已经通过FDA认证批准上市,在生物医药领域显示出巨大的应用前景。
1 核酸适配子药物的研发现状适配子类药物通过靶向作用在疾病的发生发展过程中产生的“明星分子”,干扰信号通路以达到治疗效果[5]。至目前已经有越来越多的适配子在生物医学方面受到青睐。
第1个适配子药物Macugen (哌加他尼那),为特异性靶向血管内皮生长因子165 (vascular endothelial growth factor,VEGF165) 的27个核糖核苷酸的RNA适配体,通过眼部注射给药,治疗年龄相关性黄斑变性 (age-related macular degeneration,AMD),2004年经美国FDA获批上市[6]。该适配体通过2'-氟嘧啶和2'-氧-甲基嘌呤修饰转录,并加3'-3' 连接的脱氧胸苷终端帽来增加其稳定性,同时在适配子5' 端连接一个40 kDa的聚乙二醇 (polyethylene glycol,PEG) 分子 (图 1a),延长其半衰期。
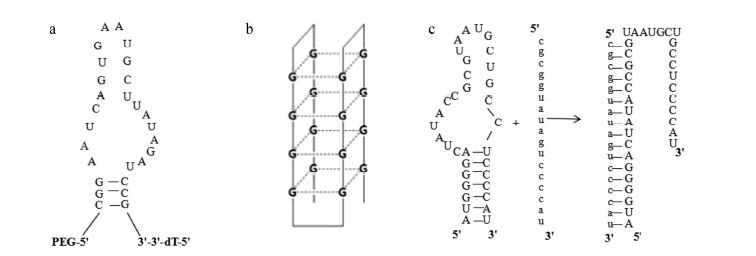
|
Figure 1 The structures of aptamer. a: Pegaptanib; b: AS1411; c: REG-1 |
AS1411 (亦称AGRO100),是针对癌症最早进入临床试验的富含鸟嘌呤的适配子,也是特异性针对核仁最早的药物[7],可自身形成G-四链体结构 (图 1b),并因此具有很多特殊的生物活性。该适配子通过静脉注射给药,可以与肿瘤细胞表面过量表达的核仁膜蛋白外部域结合,抑制核仁活性,在细胞存活、生长、增殖、核运输和转录方面起着重要作用。
REG-1是第1个被称为可调控的核酸适配子,由针对凝血酶因子Ⅸa的RNA适配子 (RB006) 和与RB006相互补的单链RNA寡聚核苷酸 (RB007) 构成 (图 1c),通过两者相互竞争使得REG-1结构发生改变,从而抑制凝血酶因子Ⅸa,起到抗凝的效果[8]。通过静脉注射给药,在急性冠状动脉综合征患者中显示出很好的医疗价值。
另外,Lee等[9]筛选并鉴定出一个特异结合甲胎蛋白 (alpha fetoprotein,AFP) 的RNA适配子,此适配子可特异和有效地抑制由AFP介导的肝癌细胞的增殖。Roth等[10]报道了一个可阻滞小鼠或人类的白细胞介素4受体ɑ (IL-4ɑ) 的RNA适配子,该适配子靶向作用于髓源性抑制细胞 (myeloid-derived suppressor cells,MDSC) 和肿瘤相关巨噬细胞 (tumor- associated macrophages,TAM) ,并有效抑制肿瘤模型小鼠肿瘤细胞的生长。
目前,随着科研的不断深入,更多的适配子药物进入临床试验阶段,适应症包括新生血管性年龄相关性黄斑变性、癌症、急性冠状动脉综合征、血友病和糖尿病等,表 1是目前已进入临床试验阶段的适配子药物[11]。
|
|
Table 1 The clinical trials of aptamer drugs |
除了作为药物单独应用外,适配子更多可作为药物递送系统中的靶向载体,在机体系统给药后发挥靶向治疗作用。在肿瘤治疗过程中,由于化疗药物对癌细胞的低选择性及对正常细胞的严重不良反应,适配子高效识别靶点的能力为化疗药物的递送提供了很好的平台,是将药物传送到指定癌细胞和组织的主要策略。类似于抗体偶联药物 (antibody drug conjugates,ADC),适配子偶联药物 (aptamer drug conjugates,ApDCs) 通常由3部分组成: 配体 (适配子)、连接体和药物。适配子作为识别患病位点或调节生物标志物的靶向配基,能特异性刺激或抑制相应靶点,是非常理想的靶向药物输送剂。
2.1 适配子−药物直接偶联系统 2.1.1 适配子偶联化疗药物适配子与化疗药物多采用共价和非共价的方法进行桥接。通过偶联靶向 性适配子将多柔比星 (doxorubicin,DOX) 特异运送到肿瘤细胞中,大大减少DOX化疗的不良反应,提高抗癌效果[12]。在早期研究中,Huang等[13]通过腙键将DNA适配体sgc8和DOX偶联 (图 2a),靶向于许多类型癌症中过表达的蛋白酪氨酸激酶7 (protein tyrosine kinase 7,PTK7)。在酸性环境下,如在核内体或溶酶体中,连接键断裂使药物释放。体外研究人淋巴细胞系白血病细胞CEM,与缺乏靶向作用的DOX相比,该ApDC成功选择性针对CEM细胞,并在核内体内释放DOX,有效抑制癌细胞的增殖。

|
Figure 2 (a) Aptamer sgc8 was covalently conjugated hydrazone,an acid-labile linker,with doxorubicin (DOX) for targeted delivery and intracellular release of DOX (structures shown in inlet). (b) Aptamer drug conjugates (ApDCs) were constructed by automated synthesis using a phosphoramidite that carried a 5-FU prodrug moiety via a photocleavable linker (structures shown in inlet). (c) In a simple reaction,multiple copies of drugs (e.g,DOX) were specifically conjugated on deoxyguanosine of DNA,making it programmable to design DNA and drugs for drug-DNA adduct-based drug delivery. (d) Schematic of aptamer-siRNA as ApDC for targeted delivery of siRNA. (e) Schematic of aptamer-shRNA as ApDC for targeted delivery of shRNA |
目前适配子−化疗药物的研发策略集中在解决单个适配子结合药物分子数低的问题,为增加药物承载能力以降低药物成本,Wang等[14]研发出可以实现自动化和模块化合成ApDCs的方法,该设计中加入亚磷酰胺结构来结合氟尿嘧啶 (5-fluorouracil,5-FU),并在适配子sgc8连接药物及亚磷酰胺部分插入光裂解 (photo-cleavage,PC) 的连接体,可以在时间空间上更好地控制药物释放 (图 2b)。亚磷酰胺在此作为一个模块的“基石”,可通过自动固相DNA合成技术与适配子结合。该适配子药物sgc8-(5-FU)5中适配子sgc8与5-FU的结合比例为1∶5,可以选择性地将化疗药物递送到PTK7过表达的HCT116细胞。在光照射下,将5-FU从适配子骨架上释放出来,起到放射增敏的效果,从而抑制癌细胞的增殖。
在最新的研究中,Zhu等[15]利用了生物相容性的方法,构建出多个药物与一个适配体结合的ApDCs,称为药物-DNA加合物 (drug-DNA adducts,DDAs) (图 2c),利用甲醛作为交联剂,在一侧形成DOX的亚甲基3-NH2结构,而在另一侧脱氧鸟嘌呤上形成2-NH2结构。从而实现适配体与多药物的稳定性结合,且在一定的生理温度下可以调控,包括蒽环类药物 (如多柔比星,柔红霉素) 和顺铂在内的各种抗癌药物通过整合到细胞内基因组DNA干扰细胞分裂,进而诱导细胞凋亡。在皮下植入CEM细胞建立的异种移植小鼠模型中,该药物DDAs在减少不良反应的同时,显著抑制肿瘤的生长。
2.1.2 适配子偶联蛋白类药物适配子还可以连接蛋白多肽类药物。蛋白质类药物在生物制剂中占有相当大的比例,但其本身很少具有靶向特异性,与适配子结合将明显增加它的有效性。为解决相关治疗性的蛋白酶难以进入细胞的难题,Chen等[16]制备出结合有DNA适配子GS24的ApDCs,GS24与α-L-艾杜糖苷、溶酶体酶相偶联,靶向小鼠转铁蛋白受体的细胞外结构域 (transferrin,TfR)。该药物通过内吞作用进入成纤维细胞溶酶体,进而修正这些细胞内糖胺聚糖降解的缺陷。在近期研究中,Wengerter等[17]研发 了适配子−抗原缀合物,靶向性递送卵清蛋白肽SIINFEKL,针对CD8+ 树突状细胞。
2.1.3 适配子偶联核酸类药物小干扰RNA (small interfering RNA,siRNA) 药物通过特异性抑制致病基因的表达,已经成为核酸药物研究热点,但siRNA的靶向成药性是其应用到临床治疗上的主要瓶颈[18, 19]。Neff等[20]将一个2'-氟修饰的抗HIV-1的gp120适配子共价融合到27-mer的Dicer酶底物的siRNA上 (图 2d)。当HIV-1感染的CEM-T细胞、人外周血单核细胞 (human peripheral blood mononuclear cells,PBMCs) 与Apt-siRNA偶联物孵育时,该gp120适配子通过受体内化,与缺乏适配子的siRNA药物和适配子突变的结合体药物对照相比,能够表现出高效、特异性基因沉默。Rag-Hu小鼠体内实验同样证实适配子偶联siRNA药物的可行性和高效性。与适配子-siRNA基因治疗类似,Ni等[21]针对前列腺特异性膜抗原 (prostate-specific membrane antigen,PSMA) 的适配子A10-3与短发夹RNA (short hairpin,shRNA) 缀合 (图 2e),通过A10-3将DNA活化的蛋白激酶 (DNA protein kinase,DNAPK) shRNA选择性递送到前列腺癌细胞内,可特异性抑制放疗增敏靶点 DNAPK的表达,通过有效增强PSMA阳性肿瘤的电离辐射敏感性来提高疗效。当然,对于适配子−核酸类药物递送系统,更多地研究选择利用纳米粒包裹核酸药物再与适配子结合以实现对核酸药物的靶向递送[22]。
2.2 适配子−纳米粒递送系统适配子−纳米粒递送系统是目前最常采用的递送系统形式,可适用于包裹化疗药物、核酸和蛋白等。纳米粒具有可控释、易修饰、载药性及可工业化生产等特点[23],目前用于药物输送较为广泛的纳米材料包括: 二氧化硅纳米粒[24, 25]、脂质体[26, 27]、聚合物胶束[28, 29]、金纳米粒[30, 31]、量子点[32, 33]、超顺磁性氧化铁纳米颗粒[34]、碳纳米管[35]和石墨烯相关的材料[36]。适配子通常作为靶向作用修饰在纳米粒表面,其载药模式主要包括以下几种策略。
对于像二氧化硅纳米粒、脂质体和聚合物胶束 的纳米粒而言,药物通过静电吸附或共价结合掺入纳米粒内部。Zhu等[24]通过在介孔二氧化硅纳米粒 (mesoporous silica nanoparticles,MSN) 表面修饰特异靶向PTK7的DNA适配子sgc8,同时包裹DOX和荧光素FITC,组成MSN-FITC-PEM-Apt结合物。当遇到还原环境 (如细胞内环境) 时,聚电解质多层 (polymer electrolyte membranes,PEM) 的结构发生变化,二硫键断裂,包裹药物随之释放。该递送系统在利用二氧化硅纳米粒可以高负载包裹药物的同时,控制药物的胞内释放,具有很好的应用前景。Yang等[25]巧妙地将纳米金棒DNA“门控”式应用于MSN载体,在激光照射下更好的控制药物释放。将四链体结构的适配子AS1411 作为靶向配基,MSN通过EDC/NHS共价连接12个序列的DNA-1,DNA-1的3' 端与适配子互补连接,所形成的双链DNA结构可以覆盖在MSN表面,孔隙里还可以包裹药物分子,如DOX等。当该载体受到金纳米棒吸收峰处的激光束照射后,光能转化为热能,双链DNA结构被破坏,随后药物得以释放 (图 3a)。
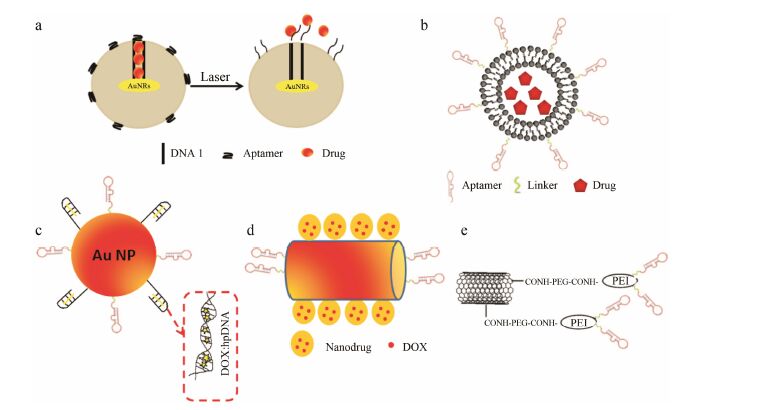
|
Figure 3 (a) Schematic of AuNRs and DNA-gated MSNs nanocomplexes released drug by laser,photothermal heat converted from photoenergy dehybridized the duplex DNA structure,subsequently releasing the drugs from the pore. (b) Schematic of aptamer- functionalized liposome gold nanoparticles (NPs) for delivering DOX. The SRZ1 aptamer was covalently conjugated to the surface of the liposome. (c) Schematic of DOX: apt/hp-Au NP nanocomplexes released DOX by laser. (d) Schematic of NP-DOX/NR (nanorod)- aptamer nanocomplexes,NIR irradiation triggers the release of nanodrugs (DOX-loaded NPs) from the nanotruck (functionalized NR) via the photothermal effect of the NR. (e) Schematic of the functionalization of SWCNT |
脂质体因其双分子层结构可同时结合疏水性和亲水性药物,作为药物递送系统被广泛应用于疾病的治疗。Ara等[26]将靶向热休克蛋白70 (heat shock protein 70,HSP70) 的适配子与聚乙二醇脂质体结合,可以靶向小鼠的肿瘤血管内皮细胞mTECs。Song等[27]将针对乳腺癌细胞4T1的适配子SRZ1与包裹DOX的阳离子脂质体混合物 (DOTAP/DOPE) 结合 (图 3b),能够显著地抑制肿瘤的生长并明显增加4T1肿瘤小鼠的存活率。
适配子−高分子胶束−化疗药物递送系统也是药物靶向递送主要形式之一。Dhar等[28]合成PSMA适配子缀合聚乳酸羟乙酸共聚物 (polylactic glycolic acid,PLGA) 靶向递送化疗药物顺铂,可将治疗效率提高3倍。此外,该递送系统可以延长药物血液半衰期,因此在增加靶向性的基础上,使用剂量仅为单独顺铂治疗剂量的0.3倍,化疗药物用量的减少降低了对机体的毒副作用。
其他纳米材料,如金纳米粒、超顺磁性氧化铁纳米颗粒、量子点、碳纳米管和石墨烯等通常通过π-π共轭、疏水相互作用或共价缀合与药物连接。金纳米粒具有本身惰性和无毒的优势,且可以通过增强渗透和保留效果 (permeation and retention effect,EPR) 在肿瘤组织中蓄积。此外,加上适配子在其表面的修饰,可以主动靶向并递送药物进入肿瘤细胞和组织。Luo等[30]通过金−硫醇发生的超强结合作用,研发适配子金纳米粒 (APT/HP-金纳米粒),同时将DOX嵌入DNA 链 (图 3c)。该递送系统的特点为激光照射下使得金纳米粒很容易释放DOX,相比未修饰的金纳米粒,针对靶细胞诱导的细胞毒性至少提高3倍。Qiu等[31]使用DNA自组装核摄取金纳米粒,通过纳米载体系统与靶向细胞的近红外 (near-infrared,NIR) 响应对耐药肿瘤进行治疗。将药物通过细胞膜到细胞核的传递中绕过细胞膜表面P-糖蛋白,避免癌症治疗中多药耐药性 (multidrug resistance,MDR) 的发生。该药物由金纳米棒 (nanorod,NR) 及侧面组装银组成,表面由金纳米粒装载抗癌药物,其端面是修饰后的针对细胞特异性的适配子 (图 3d)。通过使用该大小及成像可控性的药物递送系统,抗癌药物可以有效积累细胞核内并杀死癌细胞。
Taghavi等[35]的研究中,将单壁碳纳米管 (single- walled carbon nanotubes ,SWCNTs) 与PEG和10 kDa聚乙烯亚胺 (polyethylenimine,PEI) 共价连接,且PEI 经过伯胺烷基羧化,以增加载体的亲脂性。通过SWCNT和PEI的静电相互作用,产 生有效的DNA凝聚力,使载体能够与细胞膜发生作用 (图 3e)。为了提高抗肿瘤疗效,将靶向MUC1阳性细胞的适配子5TR1与之结合,与标准的PEI相比,有效提高了转染效率,高效、高选择性地将shRNA质粒转染到MUC1阳性细胞。
Zhang等[37]开发了基于适配子的DNA树枝状纳米结构作为肿瘤成像及靶向药物递送的载体。该载体根据预先设计的碱基配对将Y形骨架、DNA适配子sgc8和抗癌药物交联。该载体具有模块设计轻便、生物稳定性及生物相容性好、高选择性、高亲和力和高载药量的优势。由于该树枝状骨架的独特结构,可以一次性结合适配子多个拷贝,明显提高了药物的亲和力。该课题组将DOX与树枝状载体结合,结果表明,该药物针对适配子靶向的人T细胞急性淋巴白血病细胞系产生明显的毒性作用,而针对非靶向的人伯基特淋巴瘤细胞系则表现出低选择性,证明这种基于适配子靶向的递送系统在生物医学领域很有发展前景 (图 4)。
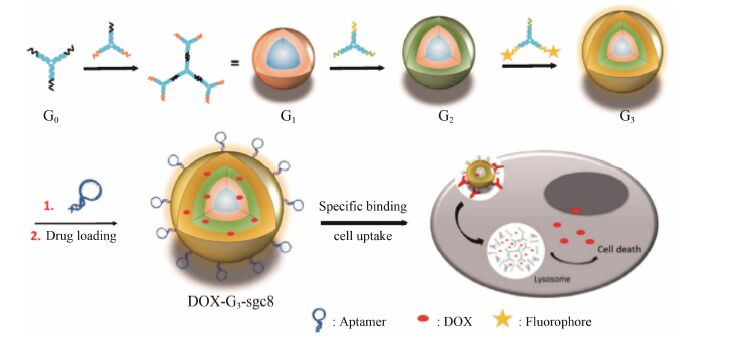
|
Figure 4 Working principle of aptamer-based dendritic DNA nanostructure. The final generation DOX-G3-sgc8 is designed with various functional groups,including fluorophores,targeting ligands and anticancer drugs to endow the DNA dendrimer with the capability of cancer cell recognition,imaging and drug delivery[37] |
Mark课题组[38]则采用超大孔材料体系的水凝胶和适配子结合,解决了药物包封率低、难释放的问题。实验结果表明,水凝胶因为超大孔和适配子的存在,能够瞬间和充分螯合大量的生长因子 (图 5a)。该递送系统不涉及任何苛刻的条件,可通过改变适配子的亲和力以及使用触发反应来调控生长因子的释放动力学。通过分子实验验证,该研究提出了一个很有前途的水凝胶生物制剂,可以与生长因子、细胞因子、肽和疫苗等有效结合应用于临床。

|
Figure 5 (a) Reaction scheme of hydrogel synthesis. The superporous hydrogel is synthesized by using free radical polymerization coupled with gas formation. Acrydite-functionalized aptamers are incorporated into the hydrogel network during the polymerization[38]. (b) Schematic illustration to show the preparation process of bovine serum albumin (BSA) nanoparticles coated with PAH/PSS multilayers and coupled with aptamer AS1411 |
另外,Xie等[39]首次成功地用聚电解质复合纳滤膜 (PAH/PSS) 2层膜以及PAH-g-PEG-COOH修饰了牛血清白蛋白 (bovine serum albumin,BSA) 包裹的纳米粒,并在粒子表面偶联适体AS1411,得到了同时具有靶向功能和pH响应包埋释放抗癌药物的纳米载体 (图 5b),细胞培养实验证明,这种纳米粒对肝癌细胞靶向性明显,载药后对肝癌细胞毒性增强。
3 适配子药物面临的挑战尽管近年来生物医学领域在适配子研究方面不断有新的突破,但在适配子药物研发方面仍面临很多挑战。
3.1 研发生产领域随着生物医药领域对核酸适配子研究的不断深入,更多的药物走向临床,甚至走向市场。面对需求的加大,适配子药物生产制备过程必须高效、合理和稳定。原料的有效性、产量、成本、重现性和纯度都是在寡核苷酸生产制备中需要考虑的因素,而高产量、高纯度及低成本是寡核苷酸制备的基本要求。目前采用固相核酸合成技术,方便又经济地制备适配子,并有效的减小批次差异。而适配子作为靶向载体与治疗药物联用时,增加固相载体的适配子装载、空间稳定性及合成效率能有效地提高综合效益。另外,适配子药物成药前需要经过修饰才能在机体内稳定高效发挥作用。而在位点特异性修饰后,在保证修饰组分合理性的前提下,还要保证药物的药理学性质和治疗作用。目前比较常用的是硫醇、胺和醛等修饰[12]。
3.2 药代动力学方面目前适配子单纯药物治疗剂一般通过静脉注射、皮下注射或玻璃体内注射等方式给药[4]。基于寡核苷酸给药的方式,适配子药物通过吸入、黏膜、皮肤和鞘内递送等方式在理论上是可行的,但仍需实践证明。目前适配体药物的治疗靶标多数存在于血液或间质液的细胞表面蛋白,而未经修饰的适配子进入体内达到靶细胞前可能会迅速被核酸酶降解,释放的核苷通过内源性嘌呤和嘧啶被代谢[4],其在血液里的半衰期短至2 min,因此适配子药物的药代动力学成为其药物研发的主要瓶颈之一[40]。研究表明,通过在核苷酸的糖部分进行修饰或连接磷酸二酯增加适配子分子量,将有效增加适配子药物的半衰期,其中应用最广泛的是在糖苷2' 位加以氟或氧甲基修饰,这些修饰将显著提高适配子的药代动力学曲线[41]。此外,也可以通过连接高分子量的聚乙二醇或胆固醇[4, 42],降低肾清除率,改善其药代动力学。
3.3 毒理学方面至目前,关于适配子的毒理学资料有限,根据临床试验阶段的Macugen、AS1411等药物毒理结果,适配子作为治疗剂毒性非常小[4, 12],其毒理学与反义寡核甘酸类似,但也不完全局限于相同的属性。目前认为,寡核苷酸主要引起的不良反应有3种: 聚离子效应、对先天免疫力的刺激和寡核苷酸的组织累积。这些在应用寡核苷酸药物治疗之前是必须考虑的。
体内高浓度的寡核苷酸及其非特异性,还有脱靶蛋白的相互作用容易引发聚离子效应。该效应干涉补体代替途径的活化,在H因子作用下引起一种阻碍补体代替途径调节蛋白C ' 的激活,引发伪超敏反应和凝血途径的抑制,导致心血管综合征,表现为低血压和心动过速,甚至可能导致心血管崩溃甚至死亡[4]。值得注意的是,该不良反应目前只在灵长类动物试验中发现,尚未在啮齿动物和人体研究中报道。
寡核苷酸对免疫系统的刺激已有较为广泛的研究,主要体现在啮齿类动物上,在Toll样受体9 (toll-like receptor 9,TLR9) 的识别下单链DNA CpG基序发生相互作用[4]。基于RNA的分子,可刺激其他Toll样受体 (TLR3、7、8),并产生类似的免疫刺激作用。这些免疫刺激很可能造成不良后果,例如在淋巴器官中引起血浆过多及在非淋巴器官中引起单核细胞浸润[43]。
在组织形态学中寡核苷酸重复给药后可能引起其形成嗜碱性颗粒,积累于肾小管上皮细胞、淋巴结网状内皮细胞的细胞质及肝脏中。此蓄积毒性往往与累积剂量相关,在常规治疗剂量下,一般不会对细胞产生不良影响。
4 总结与展望本文主要介绍了适配子在靶向药物方面的研究进展,从目前研究及临床试验来看,适配子为靶向治疗提供了一个很好的平台。适配子不仅可作为药物和靶向递送载体,还广泛应用于生物传感器的设计、基因芯片和癌症成像等,在生物医学相关的基础研究、临床诊断和药物研发等领域优势显著。面对高亲和力适配子筛选及靶向药物研发的种种挑战,研究热点应聚焦在筛选更多靶点的高亲和力适配子,并不断改进适配子作为靶向载体与其他治疗药物的结合模式,以提高和改善药物的药效及药代动力学,以期在更多疾病的靶向治疗中发挥更大的作用。
| [1] | Tuerk C, Gold L. Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J]. Science, 1990, 249:505-510. |
| [2] | Ellington AD, Szostak JW. In vitro selection of RNA molecules that bind specific ligands[J]. Nature, 1990, 346:818-822. |
| [3] | Zhu G, Ye M, Donovan MJ, et al. Nucleic acidaptamers:an emerging frontier in cancer therapy[J]. Chem Commum, 2012, 48:10472-10480. |
| [4] | Bouchard PR, Hutabarat RM, Thompson KM. Discovery and development of therapeutic aptamers[J]. Annu Rev Pharmacol, 2010, 50:237-257. |
| [5] | Mahlknecht G, Maron R, Mancini M, et al. Aptamer to ErbB-2/HER2 enhances degradation of the target and inhibits tumorigenic growth[J]. Proc Natl Acad Sci USA, 2013, 110:8170-8175. |
| [6] | Ng EW, Adamis AP. Anti-VEGF aptamer (pegaptanib) therapy for ocular vascular diseases[J]. Ann NY Acad Sci, 2006, 1082:151-171. |
| [7] | Bates PJ, Laber DA, Miller DM, et al. Discovery and development of the G-rich oligonucleotide AS1411 as a novel treatment for cancer[J]. Exp Mol Pathol, 2009, 86:151-164. |
| [8] | Nimjee SM, Rusconi CP, Harrington RA, et al. The potential of aptamers as anticoagulants[J]. Trends Cardiovasc Med, 2005, 15:41-45. |
| [9] | Lee YJ, Lee SW. Regression of hepatocarcinoma cells using RNA aptamer specific to alpha-fetoprotein[J]. Biochem Biophys Res Commun, 2012, 417:521-527. |
| [10] | Roth F, De La Fuente AC, Vella JL, et al. Aptamer-mediated blockade of IL4Rα triggers apoptosis of MDSCs and limits tumor progression[J]. Cancer Res, 2012, 72:1373-1383. |
| [11] | Sundaram P, Kurniawan H, Byrne ME, et al. Therapeutic RNA aptamers in clinical trials[J]. Eur J Pharm Sci, 2013, 48:259-271. |
| [12] | Tan L, Neoh KG, Kang ET, et al. PEGylated anti-MUC1 aptamer-doxorubicin complex for targeted drug delivery to MCF7 breast cancer cells[J]. Macromol Biosci, 2011, 11:1331-1335. |
| [13] | Huang YF, Shangguan DH, Liu H, et al. Molecular assembly of an aptamer-drug conjugate for targeted drug delivery to tumor cells[J]. ChemBioChem, 2009, 10:862-868. |
| [14] | Wang R, Zhu G, Mei L, et al. Automated modular synthesis of aptamer-drug conjugates for targeted drug delivery[J]. J Am Chem Soc, 2014, 136:2731-2734. |
| [15] | Zhu G, Cansiz S, You M, et al. Nuclease-resistant synthetic drug-DNA adducts:programmable drug-DNA conjugation for targeted anticancer drug delivery[J]. NPG Asia Mater, 2015, 7:e169. |
| [16] | Chen CH, Dellamaggiore KR, Ouellette CP, et al. Aptamerbased endocytosis of a lysosomal enzyme[J]. Proc Natl Acad Sci USA, 2008, 105:15908-15913. |
| [17] | Wengerter BC, Katakowski JA, Rosenberg JM, et al. Aptamer-targeted antigen delivery[J]. Mol Ther, 2014, 22:1375-1387. |
| [18] | Bora RS, Gupta D, Mukkur TK, et al. RNA interference therapeutics for cancer:challenges and opportunities[J]. Mol Med Rep, 2012, 6:9-15. |
| [19] | Wang XL, Wang QQ, Song HF. Advance in the study of targeting delivery system for siRNA mediated by aptamers[J]. Acta Pharm Sin (药学学报), 2012, 47:850-855. |
| [20] | Neff CP, Zhou J, Remling L, et al. An aptamer-siRNA chimera suppresses HIV-1 viral loads and protects from helper CD4+ T cell decline in humanized mice[J]. Sci Transl Med, 2011, 3:66ra6. |
| [21] | Ni X, Zhang Y, Ribas J, et al. Prostate-targeted radiosensitization via aptamer-shRNA chimeras in human tumor xenografts[J]. J Clin Invest, 2011, 121:2383-2390. |
| [22] | Esposito CL, Catuogno S, de Franciscis V. Aptamer-mediated selective delivery of short RNA therapeutics in cancer cells[J]. J RNAi Gene Silencing, 2014, 10:500-506. |
| [23] | Xing H, Tang L, Yang X, et al. Selective delivery of an anticancer drug with aptamer-functionalized liposomes to breast cancer cells in vitro and in vivo[J]. J Mater Chem B Mater Biol Med, 2013, 1:5288-5297. |
| [24] | Zhu CL, Song XY, Zhou WH, et al. An efficient cell-targeting and intracellular controlled-release drug delivery system based on MSN-PEM-aptamer conjugates[J]. J Mater Chem, 2009, 19:7765-7770. |
| [25] | Yang X, Liu X, Liu Z, et al. Near-infrared light-triggered, targeted drug delivery to cancer cells by aptamer gated nanovehicles[J]. Adv Mater, 2012, 24:2890-2895. |
| [26] | Ara MN, Matsuda T, Hyodo M, et al. Construction of an aptamer modified liposomal system targeted to tumor endothelial cells[J]. Biol Pharm Bull, 2014, 37:1742-1749. |
| [27] | Song XL, Ren Y, Zhang J, et al. Targeted delivery of doxorubicin to breast cancer cells by aptamer functionalized DOTAP/DOPE liposomes[J]. Oncol Rep, 2015, 34:1953-1960. |
| [28] | Dhar S, Kolishetti N, Lippard SJ, et al. Targeted delivery of a cisplatin prodrug for safer and more effective prostate cancer therapy in vivo[J]. Proc Natl Acad Sci U S A, 2011, 108:1850-1855. |
| [29] | Kataoka K, Harada A, Nagasaki Y. Block copolymer micelles for drug delivery:design, characterization and biological significance[J]. Adv Drug Deliv Rev, 2012, 64:37-48. |
| [30] | Luo YL, Shiao YS, Huang YF. Release of photoactivatable drugs from plasmonic nanoparticles for targeted cancer therapy[J]. ACS Nano, 2011, 5:7796-7804. |
| [31] | Qiu LP, Chen T, Öçsoy I, et al. A cell-targeted, size-photocontrollable, nuclear-uptake nanodrug delivery system for drugresistant cancer therapy[J]. Nano Lett, 2015, 15:457-463. |
| [32] | Probst CE, Zrazhevskiy P, Bagalkot V, et al. Quantum dots as a platform for nanoparticle drug delivery vehicle design[J]. Adv Drug Deliv Rev, 2013, 65:703-718. |
| [33] | Wu X, Tian F, Zhao JX, et al. Evaluating pharmacokinetics and toxicity of luminescent quantum dots[J]. Expert Opin Drug Met, 2013, 9:1265-1277. |
| [34] | Wang YX, Xuan S, Port M, et al. Recent advances in superparamagnetic iron oxide nanoparticles for cellular imaging and targeted therapy research[J]. Curr Pharm Des, 2013, 19:6575-6593. |
| [35] | Taghavi S, HashemNia A, Mosaffa F, et al. Preparation and evaluation of polyethylenimine-functionalized carbon nanotubes tagged with 5TR1 aptamer for targeted delivery of Bcl-xL shRNA into breast cancer cells[J]. Colloids Surf B Biointerfaces, 2016, 140:28-39. |
| [36] | Pan Y, Sahoo NG, Li L. The application of graphene oxide in drug delivery[J]. Expert Opin Drug Deliv, 2012, 9:1365-1376. |
| [37] | Zhang HM, Ma YL, Xie Y, et al. A controllable aptamer-based self-assembled DNA dendrimer for high affinity targeting, bioimaging and drug delivery[J]. Sci Rep, 2015, 5:10099. |
| [38] | Battig MR, Huang YK, Chen NC, et al. Aptamer-functionalized superporous hydrogels for sequestration and release of growth factors regulated via molecular recognition[J]. Biomaterals, 2014, 35:8040-8048. |
| [39] | Xie LL, Tong WJ, Yu DH, et al. Bovine serum albumin nanoparticles modified with multilayers and aptamers for pH-responsive and targeted anti-cancer drug delivery[J]. J Mater Chem, 2012, 22:6053-6060. |
| [40] | Jacobson O, Yan X, Gang N, et al. PET imaging of tenascin-C with a radiolabeled single-stranded DNA aptamer[J]. J Nucl Med, 2015, 56:616-621. |
| [41] | Keefe AD, Cload ST. SELEX with modified nucleotides[J]. Curr Opin Chem Biol, 2008, 12:448-456. |
| [42] | Burmeister PE, Lewis SD, Silva RF, et al. Direct in vitro selection of a 2"-O-methyl aptamer to VEGF[J]. Chem Biol, 2005, 12:25-33. |
| [43] | Banerjee J, Nilsen-Hamilton M. Aptamers:multifunctional molecules for biomedical research[J]. J Mol Med, 2013, 91:1333-1342. |
 2016, Vol. 51
2016, Vol. 51


