中药资源丰富,成分种类多样,在我国使用历史悠久且临床疗效显著,因此中药在新药研发中具有得天独厚的优势。据统计,从1981年到2010年,全球获审批的1 073种新型小分子活性物质中有超过50% 是直接或间接地源于中药[1]。但是,由于中药化学成分组成复杂且含量参差不齐,在筛选有效成分时存在非特异性吸附不易发现、假阳性结果干扰明显、微量活性成分难以检测等问题[2],这对从中药发现活性成分、阐明其作用机制提出了严峻的挑战。
绝大多数药物通过与疾病相关的酶、受体等大分子物质相互作用进而在人体内发挥疗效。这些生物大分子通过调节人体的信号传导,维持机体正常代谢,对人体的正常生命活动起着重要作用。因此以生物大分子为靶标,体外筛选中药提取物中的有效物质不仅为药物的筛选提供了新的思路与方法,同时也有助于揭示中药小分子活性物质的作用机制[3]。
亲和超滤 (affinity ultrafiltration,UF) 是一种将亲和捕获与超滤技术结合以实现化合物高通量筛选的手段之一[4]。较之传统分离获取中药成分再进行活性筛选和评价的方法,亲和超滤操作简便,大大缩短了筛选时长,减少了样品及试剂的消耗[5]。液质技术的出现和发展,使亲和超滤分离得到的活性物质的检测成为可能,也进一步扩大了亲和超滤筛选的应用范围,如复杂体系、未知体系、微量体系等。自1997年,van Breemen等[6]将亲和超滤与液质技术结合,以血清白蛋白和腺苷脱氨酶为靶点,成功地应用于组合化合物库的筛选,使得人们看到了这一联用技术在复杂体系中发现活性成分的优势,因此越来越多的研究将其运用到中药提取物的小分子活性物质筛选中。
1 UF-LC-MS的基本概述 1.1 基本原理和步骤超滤技术可分为离心超滤和脉冲超滤两类,均是利用生物大分子与小分子物质的质量差异实现筛选和分离。将选定的靶标 (生物大分子) 与待筛选物质 (小分子) 在溶液中混合,采用适当孔径的超滤膜截留靶标与潜在活性小分子形成的复合物,未结合的成分则被滤过洗脱下来。再选取适宜的有机试剂或改变体系的pH等使靶标分子变性,潜在活性小分子即与靶标分离,运用液质技术对分离的潜在活性小分子进行分析和鉴定,进而快速发现活性化合物[7, 8]。离心超滤目前多利用商品化的超滤离心管实现,由于超滤膜的超低结合及各向异性,仅通过多次离心洗脱就能快速完成整个筛选过程,且多次实验的重现性良好。而脉冲超滤装置是由流通室、磁力搅拌器及超滤膜 (表面材料均不易与待测成分及蛋白结合) 组成,向流通室加入待测物及靶标蛋白之后通过施加一定的压力即可完成靶标−配体复合物及非作用成分的分离。在脉冲超滤中,不仅可以根据待测液的容量选择流通室的体积,还可将其置于一些保温箱、温水浴等装置中,实现控温,更好地维持靶标的活性[3]。尽管都可以用于亲和选择富集配体,但使用设备本身的差异决定了它们的应用范围会有所不同。相较之下,离心超滤更常用于活性小分子物质的筛选,而脉冲超滤在描述受体−配体的结合特征和考察药物的代谢、测定其产物等方面更为有效。此外,脉冲超滤与MS的在线连接使得它在筛选更大的组合化学库方面具有更高的实际应用价值[4]。
1.2 UF-LC-MS的优势目前,已有的筛选活性成分的方法很多,如分 子印迹技术[9]、细胞膜色谱法[10, 11]、磁珠吸附筛选[12]等。相较于这些方法,将超滤与液质技术联用筛选中药小分子活性物质具有操作简便、检测灵敏、结果特异等多方面优势。
首先,亲和超滤时靶标是在溶液中直接与潜在的活性小分子结合,与磁珠吸附等方法相比,省去了靶标固定化的前处理,利用超滤膜的截留即实现了靶标亲和成分的筛选。这不仅省时省力,还有效地避免亲和靶标的变性与失活,提高了结果的准确性和特异性。其次,超滤所需靶标用量很少,当靶标价格昂贵不易获得或量少时值得考虑[4]。基于光学或放射性的传统色谱鉴别方法很容易受到基体的干扰,不易于分析鉴定复杂的中药成分[13]。液质技术在复杂成分分析中具有独特优势,其检测分子量范围跨度大、灵敏度高,可获得保留时间、分子量 (质核比) &nb sp;及含量的三维信息,对多种物质进行定性定量分析通用性好。当亲和超滤与液质技术联用时,后者的高灵敏度可以弥补前者因上样量低引起的部分成分难以检测的缺陷。近年来,随着更多类型的质谱技术的出现可以从不同方面满足成分分析鉴定的需求,如Orbitrap MS[14]、DART MS[15]、IT-TOF MS[16]、FT-ICR MS[17]、MALDI-TOF-MS[18]、ESI-Q/TOF-MS[19]等。
1.3 UF-LC-MS的影响因素亲和超滤偶联液质技术在被应用于有效成分的筛选时,为了得到理想的结果,在超滤环节有诸多因素需要考量,如靶标与待测成分混合的浓度、解离液的选择、超滤膜的材质、截留量、共孵育时间等[4]。
1.3.1 靶标与配体的浓度在亲和超滤的过程中,若配体浓度相对靶标较高,则配体之间与靶标结合的竞争性较大,使得某些有活性的物质难以亲和,造成假阴性结果; 反之,则可能增加非特异性吸附,引起假阳性结果,因此,确定合适的靶标与配体浓度是确保筛选结果的准确性与特异性的关键。配体与靶 标的相互作用中存在一个解离平衡常数 (Kd),不同物质有自身的Kd值。通常情况下当受体的浓度与结合能力最弱的物质的Kd值相近时,在一定程度上可以使得所有与靶标存在结合作用的配体都与之亲和。因此,靶标与配体的浓度应适中,且受体的浓度最好不低于配体[20]。
1.3.2 解离液的选择由于中药提取物成分复杂,结构类型众多,极性各异,因此如何在尽可能减少非特异性吸附的情况下使亲和靶标的配体顺利解离下来是影响筛选结果的另一重要因素。目前使酶变性主要有两种方式,一是向解离溶剂加酸使酶在低pH下失活,或者是利用有机溶剂使酶不可逆的变构失活。当仅向溶剂加入一定量的酸时,此时溶剂极性较大,根据相似相容原理,极性较大的小分子活性物质易溶解在最后的解离液中,而那些极性较小的活性物质在最后的色谱图中可能不明显甚至没有; 相反,当单纯用含有机溶剂的解离液有时则会增加非特异性吸附。有研究表明用含酸的有机溶剂代替仅含有机溶剂的解离液,可以有效地减少无亲和作用物质的非特异性吸附。Zhao等[21]、Liu等[22]选用pH 3.3的甲醇−水 (50∶50) 作为解离溶剂筛选抑制α-葡萄糖苷酶及黄嘌呤氧化酶的中药成分,比较实验组与对照组超滤液的色谱图可以发现有效成分峰面积相差明显,且非特异性吸附的物质信号低。但是也有研究人员使用只含有机溶剂的解离液筛选到抑制环氧合酶[23]、谷胱甘肽还原酶[24]等的小分子中药活性物质,因此具体解离液的选择应进行多次实验尝试,对比结果以确定最优条件。
1.3.3 超滤膜的选取亲和超滤主要是利用超滤膜的截留完成配体−靶标复合物与非作用物质的分离以及亲和配体与靶标的分离过程,因此它对筛选结果也有着不容忽视的影响。常用的超滤离心管滤膜的材料主要有聚醚砜类、纤维素类[3]等。选择合适的滤膜材质有助于减少筛选时出现的非特异性吸附。此外,还需要根据靶标的分子量确定超滤管的截留量。若 滤膜截留量过大易造成漏筛; 过小则滤膜易堵,超滤效率降低。通常应截留分子质量小于目的蛋白分子 质量的1/3,比如靶标分子质量为35 kD,就可以选择10 kD截留分子质量的超滤管。如果靶标分子质量为10 kD左右,则可以用截留分子质量3 kD的超滤管。目前,市面上依据截留分子质量的不同,有多种规格的超滤膜可选,能够充分满足不同生物大分子的截留,进而增加了亲和超滤方法的普适性。
1.3.4 其他除了上面几点因素,靶标与配体的共孵育时间、孵育温度、离心转速、溶液的pH等因素都会对实验结果产生干扰。若孵育时间过短使得吸附不完全,过长则二者之间可能会发生其他反应,造成假阴性或假阳性结果; 孵育温度及溶液的pH选取不当都会影响靶标的活性; 离心转速、时长的不适宜也都会降低超滤的效率。因此,为了筛选结果高效且特异,需要对筛选条件进行详细摸索,并合理设计、规范操作。实验过程中,在靶标-配体复合物解离前多次加入缓冲液进行漂洗有利于减少非特异性吸附。Yang等[25]、Choi等[26]在筛选α-葡萄糖苷酶及醌还原酶-2中药抑制剂时,在漂洗与解离之间增加一个靶标−配体复合物的转膜过程,使得那些结合在超滤膜上不易漂洗下的物质在最终的解离液中含量会有所降低,这样的做法对减少非特异性吸附值得借鉴。此外,阴性对照实验的设计对减少假阳性结果、提高结果的准确性也很有必要[8]。
2 UF-LC-MS在中药有效成分发现中的应用从体系复杂的中药提取物中筛选出活性物质并不容易。由于超滤本身具有良好的分离效果,可以避免基质的干扰,而液质技术拥有强大的分析功能,能够快速实现多种成分的鉴定,因此将二者结合应用于中药小分子有效成分的发现具有巨大的潜力。近几年来,该联用技术已先后成功用于先导化合物、化合物组合文库以及天然产物有效成分的筛选[3]。黄嘌呤氧化酶 (xanthine oxidase,XOD) 是治疗痛风、高尿酸血症的一个重要靶点[27]。Liu等[22]在发现丹参总提物有抑制黄嘌呤氧化酶活性的基础上,结合超滤筛选,运用UPLC-DAD-ESI-MSn技术,从丹参提取物分离得到的14种成分中发现了12个具有XOD抑制作用的物质,经FT-ICR-MS鉴定为11个丹参酮类成分和1个酚酸。同时,他们还效仿Nikolic等[28]提出的评价COX-2抑制剂抑制能力公式,计算这12个结合配体的富集因子 (enrichment factors,为活性物质特异性结合的量与该物质加入的总量的比值),对其抑制能力进行排序。将这12种成分的结构与抑制能力相关联,发现1,2位的萘醌结构是抑制黄嘌呤氧化酶活性的重要结构,且呋喃环及羟基取代对抑制剂的活性有不同程度的增加。这一研究结果不仅为丹参防治痛风和高尿酸血症提供了治疗依据,对于研发治疗痛风药物的结构修饰也带来了一定的启迪。
不同于常见的实验设计,为了降低“结合成分为非活性成分”的假阳性结果,本课题组对亲和超滤筛选策略进行了改进,利用非布索坦先与黄嘌呤氧化酶作用,间接地筛选野菊花中的黄嘌呤氧化酶抑制剂[29]。非布索坦是黄嘌呤氧化酶的强效抑制剂[30]。当与其他抑制该酶的成分共存时,非布索坦与这些物质在黄嘌呤氧化酶活性位点的结合上产生竞争,从而减少酶与这些物质的亲和。利用这一特点,在进行亲和超滤时,研究人员在实验组中以结合了非布索坦的XOD为靶标,对照组则是用正常的XOD,再分别与野菊花提取液孵育。采用HPLC-ESI-Q/TOF MS对实验组和对照组的解离液进行分析,发现具有XOD潜在抑制作用的物质在实验组色谱图中的峰高要明显低于对照组 (整体过程如图 1)。此策略用于黄嘌呤氧化酶抑制剂的筛选,可有效减少亲和超滤过程中非特异性吸附引起的干扰。
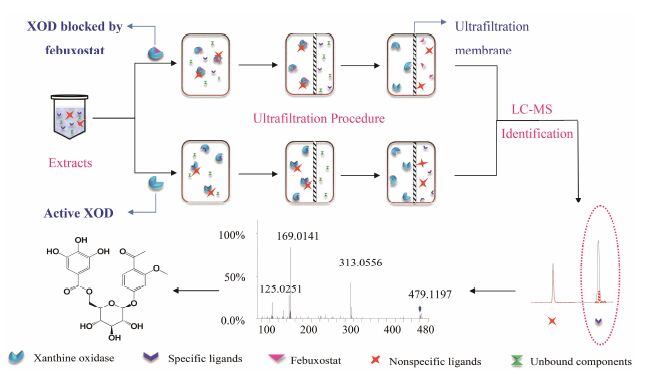
|
Figure 1 Schematic diagram of the affinity ultrafiltration (UF) LC-MS method combined with febuxostat |
在此基础上本课题组还尝试将UF-LC-MS运用于中药复方制剂脉络宁注射剂中抑制XOD的活性成分筛选[31]。在初步找到绿原酸、异绿原酸A~C等4种潜在有效物质的情况下,测定其IC50,发现终浓度为125 μmol·L−1时,异绿原酸A~C的XOD抑制率均可达50% 以上,而绿原酸却仅有6.06%,表明绿原酸很有可能是一种假阳性成分。为了验证UF-LC-MS高通量的特点,进一步对上述筛选到的3个成分进行结构改造,包括分解、转置、甲基化等共得到14个成分。利用分子芯片对接技术模拟变构成分与XOD的结合,预测这些物质的活性,最终又发现3,4-二咖啡酰奎宁酸甲酯和3,5-二咖啡酰奎宁酸甲酯2种XOD强效抑制剂。用标准品进行实验验证,测得它们的IC50分别为3.16和7.54 μmol·L−1,甚至低于已上市的抗痛风药别嘌呤醇 (IC50 = 8.36 μmol·L−1),而其他成分抑制率较低,与预测结果一致,这为基于中药成分建立相关数据库并进行高通量筛选提供了理论依据。
不仅仅是黄嘌呤氧化酶,α-葡萄糖苷酶作为治疗Ⅱ型糖尿病的一个关键靶点近年来也得到了许多关注。研究人员利用UF-LC-MS从多种中药提取物中发现了一系列黄酮类有效抑制成分。表 1 [21, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58] 汇总了自2010年至今这5年间以生物大分子为靶标,利用UF-LC-MS筛选中药有效成分的研究实例。
|
|
Table 1 Applications of UF-LC-MS in screening active components of TCMs. aThe components were identified by the standards; bThe screened candidate inhibitors were separated and then identified by NMR,compared with relative references; cThe active component was an agonist to the peroxisome proliferator-activated receptor α,but the others are inhibitors of relative targets |
值得注意的是,Zhao等[37]和Zhu等[23]在运用亲和超滤偶联液质技术分别从降香黄檀木和川乌中筛选出α-葡萄糖苷酶和环氧合酶-2的中药抑制成分后,提出利用这些活性物质实现对中药材的质量控制。事实上,仅通过中药材中所含的化学成分来评价中药质量优劣的传统化学指纹图谱在一定程度上存在自身的局限性,因为这些选定的成分并非完全是该中药发挥药效的有效物质。因此利用像UF-LC-MS这样的高通量筛选技术获取中药活性物质,根据谱效关系得到的生物指纹图谱不仅可以弥补化学指纹图谱的不足,为评价中药的有效性提供了新的思路,更重要的是为中药的质量控制提供了更为科学的依据[59]。
3 展望不同于西药在治疗疾病时具有特异性的靶向位点,中药的特色在于多成分组成,多靶点治疗。通常情况下一种中药可以应用在多种疾病的治疗中,而一种疾病也可以用多种中药来进行防治。为了能够阐述中药的作用机制,找到其药效物质基础是迈出的第一步,因此找到快速而又有效的筛选方法发现这些物质很有必要。 亲和超滤偶联液质技术是一种快速、简单、有效的潜在活性小分子成分发现模式。亲和超滤能有效地减少杂质的干扰,在简化有效成分分离步骤的同时降低实验成本。液质技术则为获得筛选结果提供了保障,提高实验结果的准确率。亲和超滤偶联液质技术加快了中药活性成分的发现,为阐明中药活性成分作用机制奠定了基础,是以中药为基础的新药研发的重要手段之一。但目前应用UF-LC-MS进行中药小分子活性物质筛选主要是针对某一种靶标,对作用于多靶点成分的筛选方法报道极少,尚不能满足中药多靶点的筛选需求。因此,在后续研究中可以尝试用多级超滤膜或多个超滤管进行串联,根据分子质量的不同选取合适的多种靶标进行多靶点的筛选。此外,不仅可以利用已知蛋白对未知中药活性成分进行筛选,利用已知的中药活性小分子也能够对未知蛋白进行探究发现,甚至是研究这些活性物质对具有相互作用的蛋白之间的影响,进而实现对这些中药活性小分子可能发挥药效的机制的探索。随着超滤技术的发展、更高分辨率质谱的出现和更多液质联用技术的革新,亲和超滤偶联液质技术为中药活性成分的筛选实现高通量与自动化提供了可能[4, 7],未来在中药有效成分的发现中该联用技术将有着广阔的应用前景。
| [1] | Atanasov AG, Waltenberqer B, Pferschy-Wenziq EM, et al. Discovery and resupply of pharmacologically active plantderived natural products:a review[J]. Biotechnol Adv, 2015, 33:1582-1614. |
| [2] | Olivier P, Matthias H. Concepts and technologies for tracking bioactive compounds in natural product extracts:generation of libraries, and hyphenation of analytical processes with bioassays[J]. Nat Prod Rep, 2013, 30:546-564. |
| [3] | Yu H. Study on the Interactions of Protein with Small Drug Molecules by Ultrafiltration Mass Spectrometry (超滤质谱法研究蛋白质与药物小分子的相互作用)[D]. Wuhan:Southcentral University For Nationalities, 2013. |
| [4] | Zhao HY, Zhang YZ, Xiao CL. Advances in the study of affinity selection-ultrafiltration/HPLC-MS[J]. Acta Pharm Sin (药学学报), 2009, 44:1084-1088. |
| [5] | Li HL, Song FR, Xing JP, et al. Screening and structural characterization of α-glucosidase inhibitors from Hawthorn leaf flavonoids extract by ultrafiltration LC-DAD-MSn and SORI-CID FTICR MS[J]. J Am Soc Mass Spectrom, 2009, 20:1496-1503. |
| [6] | van Breemen RB, Huang CR, Nikolic D, et al. Pulsed ultrafiltration mass spectrometry:a new method for screening combinatorial libraries[J]. Anal Chem, 1997, 69:2159-2164. |
| [7] | Chen LJ, Zhang XY, Huang H, et al. Novel separation and purification technique-affinity ultrafiltration and its application[J]. Membrane Sci Technol (膜科学与技术), 2006, 26:61-65. |
| [8] | Tao Y. Studies on Chemical Biology Approaches for Rapid Discovery of Bioactive Compounds from Traditional Chinese Medicine (一类基于化学生物学的中药药效成分快速发现方法研究)[D]. Zhejiang:Zhejiang University, 2013. |
| [9] | Lakka A, Mylonis I, Bonanou S, et al. Isolation of hypoxiainducible factor 1(HIF-1) inhibitors from frankincense using a molecularly imprinted polymer[J]. Invest New Drugs, 2011, 29:1081-1089. |
| [10] | Fang YL, Zhang Y, Xiao XH, et al. Advances in studies on application of cell membrane chromatography in screening bioactive components of Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2008, 39. |
| [11] | Fang SM. VEGFR-2 Cell Membrane Chromatography for Screening Inhibitors (VEGFR-2细胞膜色谱法的建立及药物筛选应用)[D]. Shandong:Shandong University, 2012. |
| [12] | Zhang YP, Shi SY, Chen XQ, et al. Functionalized magnetic nanoparticles coupled with mass spectrometry for screening and identification of cyclooxygenase-1 inhibitors from natural products[J]. J Chromatogr B, 2014, 960:126-132. |
| [13] | Mulabaqal V, Calderón AI. Development of an ultrafiltrationliquid chromatography/mass spectrometry (UF-LC/MS) based ligand-binding assay and an LC/MS based functional assay for Mycobacterium tuberculosis shikimate kinase[J]. Anal Chem, 2010, 82:3616-3621. |
| [14] | Xiong C, Li YW, Zheng YJ, et al. Progress in application of orbitrap mass spectrometry technique in food analysis[J]. Food Sci (食品科学), 2015, 36:28-287. |
| [15] | Zeng SS. Studies on the Methodology and Application of Direct Analysis in Real Time Mass Spectrometry for the Quality Control of Traditional Chinese Medicine (实时直接分析质谱在中药质量控制中的应用基础研究)[D]. Zhejiang:Zhejiang University, 2013. |
| [16] | Liang Y, Hao H, Kang A, et al. Qualitative and quantitative determination of complicated herbal components by liquid chromatography hybrid ion trap time-of-flight mass spectrometry and a relative exposure approach to herbal pharmacokinetics independent of standards[J]. J Chromatogr A, 2010, 1217:4971-4979. |
| [17] | Pattky M, Nicolardi S, Santiago-Schübel B, et al. Structure characterization of unexpected covalent O-sulfonation and ion-pairing on an extremely hydrophilic peptide with CE-MS and FT-ICR-MS[J]. Anal Bioanal Chem, 2015, 407:6637-6655. |
| [18] | Lu M, Cai Z. Advances of MALDI-TOF MS in the analysis of traditional Chinese medicines[J]. Top Curr Chem, 2013, 331:143-164. |
| [19] | Zhang X, Liang J, Liu J, et al. Quality control and identification of steroid saponins from Dioscorea zingiberensis C. H. Wright by fingerprint with HPLC-ELSD and HPLC-ESIQuadrupole/Time-of-fight tandem mass spectrometry[J]. J Pharm Biomed Anal, 2014, 91:46-59. |
| [20] | Johnson BM, Nikolic D, van Breemen RB. Applications of pulsed ultrafiltration-mass spectrometry[J]. Mass Spectrom Rev, 2002, 21:76-86. |
| [21] | Zhao HD, Zhang YP, Guo Y, et al. Identification of major α-glucosidase inhibitors in Radix Astragali and its human microsomal metabolites using ultrafiltration HPLC-DAD-MSn.[J]. J Pharm Biomed Anal, 2015, 104:31-37. |
| [22] | Liu Y, Liu S, Liu ZQ. Screening and determination of potential xanthine oxidase inhibitors from Radix Salviae Miltiorrhizae using ultrafiltration liquid chromatography-mass spectrometry[J]. J Chromatogra B, 2013, 923-924:48-53. |
| [23] | Zhu HB, Liu S, Li X, et al. Bioactivity fingerprint analysis of cyclooxygenase-2 ligands from Radix Aconiti by ultrafiltration-UPLC-MSn[J]. Anal Bioanal Chem, 2013, 405:7437-7445. |
| [24] | Mulabagal V, Calderon AI. Development of binding assays to screen ligands for Plasmodium falciparum thioredoxin and glutathione reductases by ultrafiltration and liquid chromatography/mass spectrometry[J]. J Chromatogr B, 2010, 878:987-993. |
| [25] | Yang JR, Luo JG, Kong LY. Determination of α-glucosidase inhibitors from Scutellaria baicalensis using liquid chromatography with quadrupole time of flight tandem mass spectrometry coupled with centrifugal ultrafiltration[J]. Chin J Nat Med, 2015, 13:0208-0214. |
| [26] | Choi Y, Jermihov K, Nam SJ, et al. Screening natural products for inhibitors of quinone reductase-2 using ultrafiltration LC-MS[J]. Anal Chem, 2011, 83:1048-1052. |
| [27] | Harzand A, Tamariz L, Hare JM. Uric acid, heart failure survival, and the impact of xanthine oxidase inhibition[J]. Congest Heart Fail, 2012, 18:179-182. |
| [28] | Nikolic D, Habibi-Goudarzi S, Corley DG, et al. Evaluation of cyclooxygenase-2 inhibitors using pulsed ultrafiltration mass spectrometry[J]. Anal Chem, 2000, 72:3853-3859. |
| [29] | Song HP, Zhang H, Fu Y, et al. Screening for selective inhibitors of xanthine oxidase from Flos Chrysanthemum using ultrafiltration LC-MS combined with enzyme channel blocking[J]. J Chromatogra B, 2014, 961:56-61. |
| [30] | Frampton JE. Febuxostat:a review of its use in the treatment of hyperuricaemia in patients with gout[J]. Drugs, 2015, 75:427-438. |
| [31] | Song HP, Chen J, Hong JY, et al. A strategy for screening of high-quality enzyme inhibitors from herbal medicines based on ultrafiltration LC-MS and in silico molecular docking[J]. Chem Commun, 2015, 51:1494-1497. |
| [32] | Zhou XL, Liang JS, Zhang Y, et al. Separation and purification of α-glucosidase inhibitors from Polygonatum odoratum by stepwise high-speed counter-current chromatography combined with Sephadex LH-20 chromatography target-guided by ultrafiltration-HPLC screening[J]. J Chromatogr B, 2015, 985:149-154. |
| [33] | Li SN, Tang Y, Liu CM, et al. Development of a method to screen and isolate potential α-glucosidase inhibitors from Panax japonicus C.A. Meyer by ultrafiltration, liquid chromatography, and counter-current chromatography[J]. J Sep Sci, 2015, 38:2014-2023. |
| [34] | Tang Y, Liu CM, Ren JQ, et al. Screening of α-glucosidase and xanthine oxidase Inhibitors from Garcinia mangostana extract using ultrafiltration HPLE-ESI-MS[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2015, 26:2322-2325. |
| [35] | Liu Y, Zhou H, Liu S, et al. Screening of α-glucosidase inhibitors in Ginkgo biloba extract using ultrafiltration LCESI-MSn[J]. Chem J Chin Univ (高等学校化学学报), 2013, 34:813-818. |
| [36] | Zhou H, Xing JP, Liu S, et al. Screening and determination for potential α-glucosidase inhibitors from leaves of Acanthopanax senticosus harms by using UF-LC/MS and ESI-MSn[J]. Phytochem Anal, 2012, 23:315-323. |
| [37] | Zhao CF, Liu YQ, Cong DL, et al. Screening and determination for potential α-glucosidase inhibitory constituents from Dalbergia odorifera T. Chen using ultrafiltration-LC/ESI-MSn[J]. Biomed Chromatogr, 2013, 27:1621-1629. |
| [38] | Zhou H, Jiang T, Wang Z, et al. Screening for potential α-glucosidase inhibitors in Coptis chinensis franch extract using ultrafiltration LC-ESI-MSn[J]. Pak J Pharm Sci, 2014, 27:2007-2012. |
| [39] | He ZM, Wang XH, Li GF, et al. Screening and structures characterization of α-glucosidase inhibitors from total saponins of ginseng stems and leaves by ultrafiltration LC-MSn[J]. Chin J Anal Chem (分析化学), 2013, 41:1694-1698. |
| [40] | Wang J, Liu S, Ma B, et al. Rapid screening and detection of XOD inhibitors from S.tamariscina by ultrafiltration LC-PDAESI-MS combined with HPCCC[J]. Anal Bioanal Chem, 2014, 406:7379-7387. |
| [41] | Li SN, Tang Y, Liu CM, et al. Development of a method to screen and isolate potential xanthine oxidase inhibitors from Panax japlcus var ultrafiltration liquid chromatography combined with counter-current chromatography[J]. Talanta, 2015, 134:665-673. |
| [42] | Liu LL, Shi SY, Chen XQ, et al. Analysis of tyrosinase binders from Glycyrrhiza uralensis root:evaluation and comparison of tyrosinase immobilized magnetic fishing-HPLC and reverse ultrafiltration-HPLC[J]. J Chromatogra B, 2013, 932:19-25. |
| [43] | Wang WQ, Hwang SH, Huang B, et al. Identification of tyrosinase specific inhibitors from Xanthium strumarium fruit extract using ultrafiltration-high performance liquid chromatography[J]. J Chromatogra B, 2015, 1002:319-328. |
| [44] | Yang ZZ, Zhang YF, Sun LJ, et al. An ultrafiltration highperformance liquid chromatography coupled with diode array detector and mass spectrometry approach for screening and characterizing tyrosinase inhibitors from mulberry leaves[J]. Aanl Chim Acta, 2012, 719:87-95. |
| [45] | Xiao S, Yu RR, Ai N, et al. Rapid screening natural-origin lipase inhibitors from hypolipidemic decoctions by ultrafiltration combines with liquid chromatography-mass spectrometry[J]. J Pharm Biomed Anal, 2015, 104:67-74. |
| [46] | Tao Y, Cai H, Li WD, et al. Ultrafiltration coupled with highperformance liquid chromatography and quadrupole-time-offlight mass spectrometry for screening lipase binders from different extracts of Dendrobium officinale[J]. Anal Bioanal Chem, 2015, 407:6081-6093. |
| [47] | Liu S, Yan J, Xing JP, et al. Characterization of compounds and potential neuraminidase inhibitors from the n-butanol extract of Compound Indigowoad Root Granule using ultrafiltration and liquid chromatography-tandem mass spectrometry[J]. J Pharm Biomed Anal, 2012, 59:96-101. |
| [48] | Liu S, Xing JP, Yan J, et al. Screening and structures characterization of neuraminidase inhibitors from Radix Scutellaria extract by ultrafiltration LC-MSn[J]. Acta Chim Sin (化学学报), 2011, 69:1570-1574. |
| [49] | van Breemen RB, Tao Y, Li WK. Cyclooxygenase-2 inhibitors in ginger (Zingiber officinale)[J]. Fitoterapia, 2011, 82:38-43. |
| [50] | Cao HM, Yu R, Choi YS, et al. Discovery of cyclooxygenase inhibitors from medicinal plants used to treat inflammation[J]. Pharm Res, 2010, 61:519-524. |
| [51] | Shi SY, Peng MJ, Zhang YP, et al. Combination of preparative HPLC and HSCCC methods to separate phosphodiesterase inhibitors from Eucommia ulmoides bark guided by ultrafiltrationbased ligand screening[J]. Anal Bioanal Chem, 2013, 405:4213-4223. |
| [52] | Tao Y, Chen Z, Zhang YF. Characterization of α-amylase binding agents from hawthorn leaf using ultrafiltration and liquid chromatography tandem mass spectrometry[J]. Chin J Anal Chem (分析化学), 2013, 41:229-234. |
| [53] | Munigunti R, Mulabagal V, Calderon AI. Screening of natural compounds for ligands to PfTrxR by ultrafiltration and LC-MS based binding assay[J]. J Pharm Biomed Anal, 2011, 55:265-271. |
| [54] | Shi J, Zhang XY, Ma ZJ, et al. Characterization of aromatase binding agents from the dichloromethane extract of Corydalis yanhusuo using ultrafiltration and liquid chromatography tandem mass spectrometry[J]. Molecules, 2010, 15:3556-3566. |
| [55] | Choi YS, Jung YJ, Kim SN. Identification of eupatilin from Artemisia argyi as a selective PPARα agonist using affinity selection ultrafiltration LC-MS[J]. Molecules, 2015, 20:13753-13763. |
| [56] | Chen M, Liu LL, Chen XQ. Preparative isolation and analysis of alcohol dehydrogenase inhibitors from Glycyrrhiza uralensis root using ultrafiltration combined with high-performance liquid chromatography and high-speed countercurrent chromatography[J]. J Sep Sci, 2014, 37:1546-1551. |
| [57] | Wang X, Yu H, Pan ZA, et al. Study on the interaction between human serum albumin and licorice extracts by ultrafiltration mass spectrometry[J]. J South-Central Univ Nat (Nat Sci Ed) (中南民族大学学报自然科学版), 2015, 34:25-28. |
| [58] | Ma L, Wang ZF, Chen LN, et al. Screening DNA binders from isoflavone extracts of red clover by centrifugal ultrafiltration-LC-MSn[J]. Chem J Chin Univ (高等学校化学学报), 2013, 34:331-335. |
| [59] | Zhou JL, Qi LW, Li P. Quality control of Chinese herbal medicines with chromatographic fingerprints[J]. Chin J Chromatogra (色谱), 2008, 26:153-159. |
 2016, Vol. 51
2016, Vol. 51


