2. 泉州医学高等专科学校, 福建 泉州 362021
2. Quanzhou Medical College, Quanzhou 362021, China
20多年来,医学界一直不断地尝试采用免疫细胞缓解甚至治愈肿瘤,所试验的免疫细胞包括自然杀伤细胞 (natural killer,NK)[1],树突状细胞 (dendritic cell,DC)[2]和T细胞[3]。但直到近几年,嵌合抗原受体 (chimeric antigen receptors,CAR) 工程化T细胞 (CAR-T) 治疗才在血液系统恶性肿瘤领域取得实质性的成功,肿瘤免疫治疗方法也被《科学》杂志评为2013年度10项最重要的科技突破之首[4]。
本文将回顾CAR-T的设计思路和临床疗效以及在临床应用过程中暴露出来的毒性反应,重点从基因传递的角度,探讨如何设计新型的基因表达框架,或采用新型的基因治疗载体,以避免或减少这类不良反应的发生。
1 CAR的结构设计与普通T细胞不同,CAR-T既具有单克隆抗体的靶抗原专属性,又保留了T细胞的靶细胞杀伤活性。
普通T细胞对肿瘤抗原的识别依赖T细胞受体 (T cell receptor,TCR) (图 1),TCR与抗原的结合依赖靶细胞对抗原的有效递呈,特别是需要主要组织相容性复合物 (major histocompatibility complex,MHC) 的参与。而CAR-T的抗原识别能力,来源于基因重组形成的CAR (图 1)。CAR的基本构造包括胞外、铰链、跨膜和胞内结构域四部分。其胞外结构域一般来自于单克隆抗体的抗原结合部位,即单链可变区 (single chain variable fragment,scFv),因此具有单克隆抗体的靶向性。CAR仅识别细胞表面的抗原,因此与抗原的结合不需要MHC的参与。CAR不仅可识别蛋白类抗原,还可以识别细胞的结构特征 (如糖链和糖脂),这大大增强了CAR-T对肿瘤细胞的靶向能力。

|
Figure 1 Structure of T cell receptor (TCR) and chimeric antigen receptors (CAR). A: TCR,found on the surface of T cells,is responsible for antigen recognition. It consists of two chains: the alpha (α) and beta (β) chains. Both chains have a constant region (C) and a variable region (V). The V region determines antigen specificity. The TCR is associated with the CD3 complex,which comprises three transmembrane signaling molecules (CD3ζζ,CD3δε and CD3γε). B: CAR consist of an ectodomain,commonly derived from a single chain variable fragment (scFv),a hinge,a transmembrane domain and an endodomain. Depending on the number of signaling domains,CAR are classified into 1st generation,2nd generation,or 3rd generation CAR |
T细胞的活化依赖于其表面TCR与胞内CD3复合物的信号传导。CAR-T的活化也需要负责信号传导的CD3-ζ胞内域部分的参与。一旦CAR-T识别抗原后,胞内CD3-ζ立即发送激活信号,激活CAR-T的生存、扩增、体内转运及效应细胞功能。
根据CAR-T的胞内域组成情况,可将其分为三代 (图 1)。第一代CAR-T的胞内域仅由CD3-ζ组 成。因T细胞的有效活化还需要其他共刺激信号的参与,第一代CAR-T虽可以产生抗肿瘤效应,但由于缺少共刺激信号分子,经常因体内扩增能力缺乏,生存时间短而疗效不理想。第二和三代CAR-T则分别在胞内域中增加了一至两段共刺激信号分子,如CD28、OX40 (一种肿瘤坏死因子受体) 和CD40L等,与CD3-ζ一起共同激活T细胞,提高了CAR-T在体内的扩增及持续生存活性[5]。
2 CAR-T细胞的临床疗效CAR-T的临床疗效首先在B细胞恶性肿瘤得到验证[3, 6, 7]。CD19抗原仅在B细胞恶性肿瘤以及正常的B细胞表达,但在其他类型的细胞不表达,因此其成为CAR-T疗法最重要的治疗靶点。对复发性或难治性B细胞白血病,抗CD19 CAR-T治疗的有效率达到60%~90%,部分患者病情持续缓解达2年以上[7]。抗CD19 CAR-T在治疗B细胞恶性肿瘤的巨大成功,极大地鼓舞了人们对CAR-T的信心。
CAR-T对实体瘤的临床治疗虽取得了一定的进展[8, 9],但整体效果仍不能令人满意。如在神经母细胞瘤[10]和卵巢癌[11]临床研究中,发现CAR-T在体内不能持续存活,也不能有效转运到肿瘤部位。Pule等[12]将CAR-T设计为既靶向神经母细胞瘤的非病毒肿瘤相关抗原双唾液酸神经节苷脂 (GD2),又靶向EBV (Epstein-Barr virus) 病毒抗原,至少有一半受试者的肿瘤发生消退或坏死,其原因很可能是病毒抗原提供了额外的共刺激信号,提高了CAR-T的体内存活能力。因此,在设计CAR-T结构时,应针对实体瘤的特点进行调整,如与溶瘤病毒载体结合[13],既可以提高CAR-T的迁移和生存能力,又可以直接裂解肿瘤细胞,从而改善对实体瘤的疗效。
CAR-T在体内增殖和持续存活的能力,是影响其临床疗效的关键因素。虽然给予的CAR-T细胞剂量不尽相同,但肿瘤完全缓解的肿瘤患者,其输入的抗CD19 CAR-T必须要在体内持续超过6个月[14, 15]。另外,肿瘤微环境中的许多因素也可影响CAR-T的疗效。肿瘤微环境由肿瘤细胞、血管和免疫细胞组成,其特征是形成了一个免疫抑制环境,其中可以促进DC功能、促进肿瘤抗原与表达呈递的分子缺乏,造成T细胞活化不足,甚至引起T细胞耐受。此外,肿瘤微环境中还存在大量的调节性T细胞 (regulatory T cell,TReg),减弱了肿瘤特异性T细胞的杀伤活性。
3 CAR-T治疗的不良反应随着CAR-T的体内扩增性能和抗肿瘤活性的提高,新型CAR-T在临床应用时也导致了一系列的不良反应,如细胞因子风暴 (严重细胞因子释放综合征)、靶点毒性和肿瘤溶解综合征等。
3.1 细胞因子风暴临床研究表明,CAR-T通过诱导肿瘤细胞裂解,以传统免疫疗法无可比拟的速度有效清除肿瘤细胞。与此同时,CAR-T的大量快速输注,经常导致患者出现发烧、恶心、头痛、心动过速、低血压、缺氧以及心脏或神经系统症状等严重不良 反应。这些不良反应发生的原因,是由于免疫系统迅速激活造成炎性细胞因子的大量释放,即细胞因子风暴。这些炎性细胞因子包括白细胞介素-6 (interleukin-6,IL-6)、IL-10和干扰素-γ (interferon-γ,IFN-γ) 等。IL-6是由单核细胞和巨噬细胞等产生的,具有促进中性粒细胞转运和急性炎性反应等多种功能的细胞因子。IL-6的显著增加可能是由于巨噬细胞活化综合征引起,在给予IL-6受体拮抗剂blinatumomab后,患者毒性反应明显缓解[16]。IL-10是参与天然免疫及细胞免疫反应的免疫调剂细胞因子。IFN-γ由细胞毒性T淋巴细胞 (cytotoxic T lymphocyte,CTL) 和辅助T细胞 (helper T cell 1,TH1) 等产生,具有促进巨噬细胞活化、TH1分化等功能,其高水平表达正是CAR-T强大效应的体现。
目前已从临床应用角度提出几种不同的医疗方案,以减少危及生命的细胞因子风暴的危险。其中预防性措施包括降低CAR-T的初始剂量,并从低到高逐渐增加[17]; 在输注CAR-T后严格监控关键参数,早期检测预示风险的迹象[18]; 治疗性干预措施包括应用IL-6受体拮抗剂和糖皮质激素[19]。虽然这些措施非常有效,细胞因子风暴仍然是CAR-T治疗的严重安全问题。
3.2 靶点毒性在CAR-T治疗过程中,因某些正常组织也表达靶抗原而引起的免疫毒性反应,被称为靶点毒性 (on-target off-tumor toxicity)。CAR-T所出现的靶点毒性,首先发现于以碳酸酐酶IX为靶抗原的转移性肾细胞癌的治疗,表现为肝酶升高[20],其原因是胆管上皮细胞也表达低水平的碳酸酐酶IX。抗CD19 CAR-T是治疗B细胞恶性肿瘤最有效的免疫疗法,但因正常B细胞也表达CD19,所有经CAR-T治疗的患者也不可避免地发生了B细胞再生障碍,万幸的是患者可以通过注射丙种球蛋白缓解 B细胞再生障碍引起的症状[21]。对于其他类型的肿 瘤患者,靶点毒性可能会非常严重,甚至引起死亡。如结肠癌患者在注射靶向肿瘤抗原HER2 (human EGF receptor related gene 2) 的CAR-T后,由于肺上皮细胞也表达低水平的HER2,结果引起致命的肺毒性[22]。因此,在开发靶向肿瘤相关抗原的CAR-T时,一定要详细分析该抗原在正常组织的表达情况,避免引起严重的不良反应。另外,一定要通过适当的动物模型进行临床前毒性研究,尽量避免致命性靶点毒性的发生。
3.3 肿瘤溶解综合征经CD19 CAR-T治疗的患者,还会发生肿瘤溶解综合征 (tumor lysis syndrome,TLS)[14, 15]。TLS是因恶性肿瘤细胞裂解,细胞内代谢物快速释放所引起的代谢异常,也是血液系统恶性肿瘤经细胞毒药物治疗后最常见的不良反应[23]。发生TLS后,可采用标准的治疗方案,如别嘌呤醇和拉布立酶等药物进行治疗[24]。
3.4 插入突变毒性到目前为止,构建CAR-T最有效的转导载体是γ逆转录病毒载体和慢病毒载体。这两种载体介导的CAR-T表达水平高且稳定。虽然CAR-T的临床应用尚未发现致癌突变,但在过去由 γ逆转录病毒载体介导的造血干细胞基因治疗中,因载体与基因组整合曾导致患者发生白血病,甚至死亡的事件[25],仍然提醒研究者应警惕该类病毒载体插入突变的毒性风险。
4降低CAR-T毒性反应的对策 4.1 自杀基因开关系统在发生细胞因子风暴等致命性不良反应后,最直接、最便捷的策略是迅速清除输注的CAR-T。在CAR-T中预先设置自杀基因开关系统,必要时通过毒性小且药物动力学特点理想的小分子诱导物启动自杀程序,迅速消除风险,是最理想的对策。单纯疱疹病毒−胸苷激酶 (herpes simplex virus-thymidine kinase,HSV-TK) 系统是最经典的自杀基因开关,已应用于细胞治疗[26]。TK可将自杀基因诱导物更昔洛韦转化为三磷酸物,从而导致CAR-T因无法进行DNA复制而凋亡。该系统最大的缺陷是诱导细胞凋亡的时间太长 (3天)。其次,HSV-TK的表达产物还具有免疫源性风险。
另一种自杀基因开关系统由可诱导性凋亡酶9 (inducible caspase 9,iCasp9) 及小分子配体AP1903构成。iCasp9基因由人凋亡酶9及人FK506结合蛋白的部分基因融合而成,AP1903促使iCasp9二聚体化,从而激活下游的凋亡酶3,导致细胞凋亡。该系统的优点在于起效迅速,患者单次注射小分子配体30 min后,体内转基因T细胞即迅速减少90%,而内源性T细胞数目不受影响[27]。GD2是神经外胚层起源的肿瘤细胞中表达上调的表面抗原。基于iCasp9系统设计的、以GD2为靶点的第三代CAR-T,正在应用于晚期黑色素瘤和神经母细胞瘤的Ⅰ期临床 试验[28]。
4.2 组合靶向系统采用组合靶向系统修饰的T细胞,具有靶向不同抗原的两种CAR。两种CAR分别负责抗原识别和共刺激信号,因此为降低靶点毒性、提高肿瘤细胞特异性提供了可能。第一种组合靶向 系统采用激活和抑制性CAR实现肿瘤的选择性 (图 2A)。在这种情况下,激活性CAR的靶分子在肿瘤细胞和一些正常细胞均表达,而抑 制性CAR的靶分子只在正常细胞表达。抑制性CAR的胞内域采用来自细胞毒T淋巴细胞相关抗原4 (cytotoxic T lymphocyte- associated antigen-4,CTLA-4) 或程序性死亡分子1 (programmed death 1,PD-1) 的胞内域部分。因CTLA-4和PD-1均为免疫抑制受体,当正常细胞表达的靶分子与抑制性CAR结合后,会抑制CAR-T活性,从而避免对正常组织造成损伤[29]。而当回到肿瘤微环境后,因抑制信号解除,该类CAR-T又可以恢复对肿瘤细胞的杀伤活性。在今后临床实践中应用该系统的关键,在于找到一种在肿瘤细胞不表达或低表达,但在正常组织中高表达的靶点。第二种组合靶向系统所选用的靶分子都是肿瘤细胞表面抗原,其完全激活需要两种靶分子的共同参与 (图 2B)。所以对仅表达一种靶抗原分子的正常细胞,靶点毒性风险大大降低[30, 31]。在构建该组合靶向系统时,其中一个CAR的胞外域由亲和力较低的scFv构成,或其胞内域由突变的低活性CD3ζ构成,因此,单一靶抗原不足以完全激活T细胞; 另一个CAR的胞内域仅由共刺激信号分子构成。两种靶抗原共同参与时,CAR-T才能完全激活,并具备肿瘤细胞毒性。

|
Figure 2 Strategies to overcome the toxicities of CAR-T cells. A: Combinatorial target-antigen recognition,with one inhibitory CAR-triggered by an antigen expressed on normal cells. B: Combinatorial target-antigen recognition,with two CAR triggered by different antigens coexpressed on malignant cells. TAA,tumor-associated antigen; NTA,normal tissue antigen |
在发生严重不良反应时,自杀基因开关系统可以终止CAR-T治疗。但其缺点是调节 速度不够快,不能迅速抑制细胞因子风暴引起的不良反应,并且终止后CAR-T的活性不可逆转。
Wu等[32]最近报道了一种用于控制CAR-T活性的正调控策略,在小分子配体的作用下,这种正调控系统 (ON开关),可以逐步提高CAR-T活性至适当的治疗水平。如果与小分子配体的局部释药和控制释药技术相结合,就可以从时间和空间上控制CAR-T的激活,从而防止CAR-T的毒副反应。采用ON开关有利于防止大量输注CAR-T的首过性毒副反应。这种ON开关CAR的结构,与第二和三代CAR基本类似,但其胞内域部分将CD3ζ与共刺激分子分割开来。只有在小分子配体的桥连作用下,CD3ζ才与共刺激分子偶联,此时肿瘤抗原才能有效激活CAR-T活性 (图 3)。该正调控系统具有以下特点: ① CAR-T的激活需要同时识别特定的肿瘤抗原和小分子配体。② CAR-T的活性可以通过小分子浓度调节。③ CAR-T的活性可以通过添加或去除小分子可逆控制。
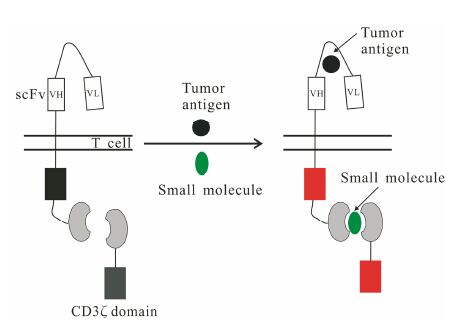
|
Figure 3 ON-switch CAR system. This system contains two physically separate parts that can be conditionally re-assembled when a heterodimerizing small molecule agent is present. The CAR-T cell activation requires both antigen and small molecule |
常用的非病毒载体因不能与染色体整合[33],所介导的基因表达时间往往比较短,这一特点为克服CAR-T的靶点毒性提供了可能。CAR-T在患者体内长期维持高活性[20],可能是引起靶点毒性的重要原因。间皮素是一种肿瘤相关抗原,主要在大多数恶性胸膜间皮瘤 (如胰腺癌、卵巢癌和肺癌) 高表达,但在正常腹膜、胸膜和心包间皮表面也有低水平表达。所以以间皮素为靶点的免疫治疗,经常会发生靶点毒性。Beatty等[8]使用电穿孔技术,将可介导抗间皮素CAR mRNA表达的非病毒载体,经电穿孔转染T细胞得到CARTmeso细胞。CARTmeso细胞经静脉注射后,可以迁移至肿瘤的原发及转移区域,并有效激活抗肿瘤免疫反应。可喜的是治疗过程中未发现不良反应。
CAR经非病毒载体传导T细胞后,基因表达时间很短,患者需要多次输注CAR-T。睡美人 (sleeping beauty,SB) 转座子系统是一种非病毒载体系统,可以将转基因整合至细胞基因组而实现长期表达。该 系统的转座酶可特异性切割转座子侧翼的特定序 列,即含直接重复序列的短反向重复序列 (inverted repeat containing direct repeated sequences,IR/DR),切割后的转座子通过“剪切和粘贴”模式,整合进细胞基因组的TA二核苷酸位点。因SB系统的基因组整合很少发生在转录子中间或附近,所以发生插入突变毒性的风险大大降低[34]。目前,采用SB系统转染的抗CD19 CAR-T已用于晚期白血病的临床研究[35]。
以上策略为避免在临床应用CAR-T时出现毒副反应提供了可能,但每种设计思路又具有各自的局限性 (表 1),所以还应根据临床需要灵活采用。
|
|
Table 1 Strategies to overcome toxicities of CAR-T cell therapy |
CAR-T在肿瘤免疫治疗领域疗效确切,可能是肿瘤最有前景的治疗方式,社会和经济效益潜力巨大,不仅是学界的研究热点,也日益成为医药产业追逐的目标。最近美国诺华公司开发的CAR-T产品CTL019获得FDA突破性药物认证,已经进入快速审查通道,并有可能会在近期获得批准。FDA也发布了“细胞和基因治疗早期临床试验设计的产业界指南”,表明CAR-T研究已经从实验室转移至产业化领域。
但目前的CAR-T治疗,基本上还限于个体化治疗,必须为每位患者量身定做。这样的医药产品,无论是生产技术,还是质量控制以及治疗成本等均存在很大问题。如果能成功开发各种肿瘤都通用的CAR-T,则有可能实现批量生产,有利于质量控制和降低成本,真正将CAR-T转变为药品。从CAR-T的结构进行分析,其胞外结构域的功能主要是识别靶抗原,而各类同代CAR-T间的差异也主要是胞外结构域。如果借鉴抗体偶联药物的思路[36],以单克隆抗体代为执行靶抗原识别功能,即CAR-T与药品化的单克隆抗体合用,则完全可以实现通用化。最简单的设计思路是将CAR的胞外结构域更换为亲和素蛋白 (图 4A),在临床应用前只需根据肿瘤类型,选择生物素化的单克隆抗体与CAR-T一起注射即可[37]。也可以将 CAR的胞外结构域设计为抗FITC特异性的scFv (图 4B),使用时与FITC标记的单克隆抗体结合即可[38]。Kudo等[39]将自然杀伤细胞表达的Fc受体CD16作为CAR的胞外结构域,因CD16与人源化抗体具有很强的结合力,人源化抗体与CAR-T的结合,可以激活T细胞活性,并促进其持续增殖。
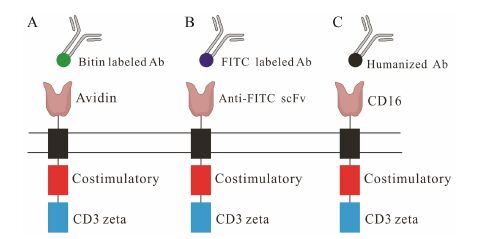
|
Figure 4 Schematic structure of universal CAR,which utilize biotin (A),or anti-FITC scFv (B),or CD16 (C) as ectodomain |
CAR-T如果要成为药品,还必须明确其活性成分构成。对于CAR-T,其活性取决于多种因素,如转基因载体、CAR的构成和T细胞类型等,但最终发挥抗肿瘤作用的活性成分,还应落实到可有效表达CAR的T细胞 (CAR+T)。在CAR+T细胞中,效应T细胞(effector T cell,Teff) 是有效的抗肿瘤效应细胞[40],但Teff在移植到体内后,其增殖能力和持久性均有限,所以作为活性成分进行质量评价可能不合适。记忆T细胞 (memory T cell,Tm) 可能是作为其活性成分的最佳选择,因这类T细胞亚群可以在体内长期存活,且在经历抗原刺激后大量扩增。Tm又可以进一步分为中央记忆T细胞和效应记忆T细胞,中央记忆T细胞和效应记忆T细胞的比例,是决定Tm体内寿命以及能否快速有效地响应抗原刺激的重要因素[41]。因此,CAR-T中各种T细胞的数量及比例,应当成为评价CAR-T药品质量的重要指标。
基于CAR-T的肿瘤细胞免疫治疗已经成为医药行业的重点发展方向。随着转基因载体、基因编辑技术和T细胞培养及诱导分化技术的突破,CAR-T药品一定会成为肿瘤治疗的主力军。
| [1] | Cheng M, Chen Y, Xiao W, et al. NK cell-based immunotherapy for malignant diseases[J]. Cell Mol Immunol, 2013, 10:230-252. |
| [2] | Vacchelli E, Vitale I, Eggermont A, et al. Trial watch:dendritic cell-based interventions for cancer therapy[J]. Oncoimmunology, 2013, 2:e25771. |
| [3] | Maus MV, Grupp SA, Porter DL, et al. Antibody-modified T cells:CARs take the seat for hematologic malignancies[J]. Blood, 2014, 123:2625-2635. |
| [4] | Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy[J]. Science, 2013, 342:1432-1433. |
| [5] | Savoldo B, Ramos CA, Liu E, et al. CD28 costimulation improves expansion and persistence of chimeric antigen receptor-modified T cells in lymphoma patients[J]. J Clin Invest, 2011, 121:1822-1826. |
| [6] | Lee DW, Kochenderfer JN, Stetler-Stevenson M, et al. T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults:a phase 1 dose-escalation trial[J]. Lancet, 2015, 385:517-528. |
| [7] | Maude SL, Frey N, Shaw PA, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia[J]. N Engl J Med, 2014, 371:1507-1517. |
| [8] | Beatty GL, Haas AR, Maus MV, et al. Mesothelin-specific chimeric antigen receptor mRNA-engineered T cells induce anti-tumor activity in solid malignancies[J]. Cancer Immunol Res, 2014, 2:112-120. |
| [9] | Maus MV, Haas AR, Beatty GL, et al. T cells expressing chimeric antigen receptors can cause anaphylaxis in humans[J]. Cancer Immunol Res, 2013, 1:26-31. |
| [10] | Park JR, Digiusto DL, Slovak M, et al. Adoptive transfer of chimeric antigen receptor re-directed cytolytic T lymphocyte clones in patients with neuroblastoma[J]. Mol Ther, 2007, 15:825-833. |
| [11] | Kershaw MH, Westwood JA, Parker LL, et al. A phase I study on adoptive immunotherapy using gene-modified T cells for ovarian cancer[J]. Clin Cancer Res, 2006, 12:6106-6115. |
| [12] | Pule MA, Savoldo B, Myers GD, et al. Virus-specific T cells engineered to coexpress tumor-specific receptors:persistence and antitumor activity in individuals with neuroblastoma[J]. Nat Med, 2008, 14:1264-1270. |
| [13] | Nishio N, Diaconu I, Liu H, et al. Armed oncolytic virus enhances immune functions of chimeric antigen receptormodified T cells in solid tumors[J]. Cancer Res, 2014, 74:5195-5205. |
| [14] | Kalos M, Levine BL, Porter DL, et al. T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia[J]. Sci Transl Med, 2011, 3:95ra73. |
| [15] | Porter DL, Levine BL, Kalos M, et al. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia[J]. N Engl J Med, 2011, 365:725-733. |
| [16] | Teachey DT, Rheingold SR, Maude SL, et al. Cytokine release syndrome after blinatumomab treatment related to abnormal macrophage activation and ameliorated with cytokinedirected therapy[J]. Blood, 2013, 121:5154-5157. |
| [17] | Ertl HC, Zaia J, Rosenberg SA, et al. Considerations for the clinical application of chimeric antigen receptor T cells:observations from a recombinant DNA Advisory Committee Symposium held June 15, 2010[J]. Cancer Res, 2011, 71:3175-3181. |
| [18] | Davila ML, Riviere I, Wang X, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J]. Sci Transl Med, 2014, 6:224ra25. |
| [19] | Barrett DM, Teachey DT, Grupp SA. Toxicity management for patients receiving novel T-cell engaging therapies[J]. Curr Opin Pediatr, 2014, 26:43-49. |
| [20] | Lamers CH, Sleijfer S, Vulto AG, et al. Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydrase IX:first clinical experience[J]. J Clin Oncol, 2006, 24:e20-e22. |
| [21] | Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J]. N Engl J Med, 2013, 368:1509-1518. |
| [22] | Morgan RA, Yang JC, Kitano M, et al. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2[J]. Mol Ther, 2010, 18:843-851. |
| [23] | Choi KA, Lee JE, Kim YG, et al. Efficacy of continuous venovenous hemofiltration with chemotherapy in patients with Burkitt lymphoma and leukemia at high risk of tumor lysis syndrome[J]. Ann Hematol, 2009, 88:639-645. |
| [24] | Cairo MS, Coiffier B, Reiter A, et al. Recommendations for the evaluation of risk and prophylaxis of tumour lysis syndrome (TLS) in adults and children with malignant diseases:an expert TLS panel consensus[J]. Br J Haematol, 2010, 149:578-586. |
| [25] | Hacein-Bey-Abina S, Garrigue A, Wang GP, et al. Insertional oncogenesis in 4 patients after retrovirus-mediated gene therapy of SCID-X1[J]. J Clin Invest, 2008, 118:3132-3142. |
| [26] | Oliveira G, Greco R, Lupo-Stanghellini MT, et al. Use of TK-cells in haploidentical hematopoietic stem cell transplantation[J]. Curr Opin Hematol, 2012, 19:427-433. |
| [27] | Di Stasi A, Tey SK, Dotti G, et al. Inducible apoptosis as a safety switch for adoptive cell therapy[J]. N Engl J Med, 2011, 365:1673-1683. |
| [28] | Gargett T, Brown MP. The inducible caspase-9 suicide gene system as a "safety switch" to limit on-target, off-tumor toxicities of chimeric antigen receptor T cells[J]. Front Pharmacol, 2014, 28:235. |
| [29] | Fedorov VD, Themeli M, Sadelian M. PD-1- and CTLA-4-basd inhibitory chimeric antigen receptors (iCARs) divert off-target immunotherapy responses[J]. Sci Transl Med, 2013, 5:215ra172. |
| [30] | Kloss CC, Condomines M, Cartellieri M, et al. Combinatorial antigen recognition with balanced signaling promotes selective tumor eradication by engineered T cells[J]. Nat Biotechnol, 2013, 31:71-75. |
| [31] | Lanitis E, Poussin M, Klattenhoff AW, et al. Chimeric antigen receptor T cells with dissociated signaling domains exhibit focused antitumor activity with reduced potential for toxicity in vivo[J]. Cancer Immunol Res, 2013, 1:43-53. |
| [32] | Wu CY, Roybal KT, Puchner EM, et al. Remote control of therapeutic T cells through a small molecule-gated chimeric receptor[J]. Science, 2015, 350:aab4077. |
| [33] | Yang FF, Huang W, Li YF, et al. Current status of non-viral vectors for siRNA delivery[J]. Acta Pharm Sin (药学学报), 2011, 46:1436-1443. |
| [34] | Hackeet PB, Largaespada DA, Switzer KC, et al. Evaluating risks of insertional mutagenesis by DNA transposons in gene therapy[J]. Transl Res, 2013, 161:265-283. |
| [35] | Kebriaei P, Huls H, Jena B, et al. Infusing CD19-directed T cells to augment disease control in patients undergoing autologous hematopoietic stem-cell transplantation for advanced B-lymphoid malignancies[J]. Hum Gene Ther, 2012, 23:444-450. |
| [36] | Guo JJ, Gao R, Quan TF, et al. Progress on pharmacokinetic study of antibody-drug conjugates[J]. Acta Pharm Sin (药学学报), 2015, 50:1203-1209. |
| [37] | Urbanska K, Lanitis E, Poussin M, et al. A universal strategy for adoptive immunotherapy of cancer through use of a novel T-cell antigen receptor[J]. Cancer Res, 2012, 72:1844-1852. |
| [38] | Tamada K, Geng D, Sakoda Y, et al. Redirecting genemodified T cells toward various cancer types using tagged antibodies[J]. Clin Cancer Res, 2012, 18:6436-6445. |
| [39] | Kudo K, Imai C, Lorenzini P, et al. T lymphocytes expressing a CD16 signaling receptor exert antibody-dependent cancer cell killing[J]. Cancer Res, 2014, 74:93-103. |
| [40] | Perret R, Ronchese F. Memory T cells in cancer immuotherapy:which CD8 T-cell population provides the best protection against tumours?[J]. Tissue Antigens, 2008, 72:187-194. |
| [41] | Gebhardt T, Mueller SN, Heath WR, et al. Peripheral tissue surveillance and residency by memory T cells[J]. Trends Immunol, 2013, 34:27-32. |
 2016, Vol. 51
2016, Vol. 51


