阿尔兹海默病 (Alzheimer’s disease,AD) 是一种神经退行性疾病,早期表现为隐匿性认知功能减退,在5~10年内发展成严重的记忆丧失、行为和人格改变、语言障碍,导致独立生活能力的丧失[1]。研究发现,随着年龄的增长,AD的发病率以指数增长的方式骤增[2]。如今伴随全球人口老龄化的步伐加快,AD已成为继心脏病、癌症以及脑卒中之后导致人类死亡的主要疾病[3]。
AD的主要特征有β-淀粉样蛋白 (Aβ) 斑块形成、神经纤维缠结和神经元缺失[4]。已有大量文献证实海马区及其周围结构是β-淀粉样蛋白最早形成的区 域[5],β-淀粉样蛋白的沉积能导致突触功能失活和成熟神经元凋亡,是AD发病的重要原因[6]。另外,海马区神经元进行性丢失是AD 的认知和记忆损害的基础[7],这会导致AD患者最典型的临床表现——记忆力的进行性减退[8]。仅仅针对Aβ沉积和神经纤维缠结的药物只能减缓AD的发病进程,而克服海马区神经元缺失则可能成为逆转AD病程的一种有效手段。
成体神经发生是指成年大脑中新神经元形成的过程。在成年哺乳动物大脑中,神经发生的两个区域是前脑侧脑室内侧壁的室下区 (subventricular zone,SVZ) 和海马齿状回的颗粒细胞下层 (subgranular zone,SGZ),后者新生成的神经元迁移至海马齿状回的颗粒细胞层,分化成熟并整合到神经环路中形成具有功能活性的新神经元,此过程即海马神经发生,包括4个阶段: SGZ区神经干细胞增殖、新神经细胞产生并迁移至齿状回的颗粒细胞层、分化为成熟神经元、整合到神经环路中[9, 10]。而促成体神经发生,则是指能够使成年大脑形成新神经元的过程。
目前,临床上对于阿尔兹海默病的治疗用药主要针对Aβ和神经纤维缠结两个方面,而针对神经元缺失的用药迄今仍处于研发阶段。在传统观念中,中枢神经系统神经元缺乏再生能力,但随着神经干细胞研究的逐渐深入,人们发现,当体内的激素水平发生变化或受到外伤时,单个神经元或神经网络组织会发生变化,有可能会引起神经发生。在成年后,中枢神经系统内以神经干细胞为基础在适宜环境下产生新生神经元,这些新生神经细胞替换衰老死亡的神经细胞,在某种意义上可实现大脑的可塑性[11],即成体神经发生。5-溴脱氧尿嘧啶核苷 (BrdU) 的应用是这一领域革命性的突破,采用BrdU标记的方法,可以发现成年海马齿状回中的神经发生,从而打破了“神经发生仅存在于胚胎中”的传统观念[12]。随着BrdU的应用,在20世纪末期,包括人类在内的所有哺乳动物的成体神经发生现象均已被证实[13]。海马区具有学习、记忆和认知调节功能,与阿尔兹海默病密切相关。海马区具有成体神经发生的潜能,该区域的神经发生有望实现该脑区的重塑,进而从根本上逆转阿尔兹海默病的病程,为阿尔兹海默病等神经退行性疾病的治疗开拓新领域。
BrdU是一个胸腺嘧啶类似物,能整合到处于细胞分裂周期S期的DNA双链中,并可通过免疫组化荧光染色,检测标记细胞在体内的变化,BrdU阳性细胞可被看作是具有增殖活性的细胞,是神经干细胞研究中最常用的标记物[14]。因此,在研究化合物是否具有促神经发生作用时,通常在对正常成年大鼠腹腔注射给药后,用BrdU对分裂细胞进行标记,从而观察化合物对海马区神经细胞增殖和分化的作用。明确增殖细胞的种类还需进一步采用其他标记物,如神经元特异的核蛋白抗体(neuron-special nuclear protein,NeuN)[15]、未成熟神经元的蛋白抗体 (doublecortin,DCX)[16]等,将神经细胞与其他细胞例如胶质细胞区分开来。
海马区以其独特而重要的生理功能成为神经科学界研究的焦点,促海马区神经发生的药物研究也逐步深入。在早期的研究中,生物学家为探究海马区神经发生的机制,将从传统医药和食物中提取的混合物或纯化后所得的化合物用于活性研究。随着药物化学家的加入,更多的化合物被合成并应用于海马区神经发生的研究中。天然化合物的发现为药物化学家提供了具有开发潜力的先导化合物,而以先导化合物为基础的合理的类药结构修饰与改造,不仅增加了生物学家可用于探索机制的化合物数量,而且也大大缩小了用于活性筛选的化合物范围。
本文总结了近年来发现的具有促海马区神经发生作用的药物,根据药物的组分和来源,将其分为提取所得的混合物、天然化合物及人工合成的化合物3类,通过比较不同混合物或化合物的给药途径、给药剂量和给药时间,为促海马区神经发生药物提供构效关系研究的依据。对于这3种不同组分和来源的药物,其优缺点见表 1。
|
|
Table 1 The advantages and disadvantages of different drugs |
对于促成体神经发生的研究,早期主要是通过从植物中提取有效成分。此类药物主要有银杏叶提 取物、香蜂叶提取物、南瓜提取物、大枣提取物和山茱萸环烯醚萜苷。
其中,银杏叶提取物 (Ginkgo biloba extract,Egb761) 是从银杏的叶子中提取的有效成分,主要含有24% 黄酮苷类和6% 萜烯酯类,还含有多酚类、生物碱、长链醇、酮类及微量元素等化学成分[17],黄酮苷主要是山柰酚及槲皮素的葡萄鼠李糖苷,萜烯酯主要是银杏内酯和白果内酯。香蜂叶提取物是从香蜂草的叶子中用乙醇提取出来的混合物。南瓜提取物是从南瓜的果实中,用70% 的乙醇提取出来的混合物。大枣提取物是用甲醇从大枣中提取出的混合物。山茱萸环烯醚萜苷是山茱萸的主要有效成分之一,主要成分为马钱素与莫诺苷[18]。提取所得的混合物的最新研究进展见表 2 [19, 20, 21, 22, 23] 。
|
|
Table 2 The effection of mixtures of extraction to hippocampal neurogenesis |
姜黄素 (curcumin) 是从姜科和天南星科中一些植物的根茎中提取的一种酮类化合物[24]。姜黄素是一个对称的分子,含有2个酚羟基、2个α,β-不饱和酮和1个活泼亚甲基 (图 1)。
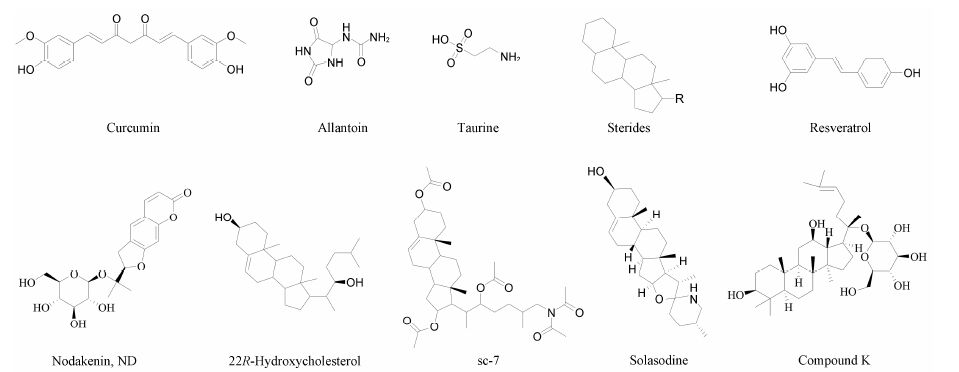
|
Figure 1 Natural compounds in promotion of neurogenesis in adult hippocampal area |
姜黄素脂溶性好,能透过血脑屏障,具有很强的抗氧化活性,可以减缓AD的发展进程,同时低剂量的姜黄素能够有效分解Aβ,也可直接与Aβ蛋白结合并阻止其聚集和纤维的形成[25]。Dong等[26]对15月龄的成年雄性SD大鼠以口服的方式进行给药,给药剂量为480 mg·kg−1。在海马区神经细胞增殖方面,对于给药时长为6周的大鼠,其海马区BrdU阳性细胞的数量与未给药组没有明显差别; 而给药12周的大鼠,其BrdU阳性细胞的数量明显增多。但在行为学实验方面,给药6周与12周的大鼠,其空间学习与记忆能力均有明显改善。
2.2 尿囊素尿囊素 (allantoin) 又名脲基醋酸内酰胺、脲基海因和脲咪唑二酮,是一种乙内酰脲衍生物 (图 1)。尿囊素广泛存在于烟草种子、甜菜和小麦芽等植物中,具有促进细胞生长的功能,是皮肤创伤的良好愈合剂和抗溃疡药剂。
为研究尿囊素对于改善认知水平的影响,Ahn等[27]对6周龄雄性ICR小鼠进行口服给药,给药剂量为 1、3和10 mg·kg−1,给药时间为7天。通过行为学实验来观察尿囊素对于增强小鼠记忆力方面的作用,发现给药量为10 mg·kg−1的小鼠记忆力比未给药组有较大的提高。同时,通过观察小鼠海马区齿状回细胞的增殖及分化状况,发现尿囊素具有促神经发生的作用。
2.3 牛磺酸牛磺酸 (taurine) 又称β-氨基乙磺酸 (图 1),是体内存在的一种游离的非蛋白氨基酸,具有抗炎性质。
在年轻的大脑中,牛磺酸的含量十分丰富,随着年龄的增长,牛磺酸浓度的降低会导致神经发生的减少。Gebara等[28]对牛磺酸在海马区神经发生方面的影响进行了评估,结果显示,牛磺酸可以激活干细胞从而增强海马区齿状回的细胞增殖; 此外,牛磺酸还可以提高新生神经元的存活率。
2.4 紫花前胡苷紫花前胡苷 (nodakenin,ND) 是传统中药狭叶羌活和宽叶羌活的主要化学成分之一 (图 1),广泛分布在前胡属药用植物中,尤以紫花前胡中含量最高。ND具有明显的抗血小板聚集和镇痛作用,同时还具有改善学习记忆障碍的功能[29]。
Gao等[30]对5周龄小鼠进行口服给药14天,观察其海马齿状回BrdU阳性细胞数目,发现紫花前胡苷能够大大增加BrdU阳性细胞数目。
2.5 白藜芦醇白藜芦醇 (resveratro1) 又称芪三酚,是一种存在于葡萄 (红葡萄酒)、虎杖、花生和桑葚等植物中的天然多酚类化合物 (图 1)。
衰老的海马区最显著的结构性变化有: 神经发生大量减少、微脉管系统衰退、星形胶质细胞过度肥大和小胶质细胞激活。白藜芦醇具有促血管生成和抗炎的特性,使其成为缓解这些症状的理想药物。因此,Kodali等[31]研究了白藜芦醇对于记忆力下降、情绪紊乱等症状的影响,这些症状均与海马区受损相关。通过研究发现,白藜芦醇能够促进神经发生和微脉管系统形成,减缓小胶质细胞的激活和星形胶质细胞的过度肥大。
2.6 甾体化合物甾体化合物是以甾体母核 (环戊烷并多氢菲,图 1) 衍生的一类化合物的总称。
22R-羟基胆甾醇 (22R-hydroxycholesterol) 是类固醇的中间体 (图 1),它是细胞色素P450侧链裂解酶的底物。与正常人相比,阿尔兹海默病患者海马区和额叶皮质处的22R-羟基胆甾醇数量明显降低。22R-羟基胆甾醇能够与Aβ结合生成对神经元无毒的22R-羟基胆甾醇/Aβ复合物,通过这种方式钝化Aβ的毒性,从而发挥其神经保护作用[32]。同时,22R-羟基胆甾醇能够诱导神经祖细胞分化为神经元[33]。这些特性使得22R-羟基胆甾醇在阿尔兹海默病的治疗方面具有很好的应用前景。但是,22R-羟基胆甾醇具有类固醇前体的特性,不能作为药物使用。
将22R-羟基胆甾醇作为一个子结构在天然化合物中进行筛选,Lecanu等[34]通过体外细胞实验和小鼠体内实验验证,sc-7和茄解定 (solasodine) (图 1) 具有诱导神经干细胞分化和促神经发生作用。sc-7不与类固醇的受体结合,从而不能发挥类固醇前体特性,且不能被类固醇代谢酶分解。人参皂苷Compound K (图 1) 在天然的人参中并不存在,是二醇型人参皂苷在人体肠道内的主要代谢产物和最终吸收形式。近年来诸多研究表明,人参的许多生物学活性是由该化合物引 起的[35]。当对8周龄的小鼠注射环磷酰胺 (可造成神经损伤的抗癌药物) 时,同时注射人参皂苷Compound K的小鼠能够大大减少环磷酰胺对海马区成体神经发生的损伤[36]。
3 合成化合物 3.1 氨丙基咔唑类Pieper等[37]通过计算从200 000个类药化合物中筛选出1 000个小分子化合物,并随机分成10组,用微型渗透泵对小鼠左侧脑室进行注射,检测其生物活性。结果发现,化合物P7C3 (图 2) 能够促进成年小鼠海马齿状回的神经发生,并减少神经元死亡。在后续的研究中[38],合成了一系列P7C3类似物,阐释氨丙基咔唑类化合物在促海马神经发生方面的构效关系,寻找可口服、无毒,能够通过血脑屏障且在动物体内代谢稳定的化合物。
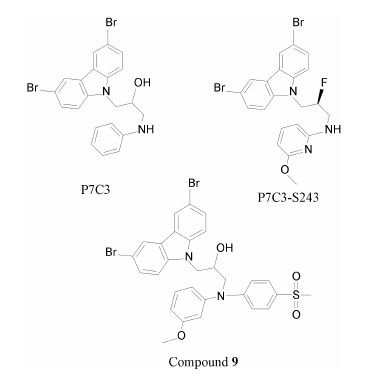
|
Figure 2 Synthesis compounds in promotion of neurogenesis in adult hippocampal area |
经筛选,发现化合物P7C3-S243 (图 2) 比P7C3具有更好的类药性质,口服生物利用度高、代谢稳定且能够通过血脑屏障,可作为研究神经退行性疾病的理想先导化合物[39]。随后,Yoon等[40]合成一系列氨丙基咔唑类似物,并在培养的神经干细胞中测试其生物活性,发现Compound 9 (图 2) 具有促神经发生和神经保护的作用,且毒性较小,也可以作为一个新的先导化合物。
3.2 松香烃与褪黑素结合产物松香烃 (pinoline) 与褪黑素 (melatonin) 是5-羟色胺 (5-hydroxytryptamine,serotonin) 在分子结构上的类似物(图 3)。5-羟色胺 广泛存在于哺乳动物组织中,特别在大脑皮层及神经突触内含量很高,它是一种抑制性神经递质。
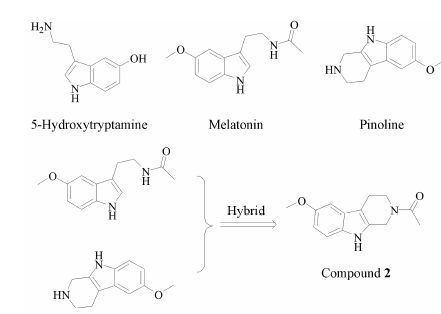
|
Figure 3 Pinoline,melatonin,and the hybrid |
de la Fuente Revenga等[41]设计合成了一系列由松香烃与褪黑素杂交所得的化合物 (图 3)。通过测试其抗氧化能力、体外血脑屏障渗透性和神经源性研究,筛选出Compound 2。Compound 2能够在体外细胞中激发早期神经发生并促进神经元成熟。
3.3 沙利度胺类似物沙利度胺 (thalidomide) 又称反应停,对减轻妇女怀孕早期出现的恶心、呕吐等反应有效,但是该药具有强致畸作用,导致新生儿先天四肢残缺。
Russo等[42]研究了沙利度胺的类似物3,6'-二硫 代沙利度胺 (3,6'-dithiothalidomide,图 4) 对于海马区神经祖细胞增殖、海马区神经发生以及记忆力的 影响。他们通过向大鼠脑内注射Aβ蛋白,造成大鼠神经祖细胞增殖和记忆力损伤。注射Aβ蛋白后,Aβ蛋白诱发神经炎症,从而导致海马区神经发生。虽然3,6'-二硫代沙利度胺使新生神经元细胞减少,但是注射过3,6'-二硫代沙利度胺的大鼠能够减弱由于小胶质细胞激活和神经炎症导致的记忆损伤。
3.4 黄酮类7,8-二羟基黄酮 (7,8-dihydroxyflavone) 是一种原肌球蛋白受体激酶B (tropomyosin-receptor- kinase B,TrkB) 的激动剂。为研究二氢黄酮类化合物在TrkB激动作用方面的构效关系,合成了一系列该化合物的衍生物。经比较,发现4'-二甲氨基-7,8-二羟基黄酮(4'-dimethylamino-7,8-dihydroxyflavone) (图 4) 在TrkB激动作用方面比7,8-二羟基黄酮具有更好的效果,对原肌球蛋白受体激酶B具有更强的激动作用且作用时间更长[43]。更重要的是,长期口服4'-二甲氨基-7,8-二羟基黄酮后,其海马齿状回的神经发生显著增强[43]。
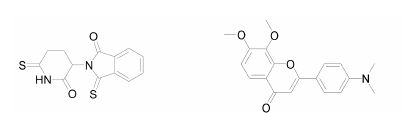
|
Figure 4 Thalidomide analogues |
阿尔兹海默病发病机制尚未阐明,目前市场上使用的药物只能对AD早期发病进程起到减缓作用,亟待探寻新的AD治疗方法。海马区成体神经发生能够实现该区域大脑的重塑,从根本上逆转阿尔兹海默病的病程。目前,促成体神经发生的研究已经取得了一定的成就,多个化合物被证明具有促海马区成体神经发生的作用。其中,有些化合物不易穿透血脑屏障 (blood-brain barrier,BBB),生物利用度低,明显不满足神经类药物的结构性质要求,对后续的研究将是一个巨大的挑战。一个合格的临床药物应满足吸收、代谢、可接受的不良反应等多方面的要求,才能投入实际应用。此外,该领域药物的理性设计和药效团的研究还十分匮乏。寻找能够更有效地促进成体神经发生的临床药物,同时探索成体神经发生的机制,必将对AD发病机制的阐明和AD临床上的防治做出巨大的贡献。促海马区神经发生药物的研究,将给阿尔兹海默病等神经退行性疾病的治疗带来新的希望。
| [1] | Ke HQ, Ji CE, Wu HL, et al. The advance of medicine for Alzheimer's disease[J]. China Pharm (中国药师), 2013, 16:1904-1907. |
| [2] | Ziegler-Graham K, Brookmeyer R, Johnson E, et al. Worldwide variation in the doubling time of Alzheimer's disease incidence rates[J]. Alzheimers Dement, 2008, 4:316-323. |
| [3] | Xu SJ, Liu GL. Recent progress of mitochondrial dysfunction induced by β-amyloid protein[J]. Prog Biochem Biophys (生物化学与生物物理进展), 2010, 37:589-593. |
| [4] | Gong HC, Wang YL, Wang HW. Epigenetic mechanisms of Alzheimer's disease and related drug research[J]. Acta Pharm Sin (药学学报), 2013, 48:1005-1013. |
| [5] | Hardy J, Selkoe DJ. The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J]. Science, 2002, 297:353-356. |
| [6] | Li QX, Maynard C, Cappai R, et al. Intracellular accumulation of detergent-soluble amyloidogenic Aβ fragment of Alzheimer's disease precursor protein in the hippocampus of aged transgenic mice[J]. J Neurochem, 1999, 72:2479-2487. |
| [7] | Chen Q, Nakajima A, Choi SH, et al. Adult neurogenesis is functionally associated with AD-like neurodegeneration[J]. Neurobiol Dis, 2008, 29:316-326. |
| [8] | Imbimbo BP, Hutter-Paier B, Villetti G, et al. CHF5074, a novel γ-secretase modulator, attenuates brain β-amyloid pathology and learning deficit in a mouse model of Alzheimer's disease[J]. Br J Pharmacol, 2009, 156:982-993. |
| [9] | Lledo PM, Alonso M, Grubb MS. Adult neurogenesis and functional plasticity in neuronal circuits[J]. Nat Rev Neurosci, 2006, 7:179-193. |
| [10] | Zhao CM, Deng W, Gage FH. Mechanisms and functional implications of adult neurogenesis[J]. Cell, 2008, 132:645-660. |
| [11] | Thomson Reuters. Alzheimer's Association International Conference 2012[R]. Barcelona:Thomson Reuters, 2012. |
| [12] | Dodel R, Balakrishnan K, Keyvani K, et al. Naturally occurring autoantibodies against β-amyloid:investigating their role in transgenic animal and in vitro models of Alzheimer's disease[J]. J Neurosci, 2011, 31:5847-5854. |
| [13] | Fillit H, Hess G, Hill J, et al. IV immunoglobulin is associated with a reduced risk of Alzheimer's disease and related disorders[J]. Neurology, 2009, 73:180-185. |
| [14] | Cattan A, Ayali A, Barnea A. The cell birth marker BrdU does not affect recruitment of subsequent cell divisions in the adult avian brain[J]. Biomed Res Int, 2015, 2015:126078. |
| [15] | Zhang YY. Advances in neuron specific antigens:NeuN and Fox3[J]. J Med Mol Biol (医学分子生物学杂志), 2012, 9:305-308. |
| [16] | Xu HY, Ye YQ, Hao YL, et al. Effect of early life stress on hippocampal neurogenesis of male rats[J]. Chin J Neurosurg Dis Res (中华神经外科疾病研究杂志), 2015, 14:225-228. |
| [17] | Liao YQ, Li WH, Liu YZ. Recent progress of the protection of Egb 761 on central nervous system[J]. Pract Clin J Integr Chin West Med (实用中西医结合临床), 2007, 7:91-92. |
| [18] | Yao RQ, Zhang L, Wang W, et al. Cornel iridoid glycoside promotes neurogenesis and angiogenesis and improves neurological function after focal cerebral ischemia in rats[J]. Brain Res Bull, 2009, 79:69-76. |
| [19] | Tchantchou F, Xu Y, Wu Y, et al. EGb 761 enhances adult hippocampal neurogenesis and phosphorylation of CREB in transgenic mouse model of Alzheimer's disease[J]. FASEB J, 2007, 21:2400-2408. |
| [20] | Yoo DY, Choi JH, Kim W, et al. Effects of Melissa officinalis L. (lemon balm) extract on neurogenesis associated with serum corticosterone and GABA in the mouse dentate gyrus[J]. Neurochem Res, 2011, 36:250-257. |
| [21] | Marzban M, Asl SS, Huseini HF, et al. Effects of butternut squash extract on dentate gyrus cell proliferation and spatial learning in male adult tats[J]. Br J Pharmacol, 2011, 6:1855-1859. |
| [22] | Hwang IK, Yoo KY, Yoo DY, et al. Zizyphus enhances cell proliferation and neuroblast differentiation in the subgranular zone of the dentate gyrus in middle-aged mice[J]. J Med Food, 2011, 14:195-200. |
| [23] | Zhang L, Zhao LH, Zhang L, et al. Effects of cornel iridoid glycoside on neurogenesis in adult rats[J]. Chin New Drugs J (中国新药杂志), 2015, 24:550-563, 564. |
| [24] | Maruszak A, Pilarski A, Murphy T, et al. Hippocampal neurogenesis in Alzheimer's disease:is there a role for dietary modulation?[J]. J Alzheimers Dis, 2014, 38:11-38. |
| [25] | Yang FS, Lim GP, Begum AN, et al. Curcumin inhibits formation of amyloid β oligomers and fibrils, binds plaques, and reduces amyloid in vivo[J]. J Biol Chem, 2005, 280:5892-5901. |
| [26] | Dong SZ, Zeng QW, Mitchell ES, et al. Curcumin enhances neurogenesis and cognition in aged rats:implications for transcriptional interactions related to growth and synaptic plasticity[J]. PLoS One, 2012, 7:e31211. |
| [27] | Ahn YJ, Park SJ, Woo H, et al. Effects of allantoin on cognitive function and hippocampal neurogenesis[J]. Food Chem Toxicol, 2014, 64:210-216. |
| [28] | Gebara E, Udry F, Sultan S, et al. Taurine increases hippocampal neurogenesis in aging mice[J]. Stem Cell Res, 2015, 14:369-379. |
| [29] | Zhang P, Yang XW. Pharmacokinetics of nodakenin in rats[J]. Chin Pharmacol Bull (中国药理学通报), 2008, 24:1240-1244. |
| [30] | Gao QT, Jeon SJ, Jung HA, et al. Nodakenin enhances cognitive function and adult hippocampal neurogenesis in mice[J]. Neurochem Res, 2015, 40:1438-1447. |
| [31] | Kodali M, Parihar VK, Hattiangady B, et al. Resveratrol prevents age-related memory and mood dysfunction with increased hippocampal neurogenesis and microvasculature, and reduced glial activation[J]. Sci Rep, 2015, 5:8075. |
| [32] | Yao ZX, Brown RC, Teper G, et al. 22R-Hydroxycholesterol protects neuronal cells from β-amyloid-induced cytotoxicity by binding to beta-amyloid peptide[J]. J Neurochem, 2002, 83:1110-1119. |
| [33] | Yao ZX, Han Z, Xu J, et al. 22R-Hydroxycholesterol induces differentiation of human NT2 precursor (Ntera2/D1 teratocarcinoma) cells[J]. Neuroscience, 2007, 148:441-453. |
| [34] | Lecanu L, Hashim AI, McCourty A, et al. A steroid isolated from the water mold Achlya heterosexualis induces neurogenesis in vitro and in vivo[J]. Steroids, 2012, 77:224-232. |
| [35] | Zhou W, Zhou P. Advances in the study of ginsenoside compound K[J]. Acta Pharm Sin (药学学报), 2007, 42:917-923. |
| [36] | Hou JG, Xue JJ, Lee MR, et al. Compound K is able to ameliorate the impaired cognitive function and hippocampal neurogenesis following chemotherapy treatment[J]. Biochem Biophys Res Commun, 2013, 436:104-109. |
| [37] | Pieper AA, Xie SH, Capota E, et al. Discovery of a proneurogenic, neuroprotective chemical[J]. Cell, 2010, 142:39-51. |
| [38] | MacMillan KS, Naidoo J, Liang J, et al. Development of proneurogenic, neuroprotective small molecules[J]. J Am Chem Soc, 2011, 133:1428-1437. |
| [39] | Naidoo J, De Jesus-Cortes H, Huntington P, et al. Discovery of a neuroprotective chemical, (S)-N-(3-(3,6-dibromo-9Hcarbazol-9-yl)-2-fluoropropyl)-6-methoxypyridin-2-amine[(-)-P7C3-S243], with improved druglike properties[J]. J Med Chem, 2014, 57:3746-3754. |
| [40] | Yoon HJ, Kong SY, Park MH, et al. Aminopropyl carbazole analogues as potent enhancers of neurogenesis[J]. Bioorg Med Chem, 2013, 21:7165-7174. |
| [41] | de la Fuente Revenga M, Pérez C, Morales-García JA, et al. Neurogenic potential assessment and pharmacological characterization of 6-methoxy-1,2,3,4-tetrahydro-β-carboline (pinoline) and melatonin-pinoline hybrids[J]. ACS Chem Neurosci, 2015, 6:800-810. |
| [42] | Russo I, Caracciolo L, Tweedie D, et al. 3,6'-Dithiothalidomide, a new TNF-α synthesis inhibitor, attenuates the effect of A β1-42 intracerebroventricular injection on hippocampal neurogenesis and memory deficit[J]. J Neurochem, 2012, 122:1181-1192. |
| [43] | Liu X, Chan CB, Jang SW, et al. A synthetic 7,8-dihydroxyflavone derivative promotes neurogenesis and exhibits potent antidepressant effect[J]. J Med Chem, 2010, 53:8274-8286. |
 2016, Vol. 51
2016, Vol. 51


