恶性肿瘤已成为我国城市居民的第一位死亡原因,在农村居民死因中也位居第二,并呈逐年上升的趋势,严重威胁公众健康和生命。糖尿病是一组以高血糖为特征的代谢紊乱疾病。近年来,随着生活方式的转变,我国居民糖尿病的发病率也在快速增加。流行病学研究表明,糖尿病增加肝癌[1]、胰腺癌[2]、乳腺癌、结直肠癌[3]和胃癌[4]等多种肿瘤的发病风险并提高其死亡率。回顾性临床研究[5, 6, 7]发现,患上述肿瘤的糖尿病患者比患同样肿瘤的非糖尿病患者预后或对药物治疗的反应更差。这些证据表明,糖尿病与恶性肿瘤有密切关联。的确,糖尿病与恶性肿瘤共享许多重要的代谢危险因素,包括高胰岛素、高胰岛素样生长因子1 (insulin-like growth factors 1,IGF-1)、高血糖、缺氧以及慢性炎症等。有趣的是,这些因素也可能是连接糖尿病与肿瘤的重要生物学联系。糖尿病相关因素调节肿瘤发生发展的具体机制至今仍不甚清楚。早期研究[8, 9]认为,高胰岛素或IGF-1主要通 过促进肿瘤细胞生长或抑制肿瘤细胞凋亡参与肿瘤的发生、发展。但是,阻断胰岛素/IGF-1受体及信号传导并不能获得令人满意的抗肿瘤效果。近年来的研究提示,多种机制的共同作用是促进糖尿病相关肿瘤发生发展的原因。本文主要从流行病学、生物学机制及治疗学等3个方面综述最近糖尿病与肿瘤发病相关研究的进展。
1 流行病学证据早在上世纪30年代,Marble[10]就提出糖尿病与肿瘤发生率的统计学相关性。近年来,临床和基础研究进一步证实了糖尿病与肿瘤之间的关联。美国科学家在1982年开展了一项对包括467 922名男性和588 321名女性 (均无肿瘤史) 的大样本人群前瞻性研究,经过16年随访,发现糖尿病与结肠癌、胰腺癌、乳腺癌、肝癌和膀胱癌死亡率密切相关[11]。其中肝癌和胰腺癌与糖尿病的关联最为密切。Wang等[1]对25项队列研究进行荟萃分析,发现与非糖尿病患者相比,糖尿病患者患肝癌的风险增加2.01倍 (95% CI: 1.61~2.51),且这种关联独立于饮酒、肝硬化以及肝炎病毒感染。其他研究组[2]也证实糖尿病与胰腺癌之间的相关性 (SRR = 1.94; 95% CI: 1.66~2.27)。此外,2型糖尿病女性罹患乳腺癌的危险较无糖尿病患者显著增加,并且以绝经后女性尤为明显。尽管大多数研究认为糖尿病与肺癌并无关联,但Jee等[12]发现,女性非吸烟糖尿病患者与肺癌存在正相关。值得指出的是,糖尿病与前列腺癌之间呈负相关,糖尿病患者前列腺癌风险比非糖尿病患者降低30%[13]。
2 生物学机制研究糖尿病是一组以高血糖为特征的代谢性疾病,以2型糖尿病居多,占糖尿病患者90%以上。研究发现胰岛素抵抗普遍存在于2型糖尿患者,并导致高胰岛素和高IGF-1血症。高胰岛素和高IGF-1血症被认为是导致肿瘤发生的首要风险因素。慢性炎症与肥胖相关脂肪因子是导致胰岛素抵抗最主要的原因,胰岛素抵抗反之又能加重肥胖和慢性炎症。此外,糖尿病发生时,还伴随着糖、脂代谢异常。这些因素之间相辅相成,共同促进糖尿病相关的肿瘤发生和发展 (图 1)。
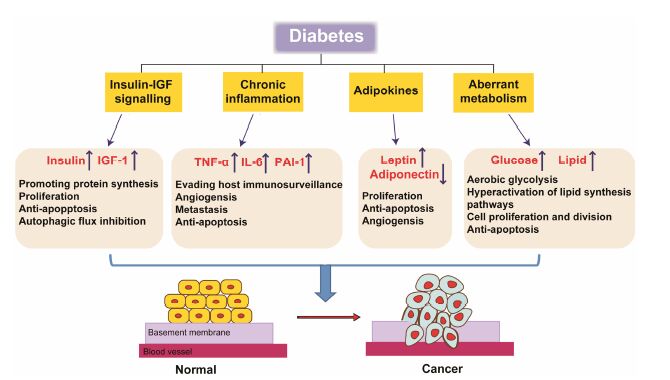
|
Figure 1 Summary of pathways that may link diabetes to cancer development. A convergence of increased insulin signalling,inflammation,increased availability of glucose and lipids,and changes in adipokine signalling may contribute to the conversion of normal epithelial cells to an invasive tumour. IGF-1,insulin-like growth factor 1; IL-6,interleukin-6; PAI-1,plasminogen activator inhibitor-1; TNF-α,tumor necrosis factor-α |
多种肿瘤均伴随着胰岛素及胰岛素受体表达增高。早期研究[14]发现,胰岛素能增加乳腺癌细胞系DNA合成,促进有丝分裂。使用β3肾上腺素受体拮抗剂CL-316243减少小鼠体内胰岛素水平,显著降低肿瘤生长。下调肿瘤细胞或肿瘤组织中胰岛素受体的表达也能抑制肿瘤细胞增殖、降低血管生成及肿瘤转移[15]。胰岛素受体底物是活化的胰岛素受体酪氨酸激酶作用的底物,是介导胰岛素信号传递的重要蛋白分子。胰岛素受体底物2缺失显著抑制肿瘤转移[16] 。上述研究表明胰岛素在肿瘤发生、发展过程中发挥重要作用。
胰岛素样生长因子因为与胰岛素具有结构同源性而得名,分为IGF-1和IGF-2。除了肝脏,肿瘤组织本身也能分泌IGF-1和IGF-2。与其他生长因子不同,体内99% IGFs与特异性IGF结合蛋白 (IGF-binding proteins,IGFBPs) 结合,以无活性的复合物形式存在。血液循环中高水平的胰岛素能降低IGFBP-1和IGFBP-2含量,从而上调游离IGFs水平。游离IGFs通过与特异性靶细胞表面的受体相结合,活化下游信号通路,发挥生物学功能。IGFs主要下游信号通 路包括: 丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK) 信号通路、磷脂酰肌醇3-激 酶 (phosphatidylinositol 3-kinases,PI3Ks) 信号通路和蛋白酪氨酸激酶/信号转导子与激活子 (Janus kinase/ signal transducer and activator of transcription,JAK/ STAT) 信号通路。MAPK信号活化促进肿瘤细胞增殖,PI3K信号活化促进蛋白合成并抑制凋亡,JAK/STAT信号活化上调大量基因转录发挥促肿瘤作用。相关 研究结果表明,IGF-1或IGF-1受体表达上调促进皮肤癌[17]、前列腺癌[18]和乳腺癌[19]的发生、发展; IGF-2表达增高则与肺癌、乳腺癌呈正相关[20]。
虽然胰岛素和IGF信号在肿瘤进展过程中发挥了非常重要的作用,但靶向该信号通路治疗肿瘤在临床研究中并未获得令人满意的效果,提示糖尿病还通过别的机制协同发挥促肿瘤作用。本课题组[21]近期发现,高胰岛素和高IGF-1还能通过诱导代谢应激蛋白TRIB3 (tribbles homologue 3) 表达,抑制自噬,介导糖尿病的促肿瘤作用。TRIB3是一个与代谢密切相关的蛋白,糖尿病中普遍存在的代谢因素如高血糖、高胰岛素和高IGF-1等均能诱导TRIB3表达增高。高表达的TRIB3促进insulin/IGF-1引起的活性氧自由基 (reactive oxygen species,ROS) 产生,加剧DNA损伤,进而促进肿瘤发生、发展。TRIB3与自噬“货车蛋白”P62相互作用,阻碍P62与LC3以及泛素化蛋白的相互作用,导致自噬流受阻以及继发性泛素蛋白酶体系统 (ubiquitin-proteasome system,UPS) 功能障碍。自噬和泛素蛋白酶体系统双重障碍将导致表皮生长因子受体 (epidermal growth factor receptor,EGFR)、环氧化酶2 (cyclooxygenase 2,COX2)、基质金属蛋白酶 (matrix metalloproteinases,MMPs) 等一系列促肿瘤蛋白堆积,促进肿瘤恶性发展。这表明,代谢应激因素造成的蛋白质量控制异常也是导致糖尿病患者群肿瘤高发的重要原因。
2.2 慢性炎症代谢与免疫是机体生存最基本的需求,两者并非各自独立、互不相干,而是存在一种微妙的平衡。当一方长期处于压倒性优势时,会对机体产生不利影响。例如,持续接触病原体或病原体相关成分可以破坏全身的新陈代谢功能; 同样,慢性代谢平衡紊乱,如营养不良或营养过剩,也会导致异常的免疫反应。肥胖是能量失衡的典型表现,通常伴随着慢性炎症。炎症细胞活化将导致全身和局部组织特异性胰岛素抵抗,促进糖尿病发生。糖尿病进一步加重炎症反应,增加肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素6 (interleukin-6,IL-6) 和纤溶酶原激活物抑制剂1 (plasminogen activator inhibitor-1,PAI-1) 等表达,促进多种肿瘤的发生、发展。
TNF-α不仅能介导内毒素引起的肿瘤坏死[22],还可促进肿瘤血管生成[23]与转移[24],对化学因素诱导的结肠癌[25]至关重要。糖尿病患者体内TNF-α水平明显偏高。早期研究[26]发现,给予TNF-α导致血糖升高,中和TNF-α降低胰岛素抵抗。后续研究证实TNF-α能刺激多种丝氨酸激酶活化,包括IκB激酶(inhibitor of nuclear factor kappa-B kinase,IKK)、c-Jun氨基末端激酶 (c-Jun N-terminal kinase,JNK)、核糖体S6激酶 (ribosome protein subunit 6 kinase,S6K) 和哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR) 等。这些激酶活化后诱导胰岛素受体底物丝氨酸磷酸化,抑制其对下游信号的触发,导致胰岛素抵抗。胰岛素抵抗引起的高胰岛素和IGF-1血症又能反作用于TNF-α信号通路,促进其生物学效应。以IGF-1为例,长时间IGF-1刺激显著增强TNF-α介导的c-Jun和核因子-κB (nuclear factor- kappa B,NF-κB) 激活。激活的NF-κB促进一系列与细胞增殖、迁移、抗凋亡和血管生成密切相关的靶基因转录,参与胶质瘤、淋巴瘤和胰腺癌等恶性肿瘤的发生发展,并影响其预后[27]。
IL-6与糖尿病和恶性肿瘤密切相关。在乳腺癌中,伴有胰岛素抵抗的患者IL-6和雌激素水平显著高于非胰岛素抵抗患者[28]。类似地,伴随有肥胖、胰岛素抵抗的激素抵抗型前列腺患者较激素依赖型患者血清IL-6水平高[29]。IL-6主要通过激活STAT信号通路调节肿瘤细胞增殖与分化,抑制宿主的抗肿瘤免疫。
除了代谢紊乱,糖尿病患者还存在不同程度的纤溶系统异常。PAI-1是纤溶系统的主要调节因子,能与纤溶酶原激活物 (plasminogen activator,PA) 快速结合使其灭活,抑制纤溶活性。糖尿病,特别是2型糖尿病患者血液中PAI-1水平增高,纤溶活性下降。体外实验表明,胰岛素和IGF-1均能促进PAI-1的表达,胰岛素原及其裂解产物也能促进PAI-1的表达[30]。高表达的PAI-1参与肿瘤的发生发展。种植于Serpine1-/-小鼠(即PAI-1基因缺陷小鼠) 上的肿瘤不能生长与转移。靶向尿激酶型纤溶酶原激活剂 (urokinase-typeplasminogenactivator,uPA) 的抗体、小分子丝氨酸蛋白酶抑制剂和siRNA均能抑制恶性肿瘤进程[31]。PAI-1的促肿瘤作用一方面与其促血管生成有关,PAI-1能抑制细胞外基质过度降解,细胞外基质为内皮细胞迁移和新生血管生成提供了支架结构; 另一方面,PAI-1还能通过抑制内皮细胞和某些肿瘤细胞凋亡发挥促肿瘤作用。
2.3 肥胖导致的脂肪因子分泌异常肥胖与糖尿病具有密切关系,超过80% 的2型糖尿病患者都存在肥胖。近年来,流行病学研究[32]表明,肥胖也增加多种癌症发病风险,包括结肠癌、乳腺癌、子宫内膜癌、肝癌、肾癌、食道癌、胃癌、胰腺癌、胆囊癌及白血病等。同时,肥胖还导致治疗效果不佳,并增加癌症相关死亡率。连接肥胖和肿瘤的生物学机制目前尚未完全阐明,除慢性炎症外,脂肪细胞分泌的脂肪因子被认为在连接肥胖与肿瘤过程中发挥关键作用。长期以来脂肪组织被认为仅仅是一个贮存能量的器官,但越来越多的证据显示脂肪在系统代谢中具有重要地位,脂肪组织本身就是机体重要的内分泌器官,它可以释放多种生物活性物质,参与肥胖相关疾病的调节。脂肪细胞能分泌多种蛋白,统称为脂肪因子,其中与肿瘤关系最为密切的是瘦素和脂联素。
瘦素是脂肪细胞分泌的重要脂肪因子,介导食欲和体内能量平衡之间的负反馈调节。瘦素主要作用于中枢神经系统,但是一些外周组织中也能检测到少量的瘦素受体。循环中瘦素水平增高是瘦素抵抗的标志性改变之一,这样的人群往往伴随着肥胖。许多研究[33]表明瘦素在乳腺癌、前列腺癌和结肠癌组织中均有表达,与肿瘤发生发展密切相关。Tamakoshi等[34]研究指出日本女性结直肠癌患者瘦素高表达; 胰腺癌与瘦素水平呈正相关[35]。高表达的瘦素还会导致食管癌患者对化疗药物产生耐受[36]。在动物实验中也观察到了类似的结果,瘦素水平高的肥胖小鼠对氧化偶氮甲烷诱发的结肠癌更为易感[37]。而给予瘦素抑制剂PEG-LPrA2 (pegylated-leptin receptor antagonist 2) 显著抑制肥胖小鼠乳腺癌生长[38]。多 种机制参与瘦素对肿瘤的调节: 当瘦素与其受体 结合能引起下游细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、STAT3等信号活 化,促进肿瘤发生发展。PI3K/AKT通路也参与其中,AKT不仅能促进肿瘤糖酵解代谢、维持线粒体膜电位,还能通过诱导X连锁凋亡抑制蛋白 (X-linked inhibitor of apoptosis protein,XIAP) 的表达,促进肿瘤恶化进程。在雄激素非依赖的前列腺癌中,瘦素能激活JNK促进肿瘤细胞增殖 [39]。在乳腺癌中,瘦素还能上调芳香化酶的活性,反式激活雌激素受体α,刺激肿瘤生长[40]。
脂联素是表达最为丰富的脂肪因子,主要由内脏脂肪组织分泌。与瘦素的作用相反,脂联素与肥胖、高胰岛素血症和肿瘤呈负相关。胰岛素能抑制脂联素分泌,而脂联素作为胰岛素增敏素,能改善糖尿病。关于脂联素与肿瘤,研究[41]发现绝经后妇女脂联素表达越低,其罹患乳腺癌的风险就越高。此外,脂联素还能降低子宫内膜癌[42]和肾细胞癌[43]等的患病风险。脂联素主要通过与脂联素受体结合,激活腺苷酸活化蛋白激酶 (AMP-activated protein kinase,AMPK) 信号通路,抑制ERK、PI3K/AKT、WNT-β- catenin、NF-κB和JAK/STAT信号通路,抑制肿瘤[44]。
2.4 糖代谢异常肿瘤细胞是一群生长旺盛、异常增殖的细胞,糖、脂肪和蛋白质代谢都存在一定程度的异常改变,尤以糖代谢改变最为明显。肿瘤细胞即使在正常氧浓度下,也主要通过糖酵解途径而并非氧化磷酸化途径产生ATP以满足其能量需求,这种现象被称为瓦伯格效应 (Warburg effect)。虽然糖酵解途径较氧化磷酸化途径产生ATP更为快速,但其单位葡萄糖产生ATP效率远远低于后者,因此肿瘤细胞必须具有超强的葡萄糖摄取能力才能满足其能量的巨大需求[45]。
糖尿病患者体内葡萄糖浓度显著增高,为肿瘤细胞能量代谢改变提供了有利条件。而且前列腺癌、结肠癌和乳腺癌等多种肿瘤细胞高表达胰岛素受体,糖尿病患者伴随的高胰岛素和高胰岛素样生长因子还能通过激活PI3K/AKT信号通路促进肿瘤糖酵解进程。PI3K/AKT信号通路是肿瘤能量代谢改变最核心的机制之一,能通过多种机制调节糖酵解过程[46]。首先,AKT可通过增加葡萄糖转运蛋白和磷酸果糖激酶2等的表达,促进肿瘤糖酵解。其次,AKT能引起外核苷三磷酸双磷酸酶5 (ectonucleoside triphosphate diphosphohydrolase 5,ENTPD5) 表达上调。ENTPD5促进内质网中蛋白质的糖基化,增加ATP消耗,降低ATP/AMP比例,解除高ATP/AMP比对磷酸果糖激酶的变构抑制,从而增加糖酵解[47]。此外,AKT还可通过激活mTOR和低氧诱导因子-1α (hypoxia inducible factor-1α,HIF-1α) 等,促进肿瘤糖酵解。
糖代谢改变能满足肿瘤细胞对物质、能量和氧化还原稳态等的需求,促进肿瘤细胞生长增殖。糖酵解途径除了产能速度快以外,还能生成大量的代谢中间产物 (6-磷酸葡萄糖和丙酮酸等),这些中间产物重新进入合成代谢途径,用以合成核苷酸、脂肪酸和蛋白质等生物大分子,满足肿瘤细胞快速增殖的物质需求。肿瘤细胞高表达M2型丙酮酸激酶 (pyruvate kinase M2,PKM2) 使大量葡萄糖进入磷酸戊糖途径进行代谢,形成NADPH用于维持肿瘤细胞氧化还原稳态。此外,糖酵解产生大量乳酸,有利于酸性微环境形成。酸性微环境有助于形成免疫抑制状态,促进肿瘤转移。肿瘤细胞产生的乳酸还能被间质细胞摄取用于重新合成丙酮酸,新合成的丙酮酸除被肿瘤细胞利用外,还能被基质细胞氧化磷酸化。由此,肿瘤细胞与周围基质细胞形成互利共存关系,促进肿瘤细胞生长[48]。
综上,糖尿病伴随的高糖、高胰岛素和高IGF可通过激活PI3K/AKT等信号通路上调肿瘤糖酵解进程,促进肿瘤发生、发展。
2.5 脂代谢异常糖尿病患者常常伴有总胆固醇、低密度脂蛋白胆固醇、甘油三酯升高和/或高密度脂蛋白胆固醇降低等血脂异常。这些过剩的脂质以及其他营养物质是肿瘤细胞生长的必要成分。脂质用于合成细胞膜,葡萄糖中间代谢产物用于合成核酸和氨基酸等生物大分子,满足肿瘤细胞快速增殖分裂的需要。肿瘤细胞中脂质合成途径高度激活。脂肪酸合成酶 (fatty acid synthase,FASN) 是生物体内源性脂肪酸合成的关键酶,它能催化乙酰辅酶A和丙二酰辅酶A生成长链脂肪酸。FASN被认为是糖尿病的生物标志物[49]。胰岛素能在转录和蛋白翻译水平对FASN产生正调节作用,并提高其酶活性。研究[50, 51, 52]发现,FASN在乳腺癌、结直肠癌、前列腺癌、卵巢癌和子宫内膜癌等多种肿瘤组织中高表达,并影响其预后。FASN调节肿瘤的具体机制尚未明确,研究者认为这主要与其为肿瘤细胞提供结构脂质及其他生物大分子相关,抑制FASN后,肿瘤细胞停滞在G0期,表明脂质合成与细胞周期相关[53]。FASN还参与血管新生,促进肿瘤转移。敲低FASN后,促血管新生因子VEGF189表达下调,而抑血管新生因子VEGF165b明显上调; 敲除FASN结肠癌细胞条件培养基还能通过抑制VEGFR-2及下游信号通路活化,降低血管内皮细胞增殖迁移能力,从而抑制血管新生[54]。
除FASN外,肿瘤组织中促进脂肪酸释放的单酰基甘油酯酶 (monoacylglycerol lipase,MAGL) 表达也相应上调。MAGL参与脂肪动员,能催化单酰甘油分解为游离脂肪酸 (free fatty acids,FFAs) 和甘油。研究[55]发现,MAGL在多种肿瘤中呈高表达,降低MAGL活性能抑制肿瘤生长,高脂饮食能重新恢复肿瘤生长。由此可见,肿瘤细胞中高游离脂肪酸,无论是高脂饮食引起或肿瘤细胞自身合成,均能促进肿瘤生长。
FFAs的促肿瘤作用还与其脂毒性相关。肥胖时,过多的脂质无法完全储存于脂肪组织而被分配到肌肉、心脏、肝脏和胰岛β细胞等组织,对其产生不良影响。多余的FFAs可能引起ROS,导致基因组不稳定,从而诱发肿瘤。
3 抗糖尿病药物与肿瘤发生风险目前治疗糖尿病药物种类繁多,包括胰岛素及其类似物、双胍类、胰高血糖素样肽-1 (glucagon-like peptide-1,GLP-1) 受体激动剂和二肽基肽酶-4 (dipeptidyl peptidase -4,DDP4) 抑制剂等,其与肿瘤关系各不相同并存在争议。
3.1 胰岛素及其类似物胰岛素及其类似物是治 疗糖尿病最主要的药物类型之一,然而它们潜在的促肿瘤作用也备受关注。2009年《Diabetologia》期刊上连续发表了4篇有关胰岛素和肿瘤风险的报道。Hemkens等[56]发现多种胰岛素均与肿瘤呈正相关,与人胰岛素相比,一种常用的长效胰岛素-甘精胰岛素更是剂量依赖性增加肿瘤的发生风险。Jonasson 等[57]也发现甘精胰岛素治疗组乳腺癌发病率更高。Rosenstock等[58]却认为甘精胰岛素与其他胰岛素相比,肿瘤发病风险并无差别。Colhoun等[59]指出,单使用甘精胰岛素患者肿瘤发病率升高,但当甘精胰岛素与其他胰岛素合用时,并不增加肿瘤风险。这些结果均为回访观察或回顾性队列研究,虽然相互之间存在些许矛盾,但却提示胰岛素可能增加恶性肿瘤患病风险。随后的研究[60]结果表明,胰岛素确实参与胰腺癌、肝癌、肾癌和胃癌等的恶化进程,却与前列腺癌和结肠癌等呈负相关。胰岛素及其类似物能 与IGF-1受体高亲和力结合,由此产生的促进有丝分裂作用与其产生的促肿瘤作用相关。与天然胰岛素相比,长效胰 岛素 (包括甘精胰岛素) 与IGF-1受体亲和力更强,解离更慢。
3.2 二甲双胍二甲双胍是使用最广泛的口服降糖药,研究发现二甲双胍能降低肺癌[61]、卵巢癌[62]和胃癌[63]等多种肿瘤的患病风险并改善其预后。250余项临床试验 (登记在www.clinicaltrials.gov) 也正在开展以评估二甲双胍辅助治疗肿瘤的可能性。二甲双胍抗肿瘤作用主要与其激活AMPK级联反应相关,活化的AMPK不仅能诱导p53依赖的凋亡,还能通过抑制 cyclin D1表达阻滞细胞周期。
但是Stevens等[64]对14项研究进行荟萃分析,认为二甲双胍并不能降低肿瘤风险。随后,Singh等[65]对15项结果 (包含840 787名糖尿病患者,其中13 871名兼患结肠癌) 进行荟萃分析, 指出二甲双胍可降低结肠癌患病风险。尽管二甲双胍降低肿瘤风险尚存争议,但可以肯定的是,二甲双胍并不增加肿瘤的患病风险,所以对于肿瘤易感患者来说,二甲双胍是相对安全的抗糖尿病药物。
3.3 其他抗糖尿病药物其他糖尿病药物如GLP-1激动剂、DDP4抑制剂、磺酰脲类促泌剂与肿瘤关系也需要更长时间的观察研究。以GLP-1激动剂为例,GLP-1激动剂模仿内源性肠促胰岛素激素,刺激机体产生更多的自身胰岛素,有助于降低血糖,其代表药物包括利拉鲁肽 (liraglutide) 和艾塞那肽 (exendin-4)。根据以往报道,利拉鲁肽和艾塞那肽均能增加胰腺炎风险从而导致胰腺癌。利拉鲁肽还能引起大鼠和小鼠剂量依赖和治疗持续时间依赖的甲状 腺C细胞肿瘤。另有研究[66]认为GLP-1激动剂能降低结肠癌、乳腺癌和前列腺癌风险。最近Nomiyama等[67]报道了艾塞那肽能抑制ERK-MAPK通路活化下调前列腺肿 瘤生长。鉴于上述研究大多数为体外实验或动物实验,GLP-1与人类癌症的相关性还有待于进一步深入研究。
4 结语与展望糖尿病与肿瘤间的关系是近年来的研究热点,糖尿病导致肿瘤高发的确切机制目前尚不清楚,糖尿病伴随的高胰岛素和高IGF、慢性炎症以及相关代谢异常被认为是促进恶性肿瘤发生、发展的主要原因。值得关注的是,不同糖尿病治疗药物对于肿瘤罹患风险具有截然不同的作用。一般而言,能够降低高血糖和高胰岛素血症的口服抗糖尿病药物二甲双胍能降低肿瘤发生的风险; 而降低高血糖但引起高胰岛素血症的胰岛素治疗则增加恶性肿瘤的发生和发展。这些证据提示,治疗糖尿病时,对患者的肿瘤风险进行评估,慎重选择治疗药物并定期进行监测。
靶向insulin/IGF-1信号治疗乳腺癌、胰腺癌和非小细胞肺癌的临床研究目前均以失败告终。本课题组最近发现,糖尿病伴随代谢应激因素诱导高表达的TRIB3与自噬“货车蛋白”P62相互作用,抑制自噬与泛素蛋白酶体系统,促进肿瘤发生和发展。最为重要的是,利用P62衍生的α螺旋肽解除TRIB3-P62之间的相互作用具有显著的抗肿瘤效果,提示TRIB3-P62相互作用是治疗糖尿病相关肿瘤的潜在靶点。因此,深入研究糖尿病患者肿瘤高发的分子机制,寻找潜在治疗靶点,将为预防和治疗糖尿病相关肿瘤带来新的机会。
| [1] | Wang C, Wang X, Gong G, et al. Increased risk of hepatocellular carcinoma in patients with diabetes mellitus:a systematic review and meta-analysis of cohort studies[J]. Int J Cancer, 2012, 130:1639-1648. |
| [2] | Ben Q, Xu M, Ning X, et al. Diabetes mellitus and risk of pancreatic cancer:a meta-analysis of cohort studies[J]. Eur J Cancer, 2011, 47:1928-1937. |
| [3] | De Bruijn KM, Arends LR, Hansen BE, et al. Systematic review and meta-analysis of the association between diabetes mellitus and incidence and mortality in breast and colorectal cancer[J]. Br J Surg, 2013, 100:1421-1429. |
| [4] | Shimoyama S. Diabetes mellitus carries a risk of gastric cancer:a meta-analysis[J]. World J Gastroenterol, 2013, 19:6902-6910. |
| [5] | Yang WS, Va P, Bray F, et al. The role of pre-existing diabetes mellitus on hepatocellular carcinoma occurrence and prognosis:a meta-analysis of prospective cohort studies[J]. PLoS One, 2011, 6:e27326. |
| [6] | Luo J, Virnig B, Hendryx M, et al. Diabetes, diabetes treatment and breast cancer prognosis[J]. Breast Cancer Res Treat, 2014, 148:153-162. |
| [7] | Giovannucci E, Harlan DM, Archer MC, et al. Diabetes and cancer:a consensus report[J]. CA Cancer J Clin, 2010, 60:207-221. |
| [8] | Macaulay VM. Insulin-like growth factors and cancer[J]. Br J Cancer, 1992, 65:311-320. |
| [9] | Kooijman R. Regulation of apoptosis by insulin-like growth factor (IGF)-1[J]. Cytokine Growth Factor Rev, 2006, 17:305-323. |
| [10] | Marble A. Diabetes and cancer[J]. N Engl J Med, 1934, 211:339-349. |
| [11] | Coughlin SS, Calle EE, Teras LR, et al. Diabetes mellitus as a predictor of cancer mortality in alarge cohort of US adults[J]. Am J Epidemiol, 2004, 159:1160-1167. |
| [12] | Jee SH, Ohrr H, Sull JW, et al. Fasting serum glucose level and cancer risk in Korean men and women[J]. JAMA, 2005, 293:194-202. |
| [13] | Blanc-Lapierre A, Spence A, Karakiewicz PI, et al. Metabolic syndrome and prostate cancer risk in a population-based casecontrol study in Montreal, Canada[J]. BMC Public Health, 2015, 15:913. |
| [14] | Fierz Y, Novosyadlyy R, Vijayakumar A, et al. Insulinsensitizing therapy attenuates type 2 diabetes-mediated mammary tumor progression[J]. Diabetes, 2010, 59:686-693. |
| [15] | Zhang H, Fagan DH, Zeng X, et al. Inhibition of cancer cell proliferation and metastasis by insulin receptor downregulation[J]. Oncogene, 2010, 29:2517-2527. |
| [16] | Nagle JA, Ma Z, Byrne MA. Involvement of insulin receptor substrate 2 in mammary tumor metastasis[J]. Mol Cell Biol, 2004, 24:9726-9735. |
| [17] | Lewis DA, Travers JB, Somani AK, et al. The IGF-1/IGF-1R signaling axis in the skin:a new role for the dermis in agingassociated skin cancer[J]. Oncogene, 2010, 29:1475-1485. |
| [18] | Chen C, Zhang Q, Liu S, et al. IL-17 and insulin/IGF1 enhance adhesion of prostate cancer cells to vascular endothelial cells through CD44-VCAM-1 interaction[J]. Prostate, 2015, 75:883-895. |
| [19] | Yerushalmi R, Gelmon KA, Leung S, et al. Insulin-like growth factor receptor (IGF-1R) in breast cancer subtypes[J]. Breast Cancer Res Treat, 2012, 132:131-142. |
| [20] | Livingstone C. IGF2 and cancer[J]. Endocr Relat Cancer, 2013, 20:R321-R339. |
| [21] | Hua F, Li K, Yu JJ, et al. TRB3 links insulin/IGF to tumour promotion by interacting with p62 and impeding autophagic/proteasomal degradations[J]. Nat Commun, 2015, 6:7951. |
| [22] | Carswell EA, Old LJ, Kassel RL, et al. An endotoxininduced serum factor that causes necrosis of tumors[J]. Proc Natl Acad Sci U S A, 1975, 72:3666-3670. |
| [23] | Leibovich SJ, Polverini PJ, Shepard HM, et al. Macrophageinduced angiogenesis is mediated by tumour necrosis factor-α[J]. Nature, 1987, 329:630-632. |
| [24] | Orosz P, Echtenacher B, Falk W, et al. Enhancement of experimental metastasis by tumor necrosis factor[J]. J Exp Med, 1993, 177:1391-1398. |
| [25] | Popivanova BK, Kitamura K, Wu Y, et al. Blocking TNF-α in mice reduces colorectal carcinogenesis associated with chronic colitis[J]. J Clin Invest, 2008, 118:560-570. |
| [26] | Hotamisligil GS, Shargill NS, Spiegelman BM. Adipose expression of tumor necrosis factor-alpha:direct role in obesity-linked insulin resistance[J]. Science, 1993, 259:87-91. |
| [27] | Che W, Lerner-Marmarosh N, Huang Q, et al. Insulin-like growth factor-1 enhances inflammatory responses in endothelial cells:role of Gab1 and MEKK3 in TNF-α-induced c-Jun and NF-κB activation and adhesion molecule expression[J]. Circ Res, 2002, 90:1222-1230. |
| [28] | Gonullu G, Ersoy C, Ersoy A, et al. Relation between insulin resistance and serum concentrations of IL-6 and TNF-α in overweight or obese women with early stage breast cancer[J]. Cytokine, 2005, 31:264-269. |
| [29] | Arcidiacono B, Iiritano S, Nocera A, et al. Insulin resistance and cancer risk:an overview of the pathogenetic mechanisms[J]. Exp Diabetes Res, 2012, 2012:789174. |
| [30] | Schneider DJ, Sobel BE. PAI-1 and diabetes:a journey from the bench to the bedside[J]. Diabetes Care, 2012, 35:1961-1967. |
| [31] | Schmitt M, Harbeck N, Brünner N, et al. Cancer therapy trials employing level-of-evidence-1 disease forecast cancer biomarkers uPA and its inhibitor PAI-1[J]. Expert Rev Mol Diagn, 2011, 11:617-634. |
| [32] | Berger NA. Obesity and cancer pathogenesis[J]. Ann N Y Acad Sci, 2014, 1311:57-76. |
| [33] | Vansaun MN. Molecular pathways:adiponectin and leptin signaling in cancer[J]. Clin Cancer Res, 2013, 19:1926-1932. |
| [34] | Tamakoshi K, Toyoshima H, Wakai K, et al. Leptin is associated with an increased female colorectal cancer risk:a nested case-control study in Japan[J]. Oncology, 2005, 68:454-461. |
| [35] | Stolzenberg-Solomon RZ, Newton CC, Silverman DT, et al. Circulating leptin and risk of pancreatic cancer:a pooled analysis from 3 cohorts[J]. Am J Epidemiol, 2015, 182:187-197. |
| [36] | Bain GH, Collie-Duguid E, Murray GI, et al. Tumour expression of leptin is associated with chemotherapy resistance and therapy-independent prognosis in gastro-oesophagealadenocarcinomas[J]. Br J Cancer, 2014, 110:1525-1534. |
| [37] | Teraoka N, Mutoh M, Takasu S, et al. High susceptibility to azoxymethane-induced colorectal carcinogenesis in obese KK-Ay mice[J]. Int J Cancer, 2011, 129:528-535. |
| [38] | Battle M, Gillespie C, Quarshie A, et al. Obesity induced a leptin-Notch signaling axis in breast cancer[J]. Int J Cancer, 2014, 134:1605-1616. |
| [39] | Onuma M, Bub JD, Rummel TL, et al. Prostate cancer celladipocyte interaction:leptin mediates androgen-independent prostate cancer cell proliferation through c-Jun NH2-terminal kinase[J]. J Biol Chem, 2003, 278:42660-42667. |
| [40] | Catalano S, Mauro L, Marsico S, et al. Leptin induces, via ERK1/ERK2 signal, functional activation of estrogen receptor α in MCF-7 cells[J]. J Biol Chem, 2004, 279:19908-19915. |
| [41] | Tworoger SS, Eliassen AH, Kelesidis T, et al. Plasma adiponectin concentrations and risk of incident breast cancer[J]. J Clin Endocrinol Metab, 2007, 92:1510-1516. |
| [42] | Gong TT, Wu QJ, Wang YL, et al. Circulating adiponectin, leptin and adiponectin-leptin ratio and endometrial cancer risk:evidence from a meta-analysis of epidemiologic studies[J]. Int J Cancer, 2015, 137:1967-1978. |
| [43] | Liao LM, Schwartz K, Pollak M, et al. Serum leptin and adiponectin levels and risk of renal cell carcinoma[J]. Obesity, 2013, 21:1478-1485. |
| [44] | Renehan AG, Zwahlen M, Egger M. Adiposity and cancer risk:new mechanistic insights from epidemiology[J]. Nat Rev Cancer, 2015, 15:484-498. |
| [45] | Koppenol WH, Bounds PL, Dang CV. Otto Warburg's contributions to current concepts of cancer metabolism[J]. Nat Rev Cancer, 2011, 11:325-337. |
| [46] | Robey RB, Hay N. Is Akt the "Warburg kinase"?-Akt-energy metabolism interactions and oncogenesis[J]. Semin Cancer Biol, 2009, 19:25-31. |
| [47] | Fang M, Shen Z, Huang S, et al. The ER UDPase ENTPD5 promotes protein N-glycosylation, the Warburg effect, and proliferation in the PTEN pathway[J]. Cell, 2010, 143:711-724. |
| [48] | Goodwin ML, Gladden LB, Nijsten MW, et al. Lactate and cancer:revisiting the warburg effect in an era of lactate shuttling[J]. Front Nutr, 2015, 1:27. |
| [49] | Fernandez-Real JM, Menendez JA, Moreno-Navarrete JM, et al. Extracellular fatty acid synthase:a possible surrogate biomarker of insulinresistance[J]. Diabetes, 2010, 59:1506-1511. |
| [50] | Li J, Dong L, Wei D, et al. Fatty acid synthase mediates the epithelial-mesenchymal transition of breast cancer cells[J]. Int J Biol Sci, 2014, 10:171-180. |
| [51] | Long QQ, Yi YX, Qiu J, et al. Fatty acid synthase (FASN) levels in serum of colorectal cancer patients:correlation with clinical outcomes[J]. Tumour Biol, 2014, 35:3855-3859. |
| [52] | Menendez JA, Lupu R. Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis[J]. Nat Rev Cancer, 2007, 7:763-777. |
| [53] | Knowles LM, Smith JW. Genome-wide changes accompanying knockdown of fatty acid synthase in breast cancer[J]. BMC Genomics, 2007, 8:168. |
| [54] | Zaytseva YY, Elliott VA, Rychahou P, et al. Cancer cellassociated fatty acid synthase activates endothelial cells and promotes angiogenesis in colorectal cancer[J]. Carcinogenesis, 2014, 35:1341-1351. |
| [55] | Nomura DK, Long JZ, Niessen S, et al. Monoacylglycerol lipase regulates a fatty acid network that promotes cancer pathogenesis[J]. Cell, 2010, 140:49-61. |
| [56] | Hemkens LG, Grouven U, Bender R, et al. Risk of malignancies in patients with diabetes treated with human insulin or insulin analogues:a cohort study[J]. Diabetologia, 2009, 52:1732-1744. |
| [57] | Jonasson JM, Ljung R, Talbäck M, et al. Insulin glargine use and short-term incidence of malignancies-a populationbased follow-up study in Sweden[J]. Diabetologia, 2009, 52:1745-1754. |
| [58] | Rosenstock J, Fonseca V, McGill JB, et al. Similar risk of malignancy with insulin glargine and neutral protamine Hagedorn (NPH) insulin in patients with type 2 diabetes:findings from a 5 year randomised, open-label study[J]. Diabetologia, 2009, 52:1971-1973. |
| [59] | Colhoun HM, SDRN Epidemiology Group. Use of insulin glargine and cancer incidence in Scotland:a study from the Scottish Diabetes Research Network Epidemiology Group[J]. Diabetologia, 2009, 52:1755-1765. |
| [60] | Shih SR, Chiu WY, Chang TC, et al. Diabetes and thyroid cancer risk:literature review[J]. Exp Diabetes Res, 2012, 2012:578285. |
| [61] | Zhu N, Zhang Y, Gong YI, et al. Metformin and lung cancer risk of patients with type 2 diabetes mellitus:a meta-analysis[J]. Biomed Rep, 2015, 3:235-241. |
| [62] | Tseng CH. Metformin reduces ovarian cancer risk in Taiwanese women with type 2 diabetes mellitus[J]. Diabetes Metab Res Rev, 2015, 31:619-626. |
| [63] | Greenhill C. Gastric cancer. Metformin improves survival and recurrence rate in patients with diabetes and gastric cancer[J]. Nat Rev Gastroenterol Hepatol, 2015, 12:124. |
| [64] | Stevens RJ, Ali R, Bankhead CR, et al. Cancer outcomes and all-cause mortality in adults allocated to metformin:systematic review and collaborative meta-analysis of randomised clinical trials[J]. Diabetologia, 2012, 55:2593-2603. |
| [65] | Singh S, Singh H, Singh PP, et al. Antidiabetic medications and the risk of colorectal cancer in patients with diabetes mellitus:a systematic review and meta-analysis[J]. Cancer Epidemiol Biomarkers Prev, 2013, 22:2258-2268. |
| [66] | Vangoitsenhoven R, Mathieu C, Van der Schueren B. GLP1 and cancer:friend or foe?[J]. Endocr Relat Cancer, 2012, 19:F77-F88. |
| [67] | Nomiyama T, Kawanami T, Irie S, et al. Exendin-4, a GLP-1 receptor agonist, attenuates prostate cancer growth[J]. Diabetes, 2014, 63:3891-3905. |
 2016, Vol. 51
2016, Vol. 51


