白藜芦醇是一种存在于葡萄、红酒和花生中的多酚植物抗毒素。它有抗氧化、心血管保护、化学预防、抗血小板凝集和抗肿瘤的作用[1]。其抗肿瘤作用的主要机制是能够通过抑制DNA的合成,抑制肿瘤细胞的增殖和诱导肿瘤细胞的凋亡[2,3]。有研究发现白藜芦醇能够增强抗肿瘤药物的抗肿瘤活性,其主要原因是能够抑制外排转运体和代谢酶的活性[4]。由于白藜芦醇对药物转运体和代谢酶有较明显的调控作用,因此与其他药物合用时有潜在的发生DDI的可能。本文主要对药物转运体和代谢酶在体内的分布、白藜芦醇对转运体和代谢酶的影响及可能发生的DDI等方面进行综述。
1 转运体与代谢酶在体内的分布 1.1 药物转运体药物转运体在体内分布广泛,对于机体内药物的吸收、分布、代谢和排泄过程有重要的影响[5] (图 1)。依据功能可将药物转运体分为将药物摄取进入细胞的摄取型转运体和将药物外排出细胞的外排型转运体[6]。药物转运体有器官分布的特异性,广泛分布于小肠、肝脏和肾脏等脏器[7, 8, 9]。这些器官上的转运体在介导药物体内处置和DDI方面发挥重要作用。此外,表达于血液组织屏障上如血脑屏障和胎盘屏障的转运体在保护敏感组织免受毒性药物攻击方面发挥的临床作用不可忽视。
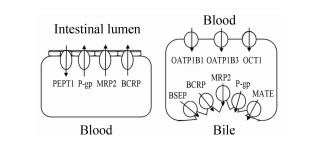 | Figure 1 Distribution of the major transporters located in intestine and liver |
肠上皮细胞上的转运体分布较多,如摄取型寡肽转运体 (oligopeptide transporter 1,PEPT1) 是一种氢离子偶联的转运体,主要负责二肽、三肽及拟二肽类化合物的摄取[8]。外排型转运体如P-糖蛋白 (P- glycoprotein,P-gp,MDR1)、乳腺癌耐药蛋白 (breast cancer resistance protein,BCRP) 和多药耐药相关蛋白2 (multidrug resistance associated protein,MRP2) 等分布于肠细胞的顶侧膜端,因此能够限制底物药物的生物利用度。如果同时服用这些外排转运体的抑制剂,可能增加底物药物体内的暴露量,但是如果服用这些转运体的诱导剂则能使底物药物的生物利用度降低[10]。药物经门静脉吸收入血后进入体循环,表达于肝细胞基底侧的摄取转运体能介导底物药物进入肝细胞。这些转运体包括有机阴离子转运多肽 (organic anion transporting polypeptides,OATPs) 和有机阳离子转运体 (organic cation transporters,OCTs)。肝脏细胞上的外排转运体主要位于肝细胞的胆小管膜侧,包括P-gp、BCRP、多药耐药毒素外排蛋白1 (multidrug and toxin extrusion protein 1,MATE1)、MPR2和胆汁酸盐外排泵 (bile salt export pump,BSEP)。这些转运体参与药物的转运、药物的I相和II相代谢及内源性药物排入胆汁的过程。除此之外,位于肾脏肾小管细胞上的转运体在参与药物排泄方面发挥重要作用。位于基底外侧膜的OCT2和位于管腔侧的MATE1和MATE2-K转运体参与阳离子药物的肾脏消除过程。同时,介导有机阴离子摄取的有机阴离子转运体 (organic anion transporters,OATs) 和外排转运体在肾脏也有广泛分布。抑制这些转运体的功能可减少底物药物的肾脏清除。近年的研究发现,部分药物能够调节药物转运体的表达,因此与其他药物合用时也有潜在发生DDI的可能。
1.2 药物代谢酶人体内代谢酶参与维持细胞内的动态平衡过程。这些酶能够参与内源性化合物如类固醇和外源性物质如药物的代谢过程。编码代谢酶在人体内可发生 基因多态性,基因遗传的变异性能够导致药物分布的改变和DDI的发生。
依据酶催化反应的类型可将药物代谢分为两种,即I相反应和II相反应。I相药物代谢反应是指在内源性和外源性物质的结构中脱去或引入功能基团,同时也包括化合物的水解反应及环化/去环化反应。肝脏的CYPs在催化反应中利用烟酰胺腺嘌呤二核苷酸磷酸 (nicotinamide adenine dinucleotide phosphate,NADPH) 和氧参与Ⅰ相的氧化反应[11]。在肝外的CYPs酶能够在相应器官参与药物的代谢过程。肠道的CYPs在参与许多药物的首过效应中发挥重要作用。研究证实,I相代谢产物的消除还需要一些II相代谢酶的参与[12]。Ⅱ相酶反应是指药物与一些内源 性的物质 (甘氨酸、葡糖醛酸、硫酸等) 结合或经乙酰化、甲基化修饰的一种反应。最常见的II相酶家族包括谷胱甘肽巯基转移酶、尿苷二磷酸葡糖醛酸转移酶、磺基转移酶和N-乙酰基转移酶[13]。
2 白藜芦醇对转运体的影响 2.1 白藜芦醇对摄取转运体的影响 2.1.1 白藜芦醇对肽转运体1 (peptide transporter 1,PEPT1) 的影响许多抗癌药物、抗菌药和抗病毒药物在肠道的吸收经PEPT1摄取,因而PEPT1可作为药物传递系统的靶点。PEPT1在体内的功能及表达可受到诸多因素调控,有文献[14]报道,白藜芦醇作为核转录因子2 (nuclear factor 2,Nrf2) 的激活剂能够使PEPT1的表达增加。Nrf2的过表达能够激活PEPT1的启动子,其原因是Nrf2能够结合位于起始密码子区域附近的抗氧化反应元件 (antioxidant responsive element,ARE) 部位,诱导Nrf2通路能够使得PEPT1的表达增加及活性增强[14]。作者[15]近期研究发现,连续给予大鼠白藜芦醇两周后,能够增加PEPT1底物药物乌苯美司的摄取,从而影响其药物代谢动力学的过程。白藜芦醇同样能够增加大鼠小肠中PEPT1基因和蛋白的表达水平[15]。
2.1.2 白藜芦醇与OATPOATP的底物覆盖范围广泛,主要包括内源性和外源性化合物。内源性的底物包括前列腺素、胆汁酸和类固醇等[16]。外源性的药物包括血管紧张素酶抑制剂、强心苷类药物、抗生素和茶多酚等[17,18]。有研究[19]报道,白藜芦醇及其代谢物在肝细胞内的摄取主要经OATPs介导。此外,白藜芦醇对OATP1B3的亲和力较OATP1B1和OATP2B1强。当白藜芦醇与OATP转运体的底物合用时应该考虑其潜在发生DDI的可能。
2.1.3 白藜芦醇对钠依赖性胆盐转运体 (apical sodium-dependent bile acid transporter,ASBT) 的影响ASBT主要表达在回肠末端。ASBT参与了胆汁酸从回肠重吸收的过程。因此ASBT能够在肝肠循环中发挥重要作用。白藜芦醇能够在ASBT的转染细胞和Caco-2细胞中分别抑制ASBT的功能和蛋白的表达[20]。研究发现,白藜芦醇降解ASBT的过程与蛋白酶体的泛素化通路相关,而与335位丝氨酸和339位苏氨酸的磷酸化过程没有直接联系[20]。此外,白藜芦醇降低胆固醇的作用与其调节ASBT的表达有临床相关性[20]。
2.2 白藜芦醇对外排转运体的影响 2.2.1 白藜芦醇对P-gp的影响P-gp是研究最多的介导药物外排的药物转运体,在体内分布广泛,在肠道、肝脏、肾脏和脑都有表达,且在肿瘤细胞中高表达,主要负责将外源物质和毒素排出细胞[21,22]。如果合用P-gp的抑制剂会阻止其将底物化合物排出胞外。白藜芦醇本身不是P-gp的底物,其与P-gp的关系主要体现在以下两个方面[23]: 一方面,白藜芦醇能够直接抑制P-gp的功能。有研究发现,白藜芦醇能够明显抑制大鼠肠道的P-gp的活性,从而增加地尔硫䓬的生物利用度[24]。另外,白藜芦醇合用尼卡地平后,尼卡地平的Cmax和AUC均增加了2倍之多,体外实验发现白藜芦醇是通过抑制P-gp的功能使 胞内药物明显增加[4]; 另一方面,白藜芦醇能够调控P-gp表达。有研究发现,白藜芦醇能够显著增加多柔比星在乳腺癌耐药株中的细胞毒性,其主要原因是白藜芦醇能够下调MDR1在基因和蛋白水平的表达从而增加多柔比星在胞内的蓄积[25]。作者最近发现,白藜芦醇能够通过PI3K/Akt/mTOR通路下调P-gp的表达从而增强乌苯美司在K562耐药细胞株中的抗增殖活性[26]。同时,白藜芦醇能够调节大鼠肠道中P-gp在基因和蛋白水平的变化,进而影响乌苯美司在大鼠体内的药代动力学过程[15]。
2.2.2 白藜芦醇对MRPs的影响MRP家族包括9个MRP蛋白(MRP1-MRP9)。研究比较广泛的是MRP1、MRP2和MRP3。MPR2和MPR3在肝脏及肾脏都有表达,而MRP1在耐多柔比星的肿瘤细胞中高表达。这三个转运体的底物有很大程度的重叠性。MRP2的底物包括许多内源合成的代谢物如葡糖醛酸胆红素、17β-葡糖醛酸雌二醇等[27]。此外,一些临床常用药物已经被证明是其底物,如甲氨蝶呤、美法仑和他汀类药物[28]。白藜芦醇能够在一定程度上调控这3个转运体的表达。据报道[29],白藜芦醇在急性髓性白血病细胞中逆转多柔比星的耐药可能与下调MRP1的表达相关。研究[30]发现,白藜芦醇及其代谢物经MRP2转运体转运。白藜芦醇对MRP2的表达也有一定程度的影响。连续给予大鼠白藜芦醇两 周后能降低大鼠小肠中Mrp2在基因和蛋白的表达水 平[15]。有研究表明,白藜芦醇能够在HepG2细胞中逆转染料木素诱导的MRP2表达增加[31]。但是,在异硫氰酸α萘酯 (alpha-naphthylisothiocyanate,ANIT) 诱导的肝损伤大鼠中,白藜芦醇能够通过增加Mrp2的表达,降低肝脏损伤[32]。MRP3能够转运白藜芦醇的代谢物白藜芦醇葡糖醛酸盐。在MRP3缺失的小鼠中,白藜芦醇及其代谢物的分布发生了明显变化,同时白藜芦醇的尿排泄减少[33]。白藜芦醇同样能够改变MRP3的表达,其能够在大鼠睾丸中明显增加MRP3的表达,这可能是白藜芦醇保护甲氨蝶呤引起睾丸损伤的一种机制[34]。亦有研究表明,白藜芦醇能够降低ANIT诱导的MRP3表达增加,但详细机制尚不明确[32]。白藜芦醇对MRP4-MRP9转运体的影响鲜有报道。
2.2.3 白藜芦醇对BCRP的影响BCRP是ABCG家族的一员,表达于肠、肝、肾和脑等器官中。研究发现,许多药物已被证明是BCRP的底物,如阿昔洛韦、普伐他汀、拓扑替康等[35,36]。白藜芦醇及其部分代谢物是BCRP的底物。研究表明,白藜芦醇能够在较大浓度时增加BCRP在MCF-7和Caco-2细胞中的表达,并能够增加苯并 (α) 芘-3-硫酸盐的转运[37],其机制可能是通过Nrf2通路调节了BCRP的变化。
3 白藜芦醇对药物代谢酶的影响CYP是参与药物代谢的最主要的酶系统,主要负责大部分化合物的I相代谢[38]。这些酶有共同的活性中心,但是在活性部位有不同的三级结构,主要体现了不同酶的底物特异性。肝脏中的CYP1A2、2C9、2C19、2D6、2E1和3A4是参与机体药物代谢的主要亚型。CYPs所介导的DDI最常见的形式是一种药物抑制了由其介导的另外一种药物的代谢,进而使得被抑制的药物体内暴露量增加,甚至引发毒性反应。
3.1 白藜芦醇对CYP3A4的影响白藜芦醇能够在体内和体外抑制CYP3A4的活性。Chow等[39]研究发现,在临床实验中,连续四周给予白藜芦醇后可使受试者体内丁螺环酮的AUC增加1.33倍。同时有研究者发现在大鼠口服给予10 mg·kg-1的白藜芦醇能够明显增加CYP3A4底物尼 卡地平的Cmax[4]。同时,白藜芦醇对CYP3A4的另一经典底物地尔硫䓬也有相似的作用[24]。在体外,白 藜芦醇能够抑制CYP3A4依赖的环孢菌素的转化,其半数抑制浓度(IC50) 为4.5 μmol·L-1。同时能够通过CYP3A4抑制睾酮的6β-羟基化,其IC50为1.4 μmol·L-1 [40]。可以看出,白藜芦醇对CYP3A4的抑 制程度很明显。在人肝细胞中,白藜芦醇对CYP3A4在RNA水平的表达没有影响[41]。因此,白藜芦醇对CYP3A4的影响主要体现在其能够直接抑制CYP3A4的功能,而对CYP3A4在基因水平的变化无明显的影响。
3.2 白藜芦醇对CYP1A1 和CYP1A2的影响Chow等[39]发现在健康受试者中连续每天给予白藜芦醇后,通过测量咖啡因及其代谢物副黄嘌呤的比率表明,白藜芦醇对CYP1A2产生了诱导作用。在大鼠实验中,给予白藜芦醇后大鼠肝脏中的CYP1A2的表达有适度的增加。在另外一项研究中发现,当Caco-2细胞用白藜芦醇孵育24小时后CYP1A1的 活性明显增加[42]。在体外研究中,白藜芦醇似乎是CYP1A1/2的抑制剂,但抑制效果不是很明显[43]。在乙氧基试卤灵脱乙基的活性实验中,在肝微粒体或包含CYP1A1和CYP1A2的重组体中白藜芦醇的IC50分别为150、40和30 μmol·L-1 [44]。在临床实验中,白藜芦醇能够诱导CYP1A1和CYP1A2的表达,但在体外实验中却能够抑制酶的活性,IC50值变化较大[44]。白藜芦醇能够拮抗CYP1A1基因的反式激活的过程[45]。在不同细胞系中已经证明了这个过程主要是芳香烃受体核转位蛋白 (aryl hydrocarbon receptor,AHR) 与多环芳烃的相互作用,然而白藜芦醇作用于这个受体的能力及作为这个受体的拮抗剂还存在争论[45]。有学者发现,白藜芦醇之所以能够抑制CYP1A1转录,是因为其能够阻止细胞质中的AHR配体结合形式转化为核内的DNA结合形式。例如,白藜芦醇能够抑制CYP1A1的诱导剂苯并 (α) 芘在小鼠肺中对CYP1A1产生的诱导作用[46]。同时有研究表明,白藜芦醇在人的肝微粒体中经CYP1A2进行代谢,其代谢产物为白皮杉醇和四羟基芪。
3.3 白藜芦醇对CYP2D6和CYP2C9的影响研究发现,服用右美沙芬、氯沙坦8小时后尿中的右美沙芬与代谢物右啡烷的比率及氯沙坦及其代谢产物E3174的比率说明了白藜芦醇能够降低CYP2D6和CYP2C9的活性[39]。在体外实验中,白藜芦醇对人类同工酶CYP2D6和CYP2C9 cDNA的重组体无抑制作用,但是对在大肠杆菌中的异源表达的CYP2D6和CYP2C9的IC50值分别为9.8和2.3 μmol·L-1 [47]。同时研究证实白藜芦醇的代谢产物白藜芦醇-3-硫酸酯对CYP2C9活性没有抑制作用[43]。
3.4 白藜芦醇对CYP2E1的影响白藜芦醇是一个很弱的非竞争性的可逆的CYP2E1的抑制剂,在大鼠及人的肝微粒体中的IC50值分别为75和150 μmol·L-1 [44]。在丙酮诱导的小鼠的肝微粒体中,白藜芦醇能够抑制对硝基苯酚羟化酶,其IC50值为18.5 μmol·L-1 [48]。说明白藜芦醇和其他药物发生基于CYP2E1的DDI可能性较小。
3.5 白藜芦醇对肠道CYP、P-gp的抑制及可能的相互作用由于食物中白藜芦醇的量较低,一般不太可能发生DDI。如红酒中白藜芦醇量从0.3到15 mg·L-1不等。但是白藜芦醇作为营养补充剂时,能够通过抑制肠道CYP3A4导致严重的DDI。例如,大鼠口服2.5 mg·kg-1的白藜芦醇能够显著增加地尔硫䓬和尼卡地平的生物利用度,地尔硫䓬和尼卡地平的Cmax和AUC均明显增加。原因是白藜芦醇减少了药物在肠道的代谢,增加了吸收。在人体实验中发现白藜芦醇增加了CYP3A4的底物丁螺环酮的AUC。虽然增加的程度只是空白组的1.33倍,但是值得注意的是,由于丁螺环酮首过代谢的影响,其生物利用度只有5%,因此,观察到的效应可能是由于抑制了肠道的CYP3A4[49]。同时在体外实验中发现大剂量的白藜芦醇能够抑制P-gp的功能,从而增加药物的吸收[24]。因此当大剂量的白藜芦醇与CYP及P-gp底物药物合用时,应该考虑可能发生的DDI。
4 结语药物转运体和代谢酶是影响口服药物生物利用度的两个关键因素。近年的研究发现,白藜芦醇对多种转运体和代谢酶的功能及表达都有影响。本文讨论了白藜芦醇对转运体和代谢酶的功能及表达的影响,同时列举了白藜芦醇与一些药物合用时可能发生的DDI。白藜芦醇对药物转运体及代谢酶的诱导与抑制,使得在临床上与其相应转运体及其代谢酶底物药物合用时会产生DDI,甚至可能导致毒性反应的发生。此时应该相应的调整给药方案,达到提高疗效、降低毒性的最佳治疗效果。
| [1] | Maier-Salamon A, Bohmdorfer M, Thalhammer T, et al. Hepatic glucuronidation of resveratrol:interspecies comparison of enzyme kinetic profiles in human, mouse, rat, and dog[J]. Drug Metab Pharmacokinet, 2011, 26:364-373. |
| [2] | Li JP. Resveratrol caused apoptosis in QGY-7701 cells[J]. Eur Rev Med Pharmacol Sci, 2015, 19:3303-3308. |
| [3] | Trung LQ, Espinoza JL, An DT, et al. Resveratrol selectively induces apoptosis in malignant cells with the JAK2V617F mutation by inhibiting the JAK2 pathway[J]. Mol Nutr Food Res, 2015, 59:2143-2154. |
| [4] | Choi JS, Choi BC, Kang KW. Effect of resveratrol on the pharmacokinetics of oral and intravenous nicardipine in rats:possible role of P-glycoprotein inhibition by resveratrol[J]. Pharmazie, 2009, 64:49-52. |
| [5] | Giacomini KM, Huang SM, Tweedie DJ, et al. Membrane transporters in drug development[J]. Nat Rev Drug Discov, 2010, 9:215-236. |
| [6] | Wang L, Liu KX. Alteration of related transporters and its application significance in common intestinal disease, liver disease, renal disease and diabetes[J]. Acta Pharm Sin (药学学报), 2015, 50:127-132. |
| [7] | Shitara Y, Sato H, Sugiyama Y. Evaluation of drug-drug interaction in the hepatobiliary and renal transport of drugs[J]. Annu Rev Pharmacol Toxicol, 2005, 45:689-723. |
| [8] | Liu Z, Wang C, Liu Q, et al. Uptake, transport and regulation of JBP485 by PEPT1 in vitro and in vivo[J]. Peptides, 2011, 32:747-754. |
| [9] | Zhang J, Wang C, Liu Q, et al. Pharmacokinetic interaction between JBP485 and cephalexin in rats[J]. Drug Metab Dispos, 2010, 38:930-938. |
| [10] | Wang L, Wang C, Peng J, et al. Dioscin enhances methotrexate absorption by down-regulating MDR1 in vitro and in vivo[J]. Toxicol Appl Pharmacol, 2014, 277:146-154. |
| [11] | Cheng X, Gu J, Klaassen CD. Adaptive hepatic and intestinal alterations in mice after deletion of NADPH-cytochrome P450 oxidoreductase (Cpr) in hepatocytes[J]. Drug Metab Dispos, 2014, 42:1826-1833. |
| [12] | Liska DJ. The detoxification enzyme systems[J]. Altern Med Rev, 1998, 3:187-198. |
| [13] | Liston HL, Markowitz JS, DeVane CL. Drug glucuronidation in clinical psychopharmacology[J]. J Clin Psychopharmacol, 2001, 21:500-515. |
| [14] | Geillinger KE, Kipp AP, Schink K, et al. Nrf2 regulates the expression of the peptide transporter PEPT1 in the human colon carcinoma cell line Caco-2[J]. Biochim Biophys Acta, 2014, 1840:1747-1754. |
| [15] | Jia Y, Liu Z, Huo X, et al. Enhancement effect of resveratrol on the intestinal absorption of bestatin by regulating PEPT1, MDR1 and MRP2 in vivo and in vitro[J]. Int J Pharm, 2015, 495:588-598. |
| [16] | Cui Y, Konig J, Leier I, et al. Hepatic uptake of bilirubin and its conjugates by the human organic anion transporter SLC21A6[J]. J Biol Chem, 2001, 276:9626-9630. |
| [17] | Kindla J, Muller F, Mieth M, et al. Influence of non-steroidal anti-inflammatory drugs on organic anion transporting polypeptide (OATP) 1B1- and OATP1B3-mediated drug transport[J]. Drug Metab Dispos, 2011, 39:1047-1053. |
| [18] | Roth M, Timmermann BN, Hagenbuch B. Interactions of green tea catechins with organic anion-transporting polypeptides[J]. Drug Metab Dispos, 2011, 39:920-926. |
| [19] | Riha J, Brenner S, Bohmdorfer M, et al. Resveratrol and its major sulfated conjugates are substrates of organic anion transporting polypeptides (OATPs):impact on growth of ZR-75-1 breast cancer cells[J]. Mol Nutr Food Res, 2014, 58:1830-1842. |
| [20] | Chothe PP, Swaan PW. Resveratrol promotes degradation of the human bile acid transporter ASBT (SLC10A2)[J]. Biochem J, 2014, 459:301-312. |
| [21] | Yerasi N, Vurimindi H, Devarakonda K. Frog intestinal perfusion to evaluate drug permeability:application to P-gp and CYP3A4 substrates[J]. Front Pharmacol, 2015, 6:141. |
| [22] | Chen T, Wang C, Liu Q, et al. Dasatinib reverses the multidrug resistance of breast cancer MCF-7 cells to doxorubicin by downregulating P-gp expression via inhibiting the activation of ERK signaling pathway[J]. Cancer Biol Ther, 2015, 16:106-114. |
| [23] | Planas JM, Alfaras I, Colom H, et al. The bioavailability and distribution of trans-resveratrol are constrained by ABC transporters[J]. Arch Biochem Biophys, 2012, 527:67-73. |
| [24] | Hong SP, Choi DH, Choi JS. Effects of resveratrol on the pharmacokinetics of diltiazem and its major metabolite, desacetyldiltiazem, in rats[J]. Cardiovasc Ther, 2008, 26:269-275. |
| [25] | Kim TH, Shin YJ, Won AJ, et al. Resveratrol enhances chemosensitivity of doxorubicin in multidrug-resistant human breast cancer cells via increased cellular influx of doxorubicin[J]. Biochim Biophys Acta, 2014, 1840:615-625. |
| [26] | Wang L, Wang C, Jia Y, et al. Resveratrol increases anti-proliferative activity of bestatin through downregulating P-glycoprotein expression via inhibiting PI3K/Akt/mTOR pathway in K562/ADR cells[J]. J Cell Biochem, 2015. DOI:10.1002/jcb.25407. |
| [27] | Kamisako T, Leier I, Cui Y, et al. Transport of monoglucuronosyl and bisglucuronosyl bilirubin by recombinant human and rat multidrug resistance protein 2[J]. Hepatology, 1999, 30:485-490. |
| [28] | Masuda M, I'izuka Y, Yamazaki M, et al. Methotrexate is excreted into the bile by canalicular multispecific organic anion transporter in rats[J]. Cancer Res, 1997, 57:3506-3510. |
| [29] | Kweon SH, Song JH, Kim TS. Resveratrol-mediated reversal of doxorubicin resistance in acute myeloid leukemia cells via downregulation of MRP1 expression[J]. Biochem Biophys Res Commun, 2010, 395:104-110. |
| [30] | Juan ME, Gonzalez-Pons E, Planas JM. Multidrug resistance proteins restrain the intestinal absorption of trans-resveratrol in rats[J]. J Nutr, 2010, 140:489-495. |
| [31] | Kim JH, Chen C, Tony Kong AN. Resveratrol inhibits genistein-induced multi-drug resistance protein 2(MRP2) expression in HepG2 cells[J]. Arch Biochem Biophys, 2011, 512:160-166. |
| [32] | Wang T, Zhou ZX, Sun LX, et al. Resveratrol effectively attenuates alpha-naphthyl-isothiocyanate-induced acute cholestasis and liver injury through choleretic and anti-inflammatory mechanisms[J]. Acta Pharmacol Sin, 2014, 35:1527-1536. |
| [33] | van de Wetering K, Burkon A, Feddema W, et al. Intestinal breast cancer resistance protein (BCRP)/Bcrp1 and multidrug resistance protein 3(MRP3)/Mrp3 are involved in the pharmacokinetics of resveratrol[J]. Mol Pharmacol, 2009, 75:876-885. |
| [34] | El-Sheikh AA, Morsy MA, Al-Taher AY. Multi-drug resistance protein (Mrp) 3 may be involved in resveratrol protection against methotrexate-induced testicular damage[J]. Life Sci, 2014, 119:40-46. |
| [35] | Jonker JW, Smit JW, Brinkhuis RF, et al. Role of breast cancer resistance protein in the bioavailability and fetal penetration of topotecan[J]. J Natl Cancer Inst, 2000, 92:1651-1656. |
| [36] | Matsushima S, Maeda K, Kondo C, et al. Identification of the hepatic efflux transporters of organic anions using doubletransfected Madin-Darby canine kidney II cells expressing human organic anion-transporting polypeptide 1B1(OATP1B1)/multidrug resistance-associated protein 2, OATP1B1/multidrug resistance 1, and OATP1B1/breast cancer resistance protein[J]. J Pharmacol Exp Ther, 2005, 314:1059-1067. |
| [37] | Ebert B, Seidel A, Lampen A. Phytochemicals induce breast cancer resistance protein in Caco-2 cells and enhance the transport of benzo[a]pyrene-3-sulfate[J]. Toxicol Sci, 2007, 96:227-236. |
| [38] | Wang C, Liu KX. The drug-drug interaction mediated by efflux transporters and CYP450 enzymes[J]. Acta Pharm Sin (药学学报), 2014, 49:590-595. |
| [39] | Chow HH, Garland LL, Hsu CH, et al. Resveratrol modulates drug- and carcinogen-metabolizing enzymes in a healthy volunteer study[J]. Cancer Prev Res (Phila), 2010, 3:1168-1175. |
| [40] | Regev-Shoshani G, Shoseyov O, Kerem Z. Influence of lipophilicity on the interactions of hydroxy stilbenes with cytochrome P4503A4[J]. Biochem Biophys Res Commun, 2004, 323:668-673. |
| [41] | Raucy JL. Regulation of CYP3A4 expression in human hepatocytes by pharmaceuticals and natural products[J]. Drug Metab Dispos, 2003, 31:533-539. |
| [42] | Sergent T, Dupont I, Van der Heiden E, et al. CYP1A1 and CYP3A4 modulation by dietary flavonoids in human intestinal Caco-2 cells[J]. Toxicol Lett, 2009, 191:216-222. |
| [43] | Yu C, Shin YG, Kosmeder JW, et al. Liquid chromatography/tandem mass spectrometric determination of inhibition of human cytochrome P450 isozymes by resveratrol and resveratrol-3-sulfate[J]. Rapid Commun Mass Spectrom, 2003, 17:307-313. |
| [44] | Piver B, Berthou F, Dreano Y, et al. Inhibition of CYP3A, CYP1A and CYP2E1 activities by resveratrol and other non volatile red wine components[J]. Toxicol Lett, 2001, 125:83-91. |
| [45] | Gusman J, Malonne H, Atassi G. A reappraisal of the potential chemopreventive and chemotherapeutic properties of resveratrol[J]. Carcinogenesis, 2001, 22:1111-1117. |
| [46] | Revel A, Raanani H, Younglai E, et al. Resveratrol, a natural aryl hydrocarbon receptor antagonist, protects lung from DNA damage and apoptosis caused by benzo[a]pyrene[J]. J Appl Toxicol, 2003, 23:255-261. |
| [47] | McLaughlin LA, Dickmann LJ, Wolf CR, et al. Functional expression and comparative characterization of nine murine cytochromes P450 by fluorescent inhibition screening[J]. Drug Metab Dispos, 2008, 36:1322-1331. |
| [48] | Mikstacka R, Gnojkowski J, Baer-Dubowska W. Effect of natural phenols on the catalytic activity of cytochrome P4502E1[J]. Acta Biochim Pol, 2002, 49:917-925. |
| [49] | Lilja JJ, Kivistö KT, Backman JT, et al. Grapefruit juice substantially increases plasma concentrations of buspirone[J]. Clin Pharmacol Ther, 1998, 64:655-660. |
 2016, Vol. 51
2016, Vol. 51


