紫杉醇为临床常用抗癌药,最早发现于植物红豆杉,1970年发现了其抗癌作用,1992年获得美国FDA批准上市[1],我国于1993年开始生产紫杉醇,目前主要来源为天然提取,此外还有半合成与生物发酵[2],其制剂为紫杉醇注射液。
由于紫杉醇为天然提取物,含同系列杂质较多,因此较合成化学药物的杂质控制难度更大。紫杉醇结构复杂,其二萜类母环具有11个手性中心,带有多个羟基、氨基等基团。强制降解实验表明,紫杉烷类化合物对热、碱、水解等均不稳定,易水解、手性中心易反转,因而在制备和贮存过程中易变质,在酸、碱或湿、热条件下极易形成差向化、脱酰基、氧化、水解等降解杂质[3]。美国药典 (38版)、欧洲药典 (8.0版) 等国外药典已经将紫杉醇根据来源分别规定了多个已知杂质,施贵宝制药公司研究人员[4]于1997年采用液质联用的方法对紫杉醇中的降解杂质进行了研究,鉴定了3~5、7、8与氧杂环丁烷开环产物 (oxetane ring opened product) 等6个降解杂质的结构。中国药典 (2010版) 首次收载了该品种,收载了杂质1~3,与国外药典及企业对杂质的控制水平有较大差距,因此非常有必要对国内产品进行全面的质量研究与评价。
本文收集了国内几乎所有目前在生产的9个企业的紫杉醇及15个企业的紫杉醇注射液的产品 (包括一部分近效期的产品),分别对原料与制剂中的杂质进行了考察,发现制剂中杂质较多,因此建立了快速、灵敏的超高效液相-三重四级杆质谱联用技术 (UPLC-MS/MS),并通过强制降解实验,对紫杉醇 原料和制剂中的杂质谱进行了分析,对紫杉醇及其杂质的质谱裂解规律与途径进行了分析与归纳,推定了10个杂质的结构。该研究成果对于国内紫杉醇及其注射液的工艺研究、质量控制与评价有较大的意义。
材料与方法 仪器、试药与材料Agilent 1100高效液相色谱系统 (美国安捷伦公司); Waters 2690高效液相色谱系统 (美国沃特世公司); Waters AcquityTM UPLC- Quattro Premier XE QQQ质谱仪,AcquityTM PDA检测器,Masslynx工作站 (美国Waters公司); Thermo LTQ ORBITRAP XL 高分辨质谱 (美国赛默飞公司); Mettler Toledo AE240型电子天平 (瑞士Mettler公 司); Mettler MP230型pH计(瑞士Mettler公司)。乙腈、甲醇 (色谱纯,Dikma公司),纯水(Millipore超纯水系统制备)。紫杉醇原料由国内9家企业提供,注射液由国内15家企业提供。对照品: 三尖杉宁碱 (cephalomannine,100926-200701)、7-表-10-脱乙酰紫杉醇(7-epi-10-deacetylpaclitaxel,100925-200701)、7-表紫杉醇 (7-epi-paclitaxel,100927-200701) 均来自于中国食品药品检定研究院,巴卡汀 (baccatin Ⅲ) 与10-脱乙酰紫杉醇 (10-deacetylpaclitaxel) 均来自于桂林辉昂药业。
HPLC色谱条件[5]色谱柱: Agilent Zorbax Elipse C18柱 (250 mm × 4.6 mm,5 μm),以乙腈-水为流动相进行梯度洗脱,初始流动相为乙腈-水 (40∶60),洗脱至主峰出完 (约35 min),然后25 min后,乙腈的比例增至80%,接着10 min后,乙腈的比例降至40%,保持10 min,流速为1.5 mL·min-1,柱温为30 ℃,检测波长为227 nm,进样体积为10 µL。
UPLC-MS/MS条件色谱柱为C18,Acquity UPLCTM BEH (50 mm × 2.1 mm,1.7 μm),流动相A为水,流动相B为乙腈,梯度洗脱 (0→10 min,65%→ 65% A; 10→15 min,65%→20% A; 15→16 min,20%→ 65% A; 16→18 min,65%→65% A); 流速为0.25 mL·min-1,进样量为3 μL。采用正离子与负离子电离方式,毛细管电压为2.0~3.0 kV,样品锥孔电压为20~30 V,源温度120 ℃,脱溶剂气温度为350 ℃,脱溶剂气流速为600 L·h-1,碰撞电压为10~20 V。
样品溶液与对照溶液的制备精密称取各企业原料或注射液适量,加甲醇制成0.5 mg·mL-1的溶 液,作为供试品溶液; 精密量取适量,加甲醇稀释成0.5 μg·mL-1的溶液,作为对照溶液。
强制降解实验 贮备液精密称取杂质含量较低的1号企业原料50 mg,置100 mL量瓶中,加乙醇适量溶解,并定容至刻度,摇匀,作为强制降解实验用样品贮备液。
碱降解溶液精密量取贮备液10 mL置25 mL量瓶中,加0.01 mol·L-1氢氧化钠溶液1 mL,30 min后加0.01 mol·L-1盐酸1 mL中和,即得。
酸降解溶液精密量取贮备液10 mL置25 mL量瓶中,加0.1 mol·L-1盐酸溶液1 mL,16 h后加0.1 mol·L-1氢氧化钠1 mL中和,即得。
氧化降解溶液精密量取贮备液10 mL置25 mL量瓶中,加3% H2O2 1 mL反应16 h即得。
高温降解溶液精密量取贮备液10 mL置25 mL量瓶中,在70 ℃水浴中放置7 h。
光降解溶液精密量取贮备液10 mL置25 mL量瓶中,进行光照破坏 (4 000 lux照射48 h)。
光降解溶液 (原料)取原料 (1号企业) 适量,进行光照破坏 (4 000 lux照射48 h),称取适量,用乙醇溶解并制成0.5 mg·mL-1的溶液。
结果与讨论 1 样品中有关物质的测定 1.1 原料药中有关物质的测定对国内9家原料进行有关物质测定的结果表明杂质含量均较低,主要存在杂质1~3,总杂质含量在0.11%~0.60% 之间。
1.2 紫杉醇注射液中有关物质的测定对国内15家企业制剂进行有关物质检测,测定结果表明制剂中杂质的个数与含量明显高于原料 (表 1),特别是近效期的样品,杂质个数较多,个别企业杂质含量超过限度。说明紫杉醇制剂较容易发生降解,稳定性较差。其中杂质3、4和7含量较高,此外紫杉醇注射液中亦可见到明显的辅料聚氧乙基蓖麻油 (cremophor EL) 的色谱峰。
|
|
Table 1 The detemination results of impurities in paclitaxel injections. RRT is the relative retention time of impurity peak to the peak of paclitaxel |
对紫杉醇原料及紫杉醇降解溶液中杂质的分析采用建立的UPLC-MS/MS方法,对紫杉醇原料样品溶液以及酸、碱、氧化、高温与光等降解溶液进行分析,得到降解杂质1~10的一级与二级质谱信息。
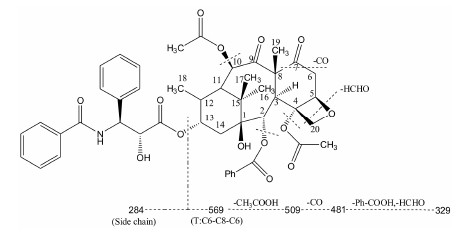
2.2 紫杉醇的裂解途径分析文献[6, 7]报道了紫杉醇容易发生裂解的位点与裂解规律,在电喷雾电离条件下,准分子离子峰为855,m/z 569是由准分子离子峰丢失完整的侧链得到,乙基侧链的离子峰为m/z 286,在源内碰撞诱导解离条件下,离子碎片容易丢失中性小分子H2O (m/z 18)、CH3COOH (m/z 60) 和Ph-COOH (m/z 122)。文献[8, 9]均报道富含氧原子的结构容易形成 [M+Na]+的离子,文献[10]报道紫杉醇在ESI源电离时主要得到 [M+Na]+与 [M+K]+的离子,紫杉醇有多个含氧的基团,本文鉴定的杂质一级质谱图中,[M+Na]+亦为主要的基峰。结合参考文献[4,11-14],本文对紫杉醇裂解机制进行了分析与归纳,见图 1 (以下ScH代表侧链,T代表C6-C8-C6环)。并根据紫杉醇的裂解规律对杂质的结构进行了推测与解析。
 | Figure 1 Proposed fragmentation pathway for paclitaxel |
原料中主要的3个杂质,杂质1的准分子离子峰为m/z 832 [M+H]+,主要碎片离子峰为m/z 754 [M-CH3COOH-H2O+H]+、m/z 569 [M-ScH+H]+、m/z 509 [M-CH3COOH-ScH+H]+与m/z 264 [M-T+H]+,鉴定为三尖杉宁碱,杂质1在侧链的结构上与紫杉醇有较大区别,一般降解实验不能实现这种结构的变化,因此推测为天然提取工艺中的杂质。杂质2的一级质谱加合离子峰为m/z 834 [M+Na]+,杂质3的准分子离子峰为m/z 854 [M+H]+,根据其主要碎片离子峰,分别鉴定为7-表-10-去乙酰紫杉醇与7-表紫杉醇。推测可能是提取工艺中的天然杂质也可能为降解产物。杂质1~3均与相应的杂质对照品质谱图一致。
2.4 降解杂质结构分析在强制降解实验杂质研究中,除了在原料中已经鉴定的杂质2与3亦为降解杂质外,还鉴定出了杂质4~10 (表 2,图 2)。
|
|
Table 2 Data of paclitaxel impurities identified by UPLC-MS/MS |
 | Figure 2 The chemical structures of paclitaxel impurities. Ethyl ester side chain (5),7-epi-baccatin III (6),paclitaxel isomer (C3-C11 bridge) (8),paclitaxel isomer (9),and N-benzoyl-(2R,3S)-3-phenylisoserine (10),impurity 9 had never been reported |
杂质4 该杂质为注射液里常见的降解杂质,在酸、碱、光照、加热条件下,均较容易产生,一级质谱加合离子峰为m/z 609 [M+Na]+,其碎片峰分别为m/z 549 [M-CH3COOH+Na]+、m/z 521 [M-CH3COOH- H2O+Na]+、m/z 427 [M-CH3COOH-Ph-COOH+Na]+与m/z 367 [M−2CH3COOH-Ph-COOH+Na]+,鉴定为巴卡汀Ⅲ,与巴卡汀Ⅲ对照品质谱图一致。
杂质5 该杂质保留时间与杂质4相邻,且经常与杂质4同时存在,其裂解途径推测如图 3,其产生原因可能为紫杉醇侧链断裂产生了杂质4与乙基侧链,同时乙基侧链可以与紫杉醇裂解产生的CH3COOH反应生成紫杉醇侧链乙酯化合物,与文献[4]报道一致。
 | Figure 3 Proposed fragmentation pathway for impurity 5 |
杂质6 该杂质在酸、碱、加热等条件下产生,含量较低,ESI+一级质谱加合离子峰为m/z 609 [M+Na]+,其二级碎片峰与巴卡汀Ⅲ基本一致,应为其同分异构体,采用ESI-质谱条件进行分析,一级质谱主要含有两个较明显的基峰,分别为631与585,推测分别为 [M+HCOOH-H]-与 [M-H]-,二级质谱与巴卡汀Ⅲ相比,则多出m/z 433峰,根据文献[15]报道,所有具有10-DAB母核及C-13侧链的紫杉烷类C-7α异构体化合物中,m/z [M-152(-Ph-COOH-HCOH)-H]-是最主要的特征碎片,且C-7α位异构体比C-7β位异构体的保留时间更长,因此推测该化合物为降解杂质巴卡汀Ⅲ的7位羟基继续发生差向异构体化反应,生成7-表巴卡汀。该化合物为首次报道的紫杉醇降解杂质。
杂质7 为常见的降解杂质,在酸、碱、光照、加热条件下,均较容易产生,一级质谱加合离子峰m/z 834 [M+Na]+,主要碎片峰为m/z 549 [M-ScH+ Na]+、m/z 308 [M-T+Na]+,与紫杉醇相比,分子量少了43,推测该化合物可能为紫杉醇发生了去乙酰化反应,鉴定为10-去乙酰紫杉醇,与10-去乙酰紫杉醇对照品质谱图一致。
杂质8 为紫杉醇原料直接光照产生的独有且主要的降解产物,其RRT为0.73,一级质谱加合离子峰为m/z 876 [M+Na]+,说明该化合物相对分子质量为854,与紫杉醇为同分异构体,其碎片峰m/z 816 [M- CH3COOH+Na]+、m/z 531 [M-ScH-CH3COOH+H]+较为明显,但没有紫杉醇中较明显的m/z 569碎片峰,其相对保留时间与碎片峰与文献[4]报道的紫杉醇异构体 (C3-C11桥联化合物) 的碎片峰基本一致,其反应机制为紫杉醇发生重排反应生成桥联化合物,因此其准分子离子峰也更容易失去CH3COOH而生成794的碎片,其569碎片峰则更容易失去CH3COOH成为509的碎片峰。
杂质9 为紫杉醇乙醇溶液光照产生的杂质,其RRT为1.24,一级质谱加合离子峰为m/z 876 [M+Na]+ (图 4),高分辨质谱显示其准分子离子峰为854.339 0,分子量与紫杉醇相同,其中碎片峰794、509、286的加钠峰与紫杉醇典型碎片峰相似,即结构与紫杉醇类似,较为特征的481与329的加钠峰在紫杉醇二级质谱中未出现,而紫杉醇二级质谱中常见的丢失H2O (-18) 现象在杂质9中并未出现。对杂质9二级质谱图进一步分析,从509到481丢失28的碎片峰,而329也较紫杉醇的特征碎片峰327多2,因此推测紫杉醇在乙醇溶液中经光照诱导发生自由基反应,11,12位的双键可能打开成为单键,7位 -OH生成酮基,可以丢失CO (28) 碎片峰,推定杂质9的结构见图 5,其分子式C47H51NO14与高分辨质谱软件预测最佳分子式一致,采用ChemAxon软件预测杂质9与紫杉醇的CLogP值分别为4.795与3.298,即杂质9的极性小于紫杉醇,符合其在反向色谱中保留时间长于紫杉醇的现象。命名为 (2α,4α,5β,10β,13α)-4,10-bis(acetyloxy)-13-{[(2R,3S)-3-(benzoylamino)-2-hydroxy-3- phenylpropanoyl]oxy}-1-hydroxy-7,9-dioxo-5,20-epoxy tax-2-yl benzoate,该结构仍需要结合NMR等方法进一步确证。
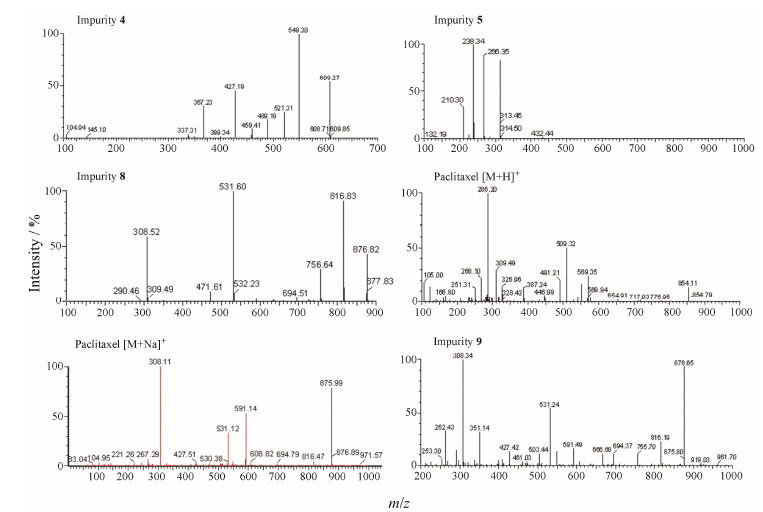 | Figure 4 MS/MS spectrums of paclitaxel and impurities (4,5,8,9) |
 | Figure 5 Proposed fragmentation pathway for impurity 9 |
杂质10 为紫杉醇乙醇溶液碱降解产生的杂质,准分子离子峰为m/z 284 [M-H]-,其碎片峰为m/z 266 [M-H-H2O]-、m/z 238 [M-H-COOH]-,推测为紫杉醇断裂产生的侧链碎片,为N-苯甲酰基-(2R,3S)-3-苯基异丝氨酸,与文献[8]报道一致。
结论由于紫杉醇为难溶的脂溶性化合物,其注射液的配方组成基本由紫杉醇、聚氧乙基蓖麻油 (助溶剂与稳定剂)、乙醇 (助溶剂) 组成。其中聚氧乙基蓖麻油有较强的基质效应,因此难以将紫杉醇注射液溶液直接接入质谱对杂质进行分析,基于上述两个原因,本文采用了只加入处方中另一主要辅料乙醇,即对紫杉醇乙醇溶液进行强制降解实验,较好的解决基线干扰问题,并且得到的降解杂质涵盖了紫杉醇与紫杉醇注射液中的杂质。
由于中国药典中收载原料药有关物质HPLC方法梯度洗脱时间较长 (约为60 min),本文建立了UPLC-MS-MS方法进行了杂质谱的分析研究,因中国药典2010版紫杉醇中HPLC色谱条件流动相中不含缓冲盐,因此只调整了梯度洗脱的时间程序,并分别采用两种方法对同一份降解溶液进行测定,测定的图谱峰型基本一致,因此认为两种方法测定的杂质有一一对应关系。
对杂质的生成机制进行分析,发现在酸、碱等不同的降解条件下,均较容易发生10、13、2、4位的水解断裂,降解生成杂质3~5和7,并且7位羟基较容易发生醇醛缩合与逆向醇醛缩合反应[15],从而产生差向异构化,如生成杂质2、3、6。而在光照条件下,紫杉醇原料直接光照产生与紫杉醇乙醇溶液光照产生的主要降解杂质不同,提示原料与制剂光照时的降解途径有较大的不同,分析原因为紫杉醇在乙醇的作用下首先比较容易发生的是水解反应,而且难易程度通常是C-10,13位> C-2位 > C-4位[16],同时发生了自由基反应,产生了杂质9,而紫杉醇原料在无乙醇的光照环境中,则优先发生裂环-环合的重排反应,生成了杂质8。杂质6和9为本文首次报道的紫杉醇降解杂质。本文研究成果提示在紫杉醇注射液的包装、贮存、运输等环节中需要十分注意,并对国内紫杉醇及其注射液的杂质控制和质量标准的有效制订提供了详实的数据支持。
| [1] | Rodríguez-Antona C. Pharmacogenomics of paclitaxel[J]. Pharmacogenomics, 2010, 11:621-623. |
| [2] | The United States Pharmacopoeial Convention. The United States Pharmacopoeia 38/The National Formulary 33[S]. Baltimore:United Book Press, Inc, 2015:4732-4734. |
| [3] | Zhang P, Sun J, Zhang WJ, et al. Method for purifying taxane compound:CN, 101648928(A)[P]. 2010-2-17. |
| [4] | Volk KJ, Hill SE, Kerns EH, et al. Profiling degradants of paclitaxel using liquid chromatography-mass spectrometry and liquid chromatography-tandem mass spectrometry substructural techniques[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 1997, 696:99-115. |
| [5] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2010 ed. Vol II. Beijing:China Medical Science Press, 2010:1007. |
| [6] | Zhang J, Duan JC, Liang Z, et al. Separation and identification of taxol in the crude extracts of Taxus cuspidata and its callus culture with HPLC-ESI-MS/MS[J]. Acta Pharma Sin (药学学报), 2006, 41:863-866. |
| [7] | Ma WX, Wang H, Wang TT, et al. Fragmentation behaviors of taxanes drugs using electrospray ionization with quadrupole time-of-flight mass spectrometry[J]. Acta Pharm Sin (药学学报), 2013, 48:1812-1816. |
| [8] | Rao YK, Wang M, Ding L, et al. Identification of the related substances in docetaxel injection by LC-MS/MS[J]. Acta Pharm Sin (药学学报), 2012, 47:779-784. |
| [9] | Jonkers N, Govers H, Voogt PD. Adduct formation in LC-ESI-MS of nonylphenol ethoxylates:mass spectrometrical,theoretical and quantitative analytical aspects[J]. Anal Chim Acta, 2005, 531:217-228. |
| [10] | Mortier KA, Zhang GF, Peteghem CHV, et al. Adduct formation in quantitative bioanalysis:effect of ioniazation conditions on paclitaxel[J]. J Am Soc Mass Spectrom, 2004, 15:585-592. |
| [11] | Abliz Z, Fang QC, Liang XT, et al. Study on fragmentation behaviors of taxoids by tandem mass spectrometry[J]. Chin Sci Bull (科学通报), 1999, 44:691-703. |
| [12] | Tian J, Stella VJ. Degradation of paclitaxel and related compounds in aqueous solutions II:nonepimerization degradation under neutral to basic pH conditions[J]. J Pharm Sci, 2008, 97:3100-3108. |
| [13] | Tian J, Stella VJ. Degradation of paclitaxel and related compounds in aqueous solutions III:degradation under acidic pH conditions and overall kinetics[J]. J Pharm Sci, 2010, 99:1288-1298. |
| [14] | Ge GB, Luan HW, Zhang YY, et al. Profiling of yew hair roots from various species using ultra-performance liquid chromatography/electrospray ionization mass spectrometry[J]. Rapid Commun Mass Spectrom, 2008, 22:2315-232. |
| [15] | Tian J, Stella VJ. Degradation of paclitaxel and related compounds in aqueous solutions I:epimerization[J]. J Pharm Sci, 2008, 97:1224-1235. |
| [16] | Fang WS, Fang QC, Liang XT, et al. Chemical reactivities and the structural modifications of the parent nucleuses of taxol and its analogues[J]. Acta Pharm Sin (药学学报), 1998, 33:310-320. |
 2016, Vol. 51
2016, Vol. 51


