Ⅱ型糖尿病(T2DM)是一种由于胰岛素抵抗或胰岛素分泌缺陷导致的以慢性血糖升高为特征的代谢异常综合征,T2DM患者约占糖尿病患者总数的90%~95%。目前T2DM治疗的常用药物有抑制肝脏糖异生的二甲双胍类药物、磺酰脲类胰岛素促泌剂、噻唑烷二酮类胰岛素增敏剂和抑制肠吸收的α-糖苷酶抑制剂。这些药物对胰岛β细胞的进行性衰退无能为力,存在随着治疗时间延长单药治疗失败率增加的问题,已经不能有效遏制并发症的发病和进展,经常需要与不同机制的降糖药物联合应用。因此,迫切需要新型降糖药物的出现。二肽基肽酶-4(dipeptidyl peptidase IV,DPP-IV)是一个多功能的II型跨膜丝氨酸肽酶,参与调节多种生理过程,其蛋白晶体结构于2003年首次被报道[1]。同年,其降血糖活性位点也被证实并随后陆续出现了DPP-IV抑制剂的研究报道[2, 3, 4, 5]。近年来DPP-IV已经成为T2DM治疗药物研究的重要靶点。研究表明,DPP-IV能够快速水解肠促胰岛素胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)使其失活,而GLP-1是具有增强胰岛β-细胞的糖促胰岛素分泌,促进胰岛素生物合成,抑制餐后胰高血糖素释放功能的天然活性肽。GLP-1也能够降低胃排空的速率,降低食欲,还能增加胰岛β-细胞的数量[6]。因此,活性GLP-1的存在对于帮助恢复并维持正常血糖水平至关重要。但在生理条件下,DPP-IV对GLP-1的快速降解会导致GLP-1的肠促降糖素效应很短暂,因此,DPP-IV抑制剂的研发对于保持内源性GLP-1的促降糖活性具有非常重要的应用潜力。DPP-IV抑制剂通过抑制DPP-IV水解GLP-1的作用来改善GLP-1调节血糖的生物活性,在糖尿病早期应用还能起到保护β-细胞功能的作用,突破了以往药物对胰岛β-细胞功能无作用的限制。而且,降糖作用是葡萄糖浓度依赖型,因此产生低血糖的风险小,能实现延缓疾病进程、安全降血糖的效果[7]。到目前为止,已经有多种类型的DPP-IV抑制剂被FDA批准上市,作为二线降糖药应用于临床。DPP-IV抑制剂降糖效果明显,可以在不影响体重的前提下实现稳定降糖,显示出安全性好和药效长的特点,为降糖药联合应用提供了更安全的选择[8, 9, 10, 11, 12]。目前报道的DPP-IV抑制剂的主要不良反应为胃肠道反应和肝肾毒性。利拉利汀(linagliptin,LNP,图 1)是由勃林格殷格翰和礼来共同开发的DPP-IV抑制剂,2011年获得FDA批准,是首个可以单药给药的DPP-IV抑制剂。相比其他同类药物,LNP是首个经胆道和胃肠道排泄的药物,一日一次口服给药,基本以原型药物排出,因此具有肝肾毒性低、安全性好的优点,是唯一一个在T2DM患者中无需根据肝肾功能进行剂量调整的DPP-4抑制剂[13]。而且,LNP呈现了一个独特的黄嘌呤母核结构,这与之前出现的其他利汀类化合物截然不同。
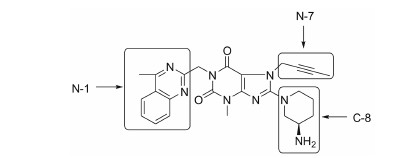 | Figure 1 Chemical structure of linagliptin (LNP)and modifying strategies |
LNP与DPP-IV蛋白的复合物结晶结构表明: LNP分子位于DPP-IV结构中酶催化域和β-螺旋域之间活性空腔中,其与DPP-IV之间的相互作用主要包括: ① C8-哌啶上的氨基氢能够与Glu205、Glu206和Tyr662形成氢键;②黄嘌呤环上的C6-羰基与Tyr631的酰胺形成氢键;③黄嘌呤环结构与Tyr547的苯环之间存在两个π-π共轭;④甲基喹唑啉环与Trp629的苯并咪唑环之间形成4个π-π共轭[12]。本研究基于上述结构阐述,拟保留黄嘌呤母体结构,通过生物电子等排基团替换,设计考察LNP的黄嘌呤结构母核上N-1、N-7和C-8取代基对DPP-IV酶抑制活性的贡献,从而希望发现新的活性结构,并对这类黄嘌呤化合物抑制DPP-IV酶的构效关系进行初步探索。本研究设计的取代基替换策略为: ①将LNP结构中N-1位的甲基喹唑啉进行开环改造或向喹唑啉环上增加氢键受体的改变,考察对该位置双环结构的依赖性;②分别以平面性相似但吸电性增强的氰甲基以及增加支链的异戊烯基替换N-7丁炔基,考察电负性和立体效应对活性的影响;③分别以3-氨甲酰基哌啶、3-氨甲基哌啶或3-氨基吡咯烷替换C-8位的3-氨基哌啶环考察环体积和3位氨基的旋转角度对活性的影响。
结果与讨论 1 目标化合物的合成本研究合成了LNP及其黄嘌呤类似物(1a~1h)8个(表 1),这些类似物均为新化合物,最终目标物结构均经核磁共振氢谱和高分辨质谱确证,经HPLC测定纯度大于97%(归一化法)。
|
|
Table 1 Physicalproperties of compounds 1a-1h |
 | Scheme 1 Synthesisroute of target compounds |
如合成路线1所示,本研究根据文献[14]报道的方法,以商业购得的3-甲基-8-溴黄嘌呤为原料,首先与溴代的烯烃、炔烃或氰基化合物在碳酸钾存在下,在DMF溶液中反应得到7位被R1取代的中间体2~4;2~4再分别与不同取代的卤代烃反应得到1位含有R2取代基的中间体5~9;中间体6、7和9分别与Boc保护氨基的3-氨基哌啶在DMSO溶液中进行亲核取代反应得到8位取代的中间体10、12和11,而这3个中间体化合物再经过三氟醋酸脱保护分别得到目标产物1(LNP)、1a和1f;中间体5~9还可直接与不同取代的哌啶或吡咯反应得到8位带有R3取代基的目标产物1b~1e以及1g和1h,波谱数据见表 2。
|
|
Table 2 Chemicalstructural characterization data of final products |
本研究首先测定了50 nmol·L-1单一给药浓度下目标化合物对DPP-IV的抑制率。测定结果显示,所有受试化合物均显示出了抑制活性。自制的LNP在50 nmol·L-1浓度下显示出100%的抑制率,其中化合物1a、1d和1f抑制率分别为98.12%、65.83%和89.02%(表 3)。
|
|
Table 3 Inhibitoryactivity of compounds against DPP-IV enzyme. Measuredconcentration is 50 nmol·L-1 for LNP and 1a-1h, measured concentration of trelaglipin is 10 nmol·L-1; **ND: Not determined |
通过进一步测定上述3个抑制率大于50%的化合物(1a、1d和1f)的IC50,从表 3的结果可以看出,1a、1d和1f活性均弱于先导物LNP。而且,化合物1a、1d和1f分别仅对应在黄嘌呤母核上N-1、C-8和N-7三个位置中的单一结构变化。可见,在保持黄嘌呤母核的基础上,取代基的改变会对活性产生明显的影响,而本研究设计的取代基替换没有实现提高活性的效果,而且同时改变N-1、C-8和N-7中任意两个位置导致活性更大程度的降低。
图 2是以LNP及化合物1a、1d和1f为例,通过分子对接产生的小分子-蛋白相互作用图,为更清晰地解释构效关系提供依据。对于N-8位取代基,LNP与1b、1c和1d的活性对比显示,将3-氨基哌啶基取代替换为3-氨甲酰哌啶基(1b)、3-氨甲基哌啶基(1c)或3-氨基吡咯烷(1d)均导致活性明显降低,其结果可以从化合物1d与DPP-IV酶蛋白(PDB ID: 2RGU)模拟对接实验解释。LNP分子结构中N-8位哌啶上的氨基能够与靶蛋白上的Glu205、Glu206和Tyr662形成4个氢键作用,但化合物1b和1c由于在氨基和哌啶间插入了羰基或亚甲基而导致小分子与靶蛋白氨基酸残基形成氢键作用减弱甚至消失,说明氨基与哌啶环的直接连接是必须的。而且,化合物1d则是将LNP的N-8位哌啶环缩小为3-氨基吡咯烷,氢键作用也被减少,活性亦降低,结合之前有报道用3-氨基哌嗪替换3-氨基哌啶也导致活性降低,证实DPP-IV抑制活性对LNP的C-8位取代基具有明显的依赖性,而且对于取代基的结构要求较为苛刻。化合物1a的N-1位用取代苯胺甲酰基代替喹唑啉基导致对DPP-IV抑制率略有降低,对接实验显示,N-1位由双芳环变为单芳环使得与Tyr547之间π-π共轭作用由4个减少为两个,可见,芳香堆积作用对活性发挥有利;1b和1g活性相当,似乎提示N-1位用同样保持两个芳环的喹唑啉酮替换甲基喹唑啉对活性影响不大,但由于二者C-8位均为3-氨甲酰基哌啶导致活性不强,因此需要进一步的实验确证喹唑啉酮基的优劣;虽然图 2显示N-7位取代基伸向溶剂空腔,与蛋白没有相互作用,应该具有更宽容的改变空间,但是氰甲基取代的1f活性弱于丁炔基取代的LNP,而丁炔取代(1b)和异戊烯基取代(1h)的活性差异不大,可以推测该位置不适合吸电性取代基。
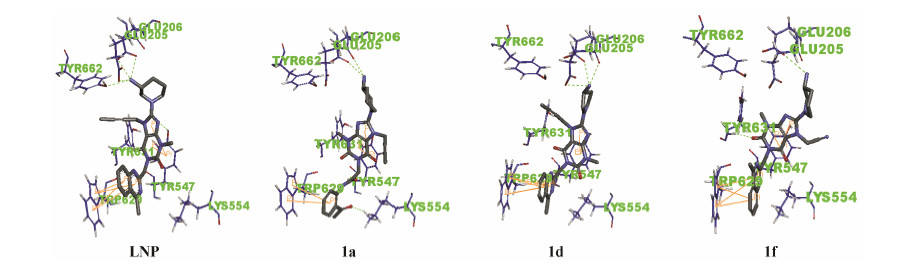 | Figure 2 CompoundsLNP, 1a, 1d and 1f bound to DPP-IV. Compounds were shown in dark blue sticks; amino acids of DPP-IV were shown in blue lines; green dashes shows the hydrogen bonds; yellowlines represents π-π aromatic stacking interactions |
化学合成除非特殊说明,所有原料和试剂均为化学纯,且经商业购得。
MERCURY-400及UNITY INOVA-500型核磁共振仪(美国Varian公司),TMS为内标。SHIMADZU公司的LCMS-2020和Thermo公司的LTQ XL质谱仪,测定离子源均为ESI+。熔点由梅特勒MP70熔点仪测定,温度未校正;薄层色谱板:德国Merck TLC 60F254硅胶铝箔板。柱色谱:青岛海洋化工厂200~300目硅胶H,干法上柱,减压柱分离,流动相:甲醇-二氯甲烷(1:10)。
DPP(IV)Inhibitor Screening Assay Kit:货号:700210,Cayman Chemical,美国;可调量程移液器(Eppendorf公司);赛多利斯BS21058天平;全波长酶标仪MD Spectramac M3(Molecular Devices);阳性对照药物为本实验室自制样品LNP和购买的曲格列汀。其他没有特殊说明的试剂均购自北京化学试剂公司。
1 化学合成 1.1 8-溴-7-[(丁-2-炔)-1-基]-3-甲基-黄嘌呤(2)的合成取3-甲基-8-溴-黄嘌呤样品1 g,溶于8 mL DMF中,搅拌下滴加入1-溴代-2-丁炔0.54 mL和1.1mL二异丙基乙基胺(DIEA),室温反应过夜。次日,过滤反应液,向滤液中加入大量二氯甲烷和水萃取,有机层蒸干,残余物用乙醚分散,过滤后得到类白色固体粗品中间体(2)0.9 g,收率:74%。1H NMR(400 MHz,DMSO-d6)δ: 11.34(s,1H),5.06(s,2H),3.32(s,3H),1.81(s,3H)。MS(ESI+)m/z 297 [M+H]+。
以合成2类似的方法,得到中间体3和4。
3:收率: 59%。1H NMR(400 MHz,CDCl3)δ: 8.19(s,1H),5.31(t,J=7.0 Hz,1H),4.95(d,J=7.0 Hz,2H),3.54(s,3H),1.88(s,3H),1.76(s,3H),MS(ESI+)m/z 313[M+H]+。
4:收率: 78%。1H NMR(400 MHz,DMSO-d6)δ: 11.48(s,1H),5.49(s,2H),3.33(s,3H)。MS(ESI+)m/z284 [M+H]+。
1.2 8-溴-7-[(3-甲基-丁-2-烯)-1-基]-3-甲基-1-[(4-甲基喹唑啉-2-基)甲基]-黄嘌呤(5)的合成取520mg粗品3,溶于约20 mL DMF中,加入碳酸钾400 mg,缓慢加入2-氯甲基-4-甲基喹唑啉400 mg,50 ℃反应至3消失,蒸除DMF,残余物加入二氯甲烷和水萃取,有机层干燥后,用硅胶柱分离得到中间体(5)500 mg,收率: 64%。1H NMR(400 MHz,DMSO-d6)δ:8.29(d,J=7.7 Hz,1H),7.99(dd,J=8.0,1.3 Hz,1H),7.70~7.55(m,1H),7.36~7.13(m,1H),5.24(t,J=6.7 Hz,1H),4.89(dd,J=23.0,6.8 Hz,2H),4.70(s,2H),3.43(s,3H),2.58(s,3H),1.80(s,3H),1.69(s,3H),MS(ESI+)m/z 469 [M+H]+。
以中间体2为原料,按照与中间体5合成类似的方法,得到中间体6~8,以中间体4为原料,按照与中间体5合成类似的方法,得到粗品中间体9。
6:收率: 61%。1H NMR(400 MHz,DMSO-d6)δ: 8.25(d,J=8.2 Hz,1H),7.92(t,J=7.5 Hz,1H),7.81(d,J=8.3 Hz,1H),7.68(t,J=7.5 Hz,1H),5.35(s,2H),5.12(s,2H),3.42(s,3H),2.89(s,3H),1.79(s,3H)。MS(ESI+)m/z 453 [M+H]+。
7:收率: 63%。1H NMR(400 MHz,DMSO-d6)δ: 11.49(s,1H),8.27(dd,J=8.3,0.8 Hz,1H),7.99(dd,J=8.0,1.4 Hz,1H),7.72~7.52(m,1H),7.34~7.06(m,1H),5.12(d,J=2.4 Hz,2H),4.71(s,2H),3.44(s,3H),2.59(s,3H),1.80(t,J=2.3 Hz,3H)。MS(ESI+)m/z 472 [M+H]+。
8:收率: 21%。1H NMR(400 MHz,DMSO-d6)δ: 12.43(s,1H),8.09(dd,J=7.9,1.2 Hz,1H),7.75(dd,J=8.5,1.6 Hz,1H),7.57~7.41(m,2H),5.12(d,J=2.4 Hz,2H),5.02(s,2H),3.43(s,3H),1.80(s,3H)。MS(ESI+)m/z455 [M+H]+。
9:收率: 38%。1H NMR(400 MHz,DMSO-d6)δ: 8.08(d,J=8.5 Hz,1H),7.82(d,J=8.3 Hz,1H),7.56(t,J=7.8 Hz,1H),7.34(t,J=7.5 Hz,1H),5.29(s,2H),5.21(s,2H),3.35(s,3H),2.67(s,3H)。MS(ESI+)m/z 440 [M+H]+。
1.3 8-(N-Boc-3-氨基哌啶-1-基)-7-[(丁-2-炔)-1-基]- 3-甲基-1-[(4-甲基喹唑啉-2-基)甲基]-黄嘌呤(10)的合成取中间体6 200 mg,溶于DMSO(5 mL),加入碳酸钾120 mg、3-叔丁氧羰基氨基哌啶(100 mg),50 ℃反应6 h,反应液用乙酸乙酯/水萃取,乙酸乙酯层干燥后,上柱分离得到中间体10的黄色固体130 mg,收率: 51%。1H NMR(500 MHz,CDCl3) δ:8.05(d,J=9.2 Hz,1H),7.91(d,J=8.8 Hz,1H),7.79(t,J=8.4 Hz,1H),7.55(t,J=8.4Hz,1H),5.60(s,2H),5.02(d,J=15.0 Hz,1H),4.86(d,J=15.0 Hz,1H),3.92(s,1H),3.60(s,1H),3.70~3.26(m,5H),2.92(s,3H),2.08~1.63(m,5H),1.49(s,9H)。MS(ESI+)m/z 573 [M+H]+。
分别以中间体9或7为原料,按照与10类似的合成方法,合成得到黄色粗品中间体11和类白色粗品中间体12。
11:粗品收率: 65%。1H NMR(400 MHz,CDCl3)δ: 8.23(s,1H),7.94(d,J=8.5 Hz,1H),7.88(d,J=8.2 Hz,1H),7.60~7.47(m,1H),7.35~7.21(m,1H),5.56(s,2H),5.49(s,2H),3.85(s,1H),3.51(s,1H),3.46(m,2H),3.33(s,3H),2.81~2.70(m,2H),2.58(s,3H),2.12(s,1H),2.00~1.64(m,2H),1.39(s,9H)。MS(ESI+)m/z 560 [M+H]+。
12:粗品收率: 52%。1H NMR(400 MHz,CDCl3)δ: 8.28(d,J=8.3 Hz,1H),7.96(dd,J=8.0,1.4 Hz,1H),7.65~7.49(m,1H),7.26~7.11(m,1H),6.97(d,J=7.7 Hz,1H),4.84(d,J=1.8 Hz,2H),4.63(s,2H),3.65(d,J=11.8 Hz,1H),3.60(d,J=12.2 Hz,1H),3.56(s,1H),3.38(s,3H),2.98(s,1H),2.91~2.78(m,1H),2.56(s,3H),1.91~1.75(m,2H),1.74(s,3H),1.64(d,J=9.9 Hz,1H),1.41(m,1H),1.39(s,9H)。MS(ESI+)m/z 592 [M+H]+。
1.4 8-(3-氨基哌啶-1-基)-7-[(丁-2-炔)-1-基]-3-甲基-1-[(4-甲基喹唑啉-2-基)甲基]-黄嘌呤(1,LNP)的合成将中间体10(100 mg)溶于二氯甲烷中,向其中滴加三氟醋酸0.1 mL,45 ℃反应至原料消失,硅胶柱分离得到目标物1的白色固体约40 mg。
按照与1类似的方法,以中间体12或11为原料,分别制备得到目标物8-(3-氨基哌啶-1-基)-7-[(丁-2-炔)-1-基]-3-甲基-1-[N-(2-乙酰基苯基)乙酰胺-2-基]-黄嘌呤(1a)和8-(3-氨基哌啶-1-基)-7-氰甲基-3-甲基-1-[(4-甲基喹唑啉-2-基)甲基]-黄嘌呤(1f)。
1.5 8-(3-酰胺基哌啶-1-基)-7-[(丁-2-炔)-1-基]-3-甲基-1-[(4-甲基喹唑啉-2-基)甲基]-黄嘌呤(1b)的合成以中间体6为原料,按照与10类似的合成方法,得到目标物1b。
分别以中间体6、9、8、5为原料,按照与10类似的合成方法,与相应的胺直接合成得到目标物8-(3-氨甲基哌啶-1-基)-7-[(丁-2-炔)-1-基]-3-甲基-1-[(4-甲基喹唑啉-2-基)甲基]-黄嘌呤(1c)、8-(3-氨基吡咯-1-基)-7-[(丁-2-炔)-1-基]-3-甲基-1-[(4-甲基喹唑啉-2-基)甲基]-黄嘌呤(1d)、8-(3-酰胺基哌啶-1-基)-7-氰甲基-3-甲基-1-[(4-甲基喹唑啉-2-基)甲基]-黄嘌呤(1e)、8-(3-酰胺基哌啶-1-基)-7-[(丁-2-炔)-1-基]-3-甲基-1-[(4-氧代-3,4-二氢喹唑啉-2-基)甲基]-黄嘌呤(1g) 和8-(3-酰胺基哌啶-1-基)-7-[(3-甲基-丁-2-烯)-1-基]-3-甲基-1-[(4-甲基喹唑啉-2-基)甲基]-黄嘌呤(1h)。
2 DPP-IV抑制活性的测定化合物使用DMSO超声溶解,配成1 mmol·L-1的贮存液。实验前先用注射用水稀释100倍,配成浓度为100 µmol·L-1的溶液,再稀释100倍,配成浓度为100 nmol·L-1的溶液,然后再倍比稀释。第一次试验配制和测定了单一浓度(50 nmol·L-1)样品,阳性对照药物曲格列汀(trelagliptin)配制的测定浓度为10 nmol·L-1。50%抑制浓度(IC50)测定过程中通过5倍稀释配制系列浓度。
用HPLC级水将DPP Assay Buffer稀释10倍;然后,吸取DPP底物贮存液240 µL,然后添加5.76 mL稀释后的Assay Buffer,涡旋,混匀制备成DPP底物反应液;同时,吸取DPP-IV贮存液240 µL,然后添加960 µL稀释后的Assay Buffer,涡旋,混匀备用。
设置空白对照组、标准对照组和不同药物浓度的实验组,每组3个复孔。空白对照组中加入40 µL Assay Buffer和10 µL药物溶剂;标准对照组中加入30 µL的Assay Buffer、10µL稀释的DPP-IV和10 µL药物溶剂;实验组中加入30 µL的Assay Buffer、10 µL稀释的DPP-IV和10 µL不同浓度的样品。向每孔中添加50 µL底物溶液,盖上封板膜,置37 ℃孵育30min。揭去封板膜,用全波长酶标仪测定其荧光信号值Abs,波长设定为激发光350 nm,发射光450 nm,计算公式为:抑制率(%)=[(Abs标准对照组 - Abs空白组)-(Abs药物组 - Abs空白组)]/(Abs标准对照组 - Abs空白组)。通过系列浓度样品的抑制率数值,采用Reed &Muench方法计算IC50。
3 小分子与蛋白晶体虚拟对接采用Accelrys公司的Discovery Studio 3.0软件包中的Simulation模块先对小分子和受体蛋白(PDB ID:2GRU)添加CHARMm力场,利用Receptor-LigandInteractions模块下的Dockligands(CDOCKER)程序进行分子对接,其他参数采用缺省值。所有计算均在DELL Precision T7500型工作站上完成。
| [1] | Hiramatsu H, Kyono K, Higashiyama Y, et al. The structure and function of human dipeptidyl peptidase IV, possessing a unique eight-bladed-propeller fold[J]. Biochem Biophys Res Commun, 2003, 302:849-854. |
| [2] | Rasmussen HB, Branner S, Wiberg FC, et al. Crystal structure of human dipeptidylpeptidase IV/CD26 in complex with a substrate analog[J]. Nat Struct Biol, 2003, 10:19-25. |
| [3] | Engel M, Hoffmann T, Wagner L, et al. The crystal structure of dipeptidyl peptidase IV (CD26) reveals its functional regulation and enzymatic mechanism[J]. Proc Natl Acad Sci USA, 2003, 100:5063-5068. |
| [4] | Oefner C, D'Arcy A, Sweeney AM, et al. High-resolution structure of human apo dipeptidyl peptidase IV/CD26 and its complex with 1-[({2-[(5-iodopyridin-2-yl)amino]-ethyl}amino)-acetyl]-2-cyano-(S)-pyrrolidine[J]. Acta Cryst, 2003, D59:1206-1212. |
| [5] | Peters JU, Weber S, Kritter S, et al. Aminomethylpyrimidines as novel DPP-IV inhibitors:a 105-fold activity increase by optimization of aromatic substituents[J]. Bioorg Med Chem Lett, 2004, 14:1491-1493. |
| [6] | Campbell JE, Drucker DJ. Pharmacology, physiology, and mechanisms of incretin hormone action[J]. Cell Metab, 2013, 17:819-837. |
| [7] | Marguet D, Baggio L, Kobayashi T, et al. Enhanced insulin secretion and improved glucose tolerance in mice lacking CD26[J]. Proc Natl Acad Sci USA, 2000, 97:6874-6879. |
| [8] | Kim D, Wang L, Beconi M, et al. (2R)-4-Oxo-4-[3-(trifluoromethyl)-5,6-dihydro[1,2,4] triazolo[4,3-a]pyrazin-7(8 H)-yl]-1-(2,4,5-trifluorophenyl)butan-2-amine:a potent, orally active dipeptidyl peptidase IV inhibitor for the treatment of type 2 diabetes[J]. J Med Chem, 2005, 48:141-151. |
| [9] | Villhauer EB, Brinkman JA, Naderi GB, et al. 1-[[(3-Hydroxy-1-admantyl)amino]acetyl]-2-cyano-(S) pyrrolidine:a potent, selective and orally bioavailable dipeptidyl peptidase IV inhibitor with antihyperglycemia properties[J]. J Med Chem, 2003, 46:2774-2789. |
| [10] | Augeri DJ, Robl JA, Betebenner DA, et al. Discovery and preclinical profile of Saxagliptin (BMS-477118):a highly potent, long-acting, orally active dipeptidyl peptidase IV inhibitor for the treatment of type 2 diabetes[J]. J Med Chem, 2005, 48:5025-5037. |
| [11] | Feng J, Zhang Z, Wallace MB, et al. Discovery of alogliptin:a potent, selective, bioavailable, and efficacious inhibitor of dipeptidyl peptidase IV[J]. J Med Chem, 2007, 50:2297-2300. |
| [12] | Eckhardt M, Langkopf E, Mark M, et al. 8-(3-(R)-Aminopiperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methyl-quinazolin-2-ylmethyl)-3,7-dihydropurine-2,6-dione (BI 1356), a highly potent, selective, long-acting, and orally bioavailable DPP-4 inhibitor for the treatment of type 2 diabetes[J]. J Med Chem, 2007, 50:6450-6453. |
| [13] | Graefe-Mody U, Friedrich C, Port A, et al. Effect of renal impairment on the pharmacokinetics of the dipeptidyl peptidase-4 inhibitor linagliptin[J]. Diabetes Obes Metab, 2011, 13:939-946. |
| [14] | Tadayyon M, Mark M, Eckhart M, et al. 8-(3-Aminopiperidin-1-yl)-xanthines, the production thereof and the use of the same as medicaments:EP2003009127[P]. 2003-08-18. |
 2016, Vol. 51
2016, Vol. 51