2. 海南省人民医院药学部, 海南 海口 570311;
3. 武汉大学药学院, 湖北 武汉 430071
2. Department of Medicine, Hainan General Hospital, Haikou 570311, China;
3. School of Pharmaceutical Sciences, Wuhan University, Wuhan 430071, China
熊果酸(ursolic acid,UA)又名乌苏酸,化学名3β-羟基-熊果-12-烯-28-甲酸(3β-hydroxyurs-12-en- 28-oic acid),是一种在许多植物中存在的乌苏烷型五环三萜类化合物[1],具有抗炎、抗肿瘤、抗菌、降血糖等多种生物活性[2, 3, 4, 5],且不良反应小、毒性低,有着较好的临床开发价值。特别是其抗炎、抗癌活性受到人们的重视并开展了相关的研究[6, 7, 8]。然而,由于熊果酸自身作用强度较弱,加上其生物利用度低,致使其在临床的应用受到了限制[9]。因此,为了进一步增强熊果酸的生物活性或改善其理化性质,人们对其展开了大量的结构修饰及构效关系研究。本文也以熊果酸为先导化合物对其进行结构修饰,即通过酯化反应将具有良好抗炎、抗肿瘤、抗溃疡、抗氧化等药理活性的天然活性化合物查耳酮[10, 11, 12, 13](chalcone)拼接到其结构上构建成一个单元的分子,以期得到抗炎活性更强的新型、高效的熊果酸缀合物。
参考五环三萜类化合物结构改造经验发现,在其A环引入α,β-不饱和酮即构建1-烯-3-羰基的官能团能够提高抗炎活性[14, 15]。因此本文拟合成1-烯-3-氧代熊果酸-查耳酮缀合物(合成路线1,6a~6g);同时,为了探讨1-烯-3-羰基官能团对活性的影响,也合成了3-氧代熊果酸-查耳酮(合成路线1,5a~5g)和3-烯熊果酸-查耳酮(合成路线1,7a~7g)缀合物,并采用二甲苯致小鼠耳廓肿胀和角叉菜胶大鼠足跖肿胀炎症模型来测试所得目标化合物的体内抗炎活性。结果表明,目标化合物均具有不同程度的抗炎活性,且大部分化合物的活性强于熊果酸,其中1-烯- 3-氧代熊果酸-查耳酮缀合物(6a~6g)的抗炎活性强于3-氧代熊果酸-查耳酮(5a~5g)和3-烯熊果酸-查耳酮(7a~7g)缀合物。所合成的21个新化合物均未见文献报道。
结果与讨论 1 目标化合物的合成首先,以对羟基苯乙酮和芳醛为原料,通过经典的Claisen-Schmidt羟醛缩合反应合成了羟基查耳酮Cha 1~7。然而,由于反应是在碱性条件下进行,使得羟基转移了酮的正电中心,从而抑制了缩合反应[16]。因此,这些含羟基的查耳酮只有中等的产率(21.4%~33.1%)。
 | Scheme 1 Synthetic routeof quinoxaline ursolic acid-chalcone conjugates 5-7 |
各种熊果酸衍生物的构建是参照五环三萜类化合物的改造方法进行。在熊果酸易溶的THF中,以新配置的琼斯试剂(Jones)做为氧化剂,首先将C3位羟基氧化成羰基得到3-氧代熊果酸1[17];接着3-氧代熊果酸1的C2位与苯硒氯发生亲核取代反应后,并在H2O2的作用下发生消去反应,从而在熊果酸A环构建了1-烯-3-酮的活性官能团(2)[18]。在采用消去反应合成3-烯熊果酸中,由于熊果酸C3位羟基活性较低难以直接离去,因此用对甲苯磺酰氯将其制备成更容易发生消去反应的对甲苯磺酸酯(3),随后在醋酸钠的催化下将对甲苯磺酸酯基离去得到了3-烯熊果酸(4)[19]。最后,采用查耳酮和熊果酸衍生物在4-二甲氨基吡啶(DMAP)和二环己基碳二亚胺(DCC)缩合下直接酯化的方法得到了目标化合物(5a~5g、6a~6g、7a~7g)[20]。总的来说,合成路线步骤较短,操作便利。目标化合物的结构经1H NMR、13C NMR、IR及HRMS分析确证,其收率、理化常数及波谱数据见表 1、2。
|
|
Table 1 Physicalcontants and HR-MS of synthesized conjugates |
|
|
Table 2 The spectradata of target compounds |
二甲苯能明显的诱导小鼠耳廓肿胀,熊果酸衍生物-查耳酮缀合物对二甲苯致小鼠耳廓肿胀有不同程度的抑制作用,其抗炎实验结果如表 3所示。与阴性对照组比较,这些缀合物均具有一定的抗炎活性(P <0.05)。从目标化合物的结构上看,熊果酸骨架A环具有1-烯-3-羰基官能团(化合物6a~6g)的抗炎活性强于3-氧代熊果酸(化合物5a~5g)和3-烯熊果酸骨架的缀合物(化合物7a~7g)。与原料组熊果酸相比,1-烯-3-氧代熊果酸缀合物6a~6g具有更强的抗炎活性(6a~6g/UA),其中化合物6d和6f甚至强于阳性对照药阿司匹林(6d、6f/aspirin),而另外两个系列的缀合物(化合物5a~5g,7a~7g)抗炎活性却弱于阿司匹林。实验表明,缀合物中查耳酮单元对活性影响较大,含有吸电子基和体积较小的查耳酮单元的缀合物活性较佳。例如,在查耳酮单元引入给电子基OMe降低了抗炎活性(5a/5c、7a/7c),用强吸电子基F取代后却显著地增强了活性(5a/5d、6a/6d、7a/7d),进一步将吸电子基F用体积更大的Cl取代也降低了活性(5d/5e、6d/6e、7d/7e);将六元环的查耳酮用体积更小的五元环查耳酮取代也明显增加活性(5a/5f、5g;6a/6f、6g;7a/7f、7g);同样,在这些含有五元环查耳酮缀合物中仍然是以吸电性更强的化合物具有更强的活性(5f/5g、6f/6g、7f/7g)。其中含有呋喃查耳酮单元的缀合物(6f)对二甲苯致小鼠耳廓肿胀抑制作用最强(图 1)。
|
|
Table 3 Effects oftarget compounds and aspirin in xylenen- induced mouseear edema. n = 4, x± s . P < 0.05, **P < 0.01 vscontrol |
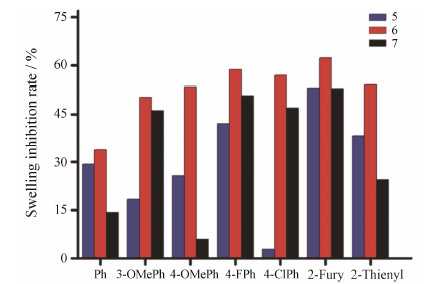 | Figure 1 Effect of chalcone unit of targetcompounds and aspirin in xylenen-induced mouse ear edema |
注射角叉菜胶后,大鼠足跖开始肿胀,并逐渐加重,在5 h达到了高峰。熊果酸衍生物-查耳酮缀合物能够不同程度的抑制角叉菜胶所致的大鼠足肿胀,其实验结果如表 4所示。与阴性组相比较,阿司匹林组、目标化合物组均能明显抑制角叉菜胶所引起的大鼠足肿胀程度(P <0.05),并且大部分缀合物的抗炎活性强于原料组熊果酸。从结构上分析仍然是熊果酸A环具有1-烯-3-酮官能团的化合物6a~6g具有良好的抗炎活性,而缀合物中查耳酮单元对活性也有较大影响。总体上来说,仍然以含有吸电子基和体积较小的查耳酮单元缀合物具有更好的活性。例如,在所有化合物中,仍然以含呋喃查耳酮的化合物6f展现出了最强的抗炎活性,甚至强于阳性对照药阿司匹林。
|
|
Table 4 Effects oftarget compounds (t = 5 h) in carrageenan- induced pawedema in rats. n = 4, x± s . P < 0.01, **P < 0.05 vscontrol |
炎症是机体在各种损伤刺激下所表现出的以防御为主的反应,是机体对创伤局部的应答,也是临床上常见的病理过程之一,因此抗炎药物研究具有重要的临床意义。本论文合成了3种类型的熊果酸衍生物-查耳酮缀合物: 3-氧代熊果酸-查耳酮缀合物(化合物5a~5g)、1-烯-3-氧代熊果酸-查耳酮缀合物(化合物6a~6g)和3-烯熊果酸-查耳酮缀合物(化合物7a~7g),并通过建立二甲苯致小鼠耳廓肿胀和角叉菜胶大鼠足跖肿胀炎症模型评价了这3类缀合物的体内抗炎活性。实验结果显示,熊果酸衍生物-查耳酮缀合物对二甲苯诱导的小鼠耳廓肿胀和角叉菜胶诱导的大鼠足跖肿胀均有明显的抑制作用,表明这些缀合物具有良好的抗炎作用。其中,1-烯-3-氧代熊果酸-查耳酮缀合物6a~6g抗炎活性强于其他两个类型的缀合物。此外,缀合物以含有吸电子基和体积较小的查耳酮单元具有更强的活性,其中化合物6f(150 mg×kg-1)的抗炎活性最强,甚至强于阳性对照药阿司匹林(0.33 mg×kg-1)。这些结果说明熊果酸A环的1-烯-3-羰基是一个活性官能团,能够增强抗炎活性,其抗炎作用机制正在进一步的研究中。
实验部分BrukerAM-400Hz型核磁共振仪(TMS内标);DF-101S集热式恒温加热磁力搅拌器(河南巩义市予华仪器有限责任公司);XR4显微熔点测定仪(上海光学仪器厂,温度未校正);FA(N)/JA(N)系列MINQI∧O电子天平(上海民桥精密科学仪器有限公司)。
熊果酸(含量>99%,西安高远生化有限责任公司);合成使用的其他试剂均为市售分析纯(质量分数≥99%);GF254硅胶薄层板(青岛海洋化工厂);200~300目柱色谱硅胶(青岛海洋化工厂);水为蒸馏水;动物:昆明种小鼠,体重19~22 g,SD大鼠,体重200~250g,雌雄各半,由武汉大学实验动物实验中心提供,动物使用许可证号: SCXK(鄂)2008-0004;动物级别: SPF级。
1 化学合成 1.1 查耳酮Cha 1~7的合成Ar保护下,将对羟基苯乙酮(10.1 mmol)和相应的芳醛(10.1 mmol)溶解到甲醇(20 mL)中,于冰浴下缓慢加入KOH(2.828 g,50.5 mmol),然后撤掉冰浴在室温反应12 h,用2 mol·L-1的稀盐酸调节反应液的pH=3,析出的黄色查尔酮沉淀过滤、干燥即得到查尔酮Cha1~7。
1-(4-羟基苯基)-3-苯基-2-丙烯酮(Cha 1):黄色固体,产率32.3%,mp 91~94 ℃;1H NMR(400 MHz,acetone-d6): δ 8.01(2H,d, J=8.4Hz),7.76(1H,d, J=16.0 Hz),7.57(1H,m),7.52(1H,d, J=15.6 Hz),7.42(3H,m),6.99(2H,d, J=8.4 Hz);13C NMR(100 MHz,acetone-d6): δ 188.78,164.52,141.69,134.65,131.25,130.16,130.07,128.96,128.42,121.81,114.37。
1-(4-羟基苯基)-3-(3-甲氧基苯基)-2-丙烯酮(Cha 2):黄色固体,产率27.8%,mp 97~99 ℃;1H NMR(400 MHz,acetone-d6): δ8.02(2H,d, J=8.8 Hz),7.76(1H,d, J=15.6 Hz),7.58(2H,d, J=8.8 Hz),7.41(1H,d, J=15.2 Hz),7.20(1H,d, J=8.0 Hz),7.18(1H,s),6.92(1H,d, J=8.8 Hz),6.84(1H,t, J=8.4 Hz),3.78(3H,s,-OCH3);13C NMR(100 MHz,CDCl3): δ188.75,163.28,143.83,131.34,130.72,130.14,127.79,124.31,122.50,119.82,114.39,113.80,55.50。
1-(4-羟基苯基)-3-(4-甲氧基苯基)-2-丙烯酮(Cha 3):黄色固体,产率25.3%,mp 102~104 ℃;1H NMR(400 MHz,acetone-d6): δ8.05(2H,d, J=8.4 Hz),7.61(1H,d, J=16.0 Hz),7.55(2H,d, J=8.4 Hz),7.53(1H,d, J=16.0 Hz),7.40(2H,d, J=8.0 Hz),7.11(2H,d,J=8.4 Hz),3.77(3H,s,-OCH3);13C NMR(100 MHz,acetone-d6): δ 188.71,163.82,144.05,134.88,131.12,129.86,129.39,128.42,128.42,121.81,113.88,55.47。
1-(4-羟基苯基)-3-(4-氟苯基)-2-丙烯酮(Cha 4):黄色固体物,产率21.4%,mp 86~89 ℃;1H NMR(400 MHz,CDCl3): δ 8.07(2H,d, J=8.8 Hz),7.88(1H,d, J=15.6 Hz),7.83(2H,d, J=8.4 Hz),7.69(1H,d,J=15.6 Hz),7.46(2H,d, J=8.4 Hz),7.00(2H,d, J=8.4 Hz);13C NMR(100 MHz,acetone-d6): δ 187.85,164.04,141.95,136.13,135.21,131.96,131.51,130.90,130.28,129.88,123.75,116.48,116.13。
1-(4-羟基苯基)-3-(4-氯苯基)-2-丙烯酮(Cha 5):黄色固体,产率33.1%,mp 105~107 ℃;1H NMR(400 MHz,acetone-d6): δ8.07(2H,d, J=8.8 Hz),7.88(1H,d, J=15.6 Hz),7.83(2H,d, J=8.4 Hz),7.69(1H,d, J=15.6 Hz),7.46(2H,d, J=8.4 Hz),7.00(2H,d,J=8.4 Hz);13C NMR(100 MHz,acetone-d6): δ 187.85,164.04,141.95,136.13,135.21,131.96,131.51,130.90,130.28,129.88,123.75,116.48,116.13。
1-(4-羟基苯基)-3-呋喃基-2-丙烯酮(Cha 6):黄色固体;产率23.3%;mp 98~101 ℃;1H NMR(400 MHz,CDCl3)δ 7.82(1H,d, J=16.0 Hz),7.73(1H,d, J=1.2Hz),7.67(2H,d, J=8.8 Hz),7.51(2H,d, J=8.4 Hz),7.39(1H,d, J=15.6 Hz),7.31(1H,d, J=4.0 Hz),6.71(1H,m);13C NMR(100 MHz,CDCl3)δ 188.72,162.718,160.68,144.55,131.97,131.54,131.38,127.85,119.68,116.83,116.29。
1-(4-羟基苯基)-3-噻吩基-2-丙烯酮(Cha 7):黄色固体;产率31.8%;mp 105~107 ℃;1H NMR(400 MHz,acetone-d6):δ 8.06(2H,d, J=8.8 Hz),7.90(1H,d, J=15.2 Hz),7.63(1H,d, J=5.2 Hz),7.55(2H,m),7.15(1H,m),6.99(2H,d, J=8.4 Hz);13C NMR(100 MHz,acetone-d6)δ187.62,162.78,141.41,136.45,132.77,131.85,131.01,129.82,129.34,121.44,116.28。
1.2 3-氧代熊果酸(1)的合成将熊果酸(10.001 g,21.9 mmol)溶解到四氢呋喃(40 mL)中,于冰浴下缓慢滴加新配制的琼斯试剂(10 mL),在冰浴下继续反应1 h后,减压脱除溶剂,残留物用二氯甲烷(100 mL)溶解,饱和NaCl溶液(30 mL)洗涤,有机层用无水Na2SO4干燥,脱除溶剂,经柱色谱纯化(石油醚-乙酸乙酯,1∶1)得到9.751 g白色固体(1),产率为98.1%。1H NMR(400 MHz,CDCl3): δ 5.40(1H,s,H-12),2.99(1H,dd,J=4.0,13.6 Hz,H-18),1.26(3H,s,CH3)1.16(3H,s,CH3),1.10(3H,s,CH3),1.05(3H,s,CH3),0.94(3H,s,CH3),0.92(3H,s,CH3),0.86(3H,s,CH3)。
1.3 1-烯-3-氧代熊果酸(2)的合成Ar保护下,将3-氧代熊果酸1 (2.472 g,5.4 mmol)溶解到无水乙酸乙酯(20 mL)中,缓慢向反应液加入PhSeCl(1.145 g,5.9 mmol),室温反应3 h,减压脱除溶剂,残留物用二氯甲烷(20 mL)溶解,在冰浴下依次加入吡啶(1 mL)和H2O2(1.1 mL),撤掉冰浴后在室温下反应20 min,随后加热回流25 min,加入二氯甲烷(25 mL)稀释,有机层用饱和NaCl和NaHCO3溶液洗涤,减压脱除溶剂,经硅胶柱纯化(石油醚-乙酸乙酯,7∶3)得到1.335 g白色固体(2),产率54.6%。1H NMR(400 MHz,CDCl3):δ 7.05(1H,d,J =10.0Hz,H-1),5.84(1H,d,J=9.6 Hz,H-2),5.37(1H,s,H-12),2.99(1H,dd,J=4.0,13.6 Hz,H-18),1.24(3H,s,CH3),1.18(3H,s,CH3),1.12(3H,s,CH3),1.01(3H,s,CH3),0.97(3H,s,CH3),0.95(3H,s,CH3),0.92(3H,s,CH3)。
1.4 3-对甲苯磺酸酯熊果酸(3)合成Ar保护下,将熊果酸(5.766 g,12.6 mmol)和对甲苯磺酰氯(7.206 g,37.8 mmol)溶解到无水吡啶(30 mL)中,室温反应24 h,向反应液中加入35 mL水稀释,用CH2Cl2(3×50 mL)萃取,有机层用饱和KHSO4溶液(100 mL)洗涤,无水Na2SO4干燥,减压脱除溶剂,经硅胶柱纯化(石油醚-乙酸乙酯,6∶1)得到7.173 g白色固体3,产率93.2%。1H NMR(400 MHz,CDCl3):δ 7.72(2H,d,J=8.4Hz),7.43(2H,d,J=8.0 Hz),5.40(1H,s,H-12),2.96(1H,dd,J=4.0,14.0 Hz,H-18),2.46(3H,s,CH3),1.21(3H,s,CH3),1.13(3H,s,CH3),1.00(3H,s,CH3),0.95(3H,s,CH3),0.92(3H,s,CH3),0.89(3H,s,CH3),0.87(3H,s,CH3)。
1.5 3-烯熊果酸(4)的合成Ar保护下,将3-对甲苯磺酸酯熊果酸3 (6.768 g,11.1 mmol)和醋酸钠溶解于无水DMF(35 mL)中,加热至120 ℃,反应24 h,将反应液冷却至室温后倾入100 mL的水中,用CH2Cl2(3×30 mL)萃取,有机层用饱和NaCl溶液(3×100 mL)洗涤,无水Na2SO4干燥,减压脱除溶剂,经硅胶柱纯化(石油醚-乙酸乙酯,6∶1)得到2.186 g白色固体4,产率44.9%。1H NMR(400 MHz,CDCl3): δ5.41(3H,m,H-2,H-3,H-12),2.96(1H,dd,J=4.0,13.6 Hz,H-18),1.24(3H,s,CH3),1.14(3H,s,CH3),1.06(3H,s,CH3),1.01(3H,s,CH3),0.94(3H,s,CH3),0.91(3H,s,CH3),0.88(3H,s,CH3)。
1.6 熊果酸衍生物-查尔酮缀合物的合成Ar保护下,将熊果酸衍生物1、2或4 (0.5mmol)和查耳酮Cha 1~7(0.5 mmol)溶解到无水二氯甲烷(10 mL)中,于冰浴下依次加入DMAP(0.1 mmol)和DCC(1.1 mmol),撤掉冰浴后在室温反应24 h,向反应液中加入30 mL水,用二氯甲烷(3×20 mL)萃取,有机层用无水硫酸钠干燥,减压脱除溶剂,经硅胶柱纯化(石油醚-乙酸乙酯,2∶1~1∶1)得到相应的缀合物5~7,其理化和波谱数据见表 1和表 2。
2 抗炎活性实验 2.1 二甲苯致小鼠耳廓肿胀法观察目标化合物的抗炎作用将化合物5~7和熊果酸(UA)用0.5%羧甲基纤维素钠(CMC)配制成浓度为7.5 mg·mL-1混悬液,阿司匹林用0.5% CMC配制成浓度为16.5 mg·mL-1混悬液。取昆明种小鼠100只,按体重随机分为25组,每组4只,雌雄各半。阴性对照组灌服(0.5% CMC液)0.4 mL/20 g;阿司匹林组灌服(1.65%阿司匹林)0.4 mL/20 g;各化合物组分别灌服(0.75%混悬液)0.4 mL/20 g。以上各组小鼠,每日给药1次,连续给药4天,于末次给药后30 min,用二甲苯(0.05 mL/鼠)均匀的涂抹小鼠右耳致炎,左耳作对照,致炎后30 min将小鼠处死,用打孔器(9 mm)分别在两耳的同一位置取下圆形左、右耳片,分别用分析天平称重,计算出各组小鼠的耳片肿胀程度,并进行组间显著差比较。耳片肿胀程度=致炎侧耳片质量(右耳)-对照侧耳片质量(左耳)[6]。
2.2 目标化合物对角叉菜胶致大鼠足跖肿胀的影响大鼠100只,雌雄各半,分组及给药方法同二甲苯致小鼠耳廓肿胀法。在末次给药后30 min分别给每只大鼠左后足跖皮下注射0.5%角叉菜胶溶液0.1 mL,致炎后5 min、30 min、1h、2 h、4 h、5h和6 h观察并测量每只大鼠两后肢足跖厚度,计算出足跖的相对肿胀度及肿胀抑制率,并进行组间显著差比较。足跖相对肿胀度=(左足跖厚度-右足跖厚度)/右足跖厚度;足跖肿胀抑制率(%)=[1 -(给药组足跖相对肿胀度/阴性组足跖相对肿胀度)] x 100%[21]。
| [1] | Wang P, Zhang ZY, Wu Z. Distribution and epidemiological effect of ursolic acid in medical plants[J]. J Chin Med Mater (中药材), 2000, 23:717-721. |
| [2] | Nelson AT, Camelio AM, Claussen KR, et al. Synthesis of oxygenated oleano-lic and ursolic acid derivatives with antiinflammatory properties[J]. Bioorg Med Chem Lett, 2015, 25:4342-4346. |
| [3] | Meng YQ, Liu D, Bai ZW, et al. Synthesis and anti-tumor activity of ursolic acid derivatives[J]. Acta Pharm Sin (药学学报), 2011, 46:556-560. |
| [4] | Meng YQ, Chen Y, Wang Z, et al. Research advance of ursolic acid[J]. Chin J New Drugs (中国新药杂志), 2007, 11:25-28. |
| [5] | Wu PP, Zhang K, Lu YJ, et al. In vitro and in vivo evaluation of the antidiabetic activity of ursolic acid derivatives[J]. Eur J Med Chem, 2014, 80:502-508. |
| [6] | Li CH, Yang CL, Zhang K, et al. Synthesis and anti-inflammatory activity of novel benzimidazole (benzothiazloe) phenylursolate[J]. Chin J Org Chem (有机化学), 2012, 32:133-137. |
| [7] | Meng YQ, Liu D, Bai ZW, et al. Synthesis and anti-tumor activity of ursolic acid derivatives[J]. Acta Pharm Sin (药学学报), 2011, 46:556-560. |
| [8] | Li X, Bai X, Wu K, et al. Synthesis and antitumor activities of 3'-substituted propanolursolates[J]. Chin J Org Chem (有机化学), 2012, 32:703-708. |
| [9] | Saraswat B, Visen PK, Agarwal DP. Ursolic acid isolated from Eucalyptus tereticornis protects against ethanol toxicity in isolated rat hepatocytes[J]. Phytother Res, 2000, 14:163-166. |
| [10] | Shoman ME, Abdel-Aziz M, Aly OM, et al. Synthesis and investigation of anti-inflammatory activity and gastric ulcerogenicity of novel nitric oxide-donating pyrazoline derivatives[J]. Eur J Med Chem, 2009, 44:3068-3076. |
| [11] | Kumar D, Kumar MN, Tantak MP, et al. Synthesis and identification of α-cyano bis(indolyl)chalcones as novel anticancer agents[J]. Bioorg Med Chem Lett, 2014, 24:5170-5174. |
| [12] | Sashidhara KV, Avula SR, Mishra V, et al. Identification of quinoline-chalcone hybrids as potential antiulcer agents[J]. Eur J Med Chem, 2015, 89:638-653. |
| [13] | Detsi A, Majdalani M, Kontogiorgis CA, et al. Natural and synthetic 2'-hydroxy-chalcones and aurones:synthesis, characterization and evaluation of the antioxidant and soybean lipoxygenase inhibitory activity[J]. Bioorg Med Chem, 2009, 17:8073-8085. |
| [14] | Honda T, Rounds BV, Gribble GW, et al. Design and synthesis of 2-cyano-3,12-dioxoolean-1,9-dien-28-oic acid, a novel and highly active inhibitor of nitric oxide production in mouse macrophages[J]. Bioorg Med Chem, 1998, 8:2711-2714. |
| [15] | Sporn MB, Liby KT, Yore MM, et al. New synthetic triterpenoids:potent agents for prevention and treatment of tissue injury caused by inflammatory and oxidative stress[J]. J Nat Prod, 2011, 74:537-545. |
| [16] | Chen WM, Guo HX. The effect of substituted groups in benzene ring on the condensation reaction of acetophenones with benzaldehydes[J]. Chin J Synthet Chem (合成化学), 1999, 7:422-426. |
| [17] | Liu D, Song DD, Guo G, et al. The synthesis of 18β-glycyrrhetinic acid derivatives which have increased antiproliferative and apoptotic effects in leukemia cells[J]. Bioorg Med Chem, 2007, 15:5432-5439. |
| [18] | You YJ, Kim Y, Nam NH, et al. Synthesis and cytotoxic activity of A-ring modified betulinic acid derivatives[J]. Bioorg Med Chem Lett, 2003, 13:3137-3140. |
| [19] | Parra A, Lopez PE, Andres GG. Different pathways for the deoxygenation of the A-ring of natural triterpene compounds[J]. Nat Prod Res, 2010, 24:177-196. |
| [20] | Lin KW, Huang AM, Hour TC, et al. 18β-Glycyrrhetinic acid derivatives induced mitochondrial-mediated apoptosis through reactive oxygen species-mediated p53 activation in NTUB1 cells[J]. Bioorg Med Chem, 2011, 19:4274-4285. |
| [21] | Li JX, Huang Y, Zhao WH, et al. Anti-inflammation effect of curcumin and its derivatives in vivo[J]. Chin Pharm J (中国药学杂志), 2012, 47:1374-1377. |
 2016, Vol. 51
2016, Vol. 51


