2. 浙江工业大学长三角绿色制药协同创新中心, 浙江 杭州 310014
2. Collaborative Innovation Center of Yangtze River Delta Region Green Pharmaceuticals, Zhejiang University of Technology, Hangzhou 310014, China
肉碱/有机阳离子转运体OCTNs(carnitine/organiccation transporters,OCTNs)是溶质载体(solute carrier,SLC)的超家族成员。在人体中,OCTNs分为hOCTN1(SLC22A4)和hOCTN2(SLC22A5),两者有75.8%的同源性。OCTN1于1997年从胎儿肝脏中克隆得到[1],其cDNA的CDS(coding sequence)区编码551个氨基酸残基,有11个跨膜区域和1个核苷酸结合位点。OCTN1在成人肾脏(定位于近端小管上皮细胞的顶侧膜上)、气管和骨髓高表达,在骨骼肌、小肠、心脏、胎盘和神经细胞亦有表达。OCTN1对抗氧化剂麦角硫因(ergothioneine)具有特异性高的亲和力[2],也可介导奎尼丁、维拉帕米、加巴喷丁和奥沙利铂等药物在肾脏主动分泌[3, 4, 5];OCTN2于1998年从成人肾脏及人胚胎滋养层细胞系克隆得到[6],其cDNA的CDS区编码557个氨基酸残基,有12个跨膜区域。OCTN2在成人肾脏、骨骼肌、心脏、胎盘和胰腺高表达,在小肠、乳腺亦有表达。OCTN2对内源性物质左旋肉碱(L-carnitine)具有特异性高的亲和力[7],在肾脏中介导左旋肉碱的重吸收,维持左旋肉碱的体内稳态。
OCTNs在体内广泛分布,参与多种外源和内源性物质的转运,具有非常重要的生理意义。阐明内外源物质与OCTNs的相互作用,有助于预测OCTNs介导的药物-药物相互作用,了解外源物对麦角硫因、左旋肉碱等生理物质体内处置的影响。体外研究OCTNs的模型主要有脂蛋白体和细胞模型[8],因细胞的生物学性质更接近天然蛋白分子而较为常用。相比于动物细胞离体培养模型,稳定高表达hOCTNs的转基因细胞模型,其蛋白功能更明确、生物学性质更稳定、更接近人体情况,是体外研究hOCTNs底物或抑制剂的理想模型。本研究构建稳定高表达hOCTNs的细胞模型,并应用该模型考察了部分内源物质、生物碱、黄酮及普利类药物与hOCTNs的相互作用。
材料与方法 材料与试剂BamH I、Xho I限制性内切酶、T4 DNA连接酶、PrimeSTAR试剂盒(日本TaKaRa公司);总RNA提取试剂盒(批号: 03601),DNA纯化回收试剂盒(批号: N3118)(TIANGEN公司);质粒小提试剂盒(批号: 10213KA1)(美国AxyPrep公司);Lipofectamine 2000(美国Invitrogen公司);SYBRPremix Ex Taq II试剂盒(日本TaKaRa公司);人肾癌组织(浙江省肿瘤医院医学伦理委员会批准使用);G418(纯度≥98%,批号: D00150320;德国Calbiochem公司);麦角硫因(L-(+)-ergothioneine,纯度≥98%,批号: 3-H2502m;瑞士Enzo公司);米屈肼(mildronate,纯度≥98%,批号:J0920AS;大连美仑公司);左旋肉碱[L-(-)-carnitine,纯度: 98%,批号: J1423007;阿拉丁公司];碘化[N-甲基-4-苯基吡啶盐](MPP+)、奎尼丁(quinidine)(美国Sigma公司);胰酶(批号: 27250-018)、DMEM培养基(批号: 1206525)、胎牛血清(批号: 1502284)(美国Gibco公司);犬肾上皮细胞MDCK(Madin-Darby caninekidney cell;中国医学科学院、北京协和医学院基础医学细胞中心),MDCK-pcDNA3.1(+)细胞[9](本实验室构建)。
pcDNA3.1(+)-hOCTN1/2质粒构建以-80 ℃冷冻保存的人肾组织为标本,用Trizol法提取总RNA,经逆转录获得的cDNA为模板,设计两对特异引物(表 1),PCR(polymerase chain reaction)扩增出hOCTN1及hOCTN2(GenBank accession number: NM_003059.2、NM_003060.3)mRNA的CDS区全长。PCR条件如下: 98 ℃预变性2 min;98 ℃变性10 s,65 ℃退火5 s,72 ℃延伸2 min,循环30次;72 ℃延伸10 min。琼脂糖凝胶电泳分离鉴定PCR产物并割胶回收。目的基因hOCTN1、hOCTN2及载体pcDNA3.1(+)经BamH I、XhoI双酶切后,用T4连接酶连接。连接产物转化E.coli DH5α细菌扩增,抽提获得重组质粒pcDNA3.1(+)- hOCTN1及pcDNA3.1(+)-hOCTN2。双酶切验证正确后,对质粒中的hOCTN1和hOCTN2基因测序鉴定。
|
|
Table 1 Primers used inPCR and real-time PCR. The sequences underlined wererestriction enzyme sites. Sequence GCCACC in forward primer is Kozaksequence which could improve translation efficiency of the protein |
MDCK细胞在含10%胎牛血清(FBS)、100u·mL-1青霉素、链霉素的DMEM培养基中培养,于37 ℃和5% CO2饱和湿度的培养箱中培养。待细胞生长至80%~90%汇合度,用0.25%胰酶消化传代。细胞以每孔1×105个的密度接种于6孔板,待细胞长至80%汇合度时,按Lipofectamine 2000说明书将重组质粒pcDNA3.1(+)-hOCTN1和pcDNA3.1(+)- hOCTN2分别转染MDCK细胞,36 h后用含800 μg·mL-1 G418的DMEM培养基抗性筛选14天,采用有限稀释法将细胞种于96孔板后进行单克隆标记。
MDCK-hOCTN1/2单克隆细胞功能鉴定MDCK-hOCTN1/2及转染了空载质粒MDCK-pcDNA3.1(+)的细胞(阴性对照,以下简称mock)以每孔3×103个的密度接种于24孔板,生长48 h后进行麦角硫因(OCTN1经典底物)和米屈肼(OCTN2经典底物)的积聚实验,并设立加或不加抑制剂组,每组平行3份。具体方法为:用37 ℃的孵育液(uptakebuffer,UpB):含NaCl125 mmol·L-1、KCl 4.8 mmol·L-1、葡萄糖5.6 mmol·L-1、KH2PO41.2 mmol·L-1、CaCl2 1.2 mmol·L-1、MgSO41.2 mmol·L-1、HEPEs25 mmol·L-1,KOH调至pH 7.4)[10]洗涤细胞两次,加入UpB 200 μL预孵育20 min,吸弃UpB,加入预热含底物的UpB(3 μmol·L-1麦角硫因或2 μmol·L-1米屈肼)200μL,加或不加抑制剂奎尼丁(500μmol·L-1,OCTN1抑制剂)或左旋肉碱(100 μmol·L-1,OCTN2抑制剂),经37 ℃孵育设定的时间后(麦角硫因溶液孵育2 min,米屈肼溶液孵育1 min),吸弃孵育液。冰冷的UpB快速洗涤两次。每孔加入0.1%十二烷基硫酸钠100 μL裂解细胞[11],反复吹打收集裂解液。
样品预处理与LC-MS/MS分析取细胞裂解液80 μL,加入含内标MPP+(4.0 ng·mL-1)的乙腈溶液400 μL,涡旋5min沉淀蛋白,13 200 r·min-1离心15 min,取上清液,以LC-MS/MS方法检测麦角硫因和米屈肼的浓度,并以BCA法测定蛋白浓度加以校正。样品检测应用Agilent1290/6460三重四级杆质谱;色谱柱为Xbridge BEH HILIC柱(50 mm×2.1 mm,2.5 μm);流动相A为含0.1%甲酸的20 mmol·L-1乙酸铵-水溶液,B为含0.1%甲酸的乙腈;梯度洗脱: 0~0.8min(80% B),0.81~2 min(80% B→70% B),2.1~4min(80% B);流速0.2mL·min-1;进样量2.0 μL;柱温30 ℃。电离方式ESI,检测模式MRM,正离子检测。质谱条件:毛细管电压3 500V,气化温度325 ℃,气化气流量6 L·min-1,喷雾压力45 psi(1 psi ≈ 6.9 kPa),鞘气流量11 L·min-1,鞘气温度350 ℃。其余质谱参数见表 2。本实验条件下,基质中的内源性杂质不干扰测定,麦角硫因和米屈肼在1.562~781.5 nmol·L-1内呈线性(R2≥0.999 0),定量下限为1.562 nmol·L-1(RSD <5%),高、中、低浓度的回收率在97.1%~101.6%(RSD <2%)。
|
|
Table 2 Mass spectrumparameters |
从MDCK-hOCTN1,MDCK-hOCTN2及mock细胞中提取总mRNA,逆转录后按SYBR Premix Ex Taq II试剂盒进行相关转运体mRNA的含量测定。以犬GAPDH为内参基因[12],引物序列见表 1,PCR条件依次为: 95 ℃预变性30 s;循环40次(95 ℃ 5 s,60 ℃ 30 s,95 ℃ 15 s);融解曲线分析: 60 ℃ 1 h,95 ℃ 15 min。
经典底物在MDCK-hOCTN1/2细胞上的积聚动力学考察细胞摄取麦角硫因(MDCK-hOCTN1)或米屈肼(MDCK-hOCTN2)的pH、Na+依赖性及浓度依赖性(MDCK-hOCTN1/2和mock细胞)。考察pH依赖性:细胞用相应UpB预孵育后,加入不同pH(6.4、7.4和8.4)的含底物UpB(3 μmol·L-1麦角硫因或2 μmol·L-1米屈肼)200μL;考察Na+依赖性:加入无Na+(相同浓度葡甲胺[3, 6]替代NaCl,pH 7.4)的含底物UpB;考察浓度依赖性:含不同浓度麦角硫因(1、3、5、8、10和20 μmol·L-1)或米屈肼(5、10、25、50、100、200和400μmol·L-1)的UpB(含Na+,pH 7.4)。经37 ℃孵育设定时间后,吸弃孵育液。冰冷的UpB快速洗涤两次,后续细胞处理同上所述。细胞积聚动力学常数最大转运速率(Vmax)和米氏常数(Km)用GraphPadPrism 5.0计算得到,公式: V=Vmax×S/(Km+S)+Pdif×S,其中V为底物的转运速率pmol·mg-1(protein)·min-1,S为底物浓度μmol·L-1,Pdif×S表示被动扩散的速率。
化合物对底物在MDCK-hOCTN1/2细胞积聚的抑制作用考察谷氨酰胺、左旋精氨酸、多巴胺(内源性物质),黄连素、胡椒碱、荷叶碱(生物碱),奥卡宁、异奥卡宁、花旗松素(黄酮类)和卡托普利、赖诺普利、福辛普利(血管紧张素酶抑制剂)对MDCK- hOCTN1/2细胞摄取麦角硫因/米屈肼的抑制情况。将MDCK-hOCTN1/2及mock细胞经UpB预孵育后,底物组加入麦角硫因或米屈肼(3 μmol·L-1)200 μL;抑制剂组除含相同浓度底物外,还含上述各化合物(100 μmol·L-1);以奎尼丁或左旋肉碱(100 μmol·L-1)为阳性抑制剂。37 ℃孵育1 min(抑制剂和底物同时加入),吸弃孵育液终止反应。后续处理同上所述。
数据分析实验数据用GraphPad Prism 5.0作图,统计分析。结果均以x±s表示,两组间差异采用Unpaired Two-tailed Student’s t-test;多组间差异采用One-way ANOVA(Dunnett或Tukey)。P <0.05为有统计学差异。
结果 1 pcDNA3.1(+)-hOCTN1/2质粒构建以人肾总mRNA逆转录获得的cDNA为模板PCR,琼脂糖凝胶电泳得到1 700 bp左右目的基因片段hOCTN1(图 1a)和hOCTN2(图 1b)。目的基因和载体均双酶切后,载体胶回收得到约5 400bp的片段(图 1c)。连接产物转化后提取质粒,双酶切验证得到约5 400bp和1 700 bp的条带(图 1d),初步说明pcDNA3.1(+)-hOCTN1/2质粒构建成功,测序结果表明hOCTN1和hOCTN2无有意义突变。
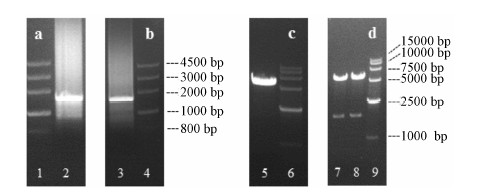 | Figure 1 Electrophoretogram of hOCTN1/2gel extraction (a, b), vector pcDNA3.1(+) doubledigestion (c) or plasmid pcDNA3.1(+)-hOCTN1/2double digestion (d). Lane 1, 4: Marker III; Lane 2,3: hOCTN1 and hOCTN2; Lane 5: Vector pcDNA3.1(+) after enzyme digestion; Lane 7, 8: pcDNA3.1(+)- hOCTN1 and pcDNA3.1(+)-hOCTN2 after enzyme digestion; Lane 6, 9: Marker 15 000 |
以经典底物麦角硫因和米屈肼的积聚实验筛选蛋白表达良好的MDCK-hOCTN1/2单克隆细胞株,以每毫克蛋白对底物的积聚量与mock细胞的比值表征细胞对底物的积聚能力。结果显示(图 2a),转染了hOCTN1的单克隆株(1-1、1-7、1-11)对麦角硫因的积聚量分别为mock细胞的122倍、49.5倍和84.0倍,hOCTN1抑制剂奎尼丁(500 μmol·L-1)使积聚量减至原来的29.7%、44.1%和35.7%,提示上述细胞株中hOCTN1的功能性表达。将积聚量为mock细胞122倍的单克隆细胞株(1-1)作为后续研究hOCTN1的细胞模型,并命名为MDCK-hOCTN1;转染了hOCTN2的单克隆株(2-9、2-13、2-21)对米屈肼的积聚量分别为mock细胞的19.9倍、108倍和44.7倍,hOCTN2抑制剂左旋肉碱(100 μmol·L-1)使积聚量减至原来的17.3%、15.5%和18.5%(图 2b),表明上述细胞株中hOCTN2的功能性表达。将积聚量为mock细胞108倍的单克隆细胞株(2-13)作为后续研究hOCTN2的细胞模型,并命名为MDCK-hOCTN2。
 | Figure 2 Accumulation of ergothioneine inMDCK-hOCTN1 monoclones (a) or mildronate in MDCK-hOCTN2 monoclones (b). 3 μmol·L−1 Ergothioneine was incubated inMDCK-hOCTN1 and mock cells with or without 500 μmol·L−1 quinidinefor 2 min; 2 μmol·L−1 mildronate was incubated in MDCK-hOCTN2 andmock cells with or without 100 μmol·L−1 L-carnitine for 1min. Define ergothioneine or mildronate accumulation in mock cells as 1. n = 3, x± s . P < 0.05, **P < 0.01, ***P < 0.001 vsmock group; △P < 0.05, △△△P < 0.001 vsincubated without inhibitor group |
从细胞中提取总mRNA,经逆转录后进行RT-PCR,检测转染了目的基因的细胞和mock细胞中SLC22A4(编码hOCTN1)和SLC22A5(编码hOCTN2)的表达。结果显示(图 3),在MDCK-hOCTN1和MDCK-hOCTN2细胞中,hOCTN1和hOCTN2mRNA的表达量分别为mock细胞的2.8×105倍和246倍。
 | Figure 3 RT-PCRanalysis of SLC22A4 (encoding hOCTN1) (a) and SLC22A5 (encoding hOCTN2) (b) mRNA expression in mock, MDCK-hOCTN1 and MDCK-hOCTN2 cells. Methods of 2(−ΔCT)×104 was used toanalyze mRNA expression, ΔCT = CT target gene − Avg. CT GAPDH. n = 3, x± s . ***P < 0.001 vsmock |
经典底物在MDCK-hOCTN1/2细胞上的积聚受pH、Na+及底物浓度影响。结果显示,pH 6.4时,麦角硫因和米屈肼在MDCK-hOCTN1和MDCK-hOCTN2细胞上的积聚量最大(图 4a1,a2);无Na+存在时,MDCK-hOCTN1/2细胞对底物的摄取量约为Na+存在时的10%(图 4b1,b2),提示hOCTN1/2对麦角硫因/米屈肼的摄取呈Na+依赖性;生理pH下,MDCK-hOCTN1/2细胞对底物的积聚均符合米氏方程(图 4c1,c2),麦角硫因在MDCK-hOCTN1中积聚的Km和Vmax分别为8.19±0.61μmol·L-1和1 427±49 pmol·mg-1(protein)·min-1;米屈肼在MDCK-hOCTN2细胞中积聚的Km和Vmax分别为52.3±4.3 μmol·L-1及2 454±64 pmol·mg-1(protein)·min-1。
 | Figure 4 pH, Na+ andconcentration dependence of ergothioneine uptake by MDCK-hOCTN1 (a1, b1, c1) and mildronate uptake byMDCK-hOCTN2 (a2, b2, c2), respectively.In panels (a, b), uptake ofergothioneine (3 μmol·L−1) or mildronate (2 μmol·L−1)for 1 min was incubated at various pH values of the medium UpB (a1, a2) and inthe presence or absence of Na+ (b1, b2) at pH 7.4. In panels(c), cells were incubated in UpB with various concentrations of ergothioneine (1 to 20 μmol·L−1) (c1) and mildronate(5 to 400 μmol·L−1) (c2) for 1 min at pH 7.4 at 37 ℃.n = 3, x± s . P < 0.05, **P < 0.01, ***P < 0.001 |
应用构建的MDCK-hOCTN1/2细胞模型考察部分内源性化合物、生物碱、黄酮及普利类药物对hOCTN1/2的影响。结果显示(图 5a),hOCTN1抑制剂奎尼丁(100 μmol·L-1)使麦角硫因在MDCK- hOCTN1细胞中的积聚量降至对照组的63.4%,相同浓度的多巴胺、胡椒碱亦对麦角硫因的细胞积聚呈明显抑制,分别抑制到对照组的53.4%和63.2%(P <0.001);此外(图 5b),hOCTN2抑制剂左旋肉碱(100 μmol·L-1)使米屈肼在MDCK-hOCTN2细胞中的积聚减少至对照组的15.5%,相同浓度的谷氨酰胺、黄连素、胡椒碱、荷叶碱、赖诺普利和福辛普利对米屈肼的细胞积聚亦呈明显抑制,分别抑制到对照组的75.0%、58.9%、60.2%、71.7%、69.1%和29.2%(P <0.01,0.001)。
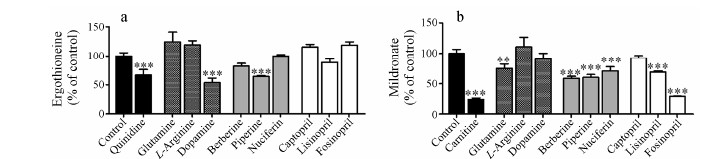 | Figure 5 Effect of compounds (100μmol·L−1) on the uptake of ergothioneine by MDCK-hOCTN1 cells (a) ormildronate by MDCK- hOCTN2 cells (b). Quindineand L-carnitine (100 μmol·L−1) are positive controls,respectively. n = 3, x± s . **P < 0.01, ***P < 0.001 vscontrol group |
OCTN1和OCTN2在体内具有重要的生理学意义,OCTN1/2摄取经典底物可以被部分内、外源性物质抑制,在一定程度上可能影响OCTN1/2对生理底物的转运,从而影响内源物的体内处置。OCTN1的经典底物麦角硫因是人体不能自身合成的重要抗氧化物质[13],OCTN1在其肠道吸收、肾脏重吸收中发挥重要作用,与人体健康密切相关。OCTN1对麦角硫因的亲和力远高于其他有机阳离子化合物,故选择麦角硫因进行单克隆细胞MDCK-hOCTN1的功能筛选;OCTN2的经典底物左旋肉碱存在于哺乳动物的血液(生理浓度约50 μmol·L-1)和各组织中,可协助活化的长链脂肪酸进入线粒体基质,促进其在线粒体内膜的β-氧化。实验发现,在MDCK-hOCTN2和mock细胞基质中均能检测到内源左旋肉碱,推测可能是细胞培养基中胎牛血清含有左旋肉碱所致。由于细胞内源性左旋肉碱会影响其细胞积聚量的检测,因此本研究选择OCTN2的非内源性底物米屈肼[14]作为筛选MDCK-hOCTN2单克隆细胞的底物,以左旋肉碱作为抑制剂。
细胞积聚实验中底物浓度和积聚时间的选择,是结合已有文献[15, 16]、底物Km值和检测方法的线性范围而确定的。在未确定Km值时,主要根据文献和线性范围;在细胞积聚动力学实验时,根据预估的Km值,取约0.3 Km至3 Km的浓度范围进行实验;确定Km后的细胞积聚实验中,底物浓度一般选择Km值范围内的较低浓度点,同时使实际样品的最低浓度点在定量下限以上即可。此外,抑制剂浓度的选择方面,因OCTN1对麦角硫因的亲和力较强,因此在单克隆细胞筛选中,选择较高浓度奎尼丁(500 μmol·L-1)作为抑制剂,使筛选结果更可靠;在考察化合物对OCTN1抑制作用时,使用阳性抑制剂奎尼丁的浓度与各化合物相同(100 μmol·L-1),可更直观地反映各化合物对OCTN1的抑制作用。
实验发现pH较低且Na+存在时,MDCK-hOCTN1/2细胞中经典底物的积聚量较大,验证了OCTN1/2介导经典底物的积聚具有H+和Na+依赖性[17]。究其原因,一方面是两性离子麦角硫因和米屈肼的结构中存在羧基和季铵基,在较酸性的条件下更倾向于以羧基(-COOH)和季铵阳离子(-R4N+)形式存在,而转运体OCTN1/2上有羧基口袋区域和季铵阳离子结合位点,可与羧基形成分子间氢键[13],与季铵形成阳离子-π键,更易识别底物;另一方面,OCTN1/2转运两性离子时与膜内外Na+-H+交换偶联,因而表现出Na+、H+依赖性。另外有文献[3]报道OCTN1/2也可介导部分有机阳离子类化合物的跨膜转运,其介导四乙胺等生理状态下带正电荷的化合物时可能呈Na+非依赖性。
本研究构建的细胞模型可用于确定hOCTN1和hOCTN2的底物及抑制剂,为进一步体外考察hOCTN1和hOCTN2介导的药物-药物相互作用,以及外源物质对hOCTN1和hOCTN2生理底物体内处置的影响提供科学依据。
| [1] | Tamai I, Yabuuchi H, Nezu J, et al. Cloning and characterization of a novel human pH-dependent organic cation transporter, OCTN1[J]. FEBS Lett, 1997, 419:107-111. |
| [2] | Carsten E, Sabrina N, Mohammed A, et al. OCTN1-mediated ergothioneine uptake protects lung epithelial cells from tobacco smoke-induced damage[J]. FASEB J, 2015, 29:970-975. |
| [3] | Nakamichi N, Shima H, Asano S, et al. Involvement of carnitine/organic cation transporter OCTN1/SLC22A4 in gastrointestinal absorption of metformin[J]. J Pharm Sci, 2013, 102:3407-3417. |
| [4] | Urban T, Brown C, Castro R, et al. Effects of genetic variation in the novel organic cation transporter, OCTN1, on the renal clearance of gabapentin[J]. Clin Pharmacol Ther, 2008, 83:416-421. |
| [5] | Jong N, Nakanishi T, Liu J, et al. Oxaliplatin transport mediated by organic cation/carnitine transporters OCTN1 and OCTN2 in overexpressing human embryonic kidney 293 cells and rat dorsal root ganglion neurons[J]. J Pharmacol Exp Ther, 2011, 338:537-547. |
| [6] | Tamai I, Ohashi R, Nezu J, et al. Molecular and functional identification of sodium ion-dependent, high affinity human carnitine transporter OCTN2[J]. J Biol Chem, 1998, 273:20378-20382. |
| [7] | Yasuro F, Tomoko S, Yukio K, et al. Muscle contraction increases carnitine uptake via translocation of OCTN2[J]. Biochem Biophys Res Commun, 2012, 418:774-779. |
| [8] | Garrett Q, Xu S, Simmons P, et al. Expression and localization of carnitine/organic cation transporter OCTN1 and OCTN2 in ocular epithelium[J]. Invest Ophthalmol Vis Sci, 2008, 49:4844-4849. |
| [9] | Tu MJ, Li LP, Lei HM, et al. Involvement of organic cation transporter 1 and CYP3A4 in retrorsine-induced toxicity[J].Toxicology, 2014, 322:34-42. |
| [10] | Toshimichi N, Kenji Y, Hikaru Y, et al. Functional characterization of ergothioneine transport by rat organic cation/carnitine transporter Octn1(slc22a4)[J]. Biol Pharm Bull, 2008, 31:1580-1584. |
| [11] | Wang K, Sun SY, Li LP, et al. Involvement of organic cation transporter 2 inhibition in potential mechanism of antidepressant action[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2014, 53:90-97. |
| [12] | Lei HM, Sun SY, Li LP, et al. Establishment of MDCK cell models expressing human MATE1 or co-expressing with human OCT1 or OCT2[J]. Acta Pharm Sin (药学学报), 2015, 50:842-847. |
| [13] | Ikumi T. Pharmacological and pathophysiological roles of carnitine/organic cation transporters (OCTNs:SLC22A4, SLC22A5 and Slc22a21)[J]. Biopharm Drug Dispos, 2013, 34:29-44. |
| [14] | Silke G, Christian F, Markus B, et al. The carnitine transporter slc22a5 is not a general drug transporter, but it efficiently translocates mildronate[J]. Drug Metab Dispos, 2009, 37:330-337. |
| [15] | Hikaru Y, Ikumi T, Jun N, et al. Novel membrane transporter OCTN1 mediates multispecific, bidirectional, and PH-dependent transport of organic cations[J]. J Pharmacol Exp Ther, 1998, 289:768-773. |
| [16] | Toshimichi N, Shigeki S, Daisuke K, et al. Decreased proliferation and erythroid differentiation of K562 cells by siRNA induced depression of OCTN1(SLC22A4) transporter gene[J]. Pharm Res, 2007, 24:1628-1635. |
| [17] | Dirk G, Stephanie H, Stefan G, et al. Discovery of the ergothioneine transporter[J]. Proc Natl Acad Sci USA, 2005, 102:5256-5261. |
 2016, Vol. 51
2016, Vol. 51


