2. 赤峰学院医学院, 内蒙古 赤峰 024000
2. Medical College of Chifeng University, Chifeng 024000, China
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指无明确过量饮酒史和其他致病因素,以肝脏内脂肪过度堆积为主要特征的临床病理综合征,其疾病谱包括单纯性脂肪肝(non-alcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、纤维化、肝硬化和肝癌。在发达国家,NAFLD的发病率已达到20%~30%,在发展中国家,NAFLD的发病率也在逐渐上升[1]。随着人们生活方式、膳食结构的改变,NAFLD已成为世界范围内常见的慢性疾病之一。
NAFLD的主要病因是胰岛素抵抗等因素引起肝脏脂代谢紊乱,脂类尤其是甘油三酯(triglyceride,TG)在肝脏的堆积。当肝脏TG的含量超过肝重的5%时,便认为NAFLD发生[2]。在生理状态下,肝脏作为脂肪代谢的中转站,将摄入的脂质或者脂肪组织分泌的脂肪酸再加工为脂蛋白或其他代谢中间产物,并运送到需要的组织中[3]。当机体处于肥胖、2型糖尿病等代谢异常状态下,肝脏的脂质输入和输出的平衡被打破,最终导致肝脏内脂质的堆积和脂肪肝的形成[4]。因此,NAFLD的防治策略中,在NAFL阶段改善胰岛素抵抗以及抑制脂肪在肝脏中的堆积显得尤为重要。目前,对NAFLD的治疗尚无良好的药物,在其NAFL阶段多采用控制饮食、增加运动的方法,发展到NASH阶段多以保肝类药物和对症治疗为主,均不能满足广大患者的需求。
蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)是胰岛素信号通路的负调节因子[5],对磷酸化的胰岛素受体(insulin receptor,IR)具有去磷酸化作用,是糖尿病治疗的潜在靶点。近年来,PTP1B与脂肪肝的关系逐渐受到关注。在肝脏PTP1B敲除小鼠模型中,给予高脂饮食诱导后,血TG以及血总胆固醇(total cholesterol,TC)水平较未敲除组显著降低,同时肝脏脂质堆积也得到显著改善[6],提示PTP1B可能是治疗脂肪肝的潜在靶点。化合物WS090152是药物研究所自行研发的一类新结构小分子化合物(图 1),具有较强PTP1B抑制作用,对高脂饮食诱导的胰岛素抵抗合并脂肪肝的小鼠具有明显的降低肝脏脂质堆积的作用,提示抑制PTP1B可能成为改善脂肪肝新的治疗途径。
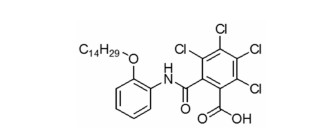 | Figure 1 The structure of compound WS090152 (C28H35NO4Cl4) |
化合物WS090152由中国医学科学院药物研究所吴松课题组合成和鉴定,纯度大于96%。Anti-actin、anti-FAS、anti-ACC、anti-IRβ、anti-AKT和anti-p-AKT等抗体购自美国CST公司;anti-p-IRβ(Tyr1162/1163)和anti-SREBP-1c等抗体购自美国Santa Cruz公司;anti-PTP1B抗体购自美国Millipore公司;ECL发光液和肝组织TG测定试剂盒购自北京普利莱基因生物技术公司;血TC检测试剂盒和血TG检测试剂盒购自中生北控生物科技股份有限公司。
实验动物雄性4周龄C57BL/6J小鼠,体重12~14 g,购于维通利华生物科技股份有限公司[合格证号: SCXK(京)2012-0001]。实验动物饲养于中国医学科学院药物研究所动物中心,饲养温度20~25 ℃,湿度40%~60%,每天光照/黑暗时间为12 h/12 h。动物自由进食饮水,以高脂饲料(D12492;Research Diets公司)诱导14周,选取体重大于40 g的动物作为NAFL模型小鼠。将模型小鼠随机分为3组(n=8):模型对照Model、Rosi和WS090152组,分别灌胃给予水、阳性药10 mg·kg-1罗格列酮(rosiglitazone,Rosi,北京高盟化工有限公司提供)和50 mg·kg-1化合物WS090152,每天给药1次。设同批正常动物(体重29~35 g)为正常对照组(Con组,n=8),灌胃等体积水。实验过程符合《北京市实验动物管理条例》的相关规定。
葡萄糖输注速率(glucoseinfusion rate,GIR)参照文献[7]方法进行高胰岛素-正常血糖钳夹(正糖钳)实验。小鼠禁食过夜,称重,戊巴比妥钠(80 mg·kg-1,ip)麻醉,固定于37 ℃恒温板,1 u·kg-1肝素抗凝。右侧颈动脉插管,每间隔10 min取血,用血糖仪(德国EKF Diagnodtics公司)快速检测血糖水平。左侧颈静脉插管,用微量注射器(美国ISMATEC公司)恒速输注胰岛素60 pmol·kg-1·min-1;同时,根据血糖水平调节输注速率,用微量蠕动泵(美国Cole Parmer公司)输注10%葡萄糖使血糖水平维持在(95±5)mg·dL-1内。记录血糖稳态时的葡萄糖输注速率至少3次,取其平均值为GIR值。
基因重组人 PTP1B(human protein tyrosine phosphatase-1B,hPTP1B)活性测定参照文献[8]方法,制备和纯化基因重组人PTP1B蛋白;以硝基苯酚磷酸酯(disodium 4-nitropheyl phosphate,pNPP)为底物测定PTP1B酶活性。
Western blot在动物肝组织中加入含蛋白酶抑制剂及磷酸酶抑制剂的RIPA裂解液,匀浆后离心(4 ℃,13 000r·min-1,30 min),得到全蛋白提取液,10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS- PAGE)分离蛋白。用Bradford蛋白检测试剂盒(美国Bio-Rad公司)检测蛋白含量。蛋白样品经过SDS- PAGE电泳、PVDF膜湿转、BSA溶液封闭、一抗4 ℃孵育过夜、二抗孵育及ECL化学发光显色,经凝胶成像系统采集图像,用Tanon图像分析软件对扫描的目的条带灰度进行统计。
组织病理学检查小鼠断头处死后,快速取肝脏,4%多聚甲醛固定,石蜡包埋、切片、HE染色,进行组织病理学检查。在光学显微镜下,参照文献[8]对肝组织脂肪变性进行半定量评分。
肝脏甘油三脂含量的测定小鼠断头处死后,快速摘取肝脏,取新鲜肝脏按1∶40(g∶mL)的比例用预冷裂解液制成匀浆液。离心(12 000 r·min-1,4 ℃,15 min),取上清液,用肝组织甘油三酯试剂盒测定TG含量。用Bradford蛋白检测试剂盒检测上清液蛋白含量,对肝脏TG含量进行校正。
统计学分析实验数据以x± s 表示,多组间比较采用one-way ANOVA(Prism 5.0),两组间比较采用Student’s t-test。P <0.05被认为存在统计学差异。
结果 1 化合物WS090152改善小鼠肝脏脂质堆积作用NAFL模型小鼠连续给药25天,对动物的肝脏进行病理学分析,结果显示(图 2A),Con组小鼠肝细胞以中心静脉为中心呈放射状排列,细胞结构清晰,未见明显病变;Model组细胞核周聚集了大量脂滴,且多为大小泡混合性脂肪变性;WS090152可显著改善NAFL模型小鼠肝细胞的大小泡混合性脂肪变性。肝脏脂肪变性半定量评分结果显示(图 2B),Model组小鼠肝脂肪变评分较Con组增加了14.4倍,提示形成NAFL模型;与Model组相比,WS090152组小鼠肝脂肪变评分降低了45.5%,说明WS090152能够明显改善NAFL模型小鼠的肝脏脂质堆积。
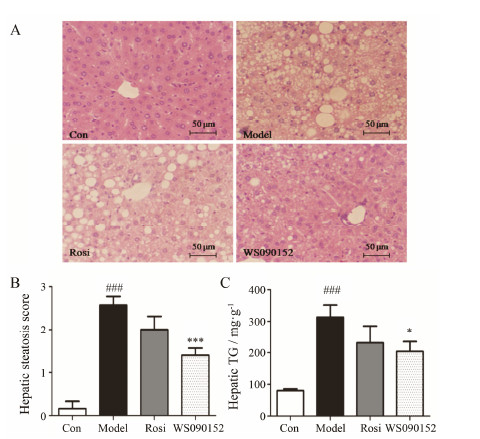 | Figure 2 Effectof WS090152 on hepatic lipid accumulation inhigh-fat-diet induced non-alcoholic fatty liver (NAFL) mice. A: Pathological changes of the livers(HE staining, 200×); B: Steatohepatitis scores of the livers; C: Content ofhepatic triglyceride (TG). n = 8,x± s . ###P < 0.001 vs Con;P < 0.05, ***P < 0.001 vsModel. Con, control group; Rosi, 10 mg·kg−1 rosiglitazone;WS090152, 50 mg·kg−1 compound WS090152 |
检测肝脏TG含量。结果显示(图 2C),与Con组相比,Model肝TG含量增加了3.9倍;与Model组相比,WS090152组动物的肝TG含量下降了34.9%。说明WS090152明显降低NAFL模型小鼠的肝TG含量。
2 化合物WS090152对小鼠血脂水平的调节作用高脂饮食可使小鼠的体重明显增长,给药前Model组小鼠的平均体重较Con组升高(17.5±5.5)g。连续给药25天,监测小鼠摄食及体重,结果显示(图 3A),各组小鼠摄食未见显著性差异(数据略),Con组小鼠平均体重增加(1.6±1.4)g,Model组小鼠平均体重基本不变,WS090152组小鼠平均体重减轻(2.8±2.2)g,提示WS090152可能有降低NAFL小鼠体重的作用。
 | Figure 3 Effect ofWS090152 on the lipid profiles in NAFL mice. A: Body weight; B: Serum toalcholesterol (TC); C: Serum TG. n = 8,x± s . ###P < 0.001 vsCon; P < 0.05, **P < 0.01 vsModel |
连续给药9天,检测动物血TC和TG水平。结果显示,与Con组比较,Model组小鼠血TC水平升高86.2%;与Model组相比,WS090152组小鼠血TC值降低了27.2%,提示WS090152具有明显的改善NAFL小鼠高胆固醇血症的作用(图 3B)。Model组小鼠血TG水平与Con组比较无明显变化,WS090152组小鼠TG值比Model组降低了23.9%(图 3C)。
3 化合物WS090152的胰岛素增敏作用胰岛素抵抗是NAFL形成的重要病理基础,连续给药25天后,通过高胰岛素-正常血糖水平钳夹实验评价WS090152改善胰岛素抵抗的作用。结果显示,Model组小鼠GIR水平比Con组降低73.1%,出现明显的胰岛素抵抗。与Model组相比,WS090152组、Rosi组小鼠GIR值分别升高了39.0%和61.0%,提示化合物WS090152与阳性药罗格列酮类似,具有显著改善NAFL模型小鼠胰岛素抵抗的作用(图 4)。
 | Figure 4 Effect ofWS090152 on insulin resistance in NAFL mice. n = 8,x± s . ###P < 0.001 vsCon; **P < 0.01, ***P < 0.001 vsModel. GIR: Glucose infusion rate |
体外酶学实验显示(图 5),化合物WS090152对基因重组hPTP1B活性具有较强的抑制作用,其IC50为0.34 μmol·L-1。
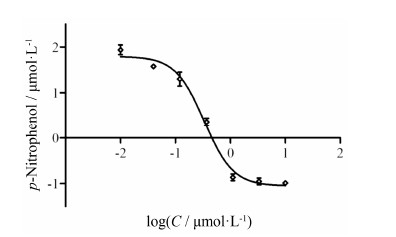 | Figure 5 Inhibition ofWS090152 on recombinant human protein tyrosinephosphatase-1B (PTP1B) activity. Each data is from 3 independent tests |
NAFL模型小鼠连续给药25天,禁食12 h,断头处死,取肝脏,观察WS090152对PTP1B表达的影响。结果显示(图 6),与Con组比较,Model组动物肝脏PTP1B表达水平显著升高,平均上调了191.8%。与Model组比较,WS090152组肝脏PTP1B表达下调了51.7%。各组动物的IRβ、AKT表达无明显变化。与Con组比照,Model组肝脏p-IRβ、p-AKT的表达水平显著降低,p-IRβ/IRβ比值平均下降了30.6%,p-AKT/AKT比值平均下降51.0%;WS090152可显著逆转NAFL模型小鼠胰岛素信号通路磷酸化水平的下调,使p-IRβ/IRβ和p-AKT/AKT比值较Model组分别上升了65.6%和62.0%。
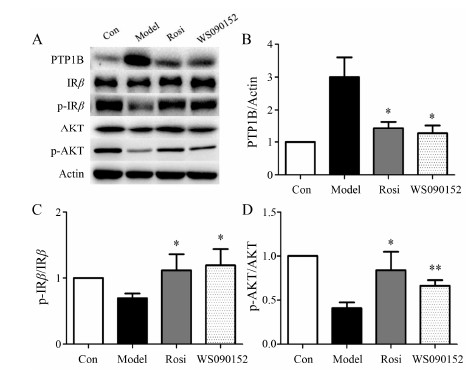 | Figure 6 Effect of WS090152on the down-regulation of hepatic PTP1B expression in NAFL mice. A: Expressionsof PTP1B and its downstream factors; B−D: Band intensities of proteinsquantified by densitometry (B: PTP1B; C: p-IRβ/IRβ; D: p-AKT/AKT). Each data is from 3 independent tests. P < 0.05, **P < 0.01 vs Model.IR: Insulin receptor |
固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBP-1c)-脂肪酸合成酶(fatty acid synthase,FAS)-乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)是肝脏脂质合成相关的重要信号通路。NAFL模型小鼠连续给药25天,禁食12 h,断头处死,取肝脏,观察肝细胞脂质合成关键因子的表达。结果显示(图 7):与Con组比较,Model组SREBP-1c、FAS和ACC表达水平分别升高了121.8%、82.4%和156.5%;与Model组相比,WS090152组的SREBP-1c、FAS和ACC表达水平分别下调了49.6%、62.8%和55.5%。
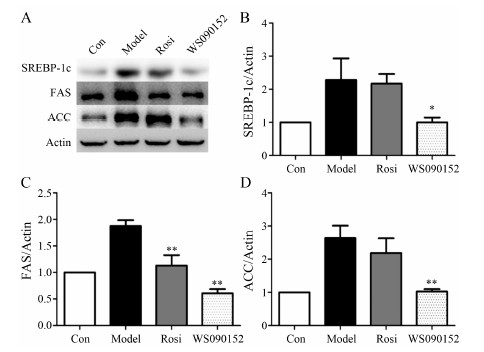 | Figure 7 Effect of WS090152 on the signaling related to hepatic TG synthesis inNAFL mice. A: Expression of sterol regulatory element bindingproteins (SREBP-1c), fatty acid synthase (FAS) and acetyl-CoA carboxylase (ACC) in liver; B−D: Band intensities of proteins quantifiedby densitometry (B: SREBP-1c/ Actin; C: FAS/Actin; D: ACC/Actin). Each data is from 3 independenttests. P < 0.05, **P < 0.01 vsModel |
NAFLD[9, 10, 11]是与胰岛素抵抗、肥胖和脂质代谢异常等密切相关的代谢性肝损伤疾病。在NAFL及NASH阶段,其病程是可逆的,但当疾病进入肝纤维化以后,病程将很难逆转。最经典的NAFLD发病机制是“二次打击”学说。“第一次打击”是由胰岛素抵抗为中心的代谢紊乱引起的脂肪在肝脏细胞内的过度聚集,“第二次打击”则是由于肝内TG储存过量引起脂质过氧化及氧化应激,进而诱导发生在肝脏细胞内的炎症反应。因此,改善胰岛素抵抗,减少脂肪在肝脏内的过度堆积,对NAFLD的预防和治疗有重要作用。本研究结果显示,化合物WS090152能够显著改善NAFL小鼠胰岛素抵抗和肝脏脂质堆积。
化合物WS090152是基于天然产物岩芹酸结构衍生而来,是一类新结构类型的PTP1B抑制剂,不同于文献已报道的任何一类抑制剂。该结构类型的PTP1B抑制剂克服了目前已知小分子抑制剂本身容易电离,穿透细胞膜作用不理想等问题。
大量研究[12, 13, 14]显示,胰岛素抵抗引起的肝细胞内TG聚集是NAFLD的重要致病因素。胰岛素抵抗是指胰岛素的靶器官对胰岛素生物学效应降低,胰岛素信号传递受阻或减弱是导致胰岛素抵抗的主要原因。胰岛素通过IR及下游的磷酸化级联反应传导信号,发挥其生物效应。胰岛素与靶细胞表面的IR结合,引起IR酪氨酸磷酸化;磷酸化的IR通过磷酸化反应激活IRS1/2(insulin receptor substrate 1/2),进而激活PI3K/AKT信号通路,完成胰岛素对代谢的调节。生理状态下,胰岛素抑制肝脏的糖异生、促进肝脏内脂肪合成;在胰岛素抵抗状态下,胰岛素抑制肝脏糖异生的功能下调,其促进肝脏脂肪合成的功能却不受影响[15]。胰岛素抵抗引起的肝脏异常脂质合成,也会加重脂质在肝脏内的异位堆积,加重肝脏脂肪化的进程[12]。PTP1B是IR和IRS1的负调控因子,可以直接对肝细胞中磷酸化的IRβ和IRS1起到去磷酸化作用,下调胰岛素信号通路[16]。本实验中,化合物WS090152可明显抑制基因重组hPTP1B蛋白的活性,下调高脂饮食诱导引起的NAFL模型小鼠肝脏PTP1B的表达,上调其下游分子IRβ、AKT的磷酸化水平,提示WS090152通过分子靶点PTP1B调控胰岛素信号通路,改善NAFL小鼠肝脏的胰岛素抵抗,从而减少肝脏内脂质堆积。
SREBPs是一类位于内质网上的膜连接蛋白,SREBP-1c是其中的一个亚型,可直接激活FAS和ACC等多个参与胆固醇、脂肪酸、TG及磷脂的合成和摄取的基因表达,是参与调控脂质合成的主要转录因子[17, 18]。FAS和ACC是合成脂肪酸的关键酶,而脂肪酸是肝脏内甘油三脂合成的主要来源。因此SREBP-1c在高脂饮食引起的NAFLD中可能起到非常重要的作用[19]。在脂肪肝及NASH患者中,可见SREBP-1c的表达显著升高,并随脂肪肝病变程度的加重而增加[20]。最新的研究[8, 21,22]表明,PTP1B可能是肝脏内脂质生成的激活剂,在糖脂代谢紊乱的病理状态下,细胞内PTP1B表达明显升高,因此PTP1B也被认为是NAFLD治疗的新的潜在靶点。肝脏PTP1B敲除小鼠,在高脂饮食诱导下表现出低肝脏TG水平及低SREBPs、FAS表达水平[6],而在PTP1B过表达的肝细胞中,SREBP-1的活性增加。其可能的机制为过表达的PTP1B对蛋白磷酸酶2A(phosphatases 2A,PP2A)的去磷酸化作用增加,上调了PP2A的活性。PP2A通过激活SREBP-1(SREBP-1a和SREBP-1c)SP位点的转录活性,增加SREBP-1的基因表达[23, 24]。本实验中,化合物WS090152具有明显的PTP1B抑制作用,同时,WS090152治疗后NAFL模型小鼠肝脏SREBP-1c、FAS和ACC的表达显著降低,提示WS090152可能是通过抑制肝脏内脂肪合成相关的SREBP-1c、FAS和ACC的表达,抑制了肝TG的合成,从而改善肝脏内的脂质堆积。
综上所述,化合物WS090152可明显抑制PTP1B活性,上调高脂饮食诱导的NAFL模型小鼠肝细胞内的胰岛素信号通路,抑制肝组织SREBP-1c及其下游FAS、ACC的表达,进而降低肝脏TG的合成,从而发挥改善脂肪肝的作用,具有良好的治疗NAFLD的新药研发前景。
| [1] | Bedogni G, Nobili V, Tiribelli C, et al. Epidemiology of fatty liver:an update[J]. World J Gastroenterol, 2014, 20:9050-9054. |
| [2] | Rahimi RS, Landaverde C. Nonalcoholic fatty liver disease and the metabolic syndrome:clinical implications and treatment[J]. Nutr Clin Pract, 2013, 28:40-51. |
| [3] | Ameer F, Scandiuzzi L, Hasnain S, et al. De novo lipogenesis in health and disease[J]. Metabolism, 2014, 63:895-902. |
| [4] | Brumbaugh DE, Friedman JE. Developmental origins of nonalcoholic fatty liver disease[J]. Pediatr Res, 2014, 75:140-147. |
| [5] | Bakke J, Haj FG. Protein-tyrosine phosphatase 1B substrates and metabolic regulation[J]. Semin Cell Dev Biol, 2015, 37:58-65. |
| [6] | Agouni A, Mody N, Owen C, et al. Liver-specific deletion of protein tyrosine phosphatase (PTP) 1B improves obesity- and pharmacologically induced endoplasmic reticulumstress[J]. Biochem J, 2011, 438:369-378. |
| [7] | Ye F, Tao RY, Cong WN, et al. Utilization of fluorescence tracer in hyperinsulinemic-euglycemic clamp test in mice[J]. J Biochem Biophys Methods, 2008, 70:978-984. |
| [8] | Ma YM, Tao RY, Liu Q, et al. PTP1B inhibitor improves both insulin resistance and lipid abnormalities in vivo and in vitro[J]. Mol Cell Biochem, 2011, 357:65-72. |
| [9] | Dietrich P, Hellerbrand C. Non-alcoholic fatty liver disease, obesity and the metabolic syndrome[J]. Best Pract Res Clin Gastroenterol, 2014, 28:637-653. |
| [10] | Basaranoglu M, Kayacetin S, Yilmaz N, et al. Understanding mechanisms of the pathogenesis of nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2010, 16:2223-2226. |
| [11] | Carazo A, León J, Casado J, et al. Hepatic expression of adiponectin receptors increases with non-alcoholic fatty liver disease progression in morbid obesity in correlation with glutathione peroxidase 1[J]. Obes Surg, 2011, 21:492-500. |
| [12] | Asrih M, Jornayvaz FR. Metabolic syndrome and nonalcoholic fatty liver disease:is insulin resistance the link?[J]. Mol Cell Endocrinol, 2015, 418:55-65. |
| [13] | Cong WN, Tao RY, Tian JY, et al. The establishment of a novel non-alcoholic steatohepatitis model accompanied with obesity and insulin resistance in mice[J]. Life Sci, 2008, 82:983-990. |
| [14] | Pansuria M, Xi H, Li L, et al. Insulin resistance, metabolic stress, and atherosclerosis[J]. Front Biosci, 2012, 4:916-931. |
| [15] | Gruben N, Shiri-Sverdlov R, Koonen DP, et al. Nonalcoholic fatty liver disease:a main driver of insulin resistance or a dangerous liaison?[J]. Biochim Biophys Acta, 2014, 1842:2329-2343. |
| [16] | Feldhammer M, Uetani N, Miranda-Saavedra D, et al. PTP1B:a simple enzyme for a complex world[J]. Crit Rev Biochem Mol Biol, 2013, 48:430-445. |
| [17] | Xiao X, Song BL. SREBP:a novel therapeutic target[J]. Acta Biochim Biophys Sin, 2013, 45:2-10. |
| [18] | Tsukamoto H, She H, Hazra S, et al. Fat paradox of steatohepatitis[J]. J Gastroenterol Hepatol, 2008, 23:S104-S107. |
| [19] | Yan F, Wang Q, Lu M, et al. Thyrotropin increases hepatic triglyceride content through upregulation of SREBP-1c activity[J]. J Hepatol, 2014, 61:1358-1364. |
| [20] | Fu Y, Luo N, Klein RL, et al. Adiponectin promotes adipocyte differentiation, insulin sensitivity, and lipid accumulation[J]. J Lipid Res, 2005, 46:1369-1379. |
| [21] | Sanderson SO, Smyrk TC. The use of protein tyrosine phosphatase 1B and insulin receptor immunostains to differentiate nonalcoholic from alcoholic steatohepatitis in liver biopsy specimens[J]. Am J Clin Pathol, 2005, 123:503-509. |
| [22] | Chen PJ, Cai SP, Huang C, et al. Protein tyrosine phosphatase 1B (PTP1B):a key regulator and therapeutic target in liver diseases[J]. Toxicology, 2015, 337:10-20. |
| [23] | Ugi S, Shi K, Nishio Y, et al. Membrane localization of protein-tyrosine phosphatase 1B is essential for its activation of sterol regulatory element-binding protein-1 gene expression and consequent hypertriglyceridaemia[J]. J Biochem, 2009, 146:541-547. |
| [24] | Shimizu S, Ugi S, Maegawa H, et al. Protein-tyrosine phosphatase 1B as new activator for hepatic lipogenesis via sterol regulatory element-binding protein-1 gene expression[J]. J Biol Chem, 2003, 278:43095-43101. |
 2016, Vol. 51
2016, Vol. 51


