2. 北京朝阳医院乳腺外科, 北京 100020
2. Department of Breast Surgery, Beijing Chao-Yang Hospital, Beijing 100020, China
乳腺癌是全球女性最常见的恶性肿瘤,其发病率约占女性肿瘤的23% 左右,且逐年提高。过去5年,全球每年仍有约620万妇女被诊断患有乳腺癌[1]。
目前,临床上用于晚期乳腺癌药物包括蒽环类药物、紫杉类药物、卡培他滨、多柔比星和表柔比星等。但是化疗药物毒性大、维持治疗的给药周期较长,患者的依从性较差、不良反应较多,且容易产生耐药。因此,更理想的治疗药物应具有效、低毒和使用方便等特点。而PARP抑制剂正是符合目前临床要求,具有低毒、不易产生耐药的靶向小分子药物。
PARP抑制剂的靶点多聚ADP-核糖聚合酶 (PARP) 是一种蛋白修饰酶,它能催化NAD+分子中ADP-核糖转移到蛋白分子的氨基酸残基上,催化合成多聚腺苷酸二磷酸核糖 (PAR),从而对蛋白进行修饰,调节蛋白的功能[2]。PARPs家族共有17个成 员,目前研究相对深入的是PARP1/2,这两个酶都能催化蛋白的多聚ADP-核糖化修饰,参与DNA的损伤修复,在多种肿瘤疾病的发生发展中起到重要作用。PARP1/2可通过碱基剪切修复对DNA单链断裂的修复起到极其重要的作用,而这些断裂位点的修复正是造成放化疗耐药 (如烷化剂) 的原因[3, 4]。大 量研究表明,在肿瘤细胞中,PARP一般处于高表达状态,导致肿瘤容易产生治疗耐受。因此,抑制PARP能够减少肿瘤产生耐受,PARP也成为肿瘤治疗的一个新靶点。
奥拉帕尼 (AZD2281) 作为第一个上市的PARP抑制剂,美国FDA已批准用于治疗乳腺癌 (breast cancer) 基因 (BRCA) 突变的晚期卵巢癌。同时研究表明,奥拉帕尼对多种乳腺癌也有较好的治疗作用。本文以恶性程度高的乳腺癌4T1为模型,利用小动物活体成像技术研究奥拉帕尼增敏Taxol的抗乳腺癌作用。
材料与方法 材料与试剂小鼠乳腺癌细胞株4T1/Luc购自上海科远迪生物科技有限公司。噻唑蓝 (MTT) 购自Sigma公司。BALB/c小鼠,体重17~19 g,清洁级,雌性,由北京维通利华实验动物技术有限公司提供,合格证号: (京) 2012-0001。荧光素购自上海科远迪生物科技有限公司。化合物AZD2281由科莱博公司合成并赠与,纯度为98%以上。动物实验注射用Taxol,来自北京协和药厂,规格为每支5 mL/30 mg。
仪器酶标仪 (EnSpire) 购于PE公司,凝胶成像仪 (ImageQuantLAS4000 mini) 购于GE公司,小动物活体成像系统 (LB983 NC100) 购于Berthold公司,五分类血球计数仪 (KOHDEN Celltac E) 购于Nihon公司,全自动样品快速研磨仪 (Tissuelyser-48) 购于上海净信科技有限公司,流式细胞仪 (FACS Calibur) 购于BD公司。
细胞培养乳腺癌细胞株4T1/Luc于含10% 胎牛血清、100 μg·mL-1潮霉素 (hygromycin)、100 u∙mL-1青霉素和100 μg∙mL-1链霉素的DMEM中传代培养,置于5% CO2、37 ℃培养箱中,待细胞密度达到90%时,0.25% 胰酶-EDTA消化传代,实验前将培养基中的潮霉素除去。
MTT 检测收集对数生长期的4T1/Luc细胞,调整细胞数为每毫升2×104个,于96孔板中每孔加入含细胞的培养基100 μL。过夜培养后,每孔加入含0.1% DMSO或待测化合物的培养基100 μL,继续培养72 h。每孔加入MTT (5 mg∙mL-1) 20 μL,37 ℃反应4 h后,小心弃去上清,然后每孔加入DMSO 200 μL溶解沉淀,于490 nm处测定吸光度值。增敏系数 (potential factor,PF) 的计算公式为PF = IC50 (Taxol) / IC50 (Taxol + AZD2281)。
细胞凋亡检测4T1/Luc细胞用AZD2281和Taxol单独或联合处理48 h后,根据Annexin V检测试剂盒 (天津三箭生物技术有限公司) 说明进行操作。即将细胞用胰酶消化后收集,并用PBS洗两遍,然后加入Annexin V-FITC 5 μL孵育30 min,再加入PI 5 μL处理5 min后用流式细胞术分析结果。
小鼠异位移植瘤实验收集对数生长期的4T1/Luc细胞,用0.9% 无菌生理盐水漂洗2次后调整细胞数为每毫升5×106个。于小鼠右侧腋下接种,接种量为0.2 mL,即1×106个细胞,接种日记为第0天,即day 0。接种后第1天,随机将小鼠分为4组,分别为对照组、AZD2281组 (50 mg∙kg-1∙d-1)、Taxol组 (24 mg∙kg-1,每3天给药1次)、AZD2281与Taxol联用组 (A+T,即50 mg∙kg-1∙d-1 AZD2281和每3天给药1次的24 mg∙kg-1 Taxol)。其中AZD2281为口服给药 (po),Taxol为腹腔注射给药 (ip)。定期称重,实验完成时,即第15天后,将小鼠脱臼处死,剥离瘤体,称重,计算肿瘤抑制率。
活体生物荧光成像检测50 mg∙kg-1戊巴比妥钠 (即2.5 mg∙mL-1溶于生理盐水,每只0.4 mL腹腔注射) 麻醉小鼠后,腹腔注射150 mg∙kg-1荧光素,5 min后,利用小动物活体成像系统进行化学发光检测。
Western blot 实验取约0.1 g瘤块,加入含蛋白酶抑制剂的RIPA裂解液0.7 mL,用全自动样品快速研磨仪处理瘤块,得到匀浆液继续于冰上放置裂解0.5 h。12 000×g离心15 min取上清。测量蛋白浓度后进行Western blot实验,上样量为20 μg,将上样蛋白进行5 min的沸水浴使其变性,待样品冷却后将其加入SDS-PAGE的上样孔内。设置电压100 V,待溴酚蓝到达底端时停止电泳。然后采用PVDF膜进行转膜,转膜电压120 V,时间2 h。最后将转膜进行牛奶封闭,抗体孵育,ECL显色。
统计学分析数据以x± s表示,采用Student’s t-test检验,P < 0.05为有统计学意义差异。
结果 1 AZD2281 体外对 Taxol 增敏作用已知AZD2281是一种选择性的PARP1/2抑制剂,酶学水平活性的半数抑制浓度 (IC50) 为5 nmol∙L-1/ 1 nmol∙L-1。但是目前对于恶性乳腺癌4T1的治疗效果还没有研究数据。在本研究中,单独使用AZD2281,对4T1/Luc细胞的杀伤作用较弱,IC50为31.43 μmol∙L-1。当AZD2281联合Taxol给药时,能显著增加4T1/Luc细胞对Taxol的敏感性,给药浓度为5和10 μmol∙L-1时,Taxol的IC50从19.65 nmol∙L-1减少至2.11和0.21 nmol∙L-1,经计算增敏倍数分别为9.32和94.91倍(图 1)。
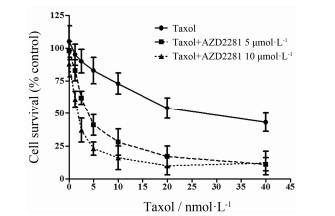 | Figure 1 The sensitizing effect of olaparib (AZD2281) to Taxol on breast cancer cell line 4T1/Luc. The breast cancer cells 4T1/Luc were treated with different concentrations of AZD2281 and/or Taxol for 72 h,then subjected to MTT assays |
为了证明AZD2281是否能诱导细胞凋亡来增加其对Taxol的作用,在实验中采用流式细胞术检测。如图 2所示,在没有加药处理的情况下,4T1/Luc细 胞自然状态约有11.8% 的总凋亡率 (早期凋亡5.8%,中期凋亡6.0%),单用AZD2281或Taxol处理,都能诱导4T1/Luc细胞的凋亡,总凋亡率分别为26.5% 和35.9%。当联合两个药物处理,一定程度上能进一步诱导4T1/Luc细胞凋亡,总凋亡率为50.4%。
 | Figure 2 The sensitizing effect of AZD2281 to Taxol on 4T1/ Luc cells’ apoptosis. 4T1/Luc cells were exposed to AZD2281 (10 μmol∙L-1) and/or Taxol (10 nmol∙L-1) for 48 h and the cells were collected for PI and Annexin V double staining and flow cytometry analysis. The representative image (A) and the quantitative data (B) were shown. *P < 0.05,**P < 0.01 vs control; #P < 0.05 vs Taxol; ΔΔP < 0.01 vs AZD2281 |
接种4T1-Luc细胞后5天内,各组小鼠的活动、饮食和毛色未见明显变化。10天后,对照组、AZD2281组和Taxol组可见进食减少、活动频率下降、皮毛松弛等恶病质表现。而联合给药组虽然在体重上有显著下降 (图 3),但是小鼠的生活状态,特别是毛色较其他组好。这表明,ADZ2281联合Taxol用药后显著改善了小鼠的生活质量。
 | Figure 3 The effect of AZD2281 and/or Taxol on the body weight of the mice. The mice implanted with 4T1/Luc xenografts were administrated with AZD2281 (po),and/or injected with Taxol (ip) as indicated time. Body weights were presented. n = 6,x± s. P < 0.05,**P < 0.01 vs control |
活体生物荧光成像技术是近年来发展起来的一项分子、基因表达的分析检测系统。传统的动物实验方法需要在不同的时间点宰杀实验动物以获得数据,得到多个时间点的实验结果。相比之下,活体成像通过对同一组实验对象在不同时间点进行记录,跟踪同一观察目标 (标记细胞及基因) 的移动及变化,所得的数据更加真实可信。由于小鼠的皮毛直接影响肿瘤的手动体积测量,因此在本研究中采用标记了荧光素的4T1/Luc细胞进行活体生物荧光成像,观测小鼠肿瘤的增殖情况。如图 4所示,不论是肿瘤的大小 (图 4A)、面积 (图 4B),还是活体成像的整体动物荧光照片(图 4C),都表明,单独使用AZD2281或Taxol时,对小鼠的治疗效果较差; 而联合给药时,AZD2281能显著增加Taxol的治疗作用。
 | Figure 4 The sensitizing effects of AZD2281 to Taxol on tumor growth in 4T1/Luc xenograft tumors model. The mice implanted with 4T1/Luc xenografts were administrated with AZD2281 (po),and/or injected with Taxol (ip) as indicated time. Tumor growth curve (counts) (A),tumor areas (B) and represented mice images (C) were presented. n = 6,x± s |
为了验证活体生物荧光成像技术是否准确真实地反映了各组肿瘤的大小,在给药15天后,剥取小鼠腋下肿瘤 (图 5A和5B)。其中,对照组、AZD2281和Taxol组的平均瘤重分别为0.93 ± 0.14、0.77 ± 0.17和0.56 ± 0.13 g,而联合给药组的平均瘤重只有0.28 ± 0.05 g。单用AZD2281和Taxol的抑瘤率分别约为16.9% 和39.0%,而两者联合给药时,AZD2281显著增敏了Taxol的体内药效,抑瘤率达到了70.1% (图 5C)。
 | Figure 5 The sensitizing effects of AZD2281 to Taxol on the growth of 4T1-Luc xenograft model. After the tumors were implantation for 15 days,the mice were sacrificed and the photos of the mice (A) and tumor (B) were presented. The tumor weights were measured (C). ***P < 0.001 vs control; ##P < 0.01 vs Taxol; ΔΔΔP < 0.001 vs AZD2281 |
PAR是PARP的活性产物。为了证实AZD2281确实通过抑制PARP的活性而产生了抗肿瘤作用,在实验中采用Western blot检测了肿瘤内PARP的活性产物PAR的表达水平,如图 6所示。单用AZD2281时,在一定程度上降低了肿瘤组织内PAR的表达。当联合Taxol时,AZD2281对PAR的抑制作用更加显著。
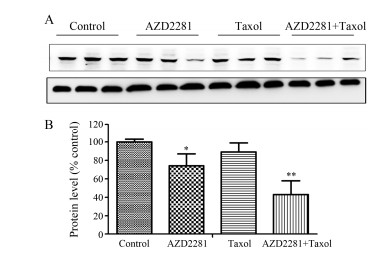 | Figure 6 The effect of AZD2281 on poly(ADP-ribose) polymerase (PARP) target protein poly(ADP-ribose) (PAR). The proteins of tumor tissues were extracted and analyzed by Western blot. A: PAR protein level was presented; B: Quantitative data. n = 3,x± s. P < 0.05,**P < 0.01 vs control |
近来PARP抑制剂的研究进展迅猛,除了阿斯利康公司的奥拉帕尼已经批准上市用于治疗BRCA缺陷的卵巢癌之外,已经有10多个PARP抑制剂进入临床试验阶段[5]。尽管这些PARP抑制剂单药在BRCA1/ BRCA2突变的乳腺癌和卵巢癌中可发挥一定治疗效果,但目前的PARP抑制剂在临床应用时,仍需要其他化
疗药物或放射治疗联合使用才能发挥更好的抗肿瘤作用,因而选择合适的联用化疗药物和敏感的瘤谱显得格外重要。本研究选择的联用化疗药物Taxol是从紫杉属植物中提取分离得到的天然物质,对于乳腺癌和卵巢癌等有显著的治疗作用。
本研究选择乳腺癌为研究对象,是因为乳腺癌既是中国女性发病率最高的癌症,同时也是PARP抑制剂的敏感瘤谱之一。在研究中使用的乳腺癌4T1细胞株是一株恶性程度特别高的鼠源细胞株,它在原位乳腺脂肪垫和异位接种时都可以成瘤。将其注射到BALB/c小鼠中时,4T1异位接种后容易产生高转移肿瘤,可转移到肺、肝、淋巴结和大脑。4T1细胞在BALB/c小鼠中的生长特性与人乳腺癌十分相近,可作为模拟人VI期乳腺癌的动物模型[6]。PARP抑制剂单药由于合成致死原理,对于BRCA1/2以及PTEN功能缺陷的乳腺癌有较好的体外抑制率,一般IC50可以达到微摩尔水平,但是PARP抑制剂单药对于其他乳腺癌的体外抑制率相对较差[7, 8]。在本研究中,初步的体外实验发现,奥拉帕尼单药对4T1/Luc细胞的IC50达到31.43 μmol·L-1,这表明奥拉帕尼单药对4T1/Luc的抗肿瘤作用不是很理想,同时也提示4T1细胞并不是一个BRCA/PTEN缺陷或者突变的肿瘤。但是在联用化疗药物Taxol后发现奥拉帕尼对Taxol的增敏作用非常明显,而进一步的体内结果也证实了这一点。Taxol是一种通过抗微管解聚、抑制细胞有丝分裂的药物,它并不直接损伤DNA,其对DNA的损伤是由药理作用引起的继发效应[9]。PARP抑制剂奥拉帕尼对于这种继发的DNA损伤的加深,即对Taxol增敏的相关药效和机制值得进一步研究和探讨。
在小鼠异位肿瘤模型中,通过肿瘤荧光素信号以及肿瘤的体积和重量的检测,进一步确证了奥拉帕尼在体内的增敏作用。抑瘤率可以在Taxol组的基础上提高近一倍,在增加化疗药物抗肿瘤作用的同时,动物的状态较好,并没有像其他一些药物放大其免疫抑制等不良反应[10]。肿瘤中的PAR结构明显减少,证明奥拉帕尼在体内发挥增敏作用与其抑制PARP酶学活性的特性密不可分。
本研究首先使用荧光素标记的4T1/Luc细胞构建了小鼠乳腺癌细胞异位模型,并在此基础上利用小动物活体生物荧光成像技术监测了AZD2281对4T1/Luc乳腺癌的抗肿瘤作用。研究发现,无论是在体内还是体外,单独使用AZD2281对4T1肿瘤的治疗作用较差,而在联合Taxol使用时,能显著增敏Taxol的抗肿瘤作用。鉴于4T1是一个观察乳腺癌转移的出色模型,同时荧光素标记的细胞可以帮助活体示踪小鼠体内的肿瘤转移灶。因此,下一步将考察奥拉帕尼等PARP抑制剂单药和联用化疗药物对4T1/Luc侵袭和转移能力的影响,这对于PARP抑制剂的抗乳腺肿瘤作用研究有重要意义。
| [1] | Braithwaite D, Demb J, Henderson LM. Optimal breast cancer screening strategies for older women:current perspectives[J]. Clin Interv Aging, 2016, 11:111-125. |
| [2] | Citarelli M, Teotia S, Lamb RS. Evolutionary history of the poly(ADP-ribose) polymerase gene family in eukaryotes[J]. BMC Evol Biol, 2010, 10:308. |
| [3] | Drew Y. The development of PARP inhibitors in ovarian cancer:from bench to bedside[J]. Br J Cancer, 2015, 113 Suppl 1:S3-S9. |
| [4] | Ricks TK, Chiu HJ, Ison G, et al. Successes and challenges of PARP inhibitors in cancer therapy[J]. Front Oncol, 2015, 5:222. |
| [5] | Bao Z, Cao C, Geng X, et al. Effectiveness and safety of poly (ADP-ribose) polymerase inhibitors in cancer therapy:a systematic review and meta-analysis[J]. Oncotarget, 2016, 7:7629-7639. |
| [6] | Heppner GH, Miller FR, Shekhar PM. Nontransgenic models of breast cancer[J]. Breast Cancer Res, 2000, 2:331-334. |
| [7] | Dedes KJ, Wetterskog D, Mendes-Pereira AM, et al. PTEN deficiency in endometrioid endometrial adenocarcinomas predicts sensitivity to PARP inhibitors[J]. Sci Transl Med, 2010, 2:53ra75. |
| [8] | Jones P, Altamura S, Boueres J, et al. Discovery of 2-{4-[(3S)-piperidin-3-yl]phenyl}-2H-indazole-7-carboxamide (MK-4827):a novel oral poly(ADP-ribose)polymerase (PARP) inhibitor efficacious in BRCA-1 and -2 mutant tumors[J]. J Med Chem, 2009, 52:7170-7185. |
| [9] | Toppmeyer DL, Gounder M, Much J, et al. A phase I and pharmacologic study of the combination of marimastat and paclitaxel in patients with advanced malignancy[J]. Med Sci Monit, 2003, 9:P199-P104. |
| [10] | Nicum S, Roberts C, Boyle L, et al. A phase II clinical trial of 6-mercaptopurine (6MP) and methotrexate in patients with BRCA defective tumours:a study protocol[J]. BMC Cancer, 2014, 14:983. |
 2016, Vol. 51
2016, Vol. 51


