2. 中山大学药学院, 广东 广州 510006;
3. 中山大学附属第一医院, 广东 广州 510080
2. School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China;
3. The First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China
细胞色素P450酶系 (cytochrome P450,CYP450) 在体内药物代谢中起着至关重要的作用。临床上,有90%以上的药物经过CYP450酶(包括CYP1A、CYP2B、CYP2C、CYP2D和CYP3A) 代谢,其中约50% 的药物经CYP3A代谢[1, 2]。近年来,几种CYP3A的底物常被用来作为“探针”研究其他药物或食物等对CYP3A活性的影响。最常用的有14C红霉素[3, 4]、咪达唑仑[5, 6, 7, 8]、阿芬太尼[9, 10]、硝苯地平[11]等。咪达唑仑是一种短效的苯二氮䓬类镇静催眠药物,口服后主要经CYP3A代谢 (其代谢产物主要为1'-羟基咪达唑仑,小部分为4'-羟基咪达唑仑及1',4-羟基咪达唑仑),由于不属于P-gp底物,因此咪达唑仑是体内及体外研究药物或食物对CYP3A活性影响的理想探针之一[12, 13, 14]。
咪达唑仑作为CYP3A体内探针药的给药剂量如何选择,目前尚未见相关报道。Xue等[15]曾报道常用的护肝中药制剂五酯片 (华中五味子的乙醇提取物制剂) 对低剂量及高剂量环孢素A (CYP3A及P-gp的底物) 的影响,结果表明五酯片对低剂量环孢素A的血药浓度及药代动力学参数影响更为显著。可见,探针药剂量或浓度的选择有可能会影响实验结果。因此,本研究旨在考察不同剂量咪达唑仑在大鼠体内的药动学及大鼠生理状态变化,从而确定咪达唑仑作为大鼠体内CYP3A探针药时的最佳剂量范围。
材料与方法 药品与试剂咪达唑仑 (midazolam,MDZ,5 mg× 1 mL/支,江苏恩华药业股份有限公司,批号: 20090501); 肝素钠注射液 (常州千红生化制药股份有限公司,批号: 090625); PE插管 (polythene 0.98 mmOD,浙江安莱科技有限公司),实验中所用试剂均为色谱纯。
实验动物清洁级雄性Sprague-Dawley (SD) 大鼠24只,200~240 g,由中山大学实验动物中心提供 [合格证号: SCXK (粤) 2009-0011],于SPF级环境饲养,动物室内温度20~25 ℃、相对湿度40%~70%、换气次数10~15次/h,保持12 h光照循环; 期间自由饮水进食,提供实验室标准动物饲料,符合我国《实验动物管理条例》和《医学实验动物管理实施细则》。实验前禁食12 h,自由饮水。
灌胃给予不同剂量的咪达唑仑在大鼠体内的药动学研究SD大鼠在给药前一天行右颈静脉插管手术[16, 17, 18]。大鼠用乙醚轻度麻醉后,剃毛,暴露右颈术野,作一约5 mm切口。钝性分离出右颈静脉,结扎远心端后作一小切口,插入外径为0.98 mm,内径为0.56 mm的PE管后结扎固定,导管经颈背部皮下穿出,确保血流通畅后,固定于后背上,术后恢复12 h后用于实验,给药前12 h禁食。
将手术后的大鼠随机分成6组,分别灌胃给予不同剂量的咪达唑仑 (1、2、5、10、15和20 mg·kg-1),并于给药前 (0 h)、给药后0.083、0.17、0.25、0.5、0.75、1、1.5、2、3和4 h从右颈静脉插管处取血 约0.25 mL,取血后即从插管处补充同体积的肝素化生理盐水 (含50 U·mL-1肝素的生理盐水),所取血 样12 000 r·min-1离心10 min,立即精密吸取上清液& nbsp; 100 μL置2 mL EP管中,置 -80 ℃保存。血样按文 献[19]方法测定,并用PKPP药动学软件包计算药代动力学参数[16, 17, 18]。
统计学分析采用方差分析及非参数检验,P < 0.05有统计学意义。数据处理软件为SAS 8.1 (SAS Ver.8.1,SAS Institute Inc.,Cary,NC,USA) 统计学软件。
结果 1 咪达唑仑在大鼠体内的药动学参数单次灌胃不同剂量咪达唑仑在大鼠体内的药时曲线见图 1,药动学参数见表 1。
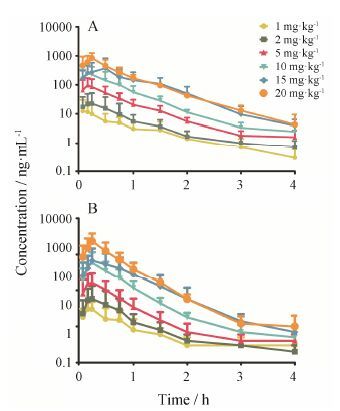
|
Figure 1 Plasma concentration-time profiles of midazolam (MDZ,A) and 1-OH MDZ (B) after oral administration of different doses of MDZ in rats. n = 4,x± s |
|
|
Table 1 Pharmacokinetic parameters of MDZ and 1-OH MDZ after oral administration of different doses of MDZ in rats. n = 4,x± s. *P < 0.05 vs AUC0-4 h/Dose of MDZ at 1 mg·kg-1 |
在1~5 mg·kg-1剂量内,咪达唑仑及1'-羟基咪达唑仑在大鼠体内的Cmax、AUC0-4 h及AUC0-∞ 随着剂量的增加而呈线性增长(r > 0.99) (图 2),但当咪 达唑仑的剂量为15~20 mg·kg-1时,咪达唑仑在大 鼠体内的血药浓度呈非线性增加。以1 mg·kg-1组的Cmax为基准,各剂量组的Cmax与1 mg·kg-1组的Cmax的比值为1.0∶1.9∶7.5∶20.5∶37.9∶67.0,而各组间给药剂量的比值为1∶2∶5∶10∶15∶20,表明在1~5 mg·kg-1剂量内咪达唑仑的Cmax与其给药剂量成 比例增加。将1~5 mg·kg-1剂量内咪达唑仑的Cmax、AUC0-4 h与灌胃给药剂量进行线性回归,得到的r值分别为0.994 2及0.995 4,而其代谢产物1'-羟基咪达唑仑的Cmax、AUC0-4 h对给药剂量进行线性回归后,其r值分别为0.998 1及0.998 8 (图 2)。

|
Figure 2 Linear regression profiles of Cmax and AUC of MDZ (A) and 1-OH MDZ (B) after oral administration of 1,2,5 mg·kg-1 dose of MDZ in rats |
1、2、5、10、15和20 mg·kg-1剂量组咪达唑仑的AUC/Dose值依次分别为10.2 ± 7.1、9.0 ± 7.2、14.2 ± 8.7、17.9 ± 13.9、28.7 ± 20.6 (P < 0.05) 和30.8 ± 12.0 (P < 0.05) (表 1)。在1~10 mg·kg-1剂量内,咪达唑仑的AUC/Dose值未见显著性差异 (P > 0.05); 但15和20 mg·kg-1这两个剂量组上述药动学参数与1 mg·kg-1剂量组相比存在统计学差异 (P < 0.05)。1~20 mg·kg-1剂量组间咪达唑仑的tmax及MRT无统计学差异 (P > 0.05)。
讨论体内实验时,相关代谢酶探针药物的剂量往往会影响相应的实验结果,因此有必要明确药物代谢酶的探针药物用于体内研究时所用的适宜剂量,以有效灵敏地反映化合物对该代谢酶的作用。本实验考察并确定咪达唑仑作为大鼠体内CYP3A探针底物使用时的最佳剂量范围,对研究药物或食物与CYP3A代谢酶的相互作用有着重要意义。
本实验通过评价单次灌胃给予不同剂量的CYP3A经典探针药——咪达唑仑的药动学变化、生理变化 从而优化其给药剂量范围。实验结果表明: 1~5 mg·kg-1剂量内咪达唑仑及其代谢物1'-羟基咪达唑 仑的血药浓度呈线性增加 (r > 0.99); 而当剂量增加至15~20 mg·kg-1时,咪达唑仑的血药浓度呈非线 性增加。咪达唑仑高剂量组 (15~20 mg·kg-1) 的非线性药动学过程提示: 灌胃给予高剂量的咪达唑仑,很可能由于瞬时浓度太高,远远超过了肠道及肝脏CYP3A对咪达唑仑的代谢能力,使其首过效应减小,从而使得高剂量 (15~20 mg·kg-1) 咪达唑仑的血药浓度 (等剂量化后) 远远高于其低剂量 (1~5 mg·kg-1) 给药时的血药浓度。此外,有文献[20]使用10 mg·kg-1咪达唑仑作为CYP3A的抑制剂考察其对沙奎那韦(saquinavir) 药动学的影响,提示10 mg·kg-1咪达唑仑对CYP3A有抑制作用。因此,当咪达唑仑作为体内CYP3A的探针药物时,若其给药剂量大于10 mg·kg-1,很可能由于瞬时酶饱和作用及咪达唑仑的自身抑制作用从而掩盖了抑制剂对CYP3A的部分抑制作用。
据文献[5, 6, 7, 8]报道,当选取咪达唑仑做为探针底 物研究药物对大鼠体内CYP3A酶活性影响时,15~ 20 mg·kg-1为研究者经常选择的咪达唑仑剂量范围。但是,当作者研究中药制剂五酯片对CYP3A的作用机制时,结果显示五酯片仅使高剂量咪达唑仑 (15 mg·kg-1) 及地高辛 (P-gp底物,给药剂量为0.25 mg·kg-1) 的AUC升高34% 及49%,明显低于作者之前的研究结果: 五酯片可使他克莫司 (CYP3A及P-gp的底物) 血药浓度升高2倍[17]。此外,实验中观察到
当咪达唑仑的灌胃给药剂量达到10 mg·kg-1时,由于强镇静作用,实验过程中大鼠处于昏睡状态 (大鼠无翻转现象) ,提示高剂量的咪达唑仑有可能也会影响大鼠的生理状态进而影响大鼠体内的CYP3A的活性。考虑到高浓度的咪达唑仑 (大于10 mg·kg-1) 可能对CYP3A活性存在抑制作用、酶饱和现象及可能改变大鼠生理状态,从而掩盖了五酯片对CYP3A的部分抑制作用,因此,作者对咪达唑仑的剂量进行了优化,进一步考察了五酯片对低剂量咪达唑仑 (给药剂量为2 mg·kg-1) 药动学的影响,结果表明五酯片使低剂量咪达唑仑的AUC升高112%。这一结果进一步提示: 高剂量的咪达唑仑可能由于其镇静作用改变了大鼠的生理状态及对CYP3A酶存在瞬时 酶饱和现象、自身抑制作用,从而减弱了五酯片对CYP3A的抑制作用。
在动物体内研究药物相互作用时,许多因素如底物及底物剂量的选择会影响到实验结果的准确性。比如,高剂量的咪达唑仑可能会影响酶的活性及改变动物的生理状态从而掩盖化合物对CYP3A的抑制作用。因此,要充分考虑药物剂量对机体各方面因素的影响,选择不影响机体的生理状况而又能满足含量测定需要的最佳剂量或剂量范围,以更好地考察及区分抑制剂或诱导剂对药物代谢酶的作用。综上,当选用咪达唑仑作为CYP3A探针药在大鼠体内研究药物相互作用时,建议咪达唑仑的灌胃剂量设计在1~5 mg·kg-1内。
| [1] | Guengerich FP. Cytochrome P-4503A4:regulation and role in drug metabolism[J]. Annu Rev Pharmacol Toxicol, 1999, 39:1-17. |
| [2] | Shimada T, Yamazaki H, Mimura M, et al. Interindividual variations in human liver cytochrome P-450 enzymes involved in the oxidation of drugs, carcinogens and toxic chemicals:studies with liver microsomes of 30 Japanese and 30 Caucasians[J]. J Pharmacol Exp Ther, 1994, 270:414-423. |
| [3] | Paine MF, Wagner DA, Hoffmaster KA, et al. Cytochrome P4503A4 and P-glycoprotein mediate the interaction between an oral erythromycin breath test and rifampin[J]. Clin Pharmacol Ther, 2002, 72:524-535. |
| [4] | Salvat C, Mouly S, Rizzo-Padoin N, et al. The[14C-Nmethyl]-erythromycin breath test dosimetry complies with the French regulations for radiation safety[J]. Fundam Clin Pharmacol, 2003, 17:349-353. |
| [5] | Kurosawa S, Uchida S, Ito Y, et al. Effect of ursodeoxycholic acid on the pharmacokinetics of midazolam and CYP3A in the liver and intestine of rats[J]. Xenobiotica, 2009, 39:162-170. |
| [6] | Lai L, Hao H, Wang Q, et al. Effects of short-term and long-term pretreatment of Schisandra lignans on regulating hepatic and intestinal CYP3A in rats[J]. Drug Metab Dispos, 2009, 37:2399-2407. |
| [7] | Matsuda K, Nishimura Y, Kurata N, et al. Effects of continuous ingestion of herbal teas on intestinal CYP3A in the rat[J]. J Pharmacol Sci, 2007, 103:214-221. |
| [8] | Zhang W, Tan TM, Lim LY. Impact of curcumin-induced changes in P-glycoprotein and CYP3A expression on the pharmacokinetics of peroral celiprolol and midazolam in rats[J]. Drug Metab Dispos, 2007, 35:110-115. |
| [9] | Chaobal HN, Kharasch ED. Single-point sampling for assessment of constitutive, induced, and inhibited cytochrome P4503A activity with alfentanil or midazolam[J]. Clin Pharmacol Ther, 2005, 78:529-539. |
| [10] | Kharasch ED, Walker A, Hoffer C, et al. Evaluation of first-pass cytochrome P4503A (CYP3A) and P-glycoprotein activities using alfentanil and fexofenadine in combination[J]. J Clin Pharmacol, 2005, 45:79-88. |
| [11] | Streetman DS, Bertino JS Jr, Nafziger AN. Phenotyping of drug-metabolizing enzymes in adults:a review of in-vivo cytochrome P450 phenotyping probes[J]. Pharmacogenetics, 2000, 10:187-216. |
| [12] | Dundee JW, Halliday NJ, Harper KW, et al. Midazolam. A review of its pharmacological properties and therapeutic use[J]. Drugs, 1984, 28:519-543. |
| [13] | Kronbach T, Mathys D, Umeno M, et al. Oxidation of midazolam and triazolam by human liver cytochrome P450ⅢA4[J]. Mol Pharmacol, 1989, 36:89-96. |
| [14] | Nordt SP, Clark RF. Midazolam:a review of therapeutic uses and toxicity[J]. J Emerg Med, 1997, 15:357-365. |
| [15] | Xue XP, Qin XL, Xu C, et al. Effect of Wuzhi tablet (Schisandra sphenanthera extract) on the pharmacokinetics of cyclosporin A in rats[J]. Phytother Res, 2013, 27:1255-1259. |
| [16] | Jin J, Bi H, Hu J, et al. Effect of Wuzhi tablet (Schisandra sphenanthera extract) on the pharmacokinetics of paclitaxel in rats[J]. Phytother Res, 2011, 25:1250-1253. |
| [17] | Qin XL, Bi HC, Wang XD, et al. Mechanistic understanding of the different effects of Wuzhi tablet (Schisandra sphenanthera extract) on the absorption and first-pass intestinal and hepatic metabolism of tacrolimus (FK506)[J]. Int J Pharm, 2010, 389:114-121. |
| [18] | Qin XL, Chen X, Wang Y, et al. In vivo to in vitro effects of six bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) on the CYP3A/P-glycoprotein-mediated absorption and metabolism of tacrolimus[J]. Drug Metab Dispos, 2014, 42:193-199. |
| [19] | Xue X, Huang M, Xiao H, et al. Rapid and simultaneous measurement of midazolam, 1'-hydroxymidazolam and digoxin by liquid chromatography/tandem mass spectrometry:application to an in vivo study to simultaneously measure P-glycoprotein and cytochrome P4503A activity[J]. J Pharm Biomed Anal, 2011, 55:187-193. |
| [20] | Usansky HH, Hu P, Sinko PJ. Differential roles of P-glycoprotein, multidrug resistance-associated protein 2, and CYP3A on saquinavir oral absorption in Sprague-Dawley rats[J]. Drug Metab Dispos, 2008, 36:863-869. |
 2016, Vol. 51
2016, Vol. 51


