2. 广安市食品药品检验检测中心, 四川 广安 638500;
3. 澳门理工学院高等卫生学校, 澳门 00853
2. Guangan Center for Food and Drug Control, Guangan 638500, China;
3. School of Health Sciences, Macao Polytechnic Institute, Macau 00853, China
Pickering乳液中微小的固体颗粒吸附于油水界面形成膜状结构,起到稳定乳剂的作用。与传统乳液比较,Pickering乳液不需要使用表面活性剂,安全 性更好,热力学稳定性更高[1],是一种潜在的优良给药系统。目前有关Pickering乳液的药剂学应用以Pickering乳液的经皮给药研究较多[2, 3],口服给药研究较少,而且大多使用二氧化硅纳米粒作为稳定乳滴的固体颗粒,存在潜在的安全问题[4, 5]。另外,Pickering乳液的载药方法大多是将药物溶解于内部油相中制备,油相对药物的溶解能力将直接限制乳液的载药能力。
水飞蓟宾 (silybin,SN) 临床主要用于急、慢性肝炎、初期肝硬化和中毒性肝损害等治疗,对卵巢癌、前列腺癌和肝癌等也具有较好的治疗作用[6]。但由于溶解度和渗透性差而导致口服吸收差、生物利用度低 (< 5%)。有研究采用新型给药系统,如自微乳化给药系统[7]、脂质体[8]和磷脂复合物[9]等提高SN的口服生物利用度,但制备方法复杂,需使用大量表面活性剂,具有潜在的安全性问题。
本文选择SN为模型药物,以其自身纳米晶作为固体微粒稳定剂,研究制备新型药物纳米晶自稳定Pickering乳液载药系统。在此新剂型中仅存在水、油和药物3种物质,使用水飞蓟宾纳米晶 (silybin nanocrystallines,SN-NC) 作为固体微粒稳定剂,不含表面活性剂等其他辅料。与传统脂质制剂相比,避免了表面活性剂带来的安全性问题; 与传统Pickering乳液相比,不使用异种纳米颗粒,避免了纳米颗粒的安全隐患,还能有效提高载药量。本研究制备了水飞蓟宾纳米晶自稳定Pickering乳液 (silybin nanocrystalline self-stabilizing Pickering emulsion,SN-SSPE) 并对其结构进行表征,评价了SN-SSPE的稳定性、体外释放和体内药动学性质; 拓展Pickering乳液在药剂学的应用,为难溶性药物的口服给药提供新思路。
材料与方法 仪器FA25高速剪切机 (上海弗鲁克流体机械制造公司); AH100D高压均质机 (加拿大ATS工业系统有限公司); 纳米粒度及zeta电位分析仪 (Zetasizer Nano ZS,英国马尔文仪器公司); 光学生物显微镜 (BK5000,集成Cool SNAP Photomerics光学采集系统,OPTEC奥特光学公司); 激光共聚焦显微镜 (Leica Tcs spz AoBs型,德国徕卡有限公司); 扫描电子显微镜 (JSM-6510LV,日本电子株式会社); LC-20AD高效液相色谱系统 (二元泵、紫外检测器、自动进样器,日本岛津公司); G16-WS高速离心机 (长沙湘仪离心机仪器有限公司); RCZ-6B2药物溶出度仪 (上海黄海药检仪器有限公司)。
试药SN原料药 (辽宁盘锦华成制药有限公司,纯度: > 95%); SN标准品 (中国食品药品检定研究院,纯度: 99.8%); 单油酸甘油酯 (PECEOL),单亚油酸甘油酯 (MAISINE 35-1),中链甘油三酯 (Labrafac Lipophile WL 1349) (法国嘉法狮公司); 辛酸/葵酸甘油三酯 (Captex 355),单辛酸甘油酯 (Capmul C8),辛酸/葵酸甘油一酯二酯 (Capmul MCM) (美国阿比泰克公司); 大豆油 (铁岭北亚药用油有限公司,注射级); 尼罗红 (美国Sigma试剂公司,纯度: ≥98%); 甲萘酚 (成都科龙化工试剂厂,纯度: ≥98%); 甲醇 (Fisher公司,色谱纯); 其余试剂均为分析纯。
实验动物健康SD大鼠,雄性 (220 ± 20) g,由重庆医科大学实验动物中心提供,实验动物质量合格证号: No.0003788。
SN在油相中的溶解度测定取大豆油、Labrafac Lipophile WL 1349、MAISINE 35-1、Captex 355、Capmul MCM、Capmul C8和PECEOL各2 mL于 可封离心管中。分别加入过量的SN,涡旋10 min后置于40 ℃水浴1 h,再将其置于37 ℃恒温摇床振摇 72 h,取少量于10 000 r·min-1离心10 min,取上清液500 μL,加入氯仿-甲醇溶液 (1∶2,v/v) 3 mL,充分振摇,甲醇定容至10 mL,取少量于10 000 r·min-1离心10 min后取上清液,使用高效液相色谱测定其中药物含量。色谱条件: 色谱柱: Waters Symmetry (250 mm × 4.6 mm,5 μm); 流动相为甲醇: 0.05 mol·L-1磷酸二氢钾溶液 (51∶49,10% 磷酸溶液调节至pH 4); 进样量: 20 μL; 流速: 1.0 mL·min-1; 柱温: 40 ℃; 检测波长: 288 nm。
水飞蓟宾纳米晶混悬液 (silybin nanocrystallines suspension,SN-NCS) 的制备称取SN原料药50 mg,加入水30 mL,涡旋2 min,高速剪切机剪切 (13 000 r·min-1) 2 min,加入水50 mL,混合,再用高压均质机分别在50、60、70、80、90、100、110和120 MPa下循环10次。吸取样品50 μL,稀释至5 mL后使用马尔文激光粒度仪测定SN-NC的粒径。
分别称取SN原料药100、200、300、400、600、800和1 000 mg,加入水30 mL,涡旋2 min,13 000 r·min-1高速剪切2 min,加入水50 mL,混合,再用高压均质机在100 MPa条件下循环10次。吸取样品 50 μL,稀释至5 mL后使用马尔文激光粒度仪测定SN-NC的粒径。
SN-SSPE的制备 分别称取SN原料药100、200、300、400、600、800和1 000 mg,加入至30 mL纯水中,涡旋2 min后,13 000 r·min-1高速剪切2 min,再加入纯水50 mL,在100 MPa条件下均质循环10次制得纳米晶,将所制得的纳米晶与5 mL Capmul C8混合,再使用高压均质机在100 MPa条件下循环10次,即得。制得的样品用光学显微镜观察并进行图像采集,利用Image Pro Plus 6.0进行粒径分析。
SN-SSPE的结构和表面形态分析 取SN-SSPE制备过程中首先制得的SN-NC,置于载玻片,挥干后使用原子力显微镜观察; 另取样置于硅胶膜,自然挥干,表面喷金处理后用扫描电子显微镜观察其形态。
取适量尼罗红,加入Capmul C8完全溶解,再同法制备负载荧光标记物的SN-SSPE,所得样品使用激光共聚焦显微镜观察荧光物质分布,并进行图像采集。
将制得的SN-SSPE分散于硅胶膜,自然挥干,表面喷金处理后使用扫描电子显微镜观察其形态。
SN-SSPE的物理稳定性将SN-SSPE与SN-NCS于5 000 r·min-1离心15 min,观察两种制剂的外观变化。将两种制剂在4 ℃、避光环境下静置,分别于0、2、4、7、14、21、28和40天观察外观变化。
体外释放参考中国药典中的桨法,转速为100 r·min-1,温度为37 ℃。分别将SN-SSPE、SN原料药和SN-NCS加入至900 mL模拟胃液 (0.1 mol·L-1盐酸溶液,含0.5% Tween 80) 和模拟肠液 (pH 7.4磷酸盐缓冲液,含0.5% Tween 80) 中,分别在5、10、15和30 min,1、2、4和6 h吸取样品2 mL,0.22 μm微孔滤膜过滤,续滤液用HPLC测定SN含量,计算药物累积释放百分率。
体内药动学实验将18只大鼠随机分为3组: SN原料药组、SN-NCS组和SN-SSPE组。实验前大鼠禁食24 h,按照50 mg·kg-1剂量分别灌胃给药。其中SN原料药直接使用纯水涡旋,制得与SN-NCS及SN-SSPE载药量相同的混悬液。分别在0.25、0.5、1、2、4、6、8、10和12 h采集血样,5 000 r·min-1离心5 min分离血浆,-20 ℃保存。
取血浆200 μL,加入9.95 μg·mL-1甲萘酚溶液 50 μL及0.1 mol·L-1磷酸二氢钾溶液200 μL。涡旋 2 min后加入乙醚4 mL,涡旋5 min,5 000 r·min-1离心10 min,分离有机层,氮气吹干,加流动相200 μL复溶,5 000 r·min-1离心10 min,上清液用HPLC测定药物含量。色谱条件: 甲醇: 0.05 mol·L-1磷酸二氢钾溶液 (52∶48,10%磷酸调节至pH 3.5),柱温40 ℃,进样量20 μL。
统计学分析采用DAS 2.0软件计算药动学参数,SPSS10.0统计软件进行统计学分析。检验水平 (α) 为0.05,采用t检验。
结果与讨论 1 SN在油相中的溶解度SN在不同油相中的溶解度见表 1,可见SN在Capmul C8中的溶解度最大,因此选择Capmul C8作为油相,以提高制剂载药量。
|
|
Table 1 Equilibrium solubility of silybin (SN) in different oil. n = 3,x± s |
不同匀质压力下制得的SN-NC的粒径见表 2。随着匀质压力增加,SN-NC粒径逐渐减小,当匀质压力达到100 MPa时粒径趋于平衡,粒径达到约210 nm后压力再增加,在一定范围内SN-NC粒径未见明显变化。因此选取100 MPa作为高压匀质压力。
|
|
Table 2 Particle size of silybin nanocrystallines (SN-NC,SN 50 mg) with different homogenization pressure. n = 3,x± s |
使用高压匀质法制备纳米晶的过程中,药物的加入量可能会影响所制得的纳米晶的粒径[10],因此需要考察在所设计的处方范围内,药物加入量是否影响所制得的纳米晶粒径,结果如图 1所示。与药物加入量为50 mg时粒径 (208.3 ± 1.6 μm) 相比,随着药物加入量增加,SN-NC粒径略有增加。这可能是因为纳米粒具有较高的表面自由能会促进纳米晶的聚集,同时由于药物加入量增加,体系中药物总浓度提高,导致药物纳米晶生长变大[11]。使用SPSS软件进行单因素方差分析,结果显示所有剂量组 (100~1 000 mg) 之间无显著性差异 (P > 0.05)。这表明药物加入量在100~1 000 mg内并未显著影响SN-NC的粒径。

|
Figure 1 Particle size of SN-NC and silybin nanocrystallines self-stabilizing Pickering emulsion (SN-SSPE) prepared with different SN content. n = 3,x± s |
在选定的处方比例下 (80 mL水,5 mL Capmul C8),不同的药物加入量对所制得的SN-SSPE的形态和粒径等具有非常明显的影响,结果分别见图 1和图 2。
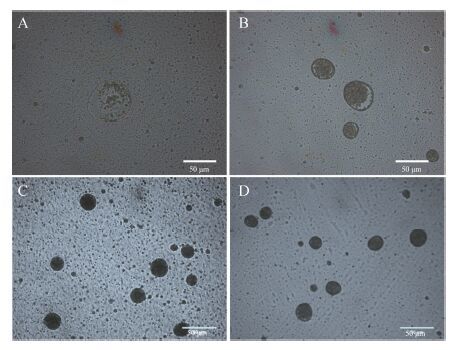
|
Figure 2 Photographs of SN-SSPE with different amounts of SN. A: 100 mg; B: 200 mg; C: 300 mg; D: 800 mg |
图 2显示随着SN加入量增加,SN-NC逐渐吸附在油滴表面,包裹油滴,从而形成SN-SSPE的过程。当药物加入量为100 mg时,大部分油滴表面只存在少量的SN-NC,并未对油滴形成完全的包裹 (图 2A); 当药物加入量为200 mg时,油滴表面被SN-NC包 裹的面积相对于100 mg组有一定的增加,但是仍然有部分表面未形成包裹 (图 2B); 当药物加入量提高至300 mg时,所产生的SN-NC量已经满足对油滴的完全包裹 (图 2C); 当SN加入量为800 mg时,与300 mg组相比,SN-NC对于油滴的包裹形态未出现明显变化 (图 2D)。
由图 1可见,随着药物加入量逐步增加,所制得的SN-SSPE的乳滴粒径逐渐减小; 当药物加入量达到300 mg时乳滴粒径与药物加入量为100 mg和200 mg时乳滴粒径比较有非常显著的差异; 而随着药物加入量继续增加,所制得的SN-SSPE乳滴粒径仍然可能存在缓慢下降的趋势,但没有显著差异。
以上结果显示,药物加入量对Pickering乳液的形成有重要影响。当SN加入量为100 mg或200 mg时,形成的SN-NC较少,不能对油滴形成完全包裹,只能覆盖油滴的部分表面,乳滴粒径较大。当药物加入量达到300 mg时,体系中已有足够量的SN-NC,可对油滴形成完全包裹,乳滴粒径有所减小。再继续增加药物加入量,SN-SSPE的乳滴形态和粒径均无明显变化。这与传统的用二氧化硅纳米粒制备Pickering乳液的规律[12, 13]一致: 若固体颗粒量较少时,会出现大量不能被固体颗粒完全包裹的油滴,且油滴粒径偏大; 固体颗粒量增加,Pickering乳液液滴粒径逐渐减小,稳定性逐渐增加; 当固体颗粒的加入量达到一定值时,其粒径不再变小,液滴粒径趋于稳定。
由于较小的乳滴粒径能使Pickering乳液具有更高的稳定性[14],同时为保证更高的制剂载药量,选择处方药物/油/水的质量体积比为800 mg/5 mL/80 mL,作为后期体内外性质评价的处方。
4 SN-SSPE的结构和表面形态分析SN-SSPE制备过程中制得的SN-NC的原子力显微镜和扫描电镜图像如图 3所示。由图可见,SN-NC呈较为均一规则的球形,直径约300 nm,这与激光粒度仪的测定结果基本一致。粒径较为均一且形态规则的固体微粒更有利于形成稳定、形态完整和粒径均一的Pickering 乳液[15]。
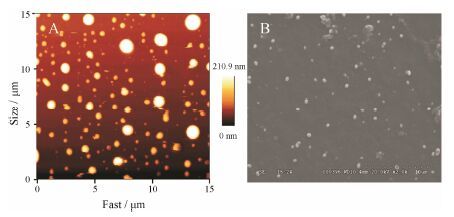
|
Figure 3 Photographs of atomic force microscope (A) and scanning electron micrograph (B) of SN-NC prepared with 800 mg SN at 100 MPa |
使用激光共聚焦显微镜观察荧光标记的SN-SSPE,结果如图 4所示。尼罗红所激发的荧光为红色,而水飞蓟宾自身发射的荧光极弱,因此可判断图 4B中红色荧光为Pickering乳液内部油相中的尼罗红产生; 除红色处,图 4B中乳滴图像形态、分布与光学显微镜图像 (图 4A) 重合。这说明尼罗红溶于油相,均匀分布于乳滴中。而由图 4A和4B均可见在油滴表面有微小颗粒堆积,即为SN-NC。这提示,在SN-SSPE中,SN-NC吸附于油滴表面,对油滴形成包裹,呈现出核壳状结构。
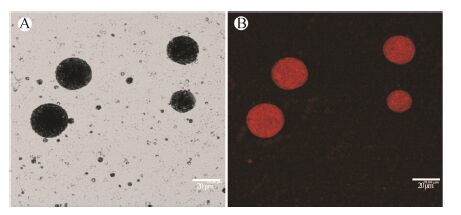
|
Figure 4 The optical micrograph (A) and confocal micrograph (B) of SN-SSPE prepared with 80 mL water,5 mL oil and 800 mg SN at 100 MPa |
SN-SSPE的扫描电镜图像如图 5所示。随着放大倍数提高 (标尺从100 μm缩小到1 μm),可以清晰地看到,在SN-SSPE挥干乳滴 (微米尺寸) 的表面覆盖着大量纳米尺寸的SN-NC,形成完整的外壳; 而且挥干的SN-SSPE乳滴粒径约为30 μm,与挥干前的粒径 (27.3 ± 3.1 μm) 基本一致,大部分球形形态未见明显变化,这说明在油滴表面的SN-NC形成了较为坚实的外壳,能够支撑其球形结构,使SN-SSPE具有较高的稳定性。另外,可见SN-SSPE乳滴表面的部分SN-NC发生变化,失去了之前完整的球形,原因可能是SN-NC吸附于油滴表面后,部分被油相溶解并重新结晶。
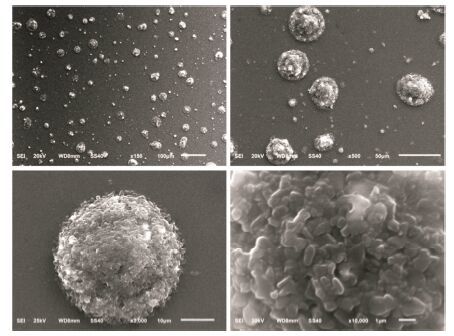
|
Figure 5 Scanning electron micrograph of SN-SSPE prepared with 80 mL water,5 mL oil and 800 mg SN at 100 MPa |
由以上结果可以推导SN-SSPE的形成原理和结构,如图 6所示,高压匀质生成SN-NC,部分SN溶解于油相中,而大部分SN-NC则吸附在油滴的表面并对油滴形成包裹,最终形成稳定的SN-SSPE。
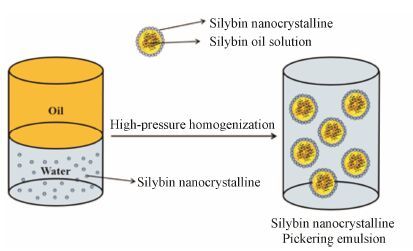
|
Figure 6 Schematic diagram of formation process of SN-SSPE |
经高速离心后SN-NCS出现了明显的沉淀,而SN-SSPE未见沉淀。SN-SSPE在40天内都能保持相对稳定,没有出现明显的不稳定现象; 而SN-NCS在放置4天时就开始出现分层,且随着放置时间增长,其分层现象更加明显,到40天时大量的水飞蓟宾纳米晶沉淀于底部,同时分层现象更为明显。说明SN- SSPE的稳定性较SN-NCS有所提高,该载药系统保持了Pickering乳液的高稳定特性。
高速离心和长期自然静置的稳定性实验均证实,SN-SSPE较SN-NCS有更好的物理稳定性。这是由于固体颗粒吸附于液滴表面形成刚性的壳状结构,这种物理间隔能够保证液滴的充分分散,有效抑制液滴的合并[16]。而传统的纳米晶混悬液由于具有较高的表面自由能会促进纳米晶的聚集,需要加入高分子材料或表面活性剂等抑制其聚集[17],而本课题所制备的SN-NCS中未加入该类辅料,故稳定性较差。
6 体外药物释放药物的体外释放结果见图 7。如图 7A所示,在人工胃液中,SN-NCS和SN-SSPE在0.25 h时累积释放分别达到44% 和51.8%,而SN原料药的累积释放量仅为10.1%; 2 h时SN-NCS和SN-SSPE的累积释放分别为53.2% 和69.9%,而SN原料药的累积释放仅为22.1%。这说明在人工胃液中,相对于SN原料药,SN-NCS和SN-SSPE的释放速率和累积释放均有较大的提高。如图 7B所示,在人工肠液中,SN-NCS和SN-SSPE在0.25 h时累积释放分别达到46.1% 和58.1%,而SN原料药的累积释放量仅为8.3%; 在6 h时SN-NCS和SN-SSPE的累积释放分别达到73.5% 和90.1%,而SN原料药的累积释放量仅为53.8%。这说明在人工肠液中,相对于SN原料药,SN-NCS和SN-SSPE的释放速率和累积释放也有较大的提高。
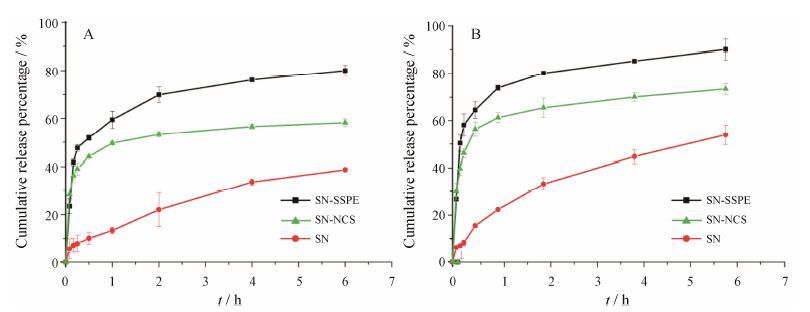
|
Figure 7 In vitro dissolution curves of SN,SN-NCS and SN-SSPE in artificial gastric juice (A) and artificial intestinal fluid (B). n = 6,x± s |
对比SN-SSPE和SN-NCS在人工胃液和肠液中的药物释放,可以发现,SN在人工肠液中的释放较多,而在人工胃液中较少。这是由于SN本身为一种含有酚羟基的弱酸性药物,其溶出速率随着pH值升高而加快。在胃液环境下,受H+作用而导致其释放速率和药物释放量偏低; 而在肠液中时,由于pH较高,释放速率较快[18]; 因此,SN在pH 7.4介质中的突释可归因于其分子特性。SN-NCS和SN-SSPE的释放速率较快主要归因于两种制剂均具有纳米晶结构。两种制剂中的SN以纳米晶的形式存在,纳米晶由于具有更小的粒径和更大的表面积,其物理化学的相关性质均出现了一定的变化[15],药物的溶出速率和溶解度相对于SN原料药增加,对提高药物的释放具有显著的作用。
7 药动学研究SN原料药、SN-NCS及SN-SSPE口服给药后的药时曲线见图 8,利用DAS 2.0软件计算非房室模型主要药动学参数,见表 3。

|
Figure 8 Plasma concentration-time curves of SN,SN-NCS and SN-SSPE (SN,50 mg·kg-1) after a single administration in rats. n = 6,x± s |
|
|
Table 3 Pharmacokinetic parameters of SN,SN-NCS and SN-SSPE (SN,50 mg·kg-1) after a single administration in rats. n = 6,x± s. P < 0.05,**P < 0.01 vs SN group; △P < 0.05,△△P < 0.01 vs SN-NCS group |
SN-SSPE的AUC相对于SN-NCS和SN原料药均具有极显著差异 (P < 0.01),分别提高了1.4倍和3.8倍; SN-SSPE的血药峰浓度 (Cmax) 相对于SN-NCS和SN原料药也具有极显著差异 (P < 0.01),分别提高了2.5倍和2.3倍; 另外,SN-SSPE在大鼠体内的平均滞留时间 (MRT) 延长为原料药的2倍。可见,SN-SSPE的口服生物利用度相对于SN-NCS和原料药有显著提高。
SN-SSPE提高SN口服生物利用度的机制与该制剂的结构和辅料有关。由于SN-SSPE中药物大部分以纳米晶形式存在,药物晶体的粒径减小,比表面积增加,溶解速率变快,有利于药物吸收。同时SN-SSPE乳滴内部为油相,具有部分脂质制剂特性,而脂质制剂在肠道消化过程中脂解产物与内源性胆盐、卵磷脂等相互作用产生一系列胶体分散态,包括胶束、混合胶束、囊泡和乳滴等,从而提高对药物的溶解能力,增加药物吸收,提高药物的生物利用度[19]。可见,SN- SSPE结合了纳米晶和脂质制剂的优点,从减小药物粒径、提高药物溶解速率和增加药物溶解度等多种途径增加药物吸收,提高口服生物利用度。
结论本文基于Pickering乳液,以难溶性药物水飞蓟宾自身纳米晶为稳定剂,不使用表面活性剂,采用高压匀质法成功设计制备了水飞蓟宾纳米晶自稳定Pickering乳液。药物纳米晶于油滴表面形成刚性外壳结构,部分药物溶解在内部油滴内。在不加表面活性剂及其他稳定剂的条件下,SN-SSPE的稳定性比SN-NCS高,至少可稳定40天以上。SN-SSPE的体外释放速率与SN-NCS相似,比SN原料药显著加快。大鼠灌胃给药的药动学研究结果表明,与SN-NCS和SN原料药相比,SN-SSPE的血药峰浓度和AUC都有显著提高。
作为一种新剂型,药物纳米晶自稳定Pickering乳液同时结合了Pickering乳液和纳米晶两种剂型的优点。相对于Pickering乳液,该制剂没有加入异种固体颗粒,保持了Pickering乳液的优点; 相对于纳米晶,没有加入普通纳米晶所需的表面活性剂或其他稳定剂等辅料,保持了纳米晶的优点,是一种潜在的难溶性药物口服给药新系统。
对于药物纳米晶自稳定Pickering乳液,有关药物纳米晶吸附于油滴表面的分子机制,不同药物及其纳米晶对制备和长期稳定性的影响,该制剂在胃肠道中的脂解和药物释放行为以及药物纳米晶在该过程中与脂质之间的相互作用等方面还有待深入研究。
| [1] | Lam S, Velikov KP, Velev OD. Pickering stabilization of foams and emulsions with particles of biological origin[J]. Curr Opin Colloid Interface Sci, 2014, 19:490-500. |
| [2] | Wahlgren M, Engblom J, Sjoo M, et al. The use of microand nanoparticles in the stabilisation of Pickering-type emulsions for topical delivery[J]. Curr Pharm Biotechnol, 2013, 14:1222-1234. |
| [3] | Laredj-Bourezg F, Chevalier Y, Bolzinger MA. Skin delivery of hydrophobic drugs using biocompatible and biodegradable carriers:Pickering emulsions and block copolymer nanoparticles. Correlation to drug localization within the skin layers as determined by confocal fluorescence microscopy[J]. Exp Dermatol, 2012, 21:E2. |
| [4] | Lin WS, Huang YW, Zhou XD, et al. In vitro toxicity of silica nanoparticles in human lung cancer cells[J]. Toxicol Appl Pharmacol, 2006, 217:252-259. |
| [5] | Li LL, Li TL, Fu CH, et al. Biodistribution, excretion, and toxicity of mesoporous silica nanoparticles after oral administration depend on their shape[J]. Nanomedicine, 2015, 11:1915-1924. |
| [6] | Wang HJ, Jiang YY, Lu P, et al. An updated review at molecular pharmacological level for the mechanism of antitumor, antioxidant and immunoregulatory action of silibinin[J]. Acta Pharm Sin (药学学报), 2010, 45:413-421. |
| [7] | Wei YH, Ye XL, Shang XG, et al. Enhanced oral bioavailability of silybin by a supersaturatable self-emulsifying drug delivery system (S-SEDDS)[J]. Colloids Surf A, 2012, 396:22-28. |
| [8] | Elmowafy M, Viitala T, Ibrahim HM, et al. Silymarin loaded liposomes for hepatic targeting:in vitro evaluation and HepG2 drug uptake[J]. Eur J Pharm Sci, 2013, 50:161-171. |
| [9] | Federico A, Dallio M, Di Fabio G, et al. Silybin-phosphatidylcholine complex protects human gastric and liver cells from oxidative stress[J]. In Vivo, 2015, 29:569-575. |
| [10] | Möschwitzer JP. Drug nanocrystals in the commercial pharmaceutical development process[J]. Int J Pharm, 2013, 453:142-156. |
| [11] | Cerdeira AM, Mazzotti M, Gander B. Miconazole nanosus-pensions:influence of formulation variables on particle size reduction and physical stability[J]. Int J Pharm, 2010, 396:210-218. |
| [12] | Frelichowska J, Bolzinger MA, Chevalier Y. Effects of solid particle content on properties of o/w Pickering emulsions[J]. J Colloid Interface Sci, 2010, 351:348-356. |
| [13] | Juárez JA, Whitby CP. Oil-in-water Pickering emulsion destabilisation at low particle concentrations[J]. J Colloid Interface Sci, 2012, 368:319-325. |
| [14] | Chevalier Y, Bolzinger MA. Emulsions stabilized with solid nanoparticles:Pickering emulsions[J]. Colloids Surf A, 2013, 439:23-34. |
| [15] | Li C, Sun PD, Yang C. Emulsion stabilized by starch nanocrystals[J]. Starch-Starke, 2012, 64:497-502. |
| [16] | Lee GJ, Son HA, Cho, JW, et al. Stabilization of Pickering emulsions by generating complex colloidal layers at liquidliquid interfaces[J]. J Colloid Interface Sci, 2014, 413:100-105. |
| [17] | Mathaudhu SN, Boyce BL. Thermal stability:the next frontier for nanocrystalline materials[J]. JOM, 2015, 67:2785-2787. |
| [18] | Bai TC, Zhu JJ, Hu J, et al. Solubility of silybin in aqueous hydrochloric acid solution[J]. Fluid Phase Equilib, 2007, 254:204-210. |
| [19] | Liu Y, Yi T, Huan D, et al. Use of an in vitro lipolysis model to evaluate type I lipid formulations[J]. Acta Pharm Sin (药学学报), 2010, 45:1307-1311. |
 2016, Vol. 51
2016, Vol. 51


