2. 天津医科大学 药学院, 天津市临床药物关键技术重点实验室, 天津 300070
2. Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics(Theranostics), School of Pharmacy, Tianjin Medical University, Tianjin 300070, China
乳腺癌是最常见的妇科恶性肿瘤。乳腺癌早期发现后治疗,治愈率可达90%以上[1]。目前乳腺癌主要临床诊断手段包括核磁共振、计算机断层扫描和钼靶射线,但这些方法的特异性和灵敏度欠缺,并且长期频繁操作可能产生辐射损伤[2, 3]。光学分子影像学作为一种新兴生物医学影像技术,发展迅速,具有无辐射、无创、成本低、检测方便和实时监控等特点[4]。
吲哚花青绿 (indocyanine green,ICG) 是目前唯一被美国食品药品监督管理局(FDA) 批准的临床用近红外荧光造影剂,吸收波长为800 nm,发射波长为820 nm,且可作为感光剂,吸收光能,并将其转化成热能或产生单线态氧,杀伤肿瘤细胞[5]。ICG在水溶液中不稳定,在血液循环中易被快速清除,发生荧光自淬灭。这些缺陷严重限制了它在肿瘤诊断及治疗方面的应用[6]。ICG装载于纳米载体后,可增加稳定性,血液循环时间延长,并具有肿瘤靶向[7, 8, 9]。ICG纳米材料可用于药物示踪、肿瘤成像及光热治疗。脂质体作为一种经典的药物载体,已成功应用于临床使用和研究[10, 11, 12]。但脂质体在血液循环中容易发生突释,导致结构解体,引起荧光泄露[13]。因此,本文通过人血清白蛋白 (HSA) 对脂质体进行包裹,以提高脂质体结构的稳定性,并考察其在肿瘤成像、靶向运输和光热作用等方面的性能。
材料与方法 试剂胆固醇 (95%)、HSA、尿素 (96%) (美国Sigma-Aldrich有限公司); 磷脂酰乙醇胺 (PE,95%,上海一基实业有限公司); ICG (90%)、戊二醛 (95%) (百灵威科技有限公司); 胎牛血清 (fetal bovine albumin,FBS,美国Hyclone有限公司); Cy5.5 NHS ester染料(美国GE Healthcare有限公司); CCK-8 (日本Dojindo laboratories); Dulbecco’s modified eagle medium (DMEM) 培养基、青链霉素、胰蛋白酶、LysoTracker Green染料、Hoechst 33342染料 (美国Life科技有限公司); 磷酸盐缓冲液 (phosphate buffered saline,PBS,97%,pH 7.4,美国NeoCell生物科技有限公司); 碘化吡啶染料 (propidiumiodide,PI,556547,美国BD生物科技有限公司); TritonX-100 (T8200)、透析袋 (8 kDa,100 kDa) (北京索来宝有限公司); 盐酸、三氯甲烷 (分析纯,天津市化学试剂一厂)。
仪器脂质体挤压器 (610000,美国Avanti Polar Lipids公司); 激光粒度分析仪 (ZetasizerNano ZS90,英国马尔文公司); 激光共聚焦显微镜 (FV1000)、倒置荧光显微镜 (BX51) (日本Olympus公司); 透射电子显微镜 (HT-7700,日本Hitachi公司); 小动物活体成像仪 (IVIS Spectrum,美国PerkinElmer公司); 荧光分光光度计 (RF-5301,日本岛津公司); 紫外-可见分光光度计 (TU-1810,北京普析通用仪器有限公司); 近红外激光发射器 (南开大学化工学院)。非接触式红外线温度计 (BLTH-2,浙江百灵医疗器械有限公司)。
LipoICG的制备与包封率测定精密称取ICG 0.3 mg、PE 20.0 mg和胆固醇5.0 mg共溶于10.0 mL三氯甲烷,将混合液于50 ℃水浴加热条件下,减压旋转蒸发除去溶剂。再将得到的脂质薄膜用4.0 mL超纯水水化,通过脂质体挤压器将水化物挤压10次,得到脂质体LipoICG。在0.1 mL LipoICG中加入1% TritonX-100破乳,用超纯水定容至3.0 mL,用紫外分光光度计 (λmax = 800 nm) 测定LipoICG中ICG含量 (W0)。另取1.0 mL LipoICG于透析袋中 (8 kDa),以超纯水为透析介质,除去游离ICG。取0.1 mL纯化的LipoICG ,加入1% TritonX-100破乳,同法测定ICG含量(W1)。按公式1计算脂质体的包封率 (EE)。
| EE (%) = W1 / W0 × 100% | (1) |
用超纯水 配制2×10-4 mol·L-1 HSA溶液2 mL,用盐酸调节 pH 3.0。再加入纯化的LipoICG 2 mL,搅拌10 min后加入终浓度为2.5×10-6 mol·L-1戊二醛,反应过 夜使HSA交联固化,得到H-LipoICG。在0.1 mL H-LipoICG中加入6 mol·L-1尿素使HSA裂解,再加入1% Triton X-100破乳,用超纯水定容至3.0 mL,采用紫外分光光度计 (λmax 800 nm) 测定H-LipoICG中ICG的含量 (W0)。另取1 mL H-LipoICG于透析 袋中 (100 kDa),在超纯水中透析除去游离HSA和ICG。取纯化的H-LipoICG 0.1 mL,同法测定ICG含量(W1)。按公式1计算脂质体的包封率。
Cy5.5 NHS ester的修饰分别在1.0 mL纯化的LipoICG和H-LipoICG中加入5.0 mg·mL-1 Cy5.5 NHS ester溶液10 μL,于室温避光搅拌12 h,使Cy5.5 NHS ester通过活性酯与纳米材料表面的活性氨基共价连接,制备出Cy5.5标记的LipoICG和H-LipoICG ,在透析袋中 (8 kDa) 以PBS为透析介质除去游离Cy5.5 NHS ester。
材料的形貌大小用超纯水将LipoICG和H-LipoICG稀释至1 mg·mL-1,置于样品池中,用激光粒度分析仪测定其水动力学直径与zeta电位。再将材料滴于铜网上,加入2% 醋酸铀染色,用超纯水洗去游离醋酸铀。待铜网充分干燥后,用透射电子显微镜观察材料的形貌和大小。
材料的释药速率分别取2.0 mL纯化的LipoICG和H-LipoICG于透析袋中 (100 kDa),加入含10% FBS的PBS缓冲液48.0 mL,于37 ℃摇床中避光震荡,在不同时间点取出透析介质3.0 mL,用紫外分光光度计测定介质中ICG含量 (W2)。另取0.1 mL纯化的LipoICG和H-LipoICG ,按前述方法裂解材料,再用含10% FBS的PBS缓冲液定容至3.0 mL,用紫外分光光度计测定材料中的ICG质量 (W3)。按公式2计算脂质体的释药速率。
| 释药速率 (%) = W2 / W3 × 100% | (2) |
分别配制ICG浓度为3×10-6 mol·L-1的游离ICG、LipoICG和H-LipoICG溶液各3.0 mL,用荧光分光光度计测定其荧光发射峰 (Ex = 800 nm,Em = 801~900 nm)。用紫外分光光度计扫描紫外吸收峰 (λ= 700~90 0 nm)。
细胞摄取实验将人乳腺癌细胞系MCF-7细胞于37 ℃、含5% 二氧化碳的细胞培养箱中,用DMEM培养基 (含10% FBS和1% 青链霉素) 培养。取对数生长期的MCF-7细胞,用胰蛋白酶消化成单细胞悬液,以每孔8×103个细胞于12孔板(含盖玻片) 中培养使细胞贴壁。将Cy5.5标记的LipoICG和H-LipoICG (含8×10-6 mol·L-1 ICG) 与细胞共培养0.5、2和6 h,用PBS将细胞洗3次,再加入含Hoechst 33342和LysoTracker Green的培养基,与细胞共孵育10 min,分别将细胞核与溶酶体染色,最后用PBS洗3次。通过激光共聚焦显微镜观察细胞摄取材料的情况。
细胞毒性取处于对数生长期的MCF-7细胞用胰蛋白酶消化制成单细胞悬液,以每孔1×104个细胞铺于96孔板中,培养过夜使细胞贴壁。分别将游离ICG溶液、LipoICG、H-LipoICG与细胞共培养24 h。加入CCK-8与细胞共孵育3 h,通过酶标仪测定空白组 (A0)、PBS组(A1) 和材料组 (A2) 的紫外吸收度 (λmax = 450 nm),通过公式3计算细胞活力。
| 细胞活力 (%) = (A2 - A0) / (A1 - A0) × 100% | (3) |
BALB/c裸鼠购于军事医学科学院实验动物中心,雌性,4~5周龄,体重22~24 g,合格证号为2012-0004。动物于SPF级环境饲养,实验研究符合机构责任委员会的伦理 (道德) 标准。取对数生长期的MCF-7细胞制成细胞数为1×107个/mL的单细胞悬液,取0.2 mL从皮下种植于小鼠下肢腋窝脂肪垫内,饲养两周使移植瘤模型建成。分别取游离ICG溶液、LipoICG和H-LipoICG (ICG浓度均为8×10-5 mol·L-1) 各0.2 mL,通过尾静脉注射入荷瘤裸鼠体内,于注射后1、8和24 h通过小动物活体成像仪观察材料在裸鼠体内的分布。
材料的光热作用分别取PBS、游离ICG溶 液、LipoICG和H-LipoICG各1 mL置于12孔板中,用近红外激光发射器 (1.6 W·cm-2) 于800 nm照射材料10 min,用非接触式红外线温度计测定材料的温度。另取对数生长期的MCF-7细胞,用胰蛋白酶消化成单细胞悬液,以每孔1×105个细胞于12孔板(含盖玻片) 中培养过夜使细胞贴壁。加入LipoICG和H-LipoICG与细胞共培养6 h,用近红外激光发射器 (1.6 W·cm-2) 于800 nm照射10 min。再加入PI染料和Hoechst 33342与细胞共孵育10 min,将细胞核染色。通过倒置荧光显微镜观察细胞核的颜色。
统计学方法实验重复n次,用SPSS软件计算平均值、相对标准偏差并进行单因素方差分析。
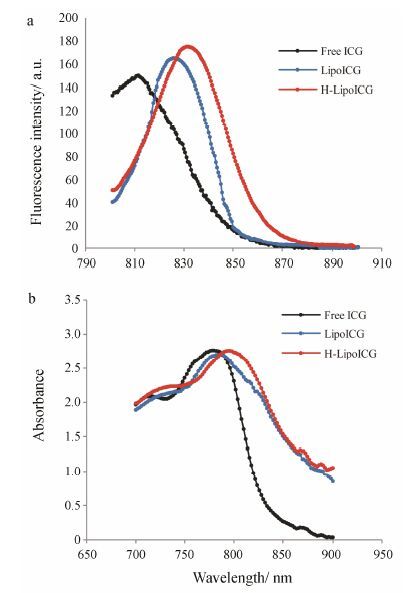
结果 1 H-LipoICG的表征本实验制备的LipoICG的大小为94.47 ± 0.13 nm,zeta电位为 -43.5 ± 2.5 mV,包封率为 (81.5 ± 0.9) %; H-LipoICG的大小为121.5 ± 0.85 nm,zeta电位为 -32.3 ± 2.2 mV,包封率为 (98.2 ± 0.5) %。材料的透射电子显微镜照片 (图 1) 显示LipoICG和H-LipoICG均呈大小均匀、形貌规则的球形。LipoICG和H-LipoICG的荧光图谱与游离ICG相比,最大发射波长均发生红移,荧光强度增加,且H-LipoICG的红移和荧光 增强更明显,具有更优良的荧光成像性质 (图 2a); LipoICG和H-LipoICG的紫外吸收峰与游离ICG相比,最大吸收波长呈明显红移,说明ICG成功被携载于脂质体中 (图 2b)。

|
Figure 1 Transmission electron microscope images of LipoICG (a) and H-LipoICG (b). Both of them were spherical shape with uniform size distribution. LipoICG: Liposomal indocyanine green; H-LipoICG: Human serum albumin coated indocyanine green |
|
Figure 2 Fluorescence spectra (a) and UV-Vis spectra (b) of free indocyanine green (ICG),LipoICG and H-LipoICG. Both LipoICG and H-LipoICG had enhanced fluorescence intensity as well as higher absorbance intensity than free ICG |
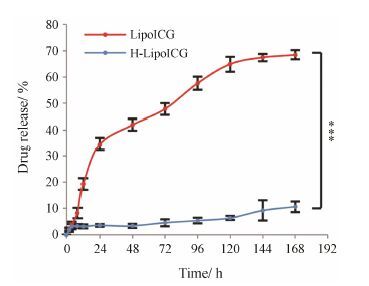
由于脂质体在血液循环中不稳定,容易发生药物的突释。为了研究HSA的包裹对LipoICG的稳定作用,以含10% FBS的PBS缓冲液来模拟血液,研究了LipoICG和H-LipoICG的释药曲线 (图 3)。与LipoICG相比,H-LipoICG能有效防止ICG泄露,透析7天后ICG的泄露量低于10%。而没有HSA保护的LipoICG在透析24 h内发生突释,释放量高于30%。因此,HSA的包裹增强了脂质体结构的稳定性,减少了ICG泄露。
|
Figure 3 ICG release of LipoICG and H-LipoICG over time in phosphate buffer saline with 10% fetal bovine serum. The release of ICG from H-LipoICG was much slower than that from LipoICG. n = 3,x± s. ***P < 0.0001 |
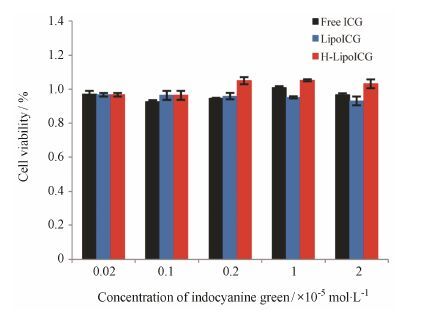
为了研究材料对MCF-7细胞的毒性,通过CCK-8实验考察了游离ICG、LipoICG和H-LipoICG对MCF-7细胞增殖能力的影响 (图 4)。与FDA批准的无毒材料ICG相比,LipoICG和H-LipoICG对细胞的增殖无影响,说明材料具有良好的生物相容性,为后续的细胞实验和动物实验奠定了良好的基础。
|
Figure 4 Quantitative evaluation of cell survival treated with free ICG,LipoICG and H-LipoICG. None of them could influence the proliferation of MCF-7 cells. n = 3,x± s |
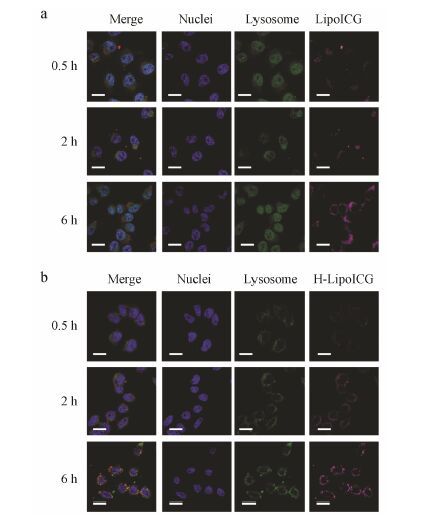
为了研究材料在肿瘤细胞中的入胞能力,通过共聚焦显微镜观察了MCF-7细胞对LipoICG (图 5a) 和H-LipoICG (图 5b) 的摄取情况。由图可见,LipoICG和H-LipoICG与细胞共孵育0.5 h即可被细胞摄取并分布于溶酶体中,随着孵育时间的延长,材料进入细胞的量迅速增加,说明LipoICG和H-LipoICG具有良好的入胞能力。
|
Figure 5 In vitro subcellular localizations of LipoICG (a) and H-LipoICG (b) in MCF-7 cells (bar = 20 μm). The fluorescence of materials could be found and overlapped with the fluorescence of lysosomes,as seen by the orange areas in the merged images |
ICG在近红外激光的激发下,可以将光能转化成热能,产生热量。如图 6所示,PBS在近红外激光的连续照射下,溶液温度不发生变化,说明近红外激光本身不具备产热的能力。而H-LipoICG溶液在激光照射下,溶液温度在2 min内迅速上升至43 ℃,此温度超过了肿瘤细胞的耐热极限,具有杀伤肿瘤细胞的能力[14]。溶液温度在8 min内持续升温至49.8 ℃,随着光照时间的延长,ICG的消耗量增加,溶液温度在8 min后逐渐下降。LipoICG的升温速度较H-LipoICG慢,溶液温度在4 min时上升至43 ℃,最高温度为46.5 ℃,其光热作用弱于H-LipoICG。游离ICG溶液的温度随着光热时间的延长逐渐升高,但是无法上升至43 ℃,无法杀伤肿瘤细胞,不能实现肿瘤的光热治疗。
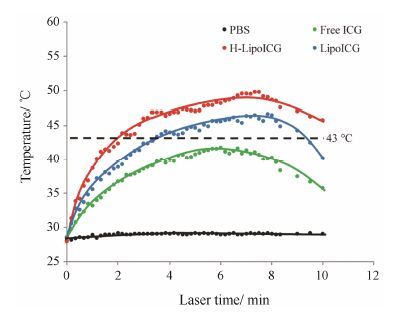
|
Figure 6 Temperature rise profiles of phosphate buffer saline (PBS),free ICG,LipoICG and H-LipoICG under laser irradiation. The maximum temperature of LipoICG and H-LipoICG were higher than 43 ℃,while PBS and free ICG were lower than 43 ℃ |
为了进一步研究材料对肿瘤细胞的光热作用,将PBS、LipoICG和H-LipoICG与MCF-7细胞共孵育6 h后辅以激光照射10 min后,加入PI和Hoechst 33342对细胞核染色,用倒置荧光显微镜观察细胞的凋亡情况。由于凋亡晚期细胞或死亡细胞的细胞膜结构破损,PI染料能够通过破损的细胞膜进入细胞,将细胞核染成红色,而活细胞可阻止PI染料的入胞,细胞核不会被PI染色[15]。由图 7可见,PBS与细胞共孵育后,给予激光照射,细胞活力不受影响,细胞核为蓝色,说明激光照射对细胞无杀伤作用。LipoICG或H-LipoICG与细胞共孵育后,不给予激光照射,细胞活力不受影响,细胞核也为蓝色,说明材料对细胞无毒,具有良好的生物相容性。然而,LipoICG或H- LipoICG与细胞共孵育后联合光热治疗,细胞全部死亡,细胞核被染成红色。因此,LipoICG或H-LipoICG联合光热治疗对肿瘤细胞具有显著的杀伤作用。
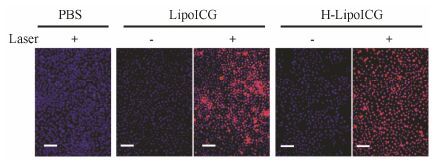
|
Figure 7 Fluorescence images of MCF-7 cells after photothermal treatment (bar = 100 μm). Viable cells were stained blue by Hoechst 33342,dead/later apoptosis cells were stained red by propidium iodide |
为了研究材料的体内靶向作用,通过尾静脉注射材料,利用小动物活体成像仪观察了H-LipoICG、LipoICG和游离ICG在MCF-7荷瘤裸鼠体内的组 织分布。图 8a说明H-LipoICG的荧光信号在注射后1 h广泛分布于全身,随着血液循环时间的延长,于注射后8 h通过肿瘤的高渗透性和滞留效应 (enhanced permeability effect,EPR) 和HSA的主动靶向作用[16]富集于肿瘤部位,24 h后观察各脏器和肿瘤组织的荧光分布,进一步证明H-LipoICG主要富集于肿瘤,具有较好的肿瘤靶向性和较高的荧光强度。由图 8b可见,LipoICG的荧光信号在注射后1 h主要分布于肝脏,注射后8 h主要分布于肠道,24 h后观察各脏器和肿瘤组织的荧光分布,信号主要富集在肝脏,少量分布于肿瘤,说明LipoICG的结构在体内不稳定,容易发生突释。由于游离ICG在血液中迅速与血浆蛋白结合,由肝实质细胞摄取后以分子原型排泄至胆管,最后随粪便排出体外[17],因此从LipoICG中泄露的ICG容易被肝脏摄取,无法实现较好的肿瘤靶向成像性。由图 8c可知,游离ICG在注射后1 h主要分布在肝脏,而注射后8 h无明显荧光信号,24 h后在各脏器和肿瘤组织中也无法检测其荧光信号,说明游离ICG在血液中容易被肝细胞摄取并迅速排出体外,血液半衰期很短。因此,脂质体的包裹能延长ICG在血液中的循环时间,维持荧光信号的强度,而HSA的包裹能提高脂质体的稳定性,增强肿瘤靶向作用。H-LipoICG不仅可以作为荧光探针实现肿瘤的成像和诊断,还能作为光热药物实现对肿瘤细胞的杀伤,为进一步探索该材料的抗肿瘤活性提供了实验基础。
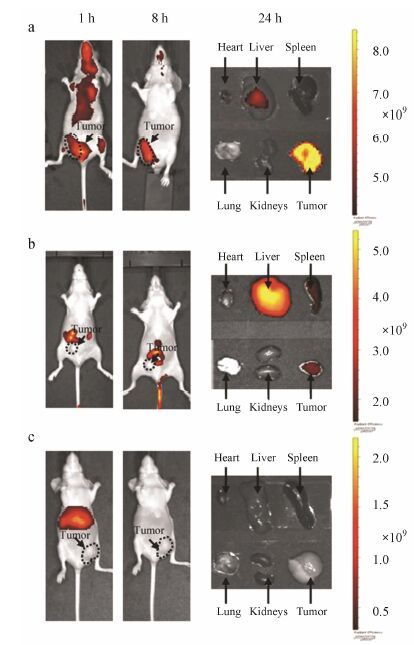
|
Figure 8 In vivo imaging and biodistribution of H-LipoICG (a),LipoICG (b) and free ICG (c) in nude mice. The signal of H-LipoICG in tumor site increased with time,while the signals of free ICG and LipoICG were failed to accumulate in tumor |
脂质体作为药物载体已经得到了非常广泛的研究,它可以将水溶性药物包裹于水相内腔中,也可以将脂溶性药物包裹于疏水性磷脂双分子层之间[18]。ICG兼具有亲水性和亲脂性,但是它在水中容易形成二聚体继而发生荧光淬灭[19]。由于ICG中疏水的吲哚基团与脂质体膜表面的PE相互作用,使得ICG的吲哚基团自组装插入脂质体的磷脂双分子层上,ICG充分裸露在脂质体的表面[20]。结果表明,与游离ICG相比,脂质体的包裹使ICG的紫外吸收峰红移,荧光发射峰发生红移,荧光强度也得到明显的提高。与此同时,由于ICG的亲脂端嵌入磷脂层中,亲水端暴露于脂质体表面,其亲水端的两个磺酸基能屏蔽PE的正电荷,改变了脂质体的表面电势,使LipoICG带负电,提高了它的生物相容性。
由于脂质体结构不稳定,进入血液循环中容易发生突释,导致携载的药物迅速发生泄露[21]。为了提高脂质体的稳定性,本研究利用HSA对脂质体进行包裹和固化。HSA的等电点为5.3[22],通过调节溶液pH至3.0使HSA带正电,充分利用正负电荷相互作用,将带负电的脂质体表面完整包裹一层带正电的HSA壳,再利用戊二醛对HSA进行交联固化。HSA的包裹提高了外壳的稳定性,保护了脂质体不受介质的影响,避免它在血液中发生突释。结果表明,与LipoICG相比,通过HSA的包裹,H-LipoICG在含10% FBS的PBS介质中的稳定性明显提高,极大地保护了携载的ICG不发生泄露,维持材料的荧光强度,为肿瘤成像提供了良好的荧光信号基础。
良好的生物安全性是评价材料能否最终应用于机体的基本条件。为了能够在细胞实验和动物实验中继续研究材料的性质,通过CCK-8实验验证了材料的生物安全性,结果说明,材料对细胞无毒,不影响细胞的增殖。传统的肿瘤成像试剂如钼靶射线等[23]会对人体产生放射性危害。而本实验采用的ICG、HSA和脂质体膜材都是经FDA批准可用于临床的药用材料,以此为原料制备的纳米荧光探针具有更好的生物安全性。
ICG不仅具有近红外荧光成像作用,而且能够吸收光能,再将其转换成热能并释放热量。实验结果显示,H-LipoICG溶液在近红外激光的照射下,溶液温度迅速上升,并能够在2 min内升至43 ℃,随着光照时间的延长,溶液温度持续上升,表现出非常明显的光热效应。与LipoICG相比,H-LipoICG的光热作用更明显,温度更高、上升速度更快。这是由于HSA的包裹使脂质体的结构十分稳定,ICG不易从脂质体中泄露,使每个脂质体中的ICG能够维持在较高浓度,通过近红外激光的照射,局部高浓度的ICG释放的热量更集中,减少了热量向空气的传导,从而使温度上升的更高更快。因此,H-LipoICG联合光热治疗具有良好的杀伤肿瘤细胞的作用。
荧光纳米探针的靶向性是评价其功能优劣的重要指标,良好的靶向性不仅可以削弱背景荧光的干扰,而且有利于将共载的药物浓集至肿瘤细胞使之充分发挥作用。当前研究表明小于200 nm的颗粒具有良好的EPR效应,能通过被动靶向作用将纳米材料富集于肿瘤[24]。通过本实验方法制备的H-LipoICG粒径为121.5 nm,结果说明H-LipoICG在荷瘤小鼠体内的循环时间长,能够特异性富集于肿瘤组织并准确勾勒出肿瘤的轮廓,其荧光强度高而且信号维持时间达24 h。
综上所述,H-LipoICG作为肿瘤成像的荧光探针,具有安全无毒、性质稳定、荧光信号强、肿瘤特异性靶向和背景干扰小等优点。同时H-LipoICG作为肿瘤治疗的光热治疗药物,具有光热作用显著、毒副作用小和成本低等特点。此研究结果对临床上肿瘤的诊疗一体化提供了新的实验依据和解决方案。
| [1] | Donepudi MS, Kondapalli K, Amos SJ, et al. Breast cancer statistics and markers[J]. J Cancer Res Ther, 2014, 10:506-511. |
| [2] | Caldorera-Moore ME, Liechty WB, Peppas NA. Responsive theranostic systems:integration of diagnostic imaging agents and responsive controlled release drug delivery carriers[J]. Accounts Chem Res, 2011, 44:1061-1070. |
| [3] | Lee DE, Koo H, Sun IC, et al. Multifunctional nanoparticles for multimodal imaging and theragnosis[J]. Chem Soc Rev, 2012, 441:2656-2672. |
| [4] | Kobayashi H, Choyke PL. Target-cancer-cell-specific activatable fluorescence imaging probes:rational design and in vivo applications[J]. Acc Chem Res, 2011, 44:83-90. |
| [5] | Sheng ZH, Hu DH, Xue MM, et al. Indocyanine green nanoparticles for theranostic applications[J]. Nano-Micro Lett, 2013, 5:145-150. |
| [6] | Yaseen MA, Yu J, Jung BS, et al. Biodistribution of encapsulated indocyanine green in healthy mice[J]. Mol Pharm, 2009, 6:1321-1332. |
| [7] | Kuo WS, Chang YT, Cho KC, et al. Gold nanomaterials conjugated with indocyanine green for dual-modality photodynamic and photothermal therapy[J]. Biomaterials, 2012, 33:3270-3278. |
| [8] | Kirchherr AK, Briel A, Mäder K. Stabilization of indocyanine green by encapsulation within micellar systems[J]. Mol Pharm, 2009, 6:480-491. |
| [9] | Ogawa M, Kosaka N, Choyke PL, et al. In vivo molecular imaging of cancer with a quenching near-infrared fluorescent probe using conjugates of monoclonal antibodies and indocyanine green[J]. Cancer Res, 2009, 69:1268-1272. |
| [10] | Li X, Zhang J, Wang DK, et al. Anti-tumor activity of folate receptor targeting docetaxel-loaded membrane-modified liposomes[J]. Acta Pharm Sin (药学学报), 2013, 48:1142-1147. |
| [11] | Zhang L, Wang Y, Gao HL, et al. The construction of cellpenetrating peptide R8 and pH sensitive cleavable polyethylene glycols co-modified liposomes[J]. Acta Pharm Sin (药学学报), 2015, 50:760-766. |
| [12] | Wei MY, Zhou Q, Wu CB. In vitro targeting effect of lactoferrin modified PEGylated liposomes for hepatoma cells[J]. Acta Pharm Sin (药学学报), 2015, 50:1272-1279. |
| [13] | Weecharangsan W, Yu B, Zheng Y, et al. Efficient delivery of antisense oligodeoxyribonucleotide g3139 by human serum albumin-coated liposomes[J]. Mol Pharm, 2009, 6:1848-1855. |
| [14] | Zheng M, Yue C, Ma Y, et al. Single-step assembly of DOX/ICG loaded lipid-polymer nanoparticles for highly effective chemo-photothermal combination therapy[J]. ACS Nano, 2013, 7:2056-2067. |
| [15] | Zhao PF, Zheng MB, Yue CX, et al. Improving drug accumulation and photothermal efficacy in tumor depending on size of ICG loaded lipid-polymer nanoparticles[J]. Biomaterials, 2014, 35:6037-6046. |
| [16] | Elsadek B, Kratz F. Impact of albumin on drug delivery-new applications on the horizon[J]. J Control Release, 2012, 157:4-28. |
| [17] | Saxena V, Sadoqi M, Shao J. Polymeric nanoparticulate delivery system for indocyanine green:biodistribution in healthy mice[J]. Int J Pharm, 2006, 308:200-204. |
| [18] | Gregoriadis G, Florence AT. Liposomes in drug delivery[J]. Drugs, 1993, 45:15-28. |
| [19] | Saxena V, Sadoqi M, Shao J. Enhanced photo-stability, thermalstability and aqueous-stability of indocyanine green in polymeric nanoparticulate systems[J]. J Photoche Photobio B, 2004, 74:29-38. |
| [20] | Kraft JC, Ho RJY. Interactions of indocyanine green and lipid in enhancing near-infrared fluorescence properties:the basis for near-infrared imaging in vivo[J]. Biochemistry, 2014, 53:1275-1283. |
| [21] | Van Rooijen N, Sanders A. Liposome mediated depletion of macrophages:mechanism of action, preparation of liposomes and applications[J]. J Immunol Methods, 1994, 174:83-93. |
| [22] | Langer K, Balthasar S, Vogel V. Optimization of the preparation process for human serum albumin nanoparticles[J]. Int J Pharm, 2003, 257:169-180. |
| [23] | Simmons JA. Risk of cancer from diagnostic X-rays:estimates for the UK and 14 other countries[J]. Lancet, 2004, 363:345-351. |
| [24] | Landesman-Milo D, Ramishetti S, Peer D. Nanomedicine as an emerging platform for metastatic lung cancer therapy[J]. Cancer Metastasis Rev, 2015, 34:291-301. |
 2016, Vol. 51
2016, Vol. 51


