2. 山西医科大学药学院, 山西 太原 030001;
3. 青海出入境检验检疫局, 青海 西宁 810000
2. School of Pharmaceutical Science, Shanxi Medical University, Taiyuan 030001, China;
3. Qinghai Entry-Exit Inspection and Quarantine Bureau, Xining 810000, China
黄芪注射液是临床常用药物,收载于中药部颁标准第17册 (WS3-B-3335-98),由黄芪药材经水提醇沉法制备而成,具有益气养元、扶正祛邪、养心通脉、健脾利湿等功效,可用于心气虚损、血脉瘀阻之病毒性心肌炎、心功能不全及脾虚湿困之肝炎等症[1]。黄芪注射液的化学成分研究主要集中于次级代谢产物,已报道的成分主要是黄酮类和皂苷类[2]。另有研究[3]采用纸层析及氨基酸自动分析仪分析了黄芪注射液中氨基酸类成分。
黄芪注射液生产厂家众多,由于原料来源、工艺的不同,不同厂家产品之间化学组成存在一定差异,这种差异的客观存在有一定隐患。阐明不同厂家黄芪注射液产品的化学差异状况,可为质量控制以及标准提高奠定依据,从而保证临床用药的安全有效。现行黄芪注射液质量标准以及质量评价研究主要采用基于黄芪甲苷的含量测定方法[4, 5, 6]。指纹图谱是中药注射剂质量控制的有效手段,已有研究建立了黄芪注射液的HPLC指纹图谱[7],不同的色谱峰反映了其所含次级代谢产物的化学信息,但由于缺乏相关色谱峰的化学指认,难以分析不同厂家产品的成分差异。除了次级代谢物外,黄芪注射液中还含有大量的初级代谢产物 (氨基酸、有机酸、糖类等),其含量远高于次级代谢产物。虽然没有文献证明这些成分具有直接的药理作用,但这些成分对于黄芪注射液的质量均一性可能有重要影响,此外,这些初级代谢产物由于极性大、缺少紫外发色团的特点,导致其在色谱柱上保留较差,紫外检测器难以检测。所以,这些成分往往是传统质量评价所忽视的成分。中药注射液质量控制要求远远高于其他中药制剂,因此需要建立一种能从整体上全面地表征黄芪注射液化学组成的指纹图谱并用于质量分析。
近年来随着仪器场强的不断升高,1H NMR技术在灵敏度、精确度、分析速度等方面有了很大提高[8],在药物分析领域也获得越来越多的应用。1H NMR理论上可以给出药材中所有含氢有机化合物的信号,且1H NMR的谱峰与样品中各化合物的氢原子一一对应,所测样品中的每一个氢原子在图谱中都有其相关的谱峰,图谱中信号的相对强弱反映样品中各组分的相对含量。因此,1H NMR指纹适用于中药和中成药中复杂成分的分析及研究[9],已成功应用于黄芩、麦冬、柴胡、黄芪、白芍、当归等药材质量控制与评价[10, 11, 12, 13, 14, 15]。本研究拟建立黄芪注射液的1H NMR指纹图谱,用于表征黄芪注射液中多种化学成分信息以反映其整体质量特征,并对市售黄芪注射液产品的质量状况进行初步分析,为提高其质量控制标准提供依据。
材料与方法 材料收集5个不同生产厂家8批黄芪注射液样品,分别记为: A1、A2、A3、B、C、D、E1、E2。参照部颁标准第17册 (WS3-B-3335-98)“黄芪注射液”项下的含量测定方法,检测不同厂家注射液中黄芪甲苷的含量均大于0.08 mg·mL-1,符合规定。对照品: 毛蕊异黄酮苷、紫檀烷苷、异黄烷苷、黄芪甲苷,均购于上海永恒生物科技有限公司,批号依次为20120428、20120528、20120515、20120315; 芒柄花苷购于成都曼斯特公司,批号: 13021808。
仪器与试剂Bruker 600-MHz AVANCE ⅡI NMR Spectrometer (600.13 MHz质子频率,德国布鲁克公司600兆核磁仪),Waters e2695高压泵、Waters 2689紫外可见检测器、Chromachem ELSD检测器,乙酸乙酯 (分析纯,北京化学试剂公司),乙腈 (色谱纯,美国Fisher公司)。NMR试剂: 重水 (Norell,Landisville公司,美国),氘代甲醇 (99.8%,Merck公司,德国),三甲基硅烷丙酸钠盐 (TSP,Cambridge Isotope Laboratories Inc.,MA)。
核磁分析样品的制备取黄芪注射液10 mL,直接蒸干,加氘代甲醇-重水 (含0.05% TSP) (1∶1) 溶解,转移至1.5 mL离心管中,13 000 r·min-1离心10 min,移取上清液600 μL于5 mm核磁管中,用于黄芪注射液初级代谢物的1H NMR和2D NMR分析; 另取黄芪注射液90 mL,加等体积的乙酸乙酯萃取2次,合并萃取液,蒸干,加氘代甲醇700 μL溶解,移取上清液600 μL于5 mm核磁管中,用于黄芪注射液次级代谢物1H NMR和2D NMR分析样品。
核磁测定条件1H NMR和2D NMR的测试均在25 ℃下于600 MHz NMR仪上测定。1H NMR测定频率为600.13 MHz,扫描次数64次,谱宽 = 12 345.7 Hz,延迟时间 (RD) = 1.0 s。黄芪注射液初级代谢产物采用noesygppr1d序列,以D2O进行锁场,脉冲宽度 (PW) = 90 ℃; 黄芪注射液次级代谢产物采用zg30序列,以CD3OD进行锁场。PW = 30 ℃。
2D NMR (1H-1H COSY和HSQC) 分别采用cosygpprqf和hsqcetgpsisp脉冲序列。1H-1H COSY的F2 (1H) 和F1 (1H) 维谱宽为6 602.1和6 601.5 Hz,RD = 2.0 s,扫描32次。HSQC的F2 (1H) 和F1 (13C) 维谱宽分别为6 602.1和36 220.3 Hz,RD = 1.5 s,扫 描32次。
高效液相色谱法测定条件以十八烷基硅烷键合硅胶为填充剂 (250 mm × 4.6 mm,5 μm),乙腈 (A) - 水(B) 为流动相,流速1.0 mL·min-1,ELSD检测器参数: N2压力为23 psi (1 psi ≈ 6.9 kPa),雾化温度为35 ℃,汽化温度为50 ℃,增益值为5.0,紫外检测波长230 nm,梯度洗脱: 0~8 min,20% A; 8~15 min,30% A; 15~30 min,43% A; 30~40 min,60% A; 40~60 min,100% A; 60~65 min,20% A。
数据分析 核磁图谱采用MestReNova (Version 8.0.1,Mestrelab Research,Santiago de Compostella,西班牙) 进行处理。图谱经过定标、相位和基线校正后,以δ 0.04积分段对化学位移区间进行分段积分。初级代谢物1H NMR中对化学区间δ 0.34~10.02进行分段积分,其中δ 4.80~5.06 (残余水峰) 不进行积分。次级代谢物1H NMR对化学区间δ 0.76~9.92进行分段积分,其中δ 3.30~3.34 (残余甲醇峰) 不进 行积分。将积分后的数据导入到Excel表中,用于后续分析。分别以TSP和氘代甲醇为内标,对初级和次级代谢物的相对含量进行分析。
变异系数计算: 由于各成分的含量数据不属于正态分布,所以采用四分位数间距 (QR = P75 - P25) 除以中位数 (M) 和极差 (R极差 = Xmax - Xmin) 除以M两种方法来计算变异系数 (变异系数1 = QR/M,变异系数2 = R极差/M),其数值的大小可以反映某一代谢物在不同厂家的含量变化范围。变异系数1表示的是中间50% 数据的变异程度,变异系数2表示两端数据的变异程度。
结果 1 黄芪注射液中主要化学成分的定性分析黄芪注射液为黄芪药材经水提醇沉制备得到,其化学成分非常复杂。本研究采用1H NMR测定建 立其化学指纹 (图 1),通过对1H NMR图谱中化学位移、偶合常数、峰型等分析,结合标准品、文献报道数据及BMRB (http://www.bmrb.wisc.edu/) 数据库中的标准物质对照的方式进行结构指认。
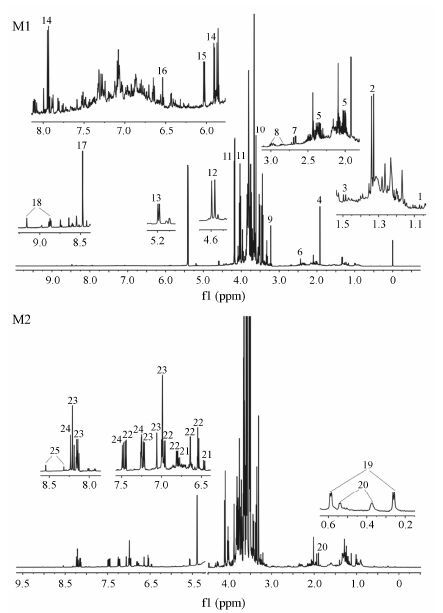
|
Figure 1 Fingerprints of Huangqi injection by 1H NMR. M1: Primary metabolites; M2: Secondary metabolites. Peaks 1-25 list in Table 1 |
黄芪注射液蒸干后直接进行核磁分析后得到的图谱中主要为初级代谢产物,其1H NMR图谱可以分为3个区间。在化学位移0~3.0之间主要为氨基酸和有机酸类,鉴定的化合物有缬氨酸、苏氨酸、丙氨酸、醋酸、脯氨酸、琥珀酸、苹果酸、天冬酰胺、胆碱、甘氨酸; 化学位移3.0~5.5之间主要为糖类化合物,鉴定化合物包括蔗糖、β-D-葡萄糖、α-D-葡萄糖; 化学位移5.5~9.5之间,鉴定的化合物有尿苷、腺苷、富马酸、甲酸、葫芦巴碱。由于黄芪注射液成分复杂,化合物间的谱峰重叠非常严重,本研究采用二维核磁共振技术对黄芪注射液中指认的上述化学成分进行验证,通过HSQC图谱中碳氢相关峰所给出的碳信号以及1H-1H COSY图谱中的氢氢相关峰所给出的偶合信息,可以确证黄芪注射液中上述化合物的存在 (表 1)。
黄芪注射液乙酸乙酯萃取物的1H NMR图谱中主要是次级代谢物,通过标准品对照,可以确定黄芪注射液中含有的次级代谢物主要有黄芪甲苷、黄芪皂苷Ⅲ、毛蕊异黄酮苷、芒柄花苷、紫檀烷苷、异黄烷苷。这些化合物的存在均得到了二维核磁图谱的验证。此外,在1H NMR还观察到δ 8.32 (s) 和8.54 (s) 两个单峰信号,结合文献[16]报道数据推测其可能为黄芪碱F中H-3和H-6的信号,由于图谱中多种化合物信号的重叠,黄芪碱F的其他信号未在氢谱中检测到。在HSQC图谱中,可以观察到黄芪碱F中除季碳之外的其他信号,如C3-H3 (δ 141.28、8.29)、C6-H6 (δ 143.5、8.45)、C1' -H1' (δ 125.6、6.69)、C2' -H2' (δ 138.0、6.90)、C3' -H3' (δ 71.8、4.19)、C2'' -H2'' (δ 71.3、3.76)、C3'' -H3'' (δ 75.0、3.35) 和C4'' -H4'' (δ 63.2、3.56)。此外,在1H-1H COSY图谱中显示H1'' -H2'' (δ 3.71、2.65)、 H2'' -H3'' (δ 3.34、3.72)、H3'' -H4'' (δ 3.42、3.59) 和H1' -H2' (δ 6.93、6.65) 的偶合相关的峰信号,因此可以确定黄芪注射液中含有黄芪碱F。
|
|
Table 1 1H NMR assignments of major metabolites in Huangqi injection. According to NMR databases such as HMDB and BMRB; DAccording to HQSC; #According to COSY. dHdM-Ifl: 1,2-Dihydroxy-3,4-dimethoxyisoflavan-7-O-β-D-glucoside; dM-Pte: 9,10- Dimethoxypterocarpan-3-O-β-D-glucoside; Cal: Calycosin-7-O-β-D-glucoside |
不同厂家黄芪注射液中黄芪甲苷含量均在0.08 mg·mL-1以上,按照部颁标准 (WS3-B-3335-98) 均为合格产品。但不同厂家的注射液样品颜色明显不同,因此本研究采用上述核磁共振指纹图谱对其化学差异进行深入分析。
2.1 相似度分析通过夹角余弦法分别计算初级代谢物和次级代谢物1H NMR指纹图谱的相似度 (图 2),可见不同厂家之间的产品在初级代谢物上相似度较低,其中A、D、E三个厂家的样本接近,而与B、C两个厂家的样本差异较大; 而对于次级代谢物,不同厂家样品之间的相似度较高,说明不同厂家样本的次级代谢物相似。

|
Figure 2 Similarity of Huangqi injection of different manufacturers. Green area represents primary metabolite; Yellow area represents secondary metabolite; A,B,C,D and E represent 5 batches of Huangqi injection from different manufacturers |
由不同厂家的1H NMR图谱直观比较显示,同一厂家不同批号的注射液差异较小,反映出同一厂家黄芪注射液生产工艺的相对稳定; 不同厂家的黄芪注射液初级代谢物差别较大,如厂家B、C的黄芪注射液产品中缬氨酸、苏氨酸、丙氨酸、脯氨酸等初级代谢物含量很低; 这种差异可能源于部分厂家在制备工艺中增加了大孔树脂纯化步骤而去掉了大量的初级代谢产物。此外,不同厂家黄芪注射液产品在次级代谢物上的差异相对较小,但仍有一定差异。为进一步分析不同厂家注射液的化学差异,对注射液中各成分进行相对含量比较。由分析结果可知,同一初级代谢物在不同厂家之间均有差异,如苏氨酸其最大值与最小值相差40倍,蔗糖的最大值与最小值相差80倍。次级代谢物的差异相对较小,如黄芪甲苷最大值与最小值为0.014 3和0.004 5,而黄芪碱F的最大值为0.030 4,最小值为0。
可见,同一成分的含量在不同厂家黄芪注射液中存在差异,每一个成分的波动变化范围亦明显不同。本文引入了变异系数来定量描述不同代谢物的含量波动范围。由表 2可见,不同代谢物的变异范围不同,苏氨酸的变异系数为6.775 5、29.795 6,腺苷的变异系数为4.840 0、7.136 6,次级代谢物中除了黄芪碱F外,变异系数相对均较小,黄芪注射液中初级代谢物比次级代谢物整体变异范围大,即初级代谢物对黄芪注射液的质量均一性影响较大。
|
|
Table 2 The variation coefficient of metabolites. dHdM-Ifl: 1,2- Dihydroxy-3,4-dimethoxyisoflavan-7-O-β-D-glucoside; dM-Pte: 9,10-dimethoxypterocarpan-3-O-b-D-glucoside; Cal: Calycosin- 7-O-b-D-glycoside; Variation coefficient 1 = QR/M; Variation coefficient 2 = Rrange/M,QR = P75 - P25,M: Median,Rrange = Xmax - Xmin |
采用高效液相色谱法对不同厂家黄芪注射液中黄酮类和皂苷类成分的含量进行测定 (表 3),并计算这些成分的变异系数 (表 4),与NMR计算的结果基本一致。
|
|
Table 3 The content (mg·mL-1) of secondary metabolites. A1,A2,A3,B,C,D,E1 and E2: Eight batches of Huangqi injection |
|
|
Table 4 The variation coefficient of secondary metabolites |
本研究采用核磁共振技术建立了黄芪注射液的1H NMR指纹图谱,通过核磁共振分析鉴定黄芪注射液化学成分25个,包括有机酸类、氨基酸类、生物碱类、糖类、黄酮类以及皂苷类等初级和次级代谢物。黄芪注射液化学成分复杂,本研究中指认的黄芪碱F、缬氨酸、醋酸、天冬酰胺、胆碱、蔗糖、尿苷和葫芦巴碱等化合物在黄芪注射液中尚未见文献报道。
中药注射液往往含有多种成分,其质量控制不应局限于与活性直接相关的次级代谢产物,而应该是基于整体物质组成的全面质量控制。与传统的色谱指纹图谱相比,本研究建立的1H NMR技术可以同时表征黄芪注射液中多种初级和次级代谢物,所反映的化学信息更全面。本研究中8批黄芪注射液均符合现行质量标准,但其外观颜色差异明显,这可能与所含有的化学成分不同有关,而这种化学差异除了与原料来源有关外,还反映了不同厂家在制备工艺上的差异。此外,黄芪注射液中初级代谢产物含量及波动范围远远高于次级代谢产物,是黄芪注射液的质量均一性的主要影响成分,为用药安全带来一定隐患。为了保证临床用药的安全,应对这些初级代谢产物在黄芪注射液中的作用进行深入研究并在质量标准中规定其含量波动范围。本研究对黄芪注射液中 的5种主要的次级代谢物的含量进行了测定,验证了NMR指纹图谱的可靠性,也为黄芪注射液的质量标准提升和二次开发奠定了研究基础。
| [1] | Chinese Pharmacopoeia Commission. Traditional Chinese Medicine Drugs Preparation:Vol 17(中药成方制剂:第十七册)[M]. Beijing:People Health Press, 1998:256. |
| [2] | Dou H, Fu TJ, Zhang F, et al. The chemical composition of Astragalus injection[J]. Nat Prod Res Dev (天然产物研究与开发), 2002, 14:14-17. |
| [3] | Chen MZ, Wang SH, Gan LY. Study of preparation and component analysis in Astragalus injection and Astragalus oral solution[J]. Chem World (化学世界), 1989, 30:391-393. |
| [4] | Lu J, Wang BQ. TLC-scanning determination of astragalloside Ⅳ[J]. Chin Tradit Pat Med (中成药), 1992, 14:34. |
| [5] | Bai XT, Huo BJ, Zhang B, et al. Rapid detection of astragalloside Ⅳ and total solids in Astragali Injection by NIRS[J]. Chin Tradit Herb Drugs (中草药), 2012, 43:2189-2193. |
| [6] | Wang C, Hou LB, Liu C. Determination of astragaloside Ⅳ in Huangqi injection by HPLC-ELSD[J]. J Chin Med Mater (中药材), 2006, 29:618-619. |
| [7] | Zhang L, Nie L, Wang WH. Correlation analysis between HPLC fingerprint of Radix Astragali injection and antioxidant activity[J]. J Chin Med Mater (中药材), 2009, 32:1757-1760. |
| [8] | Holzgrabe U, Water I, Diehl B. NMR Spectroscopy in Pharmaceutical Analysis[M]. Amsterdam:Elsevier, 2008. |
| [9] | Xu M, Lin DH, Liu CX. Current status and prospect of metabonomics[J]. Acta Pharm Sin (药学学报), 2005, 40:769-774. |
| [10] | Sun QL, Zhao HX, Lin YL, et al. Study of fingerprint of Scutellaria baicalensis Georgi by 1H NMR[J]. Chin J Magn Reson (波谱学杂志), 2007, 24:163-168. |
| [11] | Jiang HB, Jin H, Jiang JH, et al. Comparative study on 1H NMR fingerprints of root of ophiopogon japonicus cultivated in different areas[J]. Prog Mod Biomed (现代生物医学进展), 2012, 12:5665-5668. |
| [12] | Li ZY, Sun HM, Xing J, et al. Chemical and biological comparison of raw and vinegar-baked Radix Bupleuri[J]. J Ethnopharmacol, 2015, 165:20-28. |
| [13] | Li AP, Zhen YL, Sun HF, et al. Comparison of two different Astragali Radix by a 1H NMR-based metabolomic approach[J]. J Proteome Res, 2015, 14:2005-2016. |
| [14] | Li ZY, Fan ML, Qin XM. Comparison of chemical composition between raw and vinegar-baked Paeoniae Radix Alba using NMR based metabolomic approach[J]. Acta Pharm Sin (药学学报), 2015, 50:211-217. |
| [15] | Li ZY, Zhang ZZ, Du GH, et al. Comparative analysis of Danggui and European Danggui using nuclearmagnetic resonance-based metabolic fingerprinting[J]. J Pharm Biomed, 2015, 103:44-51. |
| [16] | Ma XF. Studies on the Chemical Constituents of Astragalus membranaceus Bge. Var. mongholicus (Bge.) Hsiao (蒙古黄芪的化学成分研究)[D]. Shenyang:Shenyang Pharmaceutical University, 2013. |
 2016, Vol. 51
2016, Vol. 51


