2. 大连医科大学, 辽宁 大连 116044;
3. 辽宁医学院附属第一医院, 辽宁 锦州 121000
2. Dalian Medical University, Dalian 116044, China;
3. The First Affiliated Hospital of Liaoning Medical University, Jinzhou 121000, China
金松双黄酮 (sciadopitysin,SP) 属双黄酮类化 合物,结构如图 1所示,主要分布于裸子植物中,如香附 (Rhizoma Cyperi)、银杏 (Ginkgo biloba)、柳杉 (Japan cedar)、罗汉松 (Podocarpus macrophyllus)、红豆杉 (Taxus chinensis) 等,是目前被国内外大量研究的银杏提取物及银杏制品中的活性成分[1]。银杏提取物是目前广泛应用的中草药制品和膳食补充剂,被广泛用于阿尔茨海默病、心血管疾病、脑缺血、记忆力减退等疾病的治疗[2]。
近年来,中草药作为辅助药物与西药联合应用日益增多,且逐渐成为一种用药习惯[3],特别是对于一些慢性疾病如糖尿病、高血压、心血管疾病等的治疗[4]。虽然中药和西药合用可提高疗效,但往往忽略了药物联用潜在的风险。国内外大量研究表明,银杏提取物及银杏制品与多种药物合用会产生不良反应,包括阿司匹林[5]、对乙酰氨基酚[6]、华法林等[7]。引发药物相互作用 (DDI) 的原因有很多,其中共服药物对药物代谢酶的抑制作用是导致DDI的重要原因[8, 9],因此药物代谢酶抑制介导的DDI应受到广泛重视。
尿苷二磷酸葡糖醛酸转移酶 (UGTs) 是一类重要的二相代谢酶,不仅参与了胆红素、胆汁酸以及类固醇激素等内源性化合物的代谢,而且也负责阿片类药物、镇痛药、非甾体抗炎药和抗惊厥药等 外源性化合物的代谢[10, 11, 12, 13]。不同于CYP介导的DDI已被广泛研究,中草药提取物及其活性成分对UGTs活性的体内外影响研究尚不多见,但已有研究证实,通过影响UGTs亦能产生具有临床意义的DDI[14]。
本研究通过体外孵育实验,研究金松双黄酮对12种人UGTs的抑制作用,并借助体外-体内外推 (IV-IVE) 预测药物相互作用的风险,为金松双黄酮在临床的广泛应用提供理论指导及依据,促进临床合理用药,提高金松双黄酮使用的安全性和有效性,避免由DDI引发严重的临床后果。
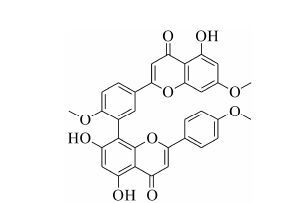
|
Figure 1 Chemical structure of sciadopitysin (SP) |
金松双黄酮对照品 (批号130520,纯度≥ 98%) 购自成都普菲德生物技术有限公司; N-3-羧丙基-4-羟基-1,8-萘酰亚胺 (NCHN)、N-3-羧丙基-4-羟基-1,8-萘酰亚胺葡糖醛酸苷 (NCHNG) 由中国科学院大连化学物理研究所药用资源研发组合成(纯度≥ 98%); 4-甲基伞形酮 (4-MU)、4-甲基伞形酮葡糖醛酸苷 (4-MUG)、三氟拉嗪 (TFP)、7-羟基香豆素、尿苷-5'-二磷酸三钠盐 (UDPGA)、聚氧乙烯醚 (Brij 58)、氯化镁 (MgCl2)、Tris-HCL均购自美国Sigma-Aldrich公司; 混合人肝微粒体 (HLM) 购自瑞德肝脏疾病研究 (上海) 有限公司 (批号YAO); 12种亚型的UGT单酶 (UGT1A1、UGT1A3、UGT1A4、UGT1A6、UGT1A7、UGT1A8、UGT1A9、UGT1A10、UGT2B4、UGT2B7、UGT2B15、UGT2B17) 均购自于美国BD Gentet公司; 甲醇、乙腈和甲酸均为色谱纯,实验用水为Millipore纯化水,其他试剂均为分 析纯。
仪器全功能微孔板检测酶标仪: Synergy H1,购自美国博腾仪器有限公司; 岛津LC-30AT高效液相色谱仪 (在线真空脱气机,SCL-30AVP系统控制器、2个LC-30ATVP泵、SIL-30AC恒温自动进样器、CTO-30A柱温箱、1个SPD-30AVP紫外可见光检测器、岛津色谱工作站) ; Beckman Coulter高速冷冻离心机: ALLEGRA-64R,购自美国贝克曼库尔特有限公司; Millipore纯水仪: 购自美国Millipore公司; 恒温振荡孵育仪: MSC-100,购自杭州奥盛仪器有限公司; 电子天平: BSA224S,Max: 220 g,d = 0.1 mg,购自赛多利斯科学仪器 (北京) 有限公司; 色谱柱: 岛津VP-ODS C18色谱柱 (150.0 mm × 4.6 mm,5 μm),岛津XR-ODS C18色谱柱 (75.0 mm × 2.0 mm,2.2 μm)。
色谱条件4-MUG色谱检测条件: 色谱柱为XR-ODS C18色谱柱 (75.0 mm × 2.0 mm,2.2 μm); 流动相为乙腈 (A)~0.2% 甲酸水溶液 (B),梯度洗脱 (0~4 min,90%~25% B; 4.01~6 min,5% B; 6.01~8 min,90% B; 体积流量0.4 mL·min-1; 柱温40 ℃; 检测波长317 nm; TFPG色谱检测条件: 色谱柱为岛津VP-ODS C18色谱柱 (150.0 mm × 2.0 mm,5.0 μm); 流动相为乙腈 (A)~0.2% 三氟乙酸水溶液 (B),梯度洗脱 (0~9 min,70%~50% B; 9.01~10 min,25%~5% B; 10.01~13 min,5% B; 13.01~16 min,5%~70% B); 体积流量0.3 mL·min-1; 柱温40 ℃; 检测波长254 nm; NCHNG检测条件: 全功能微孔板检测酶标仪检测,产物吸收波长为362 nm,发射波长为450 nm,底物吸收波长为450 nm,发射波长为564 nm,能量80。
金松双黄酮对12种UGTs活性的抑制作用筛选抑制筛选实验采用目前商业化可获得的12种亚型重组单酶 (UGT1A1、UGT1A3、UGT1A4、UGT1A6、UGT1A7、UGT1A8、UGT1A9、UGT1A10、UGT2B4、UGT2B7、UGT2B15、UGT2B17) 为酶源,选取4-MU作为除UGT1A4外所有UGT酶的广谱的探针底物,利用TFP作为UGT1A4的探针底物,考察金松双黄酮对UGT1A4的抑制能力。孵育体系200 μL,包括50 mmol·L-1 Tris-HCl缓冲液 (pH 7.4)、5 mmol·L-1 MgCl2、4 mmol·L-1 UDPGA以及不同浓度的探针底物和抑制剂。在抑制筛选实验中,金松双黄酮浓度设定在0、1和10 μmol·L-1等3个水平。在37 ℃的金属恒温振荡孵育仪中预孵3 min后加入UDPGA起始反应。孵育一定时间后,加入冰乙腈 (含10 μmol·L-1的7-羟基香豆素作为内部参照标准) 200 μL终止反应。在4 ℃、14 470 r·min-1转速条件下离心20 min去除蛋白,取上清液3 μL进行HPLC分析。孵育条件,包括反应时间、各亚型单酶的蛋白浓度、探针底物浓度均按照文献[15]进行。
金松双黄酮对4-MU-O-葡糖醛酸化反应的抑制作用根据金松双黄酮抑制初筛结果,选取抑制剂浓度为10 μmol·L-1时残余活性小于50% 的UGT1A1、UGT1A3、UGT1A8、UGT1A10展开进一步的抑制实验。在上述体外孵育体系中,通过配制一系列不同浓度的金松双黄酮测定其IC50。进一步选择IC50值附 近不同的金松双黄酮浓度和不同的探针底物浓度,对金松双黄酮抑制UGT1A1、UGT1A3、UGT1A8和UGT1A10的抑制动力学常数 (Ki) 进行了测定,并通过Lineweaver-Burk作图方法和Dixon作图方法判断其抑制类型。
金松双黄酮对NCHN-O-葡糖醛酸化反应的抑制作用UGT1A1主要分布于肝脏,是重要的肝药代谢酶,同时也介导了胆红素及多种内源性物质的代谢。鉴于目前缺乏UGT1A3、UGT1A8及UGT1A10的特异性探针底物,因此只评价了金松双黄酮在人肝微粒体层面对UGT1A1的抑制能力。NCHN是UGT1A1特异性荧光探针底物[16],具有灵敏度高、选择性好、响应时间短等优点,本研究利用NCHN的这一特性,考察了金松双黄酮在混合人肝微粒体以及重组单酶两种酶源条件下对UGT1A1的抑制作用,并对照上述实验条件及操作,测定了金松双黄酮对UGT1A1的IC50和抑制动力学常数并判断其抑制类型。对于以混合人肝微粒体为酶源的反应体系,首先将微粒体按1∶1比例加入表面活性剂Brij 58于冰 上反应20 min进行活化,探针底物NCHN的浓度 设定在其Km值附近 (40 μmol·L-1),为保证线性区间范围,在上述反应体系中,HLM和重组UGT1A1的蛋白浓度分别为0.25和0.06 mg·mL-1,反应时间为 30和60 min[17],后加入等体积乙腈终止反应,在4 ℃、14 470 r·min-1转速条件下离心5 min,取上清液200 μL于96孔荧光酶标板置于荧光酶标仪上进行检测。
体内药物相互作用风险预测利用人肝微粒体及重组单酶体外孵育体系获取的抑制参数,借助文献报道的DDI预测方法[18],预测了金松双黄酮抑制UGT1A1引发的潜在DDI风险。预测结果通过有无抑制剂条件下药物在体内的暴露量即药时曲线下面积 (AUC) 的比值来反映:
| \[AUCratio=\frac{1}{{{f}_{hep}}.\left( \frac{1}{\left( 1/{{E}_{h}}-1 \right).\left( 1+I/{{K}_{i}} \right)+1} \right)+\left( 1-{{f}_{hep}} \right)}\] | (1) |
式1中,AUC ratio = AUCi / AUC,表示代谢酶经抑制后,药物暴露量的增加,其中AUCi代表加入抑制剂后的药时曲线下面积; fhep是肝脏清除率; Eh是肝摄取率; I是进入血液中的抑制剂的最大浓度; Ki (μmol·L-1) 是抑制动力学常数。
数据分析所有的孵育实验平行两份,结果取平均值。以4-MUG、NCHN-G或TFP-G的生成速率反映孵育体系中UGTs的活性; 以未加入金松双黄酮的孵育样品中UGTs的活性记为100% 作为阴性对照,样品中代谢产物的生成速率相对于对照组代谢产物生成速率的百分比作为各UGTs的残余活性,计算公式如下: 残余活性百分比% = 样品组代谢产物生成速率 / 对照组代谢产物生成速率 × 100% 。金松双黄酮的IC50和Ki通过GraphPad Prism version 6.0 (GraphPad software Inc,CA,USA) 软件对实验数据进行拟合求得。
结果 1 金松双黄酮对12种UGT单酶活性的抑制评价抑制筛选实验结果如图 2所示。金松双黄酮的浓度为10 μmol·L-1时,UGT1A1、UGT1A3、UGT1A4、UGT1A6、UGT1A7、UGT1A8、UGT1A9、UGT1A10、UGT2B4、UGT2B7、UGT2B15和UGT2B17残余活性的百分比分别为22.28%、24.18%、97.33%、82.91%、73.41%、22.95%、82.68%、29.84%、100.77%、64.49%、57.84% 和61.07%。结果表明,金松双黄酮对UGT1A1、UGT1A3、UGT1A8和UGT1A10均具有较强的抑制作用,抑制剂浓度为10 μmol·L-1时其残余活性均小于30%,而对其他UGTs亚型几乎无抑制或在10 μmol·L-1时的抑制能力小于50%。
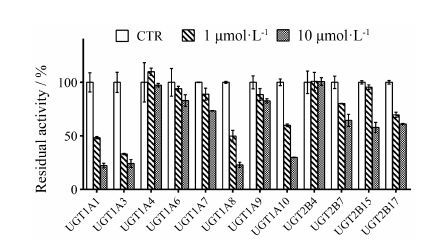
|
Figure 2 Inhibitory effects of SP (0,1,and 10 μmol·L-1) on activities of recombinant UGT isoforms. n = 2,$\overline{x}$± s |
通过非线性拟合的方法求得金松双黄酮对于UGT1A1、UGT1A3、UGT1A8和UGT1A10催化的4-MU-O-葡糖醛酸化反应的IC50值分别为0.65 ± 0.07、0.20 ± 0.09、0.60 ± 0.11和1.34 ± 0.35 μmol·L-1。如图 3所示,Lineweaver-Burk作图和Dixon作图表明,金松双黄酮对UGT1A1、UGT1A3、UGT1A8和UGT1A10催化的4-MU-O-葡糖醛酸化的抑制反应过程都遵循竞争性抑制模型,实验数据进行非线性拟合求得可逆抑制常数Ki分别为0.54 ± 0.08、0.07 ± 0.02、0.61 ± 0.13和2.12 ± 0.34 μmol·L-1。
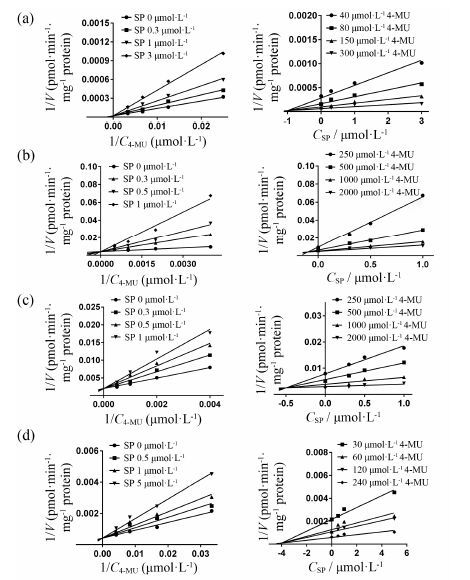
|
Figure 3 The Lineweaver-Burk (left) and Dixon (right) plot for inhibition of SP on 4-methyl umbelliferone (MU)-O-glucuronidation by recombinant UGT1A1 (a),UGT1A3 (b),UGT1A8 (c),and UGT1A10 (d) |
如表 1所示,以NCHN为探针底物,分别以HLM和UGT1A1重组单酶为酶源,测得金松双黄酮抑制UGT1A1催化的NCHN-O-葡糖醛酸化结合反应的IC50值分别为0.35 ± 0.06和0.31 ± 0.05 μmol·L-1,非线性作图法拟合的Ki值分别为为0.41 ± 0.12和0.45 ± 0.12 μmol·L-1。Lineweaver-Burk作图和Dixon作图 (图 4) 表明该抑制反应过程为竞争性抑制,与4-MU-O-葡糖醛酸化结合反应遵循相同的抑制模型。
4 基于UGT抑制的药物相互作用风险预测金松双黄酮DDI预测结果显示,金松双黄酮能使经过UGT1A1代谢底物的AUC增加19%~147% (表 2),提示有发生DDI的潜在风险。金松双黄酮在银杏总提取物中的含量为71.2 mg·g-1 [19],参照中国药典 (2010版) 的标准及银杏叶片的日常口服剂量估算金松双黄酮每天的平均摄入量约为240 mg。鉴于缺乏金松双黄酮口服生物利用度的临床参数,暂且使用银杏总提取物的口服生物利用度30% 代替[20],按人体总血流量约为5.2 L[21]推算出,金松双黄酮的最大血药浓度约为0.96 μmol·L-1。
|
|
Table 1 Comparison of inhibitory kinetic parameters of sciadopitysin on four UGTs. The inhibition type is competitive |
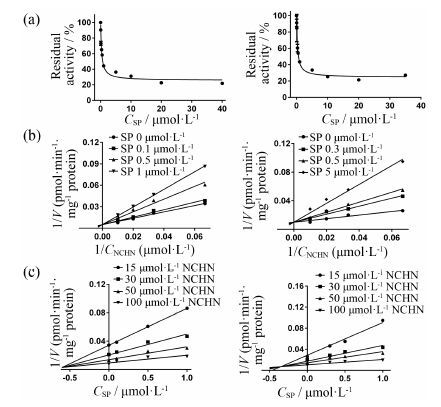
|
Figure 4 The IC50 (a),Lineweaver-Burk (b) and Dixon (c) plot for inhibition of sciadopitysin on N-3-carboxypropyl-4-hydroxy- 1,8-naphthalimide (NCHN)-O-glucuronidation by human liver microsome (HLM,left) and recombinant UGT1A1 (right) |
本研究证实了金松双黄酮对UGT1A1、UGT1A3、UGT1A8和UGT1A10催化的葡糖醛酸化反应表现出较强的竞争性抑制作用,对于UGT1A10,其0.1 < [I] / Ki < 1,提示有可能发生DDI。对于UGT1A1、UGT1A3和UGT1A8,其 [I] / Ki > 1,提示有可能发生非常严重的DDI。然而在应用本文数据解释临床DDI时,应 该注意将估算的最大血药浓度用于IV-IVE的预测可能会使预测结果有一定的的偏差。此外非特异性结合、换算系数等实验因素也可能影响体内DDI预测结果的准确性。
UGT1A1是肝脏中胆红素代谢的关键酶[22],金松双黄酮对UGT1A1的强烈抑制作用会减少胆红素的葡糖醛酸结合,致使游离的胆红素浓度升高,导致黄疸等胆红素相关病症的发生。因此出于安全性考率,含有高剂量金松双黄酮的中草药制品尽量避免与经过UGT1A1代谢的药物共服,尤其针对那些肝损伤及高胆红素血症的患者。UGT1A1还介导了很多药物的 代谢,如抗肿瘤药物依托泊苷[23]、降脂药物依泽替米贝[24]、以及结肠癌治疗药物伊立替康的活性代谢产物SN-38[25],这些药物与包含金松双黄酮的中草药或相关制品联用时,很可能发生DDI从而导致药物疗效的改变。此外,在使用预测结果解释金松双黄酮与一些药物的相互作用时,还应考虑到UGT1A1基因多态性的影响,UGT1A1基因突变导致酶表达水平的不同也会影响预测结果的准确性,例如,UGT1A1*28号基因突变的Gilbert综合征患者体内UGT1A1的表达均低于正常人[26],这类患者对于经UGT1A1介导的药物的代谢消除以及对胆红素的结合能力也会降低,更容易受到该抑制作用的影响。对于这种情况应该避免与金松双黄酮的联合用药。
UGT1A3不仅介导内源性物质胆汁酸 (bile acids) 的代谢消除,而且参与了许多芳烃、碳氢化合物、胺、非甾体类抗炎药 (NSAIDs)、以及他汀类药物的代谢消除[27]。UGT1A8和UGT1A10是重要的肠道代谢酶,能够催化诱导曲格列酮[28]和雷洛昔芬[29]等药物以葡糖醛酸化代谢产物的形式排出体外,这些物质同含有金松双黄酮的中草药或相关制品的联合用药可能会影响其葡糖醛酸化结合反应的速率,使血药浓度异常升高,引起毒性反应产生不可预知的临床后果。尤其是对于治疗窗窄及浓度-效应变化剧烈的药物,代谢酶的抑制作用更容易使肝脏代谢清除率降低而导致药物蓄积。OTS167是一种处于临床试验阶段的抗肿瘤剂,能够有效的抑制胚胎亮氨酸拉链激酶,有研究表明OTS167主要经过UGT1A1、UGT1A3、UGT1A8和UGT1A10代谢[30],临床上该药与金松双黄酮的合用应给予密切关注。然而代谢酶抑制介导的DDI不 仅可能引发毒性反应,还可能产生某些积极的作用,通过改善一些口服生物利用度低或首过消除严重的药物的代谢吸收,减缓肠道代谢药物的葡糖醛酸化反应,提高药物的生物利用度。此外对于那些经过UGT1A1、UGT1A3、UGT1A8和UGT1A10代谢且具有较高治疗指数的药物,同含金松双黄酮的中药或制品联合用药可延长药物在体内的消除半衰期,提高疗效。综上所述,本研究结果对含金松双黄酮的中草药及相关制剂的临床合理用药,避免基于UGT抑制导致的不良DDI,具有重要参考价值。
|
|
Table 2 Prediction of the potential DDI risks of sciadopitysin in vivo. Eh of drugs metabolized by UGTs was assumed to contain in the range of 0.1-0.9. fhep is the percentage of hepatic clearance mediated by UGTs,the average score was about 0.8. The Ki values of UGT1A1 and UGT1A3 were measured by HLM and recombinant UGT1A3,respectively |
| [1] | Li B, Hu GS, Hu LL, et al. Isolation and determination of biflavonoids in Ginkgo biloba leaves[J]. Chin Tradit Herb Drugs (中草药), 2014, 45:2552-2555. |
| [2] | Heinonen T, Gaus W. Cross matching observations on toxicological and clinical data for the assessment of tolerability and safety of Ginkgo biloba leaf extract[J]. Toxicology, 2015, 327:95-115. |
| [3] | Tachjian A, Maria V, Jahangir A. Use of herbal products and potential interactions in patients with cardiovascular diseases[J]. J Am Coll Cardiol, 2010, 55:512-525. |
| [4] | Zhen YQ, Kong DZ, Ren LM. An overview of effects of traditional medicine on pharmacokinetics of western medicine[J]. Acta Pharm Sin (药学学报), 2014, 49:175-182. |
| [5] | Chang LC, Huang N, Chou YJ, et al. Patterns of combined prescriptions of aspirin-Ginkgo biloba in Taiwan:a populationbased study[J]. J Clin Pharm Ther, 2008, 33:243-249. |
| [6] | Sener G, Omurtag GZ, Sehirli O, et al. Protective effects of Ginkgo biloba against acetaminophen-induced toxicity in mice[J]. Mol Cell Biochem, 2006, 283:39-45. |
| [7] | Taki Y, Yokotani K, Yamada S, et al. Ginkgo biloba extract attenuates warfarin-mediated anticoagulation through induction of hepatic cytochrome P450 enzymes by bilobalide in mice[J]. Phytomedicine, 2012, 19:177-182. |
| [8] | Kohler GI, Bode-Boger SM, Busse R, et al. Drug-drug interactions in medical patients:effects of in-hospital treatment and relation to multiple drug use[J]. Int J Clin Pharmacol Ther, 2000, 38:504-513. |
| [9] | Rodrigues AD. Drug-Drug Interactions[M]. 2nd ed. New York:CRC Press, 2008. |
| [10] | Harada H, Toyoda Y, Endo T, et al. Cysteine amide adduct formation from carboxylic acid drugs via UGT-mediated bioactivation in human liver microsomes[J]. Pharmazie, 2015, 70:678-683. |
| [11] | Walsky RL, Bauman JN, Bourcier K, et al. Optimized assays for human UDP-glucuronosyltransferase (UGT) activities:altered alamethicin concentration and utility to screen for UGT Inhibitors[J]. Drug Metab Dispos, 2012, 40:1051-1065. |
| [12] | King CD, Rios GR, Green MD, et al. UDP-glucuronosyltransferases[J]. Curr Drug Meta, 2000, 1:143-161. |
| [13] | Fisher MB, Paine MF, Strelevitz TJ, et al. The role of hepatic and extrahepatic UDP-glucuronosyltransferases in human drug metabolism[J]. Drug Metab Rev, 2001, 33:273-297. |
| [14] | Fang ZZ, Cao YF, Hu CM, et al. Structure-inhibition relationship of ginsenosides towards UDP-glucuronosyltransferases (UGTs)[J]. Toxicol Appl Pharmacol, 2013, 267:149-154. |
| [15] | Zhu LL, Ge GB, Liu Y, et al. Potent and selective inhibition of magnolol on catalytic activities of UGT1A7 and 1A9[J]. Xenobiotica, 2012, 42:1001-1008. |
| [16] | Wang XX, Lü X, Li SY, et al. Identification and characterization of naturally occurring inhibitors against UDP-glucuronosyltransferase 1A1 in Fructus Psoraleae (Bu-gu-zhi)[J]. Toxicol Appl Pharmacol, 2015, 15:75-78. |
| [17] | Lü X, Ge GB, Feng L, et al. An optimized ratiometric fluorescent probe for sensing human UDP-glucuronosyltransferase 1A1 and its biological applications[J]. Biosens Bioelectron, 2015, 72:261-267. |
| [18] | Kirby BJ, Unadkat JD. Impact of ignoring extraction ratio when predicting drug-drug interactions, fraction metabolized, and intestinal first-pass contribution[J]. Drug Metab Dispos, 2010, 38:1926-1933. |
| [19] | Pandey R, Chandra P, Arya KR, et al. Development and validation of an ultra high performance liquid chromatography electrospray ionization tandem mass spectrometry method for the simultaneous determination of selected flavonoids in Ginkgo biloba[J]. J Sep Sci, 2014, 37:3610-3618. |
| [20] | Wang W, Kang Q, Liu N, et al. Enhanced dissolution rate and oral bioavailability of Ginkgo biloba extract by preparing solid dispersion via hot-melt extrusion[J]. Fitoterapia, 2015, 102:189-197. |
| [21] | Feldschuh J, Enson Y. Prediction of the normal blood volume. Relation of blood volume to body habitus[J]. Circulation, 1977, 56:605-612. |
| [22] | Zhou J, Tracy TS, Remmel RP. Bilirubin glucuronidation revisited:proper assay conditions to estimate enzyme kinetics with recombinant UGT1A1[J]. Drug Metab Dispos, 2010, 38:1907-1911. |
| [23] | Wen ZM, Tallman MN, Ali SY, et al. UDP-glucuronosyltransferase 1A1 is the principal enzyme responsible for etoposide glucuronidation in human liver and intestinal microsomes:structural characterization of phenolic and alcoholic glucuronides of etoposide and estimation of enzyme kinetics[J]. Drug Metab Dispos, 2007, 35:371-380. |
| [24] | Montenegro-Miranda PS, Sneitz N, de Waart DR, et al. Ezetimibe:a biomarker for efficacy of liver directed UGT1A1 gene therapy for inherited hyperbilirubinemia[J]. Biochim Biophys Acta, 2012, 1822:1223-1229. |
| [25] | Li W, Xing YF, Liu Y. Inhibition of SN-38 glucuronidation by gefitinib and its metabolite[J]. Cancer Chemother Pharmacol, 2015, 75:1253-1260. |
| [26] | Udomuksorn W, Elliot DJ, Lewis BC, et al. Influence of mutations associated with Gilbert and Crigler-Najjar type II syndromes on the glucuronidation kinetics of bilirubin and other UDP-glucuronosyltransferase 1A substrates[J]. Pharmacogenet Genomics, 2007, 17:1017-1029. |
| [27] | Oda S, Fukami T, Yokoi T, et al. A comprehensive review of UDP-glucuronosyltransferase and esterases for drug development[J]. Drug Metab Pharmacokinet, 2015, 30:30-51. |
| [28] | Watanabe Y, Nakajima M, Yokoi T. Troglitazone glucuronidation in human liver and intestine microsomes:high catalytic activity of UGT1A8 and UGT1A10[J]. Drug Metab Dispos, 2002, 30:1462-1469. |
| [29] | Gufford BT, Chen G, Vergara AG, et al. Milk thistle constituents inhibit raloxifene intestinal glucuronidation:a potential clinically relevant natural product-drug interaction[J]. Drug Metab Dispos, 2015, 43:1353-1359. |
| [30] | Ramírez J, Mirkov S, House LK, et al. Glucuronidation of OTS167 in humans is catalyzed by UDP-glucuronosyltransferases UGT1A1, UGT1A3, UGT1A8 and UGT1A10[J]. Drug Metab Dispos, 2015, 43:928-935. |
 2016, Vol. 51
2016, Vol. 51


