2. 河南师范大学生命科学学院, 河南 新乡 453007
2. College of Life Science, Henan Normal University, Xinxiang 453007, China
成纤维细胞生长因子21 (FGF21) 是FGF家族中FGF19亚家族成员之一,主要表达在肝脏中,其主要作用靶器官有肝脏、脂肪和胰腺等[1],FGF21可以不依赖于胰岛素信号通路安全有效调节血糖[2],不会产生低血糖、水肿和过敏等不良反应[3]。除此之外,大量动物实验表明,FGF21可以有效改善胰岛素抵抗,降低血清中甘油三酯、胆固醇以及低密度脂蛋白的浓度[4, 5] 。FGF21在治疗代谢疾病特别是糖尿病方面有着广阔的市场前景[6, 7]。
大肠杆菌被广泛地应用到重组蛋白的生产,具有生产成本低、操作技术简单等优点,是表达非糖基化重组蛋白的首选,目前FDA批准生产的重组蛋白药物大约有30%由大肠杆菌表达[8]。然而,大肠杆菌胞内表达重组蛋白,具有易被蛋白酶降解、不能形成正确的二硫键和错误折叠等风险,从而导致重组蛋白不表达、表达量低以及错误折叠形成包涵体等问题[8, 9]。相对于大肠杆菌细胞质,细胞周质是一个氧化环境,有利于二硫键的正确形成促进蛋白质的正确折叠; 此外细胞周质蛋白酶含量低,重组蛋白不易被降解; 同时细胞周质蛋白总量低,便于重组蛋白的提取纯化,简化了提纯工艺并节约了生产成本[10]。
Sec分泌途径是大肠杆菌经典的依赖于N端信号肽的转运途径,已有许多重组蛋白通过Sec 分泌途径成功表达[10, 11, 12, 13],PelB (MKYLLPTAAAGLLLLAAQPA MA) 信号肽在大肠杆菌中是典型的Sec信号肽。鉴于细胞周质表达有其独特的优势,因此本文旨在利用该系统制备出纯度在95%以上且具有生物活性的h-FGF21蛋白。
材料与方法 质粒和菌株质粒pSUMO-h-FGF21由本实验室构建,pET27b载体由本实验室提供,pMD18-Tsimple载体购自TaKaRa公司。E. coli菌株DH5α、BL21 (含DE3) 由本实验室保存。
实验试剂dNTPs、rTaq酶、T4 DNA连接酶、限制性内切酶、异丙基硫代-β-D-半乳糖苷 (IPTG)、溶菌酶、氨苄霉素 (ampcilin,Amp) 及卡那霉素 (kanamycin,Kan) 均购自TaKaRa公司。SUMO蛋白酶由本实验室制备。葡萄糖检测试剂盒购自北京金豪制药股份有限公司。Ni Sepharose 6 FF、Sephadex G-25、Capto Q填料、Column XK16/20空柱和HiScreenTM Q HP预装柱购自GE公司。其他化学试剂均为分析纯。
实验细胞及动物HepG2细胞为东北农业大学生物制药教研室提供,db/db雄性小鼠 (8周龄,SPF级) 购于上海斯莱克实验动物有限责任公司,动物质量许可证号码SCXK (沪) 2014-0002。
引物设计引物设计软件为Primer premier 5.0,引物由Invitrogen公司合成,引物序列见表 1。
pET27bPelB-h-FGF21重组质粒构建pET27b载体上含有PelB信号肽,以P1、P2为引物,pSUMO- h-FGF21为模板扩增目的片段,目的片段PCR纯化连入pMD18-Tsimple载体,并由上海英骏生物技术有限公司进行序列测定。经MscI、BamHI双酶切后,采用凝胶回收试剂盒回收并纯化目的DNA,连入pET27b载体中构建成重组质粒pET27bPelB-h-FGF21。
ph-FGF21表达以及诱导表达温度的摸索将pET27bPelB-h-FGF21转化至大肠杆菌BL21 (含DE3); 转化后挑取单菌落接种于含Kan (50 μg·mL-1) LB 培养基20 mL中,37 ℃过夜培养,以1∶100接种于另 3个500 mL含 Kan (50 μg·mL-1) LB& lt; span style='font-family:宋体;color:black'>培养基中,37 ℃培养; 当OD600达到0.3~0.4时,加入IPTG至终浓度为0.25 mmol·L-1进行诱导,诱导温度分别为25、30和37 ℃; 3 h后收集菌体,用20 mmol·L-1 Tris (pH 8.0) 重悬,破碎离心后分别取上清液和沉淀进行15% SDS-PAGE分析,检测表达情况,上样量为20 μL。蛋白质分子质量计算公式如下: 蛋白质相对分子质量大小 = 氨基酸平均相对分子质量×氨基酸数-(氨基酸数-肽链数)×18。
细胞周质蛋白提取与纯化收集菌体6 mL,1 mL PBS溶液洗一遍,用高渗溶液350 μL Tris (20 mmol·L-1)/Sucrose (0.75 mmol·L-1) (pH 8.0) 重悬菌体; 加入质量浓度为10 mg·mL-1新鲜配制的溶菌酶母液35 μL (只有当EDTA存在时,溶菌酶才能起作用); 逐滴加入1 mmol·L-1 EDTA溶液700 μL,同 时涡旋震荡混匀; 冰上孵育15 min; 加入0.5 mol·L-1 MgCl2溶液50 μL,并在冰上孵育10 min终止反应; 4 ℃、12 000 r·min-1离心2 min,将上清液和沉淀进行15% SDS-PAGE分析,上样量为20 μL。
收集含有ph-FGF21的细胞周质蛋白提取上清 液,进行buffer置换,将蛋白置换到20 mmol·L-1 Tris (pH 8.0) 结合缓冲液中。用AKTA purifier 100纯化系统将上清液,按200 cm·h-1速度流入Capto Q (XK16/20,柱高10 cm) 柱; 待蛋白结合后采用步级梯度洗脱,根据紫外吸收峰收集蛋白。将含目标蛋白洗脱液稀释至电导值小于或等于5 mS·cm-1,用HiScreenTM Q HP column进行精细纯化,步级梯度 洗脱后收集蛋白。将收集的目标蛋白透析至PBS中。最后所得蛋白进行15% SDS-PAGE分析,上样量为20 μL。
|
|
Table 1 Primer sequence |
将pSUMO-h-FGF21转化至大肠杆菌BL21 (含DE3); 转化后挑取单菌落接种于含Amp (100 μg·mL-1) LB培养基20 mL中,37 ℃过夜培养,以1∶100接种于另一500 mL含Amp (100 μg·mL-1) LB培养基中,37 ℃培养; 当OD600达 到0.3~0.4时,加入IPTG至终浓度为0.25 mmol·L-1进行诱导,诱导温度为30 ℃; 3 h后收集菌体,用Lysis buffer (20 mmol·L-1 Na3PO4、500 mmol·L-1 NaCl、40 mmol·L-1咪唑,pH 7.4) 重悬菌体; 加入溶菌酶至终质量浓度为1 mg·mL-1,4 ℃作用60 min。利用超声破碎仪冰上破碎菌体后,12 000 r·min-1、4 ℃离心30 min,将上清液放置4 ℃待用。取全菌、离心后上清沉淀进行15% SDS-PAGE检测,上样量为20 μL。
用AKTA purifier 100纯化系统将表达ih-FGF21的BL21菌液上清依次进行Ni Sepharose 6 Fast Flow亲和层析、Sephadex G-25脱盐、SUMO 蛋白酶酶切、Ni Sepharose 6 Fast Flow亲和层析,即获得ih-FGF21成熟蛋白,并进行15% SDS-PAGE检测,上样量为融合蛋白20 μL、成熟蛋白40 μL。
细胞周质表达ph-FGF21 Western blotting分析实验室制备的鼠h-FGF21单抗[14]为一抗,HRP标记的羊抗鼠抗体为二抗。将上述得到纯化好的ph-FGF21和ih-FGF21为阳性对照以及BSA为阴性对照进行Western blotting 分析。
ph-FGF21与ih-FGF21细胞水平活性比较HepG2细胞饥饿12 h后,细胞生长状态回归至G0期,分别加入不同浓度 (10、100及1 000 nmol·L-1) 纯化后细胞周质表达ph-FGF21与ih-FGF21刺激细胞24 h; 用经微量化的POD-GOD方法检测培养基中剩余葡萄糖含量,并运用统计学分析结果。培养液中残留的葡萄糖浓度和细胞葡萄糖消耗率的计算公式如下: 葡萄糖浓度(mmol·L-1) = (A样品/A标准) × 5.55; 细胞葡萄糖消耗率 = [(C空白葡萄糖 - C给药葡萄糖) / C空白葡萄糖] × 100% (A为波长在505 nm时紫外吸收值,C为葡萄糖浓度)。
细胞周质表达ph-FGF21与ih-FGF21对II型糖尿病db/db小鼠短期与长期降糖生物学活性比较实验选取15只成模的血糖接近均值的db/db小鼠,分成3组,每组5只; 分笼饲养在动物室 (温度22~28 ℃) 中,明暗周期为12 h (6∶00~18∶00),天黑前投食,自由饮水。实验期间,通过皮下注射方式给予各实验组小鼠对应蛋白,剂量为0.05 μmol·kg-1·d-1,模型对照组注射相同体积生理盐水。第一天给药3 h后,尾静脉取血比较两种蛋白对II型糖尿病db/db小鼠短期调节血糖能力。每天上午8∶00给药,连续给药14天,隔天给药前检测记录血糖值,比较两种蛋白长期调节血糖效果,所得实验数据进行统计学分析。
数据处理实验所得数据运用SPSS软件进行 统计学分析,两组间数据比较采用t检验,多组间比较采用方差分析。
结果 1 细胞周质表达载体的构建pET27bPelB-h-FGF21重组质粒经MscI、BamHI双酶切后得到大约550 bp的小片段与预期543 bp相符(图 1),测序结果正确。实验结果表明,重组质粒构建成功。
|
Figure 2 Identification of the recombinant plasmid. 1: DL2000 marker; 2: Restriction enzyme analysis of pET27bPelB-h-FGF21; 3: λ-T14 marker |
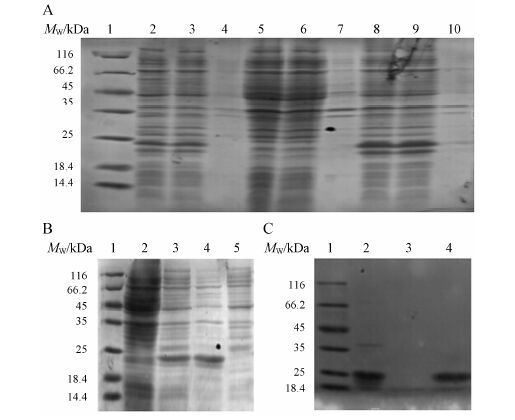
将含有pET27bPelB-h-FGF21表达载体的BL21菌株接种后诱导,诱导后3 h取样进行15% SDS-PAGE电泳分析。结果表明,含有pET27bPelB-h-FGF21的阳性菌以可溶形式表达了ph-FGF21,大小约20 kDa与计算的19.9 kDa相符(图 2A),目的蛋白在诱导表达温度为37 ℃时,ph-FGF21表达量最多,经灰度分析软件分析得知目的蛋白占菌体总蛋白10.2% (图 2A)。
3 细胞周质内重组蛋白ph-FGF21的提取与纯化收集菌体后,经EDTA和溶菌酶短时间处理后,细菌细胞壁被溶菌酶打孔后形成原生质球,细胞周质内蛋白释放,离心后分别收集上清以及沉淀,进行15% SDS-PAGE电泳分析。结果表明,重组蛋白绝大部分在细胞周质内可溶表达 (图 2B),且细胞周质内含有少量菌体自身表达蛋白。

|
Figure 2 A: Expression analysis of periplasmic expression of h-FGF21 (ph-FGF21) at different culturing temperatures. 1: Protein molecular weight (MW) marker; 2: The entire cell lysates at 30 ℃; 3: Supernatant of cell lysates at 30 ℃; 4: Precipitate of cell lysates at 30 ℃; 5: The entire cell lysates at 25 ℃; 6: Supernatant of cell lysates at 25 ℃; 7: Precipitate of cell lysates at 25 ℃; 8: The entire cell lysates at 37 ℃; 9: Supernatant of cell lysates at 37 ℃; 10: Precipitate of cell lysates at 37 ℃. B: The extracting of ph-FGF21. 1: Protein molecular weight marker; 2: Un-induced cell lysates; 3: The induced entire cell lysates; 4: The periplasmic h-FGF21; 5: Precipitate of protoplasm. C: Analysis of purified ph-FGF21 by SDS-PAGE. 1: Protein molecular weight marker; 2: Purified protein after Capto Q chromatography; 3: Blank lane; 4: Purified protein after Q high performance chromatography |
经过两步离子交换洗脱出来的峰进行SDS-PAGE分析,如图 2C所示,2号泳道为Capto Q离子交换纯化后目的蛋白,3号为空泳道,4号泳道为HiScreenTM Q HP column进行精细纯化后目的蛋白成单一条带,约为20 kDa。经紫外分光光度计测定蛋白浓度计算产量约为5 mg·L-1。经灰度分析软件分析其纯度达到95%以上。
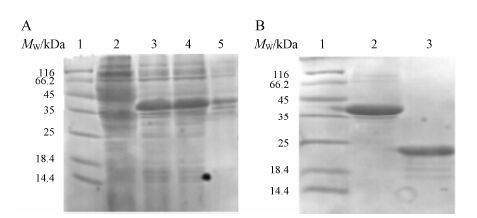
4 细胞质内重组蛋白ih-FGF21的表达与纯化经30 ℃诱导3 h后,收集菌体,破碎离心,分 别取上清沉淀,以未诱导做阴性对照,进行15% SDS- PAGE电泳分析。结果显示,ih-FGF21融合蛋白绝大部分呈可溶形式表达 (图 3A)。经Ni S epharose 6 Fast Flow亲和层析,脱盐、酶切,二次亲和后得到成熟蛋白,进行15% SDS-PAGE电泳分析 (图 3B)。经灰度分析软件分析其纯度达95% 以上,应用紫外分光光度计测量浓度计算产量约为6 mg·L-1。
|
Figure 3 A: Expression analysis of intracellular expression of h-FGF21 (ih-FGF21). 1: Protein molecular weight marker; 2: Un-induced cell lysates; 3: The induced entire cell lysates; 4: Supernatant of cell lysates 5: Precipitate of cell lysates. B: Analysis of purified ih-FGF21. 1: Protein molecular weight marker; 2: Sumo-ih-FGF21 fusion protein; 3: ih-FGF21 protein |
采用鼠抗h-FGF21的抗体进行Western blotting 分析结果表明 (图 4),1号和2号泳道均能与鼠抗h-FGF21发生特异性反应,3号泳道为BSA阴性对照,证明表达纯化出的蛋白为h-FGF21。

|
Figure 4 Western blotting analyses the physical properties difference between ph-FGF21 and ih-FGF21. 1: ph-FGF21; 2: ih-FGF21; 3: BSA |
结果如图 5所示,经过10、100和1 000 nmol·L-1 ph-FGF21与ih-FGF21分别刺激后的细胞,采用GOD- POD法检测其葡萄糖吸收率。实验结果表明,与空白对照组相比,两者均能显著增加细胞葡萄糖吸收率,且呈剂量依赖性; 相同浓度的ph-FGF21与ih-FGF21促进细胞糖吸收的生物学活性无显著差异,说明ph-FGF21与ih-FGF21在细胞水平上促进HepG2细胞糖吸收的生物学活性并没有显著差异,证实分泌到细胞周质表达的ph-FGF21在细胞水平生物活性并未受到影响。
7 ph-FGF21与ih-FGF21对II型糖尿病db/db小鼠短期与长期降糖生物学活性比较注射3 h后,模型对照组小鼠的血糖由 (17.31 ± 3.79) mmol·L-1变为 (17.18 ± 4.01) mmol·L-1,ph-FGF21组小鼠血糖由 (18.53 ± 2.30) mmol·L-1降至(10.41 ± 2.56) mmol·L-1,ih-FGF21组小鼠血糖由 (18.15 ± 2.57) mmol·L-1降至(10.72 ± 1.74) mmol·L-1。与模型对照组相比,无论作用效果还是作用时间,两种FGF-21蛋白都表现出良好的降糖效果,血糖在注射1 h开始下降,注射3 h降糖效果较模型对照组相比差异极显著,两种蛋白之间差异不显著,注射后3 h降糖效果与Yu等[15]研究结果一致。连续注射14天,每天上 午8∶00给药,隔天给药前监测血糖,给药4天后与生理盐水组相比,ph-FGF21与ih-FGF21注射组小鼠血糖均降为7.5 mmol·L-1左右,且一直保持稳定,二者并无显著差异 (图 6)。说明两种来源的重组FGF-21蛋白均能长期维持II型糖尿病小鼠血糖稳定。

|
Figure 5 Comparison of glucose uptake in HepG2 cells treated with ph-FGF21 or ih-FGF21. n = 5,$\overline{x}$± s. **P < 0.01 vs vehicle |

|
Figure 6 Comparison of ph-FGF21 and ih-FGF21 for long- term hypoglycemic effect in db/db mice. Diabetic db/db mice were administrated with saline (vehicle),0.05 μmol·kg-1·d-1 ph-FGF21 and 0.05 μmol·kg-1·d-1 ih-FGF21 for 14 days,respectively. n = 5,$\overline{x}$± s |
至今为止,多种Sec分泌途径信号肽已经成功应用于高效可溶表达重组蛋白,例如PelB、OmpA、PhoA、endoxylanase、OmpT和StII等。目前已有一些细胞周质表达的重组蛋白应用于临床,包括一些Fab片段 (Leucentis®和Cimza®) 等[8]。其中重组蛋白细胞周质表达与表达载体、宿主菌、诱导表达条件、重组蛋白质本身的性质以及信号肽的选择等一系列问题密切相关。pET表达系统由Studier和Moffat开发,是现在应用比较广泛的大肠杆菌表达重组蛋白系统之一。PelB信号肽为pET载体上固有的信号肽,Sockolosky等[16]成功地用pET-22b载体在细胞周质表达了hGH。因此,本研究选取了pET-22b同系列的表达载体pET-27b,将PelB信号肽替换成OmpT (MRAKLLGIVLTTPIAISSFA) 和PhoA (MKQSTIAL ALLPLLFTPVTKA) 进行比较研究,后两者均未能成功携带h-FGF21表达 (数据未显示),最终筛选出PelB信号肽为表达h-FGF21的合适信号肽。同时,本研究也进行了BL21与Rosetta宿主表达菌,25、30和37 ℃诱导表达等条件对ph-FGF21表达的影响,得出BL21以及37 ℃诱导为适合ph-FGF21表达条件的结论 (以上部分结果数据未在文中展现)。
大肠杆菌细胞周质为内膜和外膜中间的部分,细胞周质内含有一系列Dsb蛋白,Dsb蛋白含有多个高度保守的硫氧还蛋白样基序 (C-X-X-C),这一基序对二硫键氧化还原酶活性有重要作用[17]。其中,DsbA和DsbB蛋白作为氧化还原酶可以催化二硫键形成; DsbC和DsbD蛋白可以对蛋白质内形成的错误二硫键进行重排; 此外,包涵体一般不会在细胞周质内积聚,DegP蛋白酶可以快速将包涵体降解[17, 18]。因此,本研究可以在37 ℃、3 h内,在细胞周质内得到可溶表达的目的蛋白。细胞周质空间内菌体本身蛋白含量少,利于重组蛋白的纯化,经过细胞周质蛋白提取以及两步离子交换得到了纯度大于95% 的重组蛋白,且细胞及体内生物活性与ih-FGF21一致,表明两种表达方式得到的重组蛋白并无差异。
FGF21是重要的糖脂代谢调节因子,是治疗肥胖和II型糖尿病等代谢疾病的潜力药物。本文利用pET-27b载体成功地在大肠杆菌周质可溶表达了ph-FGF21,得到与ih-FGF21生物学活性一致的重组蛋白。ph-FGF21产量约为5 mg·L-1,与ih-FGF21产量约为6 mg·L-1相比略低,然而,ph-FGF21不需要SUMO蛋白酶过夜酶切,节约了制备蛋白酶成本以及酶切时间; 同时用于ph-FGF21纯化的离子交换填料比用于ih-FGF21的亲和层析填料便宜3~4倍。综上所述,本研究解决了带SUMO标签表达需要昂贵的蛋白酶酶切、包涵体表达费时费力、变性复性率低以及胞内表达纯化工艺复杂等一系列问题,为工业化生产提供了新思路,但后期实验需要在培养表达条件和提高蛋白产量方面做进一步优化,为大批量发酵生产做好准备。
| [1] | Nishimura T, Nakatake Y, Konishi M, et al. Identification of a novel FGF, FGF-21, preferentially expressed in the liver[J]. Biochim Biophys Acta, 2000, 1492:203-206. |
| [2] | Zhao JZ, Sun GP, Ye XL, et al. The long lasting effect of the marine fibroblast growth factor-21 on blood glucose control of diabetic animals[J]. Acta Pharm Sin (药学学报), 2013, 48:352-358. |
| [3] | Sun GP, Ye XL, Ren GP, et al. Fibroblast growth factor-21 mediates hepatic glucose metabolism of type 1 diabetes model and its mechanism[J]. Prog Biochem Biophys (生物化学与生物物理进展), 2011, 38:953-960. |
| [4] | Kharitonenkov A, Wroblewski VJ, Koester A, et al. The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21[J]. Endocrinology, 2007, 148:774-781. |
| [5] | Kharitonenkov A, Shiyanova TL, Koester A, et al. FGF-21 as a novel metabolic regulator[J]. J Clin Invest, 2005, 115:1627-1635. |
| [6] | Liu J, Xu Y, Hu YJ, et al. The role of fibroblast growth factor 21 in the pathogenesis of non-alcoholic fatty liver disease and implications for therapy[J]. Metabolism, 2015, 64:380-390. |
| [7] | Ye XL, Gao HS, Wang WF, et al. Optimization and characterization of a novel FGF21 mutant[J]. Acta Pharm Sin (药学学报), 2012, 47:897-903. |
| [8] | Huang CJ, Lin H, Yang XM, et al. Industrial production of recombinant therapeutics in Escherichia coli and its recent advancements[J]. J Ind Microbiol Biotechnol, 2012, 39:383-399. |
| [9] | Wei XF, Wang DM, Liu S, et al. Signal sequence and its application to protein expression[J]. Biotechnol Bull (生物技术通报), 2006, 6:38-42. |
| [10] | Samant S, Gupta G, Karthikeyan S, et al. Effect of codonoptimized E. coli signal peptides on recombinant Bacillus stearothermophilus maltogenic amylase periplasmic localization, yield and activity[J]. J Ind Microbiol Biotechnol, 2014, 41:1435-1442. |
| [11] | Förster S, Brandt M, Mottok DS, et al. Secretory expression of biologically active human Herpes virus interleukin-10 analogues in Escherichia coli via a modified Sec-dependent transporter construct[J]. BMC Biotechnology, 2013, 13:82-94. |
| [12] | Nematollahi L, Khalaj V, Babazadeh SM, et al. Periplasmic expression of a novel human bone morphogenetic protein-7 mutant in Escherichia coli[J]. Avicenna J Med Biotechnol, 2012, 4:178-185. |
| [13] | Morowvat MH, Babaeipour V, Rajabi-Memari H, et al. Overexpression of recombinant human beta interferon (rhINF-β) in periplasmic space of Escherchia coli[J]. Iran J Pharm Res, 2014, 13:151-160. |
| [14] | Hao ZC, Xu LM, Bai Y, et al. Preparation of monoclonal antibodies against hFGF-21 and identification of epitope[J]. Chin J Cell Mol Immunol (细胞与分子免疫学杂志), 2013, 29:834-837. |
| [15] | Yu D, Ye XL, Ren GP, et al. Improvement of yield and purity of human fibroblast growth factor-21[J]. Chin J Biotechnol (生物工程学报), 2014, 30:658-668. |
| [16] | Sockolosky JT, Szoka FC. Periplasmic production via the pET expression system of soluble, bioactive human growth hormone[J]. Protein Expr Purif, 2013, 87:129-135. |
| [17] | Choi JH, Lee SY. Secretory and extracellular production of recombinant proteins using Escherichia coli[J]. Appl Microbiol Biotechnol, 2004, 64:625-635. |
| [18] | Kurokawa Y, Yanagi H, Yura T, et al. Overproduction of bacterial protein disulfide isomerase (DsbC) and its modulator (DsbD) markedly enhances periplasmic production of human nerve growth factor in Escherichia coli[J]. J Biol Chem, 2001, 276:14393-14399. |
 2016, Vol. 51
2016, Vol. 51


