家蚕 (Bombyx mori) 不仅是中国几千年来最主要的农业经济昆虫之一,而且是一个多世纪以来重要的实验遗传学模式动物,积累了丰硕的经典遗传学成果和遗传资源。本世纪初,家蚕基因组框架图[1]、精细图[2]和多品系重测序[3]成果的取得,促进了家蚕突变机制的解析。有趣的是,与人类遗传疾病相似的家蚕突变体不断被挖掘出来,如苯丙酮尿症 (phenylketonuria,PKU)[4, 5]、帕金森疾病[6]、海-普综合征 (Hermansky-Pudlak syndrome,HPS)[7, 8, 9]等,均在家蚕中发现了对应的突变体,可作为这些疾病的动物模型。
家蚕不仅具有诸多人类遗传疾病模型,也有一些人类病原微生物感染模型。如家蚕金黄色酿脓葡 萄球菌 (Staphylococcus aureus)[10, 11, 12, 13, 14]、酿脓链球菌 (Streptococcus pyogenes)[15]、绿脓假单胞菌 (pseudomonas aeruginosa)[16]感染模型以及病原真菌,如白色念珠菌 (Candida albicans)[17]和新型隐球菌 (Cryptococcus neoformans)[18]感染模型。家蚕病原微生物感染模型,不仅可以用于病原微生物致病机制的探索,还可以用于抗生素的筛选。
家蚕作为人类疾病模型用于药物筛选有以下优点: 饲养容易,子代多,生命周期短; 大小适中易于实验操作; 遗传背景清楚,突变资源丰富。家蚕与高等生物有很多共同的关键特征,如完善的感觉和运动系统、性行为、先天性免疫和系统性反应。
1 家蚕中的人类遗传疾病模型家蚕中存在诸多突变体,宝贵的遗传资源无疑为家蚕的遗传学研究奠定了坚实的材料基础,是家蚕遗传学日渐繁荣的基石。西南大学拥有目前世界上最大的家蚕遗传资源库,保存的突变系统多达700余系[19],其中不乏与人类疾病相似的突变品系,为家蚕的实验动物化提供了资源。近年来,家蚕突变体分子解析的诸多结果,使家蚕在疾病模型开发方面受到新的关注。
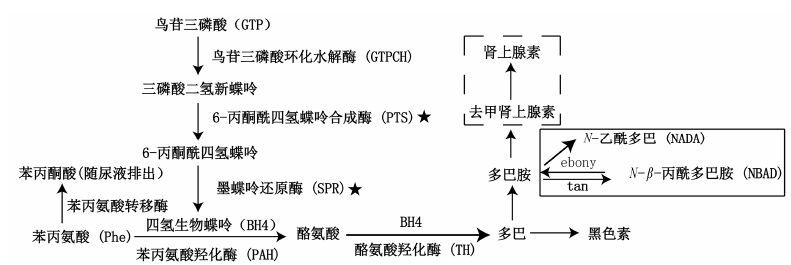
1.1 苯丙酮尿症模型苯丙酮尿症分为经典型和非经典型,前者主要由苯丙氨酸羟化酶(PAH) 基因突变导致,而非经典型苯丙酮尿症又称四氢生物喋呤 (BH4) 缺乏症。家蚕突变型白化蚕 (albino,al) (图 1B) 是由6-丙酮酰四氢蝶呤合成酶基因 (BmPTS) 突变引起的 (图 2)。BmPTS功能丧失导致其参与的BH4合成途径受阻,而BH4作为PAH和酪氨酸羟化酶 (TH) 的辅酶参与黑色素合成,因而导致这两个酶催化的底物苯丙氨酸和酪氨酸含量显著升高[4, 5]。家蚕al与人类BH4缺乏型苯丙酮尿症致病机制一致,对患有该疾病的蚕添食BH4可以起到治疗作用[20, 21]。因此,家蚕al被认为是人类非经典型苯丙酮尿症的潜在模型,可作为该疾病模式动物用于药物筛选。

|
图 1 家蚕中的人类遗传疾病模型。家蚕中存在着不同类型的人类疾病模型,它们具有药物筛选的潜在价值。A: WT (wild-type) 为野生型,品系为大造,体壁白色; B: 白化 (albino,al),可作为人类一种非经典型苯丙酮尿症模型,具有体色褐黄的特征,WT品系为大造; C: 柠檬蚕 (lemon,lem),是人类墨蝶呤还原酶缺乏症模型,由于缺乏墨蝶呤还原酶,使黄嘌呤B1在真皮细胞积聚呈黄体色; D: d油蚕 (distinct translucent,od) 皮肤透明度高,稚蚕期发育迟缓; E: Var斑油蚕 (mottled translucent of Var,ov),透明度中等; F: 青熟油蚕 (aojuku translucent,oa),皮肤中度透明; D-F均为人类海-普综合征模型 |
墨蝶呤还原酶缺乏症 (sepiapterin reductase deficiency,SRD),是一种可导致多巴反应性肌张力障碍的常染色体隐性遗传疾病[22]。家蚕突变体柠檬蚕 (lemon,lem) (图 1C),是由墨蝶呤还原酶基因 (sepiapterin reductase,BmSPR) 功能丧失引起的BH4合成困难 (图 2),而BH4是芳香族氨基酸代谢的辅因子,控制着体内单胺类神经递质的含量。由于缺乏墨蝶呤还原酶,黑色素代谢途径不能正常进行,导致家蚕黄嘌呤B1在真皮细胞积聚呈黄体色[23]。柠檬蚕是迄今昆虫中唯一的人类墨蝶呤还原酶缺乏症模型。
|
图 2 人类和家蚕苯丙氨酸代谢通路。虚线框内表示哺乳动物特有多巴胺代谢路径,实线框内表示家蚕特有的多巴胺代谢路径,其余通路为家蚕和人类保守的苯丙氨酸代谢通路。五星标记家蚕中的两种突变体的突变基因,分别是苯丙酮尿症模型 (al) 中的突变基因PTS和墨蝶呤还原酶缺乏症模型 (lem) 中的突变基因SPR |
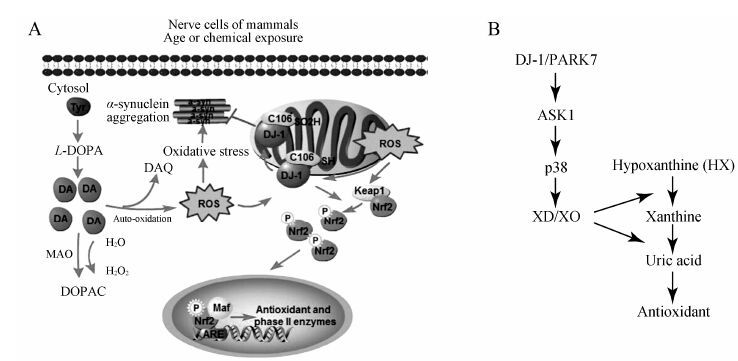
帕金森病患者血清尿酸水平 降低是帕金森病加剧的危险因素之一,血液尿酸水平与帕金森病发生发展的关系,是至今医学研究者关注的一个热点问题[24]。家蚕的一个独特突变体p油蚕 (p-translucent,op),是由于帕金森病蛋白7基因 (PARK7/DJ-1) 表达量下调,导致op突变体中黄嘌呤氧化酶合成困难 (图 3B),脑中酪氨酸羟化酶表达量降低,尿酸合成、运输、代谢以及积累降低,从而增加了机体氧化应激反应,造成机体神经和组织氧化损伤[7]。该研究表明家蚕op突变体可以作为人类帕金森病的一种动物模型,有利于帕金森病的基础研究以及治疗药物筛选。
|
图 3 哺乳动物 (A) 和家蚕 (B) 的DJ-1抗氧化信号通路。A: 哺乳动物神经细胞中DJ-1抗氧化预防帕金森病信号通路。ARE: 抗氧化反应元件; DA: 多巴胺; DAQ: 多巴醌; DOPAC: 二羟苯乙酸; Keap1: Kelch样ECH联合蛋白1; Maf: 肌腱膜纤维瘤致肿瘤基因; MAO: 单胺氧化酶; Nrf2: 转录因子E2相关因子2; ROS: 活性氧自由基; α-syn: α突触核蛋白; Tyr: 酪氨酸。 B: p油蚕中DJ-1表达量降低引起的尿酸合成困难通路图。ASK1: 凋亡信号调节激酶1; XD/XO: 黄嘌呤氧化酶 |
海-普综合征是白化病综合征中的一种,临床上以眼皮肤白化病症状、出血倾向和组织内蜡样脂质聚积三联症为主要特征。目前,国际上已经报道8种亚型 (HPS1~8)[25]。家蚕d油蚕 (distinct translucent,od)、斑油蚕 (mottled translucent of Var,ov)、青熟油蚕 (aojuku translucent,oa) 3种油蚕突变体分别由溶酶体相关细胞器生物发生复合体1亚基2 (biogenesis of lysosome-related organelles complex-1 subunits 2,BmBLOS2)、肌养素结合蛋白 (Dysbindin,Bmdysb) 和海-普综合征类型5 (Hermansky- Pudluck syndrome type 5,BmHPS5) 基因突变导致 尿酸盐颗粒形成困难,因而蚕体壁透明 (图 1E, F)。 而BmBLOS2和Bmdysb都是编码人类蛋白复合体溶酶体相关细胞器生物发生复合体1 (biogenesis of lysosome-related organelles complex-1,BLOC1) 的亚基BLOS2、dysbindin的同源基因[7, 8],BmHPS5是溶 酶体相关细胞器生物发生复合体2 (biogenesis of lysosome-related organelles complex-2,BLOC2) 的亚基HPS5的同源基因[9]。在人类中BLOC1和BLOC2蛋白复合体异常会引发海-普综合征[25] (表 1),家蚕od、ov和oa突变体都可以作为人类海-普综合征模式动物用于药物筛选。
|
|
表 1 人类和家蚕中海-普综合征类型 |
作为人类病原微生物感染模型及药物筛选近年来,研究者已经尝试把无脊椎动物用作感染性疾病的研究模型。如把秀丽隐杆线虫 (Caenorhabditis elegans) 用于绿脓杆菌感染模型[26]; 黑腹果蝇 (Drosophila melanogaster) 用于大肠杆菌 (Escherichia coli) 感染模型[27]。
2.1 病原细菌感染模型家蚕具有感染金黄色葡萄球菌致病敏感的特点,日本Kaito等[15]利用家蚕的该特点,将100个金黄色葡萄球菌基因突变菌株分别注射入家蚕血淋巴,检测其毒性,发现cvfA、cvfB和cvfC基因突变菌株在家蚕体内毒性较低,并验证cvfA和cvfC突变菌株在小鼠体内毒性也降低。表明cvfA、cvfB和cvfC是金黄色葡萄球菌的毒力基因。Miyazaki等[28]也利用家蚕金黄色酿脓葡萄球菌感染模型,成功地鉴别出细胞壁蛋白clfB、fnbB、sdrC和调控蛋白膜蛋白转肽酶A都是金黄色酿脓葡萄球菌的致毒因子。表明利用家蚕感染人类病原菌鉴定病菌毒力因子是可行的。
2.2 病原真菌感染模型除了病原细菌外,部分人类病原真菌也能感染家蚕。新型隐球菌能引起隐球菌 病(Cryptococcosis) 及隐球菌脑膜炎 (Cryptococcal meningitis),在世界各地均有散发性病例。家蚕在37 ℃条件下饲养,直接将不同致病毒力的新型隐球菌 (血清A型和D型) 注射入家蚕血淋巴,新型隐球菌致病毒力血清A型强于血清D型[18],这与哺乳动物中结果一致[28, 29]。家蚕感染新型隐球菌后,分别用抗真菌药物两性霉素B、氟胞嘧啶或氟康唑和酮康唑处理,都具有治疗效果[18]。表明家蚕新型隐球菌感染模型可以用于抗真菌药物药效的评估。另外,Ueno等[30]利用念珠菌感染家蚕鉴定出念珠菌适应肠道多变环境的一个关键基因细胞色素b2 (cytochrome b2,CYB2),该基因编码乳酸脱氢酶,是念珠菌的一个毒力因子。表明利用真菌感染家蚕来鉴定真菌毒力因子是可行的。
2.3 抗生素药物筛选模型家蚕不仅可以用于病原微生物致病因子的鉴定,在抗生素药物的高通量筛选方面也取得了成功。研究人员为筛选出抑制耐甲氧西林金黄色葡萄球菌的新型抗生素,调查了约1.4万种土壤样品。利用家蚕金黄色葡萄球菌感染模型,筛选体外实验中获得的有抑制耐甲氧西林金黄色葡萄球菌生长作用的2 794种土壤上清液,发现有23种土壤上清液具有治疗效果,筛选效率高达0.8%。后期实验[31]表明,土壤细菌分泌物lysocin E在家蚕体内能够缓解葡萄球菌感染的症状,在小鼠体内也表现出相同的效果。家蚕用于抗生素的高通量筛选,显著降低了实验费用,缩短了筛药周期。
因此,家蚕作为人类病原微生物感染模型,充分发挥了家蚕成本低和致病敏感的优点,适用于病原微生物致病因子的鉴定以及抗生素的筛选。
3 家蚕用于天然免疫激活剂筛选的进展病原微生物无处不在,动物的免疫系统在克服病原微生物感染,维持生命健康这一过程中起着关键的作用。高等动物免疫系统分为先天免疫和后天免疫。先天免疫是抵抗入侵病原微物的第一道屏障。研究表明,哺乳动物和昆虫的先天免疫通路中大部分基因高度保守[32]。昆虫具有相对简单的生理系统,由于缺乏抗体生成器官,它们仅仅依靠先天免疫抵抗外源物质入侵,这使得昆虫成为适合研究先天免疫的动物模型。Toll在抵抗病原微生物入侵的过程中发挥着重要作用,果蝇中toll的发现无疑是最具代表的昆虫免疫导向性研究。基于该项研究,人类中的toll样受体家族才被鉴定出来[33]。因此,利用昆虫作为动物模型来研究人类先天免疫的潜在调控机制在医疗以及传染病药物发展方面尤为重要。
在家蚕中,激活先天性免疫应答除了toll外,麻痹肽 (paralytic peptide,PP) 也起着重要作用。激活先天性免疫应答伴随着麻痹肽前体转化为成熟的麻痹肽,成熟的麻痹肽能够导致家蚕产生缓慢的肌肉收缩反应[34]。Fujiyuki等[35]将家蚕中的肌肉收缩反应与先天免疫应激联系起来,建立起可以量化免疫激活剂活性的家蚕幼虫肌肉收缩实验。
地衣类植物石耳 (Gyrophoraesculenta) 提取物β-葡聚糖 (GE-3),能够诱导家蚕幼虫产生肌肉收缩反应。家蚕血淋巴与GE-3共孵育后,免疫印迹分析表明,GE-3处理组有成熟的麻痹肽产生。后期生存实验中,GE-3能够很好地缓解杆状病毒感染家蚕的病情。推测GE-3可能是通过激活家蚕先天免疫应答产生麻痹肽,从而产生肌肉收缩反应[35]。除了GE-3外,在哺乳动物细胞中具有免疫激活作用的酵母β-1,6-葡聚糖、岩藻多糖、凝胶多糖以及绿茶提取物均能激活家蚕先天免疫应答[35, 36]。
从以上研究看到了家蚕作为天然免疫激活剂筛选的模式动物的可能,希望家蚕活体实验能够弥补哺乳动物细胞筛选天然免疫激活剂的缺陷 (药物的吸收、分配、代谢以及不良反应)。
4 家蚕在药物药效、药代动力学及安全性评价方面具有潜在价值 4.1 家蚕在药物药效评价上的潜力痛风是由单钠尿酸盐 (monosodium urate,MSU) 沉积所致的晶体相关性关节病,与嘌呤代谢紊乱或尿酸排泄减少所致的高尿酸血症直接相关[37, 38]。家蚕中的嘌呤代谢途径与人类的相似,其代谢终产物均为尿酸[39]。家蚕中尿酸盐颗粒沉积在真皮层,这使得其体表呈现白色; 用痛风药物处理家蚕后,真皮层的尿酸盐颗粒沉积减少,使体表由白色逐渐转为透明,药物效果可从家蚕表皮颜色 (透明度) 变化直接观察到。因此,家蚕被认为是天然的痛风药物药效评估模型[40]。
Ⅱ型糖尿病是由胰岛素耐受或胰岛素分泌异常导致的,全世界患糖尿病的人群不断扩大,市场急需快速开发出更有效的治疗糖尿病药物。Zhang等[41]在家蚕中发现有25个基因与人类糖尿病相关基因同源,并用RNA干扰的方法,降低与糖尿病相关的胰岛素受体基因 (insulin receptor,INSR) 的表达。干扰后第6天,INSR mRNA水平降低至对照组的4%,并且家蚕INSR RNAi组出现体色变黑,体重显著低于对照组的现象,这些表型与糖尿病患者相似。长期用高葡萄糖含量的饲料饲喂家蚕,也建立起家蚕高血糖模型。该高血糖模型具有血糖、血脂高、胰岛素敏感性以及葡萄糖耐受性低的特点。用降血糖药物 (人类胰岛素、二甲双胍或吡格列酮) 处理该高血糖家蚕,能恢复其血糖含量以及葡萄糖耐受性[42, 43]。以上研究表明家蚕具有作为糖尿病疾病模型和用于糖尿病药物药效评估的潜力。
延缓衰老、延长寿命,一直是人们追求的梦想。市场上很多保健类中药以“延年益寿”的卖点而得到人们的追捧。在这种热潮中,出现鱼龙混杂的现象也在所难免。利用模式动物实现对保健类中药药效的快速评价十分必要。红景天具有抗衰老,保护神经的功能[44]。Chen等[45, 46]以家蚕为实验动物,测定红景天制剂的药效,发现红景天制剂饲喂家蚕后,平均寿命延长2.7%,抗高温 (37 ℃)、耐饥饿能力增强,机体部分抗氧化物酶活性升高 (如谷胱甘肽S转移酶和过氧化氢酶)。以红景天制剂添食家蚕,其延长寿命,增强机体抗氧化能力药效实验结果与其在其他模式动物上的实验效果一致[47, 48],表明家蚕可以用于保健中药药效的评价。
4.2 家蚕用于药代动力学分析4-甲基伞形花内酯 (4-methyl umbelliferone) 添食家蚕,检测它在家蚕体内的代谢情况,发现4-甲基伞形花内酯在家蚕幼虫体内血淋巴中与葡萄糖结合,半衰期为 (7.0 ± 0.1) min[49],这些都与小鼠相似[50]。Asami等[51]通过向家蚕中肠注射橙皮提取物,用高效液相色谱比较分析家蚕血液,从而鉴定植物提取物经肠代谢吸收后稳定存在于体液中的化学物质。结果表明,川皮苷、甲氧基黄酮和桔皮素这3种物质都稳定存在于家蚕血液。同时,小鼠消化橘皮提取物后血液中也稳定存在着这3种物质[52, 53, 54]。表明这些植物提取物在家蚕和哺乳动物中的代谢过程相似,家蚕也适用于药代动力学研究。
4.3 家蚕用于药物安全性评价在药物筛选过程中,利用模式动物检测药物安全性是一个长期的实验过程。临床前对候选药物安全性的长期评估十分重要,但大量的哺乳动物用于健康风险高的毒理学研究不仅费用高、周期长,还承受着巨大的道德伦理压力。用低等动物代替高等动物用于基础研究,符合动物实验的“3R”原则中的替代 (replacement) 原则[55]。用昆虫进行化学药物的毒力测试也引起了关注,家蚕是一个很好的候选。
在哺乳动物中具有肝毒性的药物,如苯甲酸类化合物、硫酸铁、丙戊酸钠、四环素、盐酸胺碘酮、酮康唑、匹莫林以及降血压药物甲基多巴,都能不同程度地增加家蚕各个组织丙氨酸转氨酶 (alanine aminotransferase,ALT) 的活性[56]。血液中ALT含量是肝组织损伤程度的生理指标[57]。利用家蚕来评价药物对组织损伤程度有一些初步进展,包括: ① 组织氧化损伤的评价模式,通过组织中活性氧类 (reactive oxygen species,ROS) 含量和抗氧化物酶的活性来反映组织氧化损伤程度[58]。② 通过观察测定家蚕血细胞和包囊细胞 (作用类似于哺乳动物白血球) 的形态和数量,确定血淋巴损伤程度[59]。
综上,家蚕可用于药物药效、药代动力学及安全性评估。这些研究为推动家蚕成为药物筛选模式动物奠定了基础。
5 家蚕作为人类疾病模型用于药物筛选以及疾病致病机制研究的展望基于家蚕中已有的一些人类疾病模型,家蚕作为人类疾病模型用于药物筛选以及疾病致病机制研究指日可待。如何将已解析清楚的家蚕人类疾病模型应用到高通量药物筛选上,是今后努力的方向。家蚕资源丰富,通过解析更多的突变体,建立更多的家蚕人类疾病模型,必然能为人类疾病致病机制研究做出更多的贡献。同时,快速发展的基因编辑技术可以加快人为构建家蚕人类疾病模型的进程。科学家们用模式生物果蝇研究人类肿瘤已取得瞩目的成果,如把果蝇复眼RET原癌基因突变导致的多发性内分泌腺肿瘤病2A型用于药效的评估,发现酪氨酸激酶抑制剂ZD6474能够有效地抑制该肿瘤的生长[60]。相比于果蝇,家蚕个体更便于组织病变观察,如果在家蚕中敲除与人类同源的抑癌基因,构建家蚕癌症模型,在癌症致病机制及治疗癌症的药物筛选上将具有巨大的潜力。
耐药菌日益肆虐而抗生素研发缓慢,这种境况堪忧。家蚕人类病原微生物感染模型用于低成本、高通量筛选抗生素,可为处于困境中的抗生素研发提供新思路。家蚕不仅在高通量药物筛选中具有明显的优势,而且用于具体药物药效的评估方面也有广阔的前景。中药一直以来都饱受争议,鉴定中药具体活性成分,明确药理,是中药适应市场所必须解决的问题。利用家蚕生命周期短、易于大批量饲养的特点,可快速高效地初步测定中药药效。
在推动家蚕成为新型疾病模型的同时,研究者也要正视家蚕并不可能完全替代哺乳动物在疾病模型和药物筛选中的重要地位的事实。家蚕是无脊椎动物,与人类的身体构造以及生理过程相差甚远,家蚕缺少人类中的组织类型如软骨、骨骼和血管。家蚕的心侧体和脂肪体具备哺乳动物胰腺、肝脏和脂肪的功能,但却又与它们有很大的不同。另外在家蚕中发现的人类疾病模型还比较少。基于这些原因,人们质疑家蚕作为人类疾病模型是否恰当,这是可以理解的。然而,越来越多的研究已表明,家蚕看作一个相对简易而又具有较高复杂度的生物体,将其用来研究与人类保守的疾病信号通路中的致病机制,以及用于初步的药物筛选,评价药效和药物毒副作用的方案是可以采纳的,更有利于缩短实验周期和降低实验成本。总之,合理、高效地利用家蚕遗传资源很可能开创药物筛选领域的新局面。
| [1] | Xia Q, Zhou Z, Lu C, et al. A draft sequence for the genome of the domesticated silkworm (Bombyx mori)[J]. Science, 2004, 306:1937-1940. |
| [2] | Xia Q, Wang J, Zhou Z, et al. The genome of a lepidopteran model insect, the silkworm Bombyx mori[J]. Insect Biochem Mol Biol, 2008, 38:1036-1045. |
| [3] | Xia Q, Guo Y, Zhang Z, et al. Complete resequencing of 40 genomes reveals domestication events and genes in silkworm (Bombyx)[J]. Science, 2009, 326:433-436. |
| [4] | Fujii T, Abe H, Kawamoto M, et al. Albino (al) is a tetrahydrobiopterin (BH4)-deficient mutant of the silkworm Bombyx mori[J]. Insect Biochem Mol Biol, 2013, 43:594-600. |
| [5] | Liang PF. Positional Cloning of Albino (al) Mutant and Its Formation Mechanism in Silkworm, Bombyx mori (家蚕白化突变(al)的定位克隆及其形成机制研究)[D]. Chongqing:Southwest University, 2014. |
| [6] | Tabunoki H, Ono H, Ode H, et al. Identification of key uric acid synthesis pathway in a unique mutant silkworm Bombyx mori model of Parkinson's disease[J]. PLoS One, 2013, 8:e69130. |
| [7] | Wang L, Kiuchi T, Fujii T, et al. Reduced expression of the dysbindin-like gene in the Bombyx mori ov mutant exhibiting mottled translucency of the larval skin[J]. Genome, 2013, 56:101-108. |
| [8] | Fujii T, Daimon T, Uchino K, et al. Transgenic analysis of the BmBLOS2 gene that governs the translucency of the larval integument of the silkworm, Bombyx mori[J]. Insect Mol Biol, 2010, 19:659-667. |
| [9] | Fujii T, Banno Y, Abe H, et al. A homolog of the human Hermansky-Pudluck syndrome-5(HPS5) gene is responsible for the oa larval translucent mutants in the silkworm, Bombyx mori[J]. Genetica, 2012, 140:463-468. |
| [10] | Kurokawa K, Kaito C, Sekimizu K. Two-component signaling in the virulence of Staphylococcus aureus:a silkworm larvaepathogenic agent infection model of virulence[J]. Method Enzymol, 2007, 422:233-244. |
| [11] | Fujiyuki T, Imamura K, Hamamoto H, et al. Evaluation of therapeutic effects and pharmacokinetics of antibacterial chromogenic agents in a silkworm model of Staphylococcus aureus infection[J]. Drug Discov Ther, 2010, 4:349-354. |
| [12] | Uchida R, Iwatsuki M, Kim YP, et al. Nosokomycins, new antibiotics discovered in an in vivo-mimic infection model using silkworm larvae. I:Fermentation, isolation and biological properties[J]. J Antibiot, 2010, 63:151-155. |
| [13] | Hamamoto H, Urai M, Paudel A, et al. Identification of novel therapeutically effective antibiotics using silkworm infection model[J]. Yakugaku Zasshi, 2012, 132:79-84. |
| [14] | Takemura-Uchiyama I, Uchiyama J, Kato S, et al. Evaluating efficacy of bacteriophage therapy against Staphylococcus aureus infections using a silkworm larval infection model[J]. FEMS Microbiol Lett, 2013, 347:52-60. |
| [15] | Kaito C, Kurokawa K, Matsumoto Y, et al. Silkworm pathogenic bacteria infection model for identification of novel virulence genes[J]. Mol Microbiol, 2005, 56:934-944. |
| [16] | Chieda Y, Iiyama K, Yasunaga-Aoki C, et al. Pathogenicity of gacA mutant of Pseudomonas aeruginosa PA01 in the silkworm, Bombyx mori[J]. FEMS Microbiol Lett, 2005, 244:181-186. |
| [17] | Hamamoto H, Kurokawa K, Kaito C, et al. Quantitative evaluation of the therapeutic effects of antibiotics using silkworms infected with human pathogenic microorganisms[J]. Antimicrob Agents Chemother, 2004, 48:774-779. |
| [18] | Matsumoto Y, Miyazaki S, Fukunaga DH, et al. Quantitative evaluation of cryptococcal pathogenesis and antifungal drugs using a silkworm infection model with Cryptococcus neoformans[J]. J Appl Microbiol, 2012, 112:138-146. |
| [19] | Dai FY. Study on Heredity of Mutants and Near Isogenic Lines in Silkworm, Bombyx mori (家蚕突变基因的遗传与近等位基因系研究)[D]. Chongqing:Southwest University, 2008. |
| [20] | Blau N, Bonafé L, Thöny B. Tetrahydrobiopterin deficiencies without hyperphenylalaninemia:diagnosis and genetics of dopa-responsive dystonia and sepiapterin reductase deficiency[J]. Mol Genet Metab, 2001, 74:172-185. |
| [21] | Bonafé L, Thöny B, Penzien JM, et al. Mutations in the sepiapterin reductase gene cause a novel tetrahydrobiopterindependent monoamine-neurotransmitter deficiency without hyperphenylalaninemia[J]. Am J Hum Genet, 2001, 69:269-277. |
| [22] | Friedman J, Roze E, Abdenur JE, et al. Sepiapterin reductase deficiency:a treatable mimic of cerebral palsy[J]. Ann Neurol, 2012, 71:520-530. |
| [23] | Meng Y, Katsuma S, Daimon T, et al. The silkworm mutant lemon (lemon lethal) is a potential insect model for human sepiapterin reductase deficiency[J]. J Biol Chem, 2009, 284:11698-11705. |
| [24] | Zhong L. The Links Between Parkinson's Clinic Features and Serological Levels of Lipid and Urate (帕金森病临床特征与血脂、血尿酸水平的相关性研究)[D]. Chongqing:Chongqing Medical University, 2014. |
| [25] | Wei ML. Hermansky-Pudlak syndrome:a disease of protein trafficking and organelle function[J]. Pigment Cell Res, 2006, 19:19-42. |
| [26] | Mahajan-Miklos S, Tan MW, Rahme LG, et al. Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model[J]. Cell, 1999, 96:47-56. |
| [27] | Rämet M, Manfruelli P, Pearson A, et al. Functional genomic analysis of phagocytosis and identification of a Drosophila receptor for E. coli[J]. Nature, 2002, 416:644-648. |
| [28] | Miyazaki S, Matsumoto Y, Sekimizu K, et al. Evaluation of Staphylococcus aureus virulence factors using a silkworm model[J]. FEMS Microbiol Lett, 2012, 326:116-124. |
| [29] | Lin X, Nielsen K, Patel S, et al. Impact of mating type, serotype, and ploidy on the virulence of Cryptococcus neoformans[J]. Infect Immun, 2008, 76:2923-2938. |
| [30] | Ueno K, Matsumoto Y, Uno J, et al. Intestinal resident yeast Candida glabrata requires Cyb2p-mediated lactate assimilation to adapt in mouse intestine[J]. PLoS One, 2011, 6:e24759. |
| [31] | Hamamoto H, Urai M, Ishii K, et al. Lysocin E is a new antibiotic that targets menaquinone in the bacterial membrane[J]. Nat Chem Biol, 2015, 11:127-133. |
| [32] | Hoffmann JA, Reichhart JM. Drosophila innate immunity:an evolutionary perspective[J]. Nat Immunol, 2002, 3:121-126. |
| [33] | Nomura N, Nagase T, Miyajima N, et al. Prediction of the coding sequences of unidentified human genes. Ⅱ. The coding sequences of 40 new genes (KIAA0041-KIAA0080) deduced by analysis of cDNA clones from human cell line KG-1(supplement)[J]. DNA Res, 1994, 1:251-262. |
| [34] | Ishii K, Hamamoto H, Kamimura M, et al. Activation of the silkworm cytokine by bacterial and fungal cell wall components via a reactive oxygen species-triggered mechanism[J]. J Biol Chem, 2008, 283:2185-2191. |
| [35] | Fujiyuki T, Hamamoto H, Ishii K, et al. Evaluation of innate immune stimulating activity of polysaccharides using a silkworm (Bombyx mori) muscle contraction assay[J]. Drug Discov Ther, 2012, 6:88-93. |
| [36] | Dhital S, Hamamoto H, Urai M, et al. Purification of innate immunostimulant from green tea using a silkworm muscle contraction assay[J]. Drug Discov Ther, 2011, 5:18-25. |
| [37] | Schlesinger N. Diagnosis of gout:clinical, laboratory, and radiologic findings[J]. Am J Manag Care, 2005, 11:S443-S450. |
| [38] | Schlesinger N. Diagnosis of gout[J]. Minerva Med, 2007, 98:759-767. |
| [39] | Hayashi Y. Xanthine dehydrogenase in the silkworm, Bombyx mori L.[J]. Nature, 1960, 186:1053-1054. |
| [40] | Zhang X, Xue R, Cao G, et al. Silkworms can be used as an animal model to screen and evaluate gouty therapeutic drugs[J]. J Insect Sci, 2012, 12:4. |
| [41] | Zhang Z, Teng XL, Chen MH, et al. Orthologs of human disease associated genes and RNAi analysis of silencing insulin receptor gene in Bombyx mori[J]. Int J Mol Sci, 2014, 15:18102-18116. |
| [42] | Matsumoto Y, Sumiya E, Sugita T, et al. An invertebrate hyperglycemic model for the identification of anti-diabetic drugs[J]. PLoS One, 2011, 6:e18292. |
| [43] | Matsumoto Y, Ishii M, Hayashi Y, et al. Diabetic silkworms for evaluation of therapeutically effective drugs against type Ⅱ diabetes[J]. Sci Rep, 2015, 5:10722. |
| [44] | Chen YN, Liu H, Zhao HB, et al. Salidroside via ERK1/2 and PI3K/AKT/mTOR signal pathway induces mouse bone marrow mesenchymal stem cells differentiation into neural cells[J]. Acta Pharm Sin (药学学报), 2013, 48:1247-1252. |
| [45] | Chen C. The Effect of Rhodiola on Lifespan of Silkworm and Preliminary Research on Molecular Mechanism (红景天对家蚕寿命的影响及其机制初探)[D]. Chongqing:Southwest University, 2014. |
| [46] | Chen C, Song JB, Chen M, et al. Rhodiola rosea extends lifespan and improves stress tolerance in silkworm, Bombyx mori[J]. Biogerontology, 2016, 17:373-381. |
| [47] | Wiegant FA, Surinova S, Ytsma E, et al. Plant adaptogens increase lifespan and stress resistance in C. elegans[J]. Biogerontology, 2009, 10:27-42. |
| [48] | Schriner SE, Lee K, Truong S, et al. Extension of Drosophila lifespan by Rhodiola rosea through a mechanism independent from dietary restriction[J]. PLoS One, 2013, 8:e63886. |
| [49] | Hamamoto H, Tonoike A, Narushima K, et al. Silkworm as a model animal to evaluate drug candidate toxicity and metabolism[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2009, 149:334-339. |
| [50] | Chen J, Pang KS. Effect of flow on first-pass metabolism of drugs:single pass studies on 4-methylumbelliferone conjugation in the serially perfused rat intestine and liver preparations[J]. J Pharmacol Exp Ther, 1997, 280:24-31. |
| [51] | Asami Y, Horie R, Hamamoto H, et al. Use of silkworms for identification of drug candidates having appropriate pharmacokinetics from plant sources[J]. BMC Pharmacol, 2010, 10:7. |
| [52] | Li S, Sang S, Pan MH, et al. Anti-inflammatory property of the urinary metabolites of nobiletin in mouse[J]. Bioorg Med Chem Lett, 2007, 17:5177-5181. |
| [53] | Nielsen SE, Breinholt V, Cornett C, et al. Biotransformation of the citrus flavone tangeretin in rats. Identification of metabolites with intact flavane nucleus[J]. Food Chem Toxicol, 2000, 38:739-746. |
| [54] | Yasuda T, Yoshimura Y, Yabuki H, et al. Urinary metabolites of nobiletin orally administered to rats[J]. Chem Pharm Bull, 2003, 51:1426-1428. |
| [55] | Flecknell P. Replacement, reduction and refinement[J]. ALTEX, 2002, 19:73-78. |
| [56] | Inagaki Y, Matsumoto Y, Kataoka K, et al. Evaluation of drug-induced tissue injury by measuring alanine aminotransferase (ALT) activity in silkworm hemolymph[J]. BMC Pharmacol Toxicol, 2012, 13:13. |
| [57] | Yoon SY, Kim CY, Han HJ, et al. Protective effect of ischemic postconditioning against hepatic ischemic reperfusion injury in rat liver[J]. Ann Surg Treat Res, 2015, 88:241-245. |
| [58] | Shi GQ, Zhang Z, Jia KL, et al. Characterization and expression analysis of peroxiredoxin family genes from the silkworm Bombyx mori in response to phoxim and chlorpyrifos[J]. Pestic Biochem Physiol, 2014, 114:24-31. |
| [59] | Liu T, Xing R, Zhou YF, et al. Hematopoiesis toxicity induced by CdTe quantum dots determined in an invertebrate model organism[J]. Biomaterials, 2014, 35:2942-2951. |
| [60] | Vidal M, Wells S, Ryan A, et al. ZD6474 suppresses oncogenic RET isoforms in a Drosophila model for type 2 multiple endocrine neoplasia syndromes and papillary thyroid carcinoma[J]. Cancer Res, 2005, 65:3538-3541. |
 2016, Vol. 51
2016, Vol. 51


