2. 江西中医药大学基础医学院转化医学中心, 江西南昌 330004
2. Centre for Translation Medicine, School of Basic Medical Sciences, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
白木香Aquilaria sinensis (Lour) Gilg,属瑞香科沉香属植物,是我国生产名贵芳香类药材沉香的唯一正品植物来源,现已被列为国家二级重点保护野生植物; 主要分布于海南、广东、广西、福建、云南和台湾等地。沉香是我国、日本、印度以及其他东南亚国家名贵的传统中药材和天然香料,此外在宗教方面的应用也十分广泛。白木香是一种典型的伤害诱导型药用植物,只有受到外界伤害时,才能在伤口及周围木质部产生倍半萜等沉香类物质[1, 2],同时有研究表明沉香的产生是白木香树防御反应的产物[3]。沉香的化学成分组成主要是倍半萜类和苯乙基色酮类衍生物质[4, 5]。研究表明,茉莉酸 (JA) 与沉香倍半萜的形成有关[6, 7, 8],但JA是否直接参与调控白木香防御反应产生沉香倍半萜的机制至今未得到证实。
茉莉酸类物质 (JAs) 是植物体内一种重要的植物激素,同时也是植物在生物或非生物胁迫下抵御逆境产生的一类重要信号分子,通过激活相关转录因子的活性,调节植物的防御反应[9, 10, 11]。MYC类转录因子,是植物JAs响应途径中的核心转录因子。在已发现的植物MYC类转录因子中,MYC2是研究最为深入的一个。在模式植物拟南芥中,MYC2通过形成COI1-JAZ-MYC2复合物发挥调控作用,MYC2转录因子蛋白与JA响应基因DNA结合,调控基因的表达,从而调控相应次生代谢物的合成。例如,MYC2转录因子与DELLA蛋白互作,调控拟南芥倍半萜合酶基因TPS21和TPS11的表达,合成相应的倍半萜类化合物[12]; 烟草MYC2转录因子NtMYC2a和NtMYC2b能调控尼古丁合成关键基因腐胺-N-甲基转移酶 (PMT) 基因的表达[13]。此外,MYC2转录因子还参与JA、ABA等激素信号的转导过程[14, 15, 16, 17]。可见,MYC2转录因子在植物JA信号转导途径中的重要性。
本实验首次报道了白木香AsMYC2基因原核表达载体的构建,重组蛋白的表达及纯化,为制备多克隆抗体、筛选互作蛋白因子和研究基因功能提供了材料基础,为揭示JA信号在沉香倍半萜形成中的作用机制奠定基础。
材料与方法 植物材料4年生白木香树 (中国医学科学院药用植物研究所玻璃温室),于2014年4月份采集白木香的根、茎、叶和枝,每一样品取3株,每一株各取3个重复混样,共3个生物学重复。
菌种及载体原核表达载体pGEX-4T-1保存于本实验室; 大肠杆菌TPO10感受态、pGM-T连接试剂盒和E. coli BL21 (DE3) 购于天根生化科技 (北京) 有限公司。
工具酶及主要试剂植物总RNA提取试剂盒、Fast HiFidelity Polymerase高保真酶、T4连接酶和2×Taq PCR Mix购于天根生化科技 (北京) 有限公司。限制性内切酶BamH Ι和Xho I购自日本TaKaRa公司; RevertAid First Strand cDNA Synthesis Kit购于ThermoFisher Scientific公司; 高纯度质粒提取试剂盒、高灵敏度化学发光检测试剂盒 (eECL Western Blot Kit) 和抗GST标签抗体购自北京康为世纪生物科技有限公司; IPTG、氨苄青霉素 (Amp) 和DNA Ladder Marker购自北京全式金有限公司; 谷胱甘肽亲和介质 (GST QZT 4FF) 购自国家生化工程技术研究中心 (北京)。其他试剂均为国产分析纯试剂。本研究所用引物由上海生工生物工程股份有限公司合成,产物测序由英潍捷基贸易有限公司完成。
白木香总RNA提取及cDNA的合成根据天根生化科技 (北京) 有限公司的植物总RNA提取试剂盒说明书提取总RNA,利用1% 琼脂糖电泳检测RNA的完整性和分光光度计NanoDrop 2000 (Thermo Scientific,美国) 测定RNA浓度。利用RevertAid First Stran d cDNA Synthesis Kit (ThermoFisher Scientific公司) 反转录成cDNA第一链,作为基因克隆的模板。
AsMYC2基因扩增根据提交到NCBI上的白木香AsMYC2基因序列 (KP677282) 设计特异引物,上游引物加入BamHΙ酶切位点: 5'-CGGGATCCATGA CCGATTACAGGCTCCC-3',下游引物加入XhoI酶 切位点: 5'-CCGCTCGAGTTACCTTGCATCCCCCAC TTTG-3',加下划线部分即为引入的酶切序列。以白木香cDNA 为模板进行PCR扩增。PCR体系: 快速高产聚合酶0.5 μL、5×快速高产PCR 缓冲液5 μL、dNTP Mixture (2.5 mmol·L-1) 2 μL、上下游引物 (10 μmol·L-1) 各1 μL、cDNA 1.0 μL、ddH2O 14.5 μL,终体系为25 μL。PCR反应程序: 94 ℃预变性5 min; 94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸2 min,30个循环; 72 ℃延伸10 min; 4 ℃保存。PCR产物经1.0%琼脂糖凝胶电泳检测后,回收并纯化目的DNA片段,并与pGM-T克隆载体连接,转化E. coli TOP10感受态细胞,在含有X-gal和IPTG的Amp (100 μg·mL-1) 平板上进行蓝白斑筛选,挑取白斑振荡培养过夜,经菌液PCR验证后,送测序确定阳性克隆 (pGM-4T- AsMYC2)。
原核表达载体pGEX-4T-1-AsMYC2的构建将经测序目的基因序列正确的pGM-4T-AsMYC2重组质粒和pGEX-4T-1载体质粒分别用BamHΙ和XhoI进行双酶切,回收目的片段后,利用T4连接酶16 ℃连接过夜,将连接产物转化E. coli TOP10后,均匀 涂布在含有Amp (80 μg·mL-1) 的LB固体培养基中,37 ℃倒置培养12~16 h。经菌液PCR和酶切鉴定为阳性的pGEX-4T-1-AsMYC2质粒转化到E. coli BL21 (DE3) 中进行表达。
AsMYC2基因的原核表达将含有重组质粒pGEX-4T-1-AsMYC2的E. coli BL21 (DE3) 阳性克隆振荡培养过夜,菌液以1∶50比例稀释于含有Amp (80 μg·mL-1) 的LB液体培养基中,37 ℃培养至OD600 ≈ 0.6时,加入IPTG至终浓度为1 mmol·L-1,继续培养4 h,离心收集菌体,经1×PBS样品缓冲液重悬,反复冻融4~5次充分裂解菌体,沸水煮5 min使蛋白变性后,10% SDS-PAGE电泳检测分析。
表达条件的优化将过夜培养新鲜的pGEX-4T- 1-AsMYC2的E. coli BL21 (DE3) 菌液以1∶100的体积接种到含有Amp的LB液体培养基中,37 ℃培养至OD600约为0.5时,分别加入IPTG至终浓度为0.05、0.1、0.25、0.5、1和1.5 mmol·L-1,37 ℃以200 r·min-1振荡培养4 h,10% SDS-PAGE电泳分析。
重组蛋白表达形式的鉴定诱导结束后,低温条件下5 000 r·min-1离心10 min,收集菌体。加入适量1×PBS缓冲液重悬菌体,冰水浴超声破碎菌体,13 000 r·min-1离心15 min,分别收集上清液和沉淀,进行10% SDS-PAGE电泳检测分析。
重组蛋白的纯化采用16 ℃低温,IPTG终浓度为0.1 mmol·L-1诱导12~18 h,低温离心收集菌体,冰水浴超声破碎菌体,收集上清液。按照国家生化工程技术研究中心 (北京) 谷胱甘肽亲和介质 (GST QZT 4FF) 纯化程序,纯化目的蛋白。装柱: 加入1~3 mL GSH亲和介质,静置5~30 min,待介质沉降 完全后,加入5倍柱体积的平衡缓冲液 (50mmol·L-1 Tris-HCl + 0.15 mol·L-1 NaCl,pH 8.0) 平衡层析柱,至流出液电导和pH不变; 进料: 将裂解上清液上柱; 淋洗: 上样完毕后,继续用平衡缓冲液淋洗至基线; 洗脱: 用洗脱缓冲液 (50 mmol·L-1 Tris-HCl + 10 mmol·L-1 GSH,pH 8.0) 洗脱,收集流出液,利用SDS-PAGE电泳及后续的Western blotting 分析蛋白的纯度。
Western blotting鉴定表达蛋白按照Western blotting方法,将纯化的蛋白进行SDS-PAGE电泳,200 mA恒流转移2 h到PVDF膜上,1×TBST洗膜 3次,每次10 min,用5% 的脱脂牛奶4 ℃低温封闭 4 h,用鼠源的GST多克隆抗体于4 ℃孵育过夜。次日,用1×TBST洗膜3次,每次10 min,鼠二抗 (1∶ 1 000) 室温孵育1 h后,用1×TBST洗膜3次,每 次10 min,ECL显色,化学发光成像仪 (ImageQuant LAS 4 000 mini) 成像,并保存。
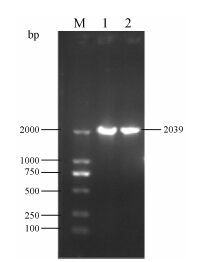
结果与分析 1 原核表达载体的构建及鉴定PCR扩增产物经1% 琼脂糖凝胶电泳鉴定,在 2 039 bp处出现一条特异性DNA条带,与预期大小符合,如图 1所示。
|
Figure 1 Cloning of AsMYC2 gene from A. sinensis. M: DL2000 DNA marker; 1,2: PCR products |
pGEX-4T-1-AsMYC2的连接产物转入E. coli BL21(DE3) 中,进行菌液PCR扩增,经琼脂糖凝胶电泳检测,能够清晰地看到一条约为2 039 bp的条带。经菌液PCR鉴定为阳性的克隆,提取重组子质粒进行双酶切鉴定,可见一条大小符合的DNA目的条带。将菌液PCR和双酶切鉴定为阳性克隆的质粒送测序,测序结果显示基因的编码区序列完全正确,表明目的片段已正确插入pGEX-4T-1表达载体中。
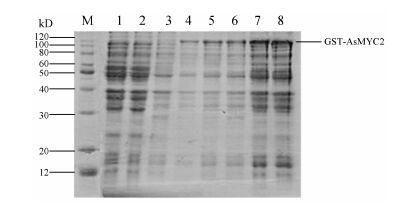
2 重组蛋白的诱导表达将表达载体pGEX-4T-1转入BL21 (DE3) 中作为对照,同时诱导含有pGEX-4T-1-AsMYC2和pGEX- 4T-1的BL21 (DE3)。为增加蛋白的表达量,设置了6个不同的IPTG诱导浓度,分别为0.05、0.1、0.25、0.5、1和1.5 mmol·L-1,诱导培养4 h,收集菌体,加上样缓冲液煮沸5 min后,经10% SDS-PAGE电泳分析。如图 2所示,含pGEX-4T-1空载体的质粒无特异蛋白出现,含有重组质粒pGEX-4T-1-AsMYC2的菌体经IPTG诱导后,在100 kD处出现1条特异蛋白条带; 随着IPTG诱导浓度的增加,蛋白的表达量随着减少,当其终浓度为0.1 mmol·L-1时,融合蛋白表达量最大。本实验独立重复3次,结果一致。
|
Figure 2 Induced AsMYC2 gene expression results with different IPTG concentrations. M: Protein marker; 1: IPTG-induced E. coli BL21 (DE3) transformed with pGMT-4T-1mock-vector; 2: E. coli BL21 (DE3) transformed with pGEX-4T-1-AsMYC2; 3-8: IPTG- induced E. coli BL21 (DE3) transformed with pGEX-4T-1-AsMYC2 (1.5,1,0.5,0.25,0.1,0.05 mmol·L-1) |
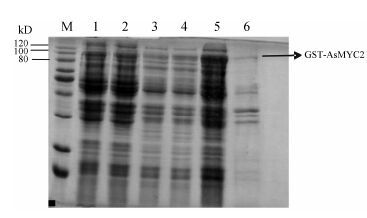
菌体超声破碎后,分别收集上清液和沉淀,SDS- PAGE电泳分析,上清液中有明显的蛋白特异条带,沉淀中的特异条带较弱,表明重组蛋白主要是可溶性蛋白存在于上清液中 (图 3)。
|
Figure 3 Expression profile analysis of GST-AsMYC2 fusion protein. M: Protein marker; 1: E. coli BL21 (DE3) transformed with pGMT-4T-1mock-vector; 2: IPTG-induced E. coli BL21 (DE3) transformed with pGMT-4T-1mock-vector; 3,4: IPTG- inducedE. coli BL21 (DE3) transformed with pGEX-4T-1- AsMYC2; 5: Supernate: IPTG-induced E. coli BL21 (DE3) transformed with pGEX-4T-1-AsMYC2; 6: Precipitate: IPTG-induced E. coli BL21 (DE3) transformed with pGEX-4T-1-AsMYC2 |
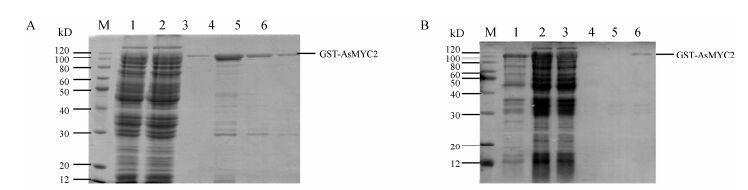
重组工程菌经诱导表达,超声破碎菌体后收集上清液,上清液经谷胱甘肽亲和层析纯化后,纯化后的AsMYC2-GST融合蛋白,经SDS-PAGE检测。如图 4A所示,目的蛋白条带明显,但非特异性蛋白条带较多。为了提高目的蛋白的纯度,对蛋白纯化的方法进行了优化。在目的蛋白洗脱之前,在淋洗液中加入2 mmol·L-1 GSH,结果如图 4B所示,减少了非特异性蛋白,提高了目的蛋白的纯度。
|
Figure 4 GST-AsMYC2 fusion protein purification. M: Protein marker; (A): 1,2: IPTG-inducedE. coli BL21 (DE3) transformed with pGEX-4T-1-AsMYC2; 3: Effluent after sampling; 4-6: Eluate washing out with 10 mmol·L-1 GSH (first,second,third). (B): 1: Supernate: IPTG-induced E. coli BL21 (DE3) transformed with pGEX-4T-1-AsMYC2; 2,3: IPTG-induced E. coli BL21 (DE3) transformed with pGEX-4T-1-AsMYC2; 4,5: Eluent; 6,7: Eluate washing out with 10 mmol·L-1 GSH (first,second) |
为了更准确鉴定所纯化的蛋白是GST-AsMYC2的融合蛋白,利用GST标签蛋白的相应抗体进行检测。经检测证实该融合蛋白可与GST多克隆抗体发生特异性结合,结果如图 5所示。大约在100 kD位置有清晰的目的条带。

|
Figure 5 GST-AsMYC2 protein verification by Western blotting. M: Protein marker; 1: GST-AsMYC2 fusion protein |
对AsMYC2基因在非胁迫条件下不同组织中的表达水平进行了分析,结果表明,表达量最高的组织是茎,其次是根,最低的是枝和叶 (图 6)。在白木香中,沉香形成的主要部位是茎和根。AsMYC2表达的主要部位与沉香形成的部位一致,这一结果表明AsMYC2与沉香的形成有可能有一定的关系,但是它们之间是否有直接的关系还需要更进一步的证实。

|
Figure 6 Tissue expression analysis of A. sinensis AsMYC2 |
MYC类转录因子是植物茉莉酸类激素途径中的核心转录因子。在现已发现的MYC类转录因子中,MYC2是研究最为深入的一个。MYC2转录因子在茉莉酸类激素刺激响应过程中处于核心调控的位置,直接调控下游响应基因的表达。本研究通过基因重组技术获得了白木香AsMYC2基因的原核表达载体,并在大肠杆菌中成功表达了带GST标签的AsMYC2融合蛋白; 此外,建立了较好的蛋白纯化方法,获得了高纯度的融合蛋白GST-AsMYC2。
本研究所使用的宿主菌株E. coli BL21 (DE3) 是一个广泛用于表达外源蛋白的菌株。对于外源基因的诱导表达受IPTG浓度、诱导温度、诱导时间、pH值和密码子偏好性等的影响。首先,诱导温度的高低直接影响到蛋白表达成功与否,以及影响所表达蛋白的溶解性。37 ℃下最有利于大肠杆菌的快速增长,蛋白表达速度最快,获得的蛋白量最大; 但是,高温条件下蛋白的快速合成,易形成蛋白包涵体,不具有可溶性,且蛋白的活性低。因此,本实验中采用16 ℃低温诱导基因表达融合蛋白,获得具有活性的可溶性蛋白。IPTG浓度对蛋白的表达也影响很大,往往较低IPTG浓度诱导表达的蛋白产量较低,不利于获得大量蛋白; 然而,高IPTG浓度也不利于高产量蛋白的获得,原因在于IPTG本身对菌株有一定的毒性,因此过高的诱导浓度反而会抑制表达。在蛋白纯化过程中,由于非特性蛋白与目的融合蛋白GST-AsMYC2竞争性的与GST亲和介质结合,导致纯化的目的蛋白纯度不高; 为了获得高纯度的GST-AsMYC2融合蛋白,作者对蛋白的纯化条件进行了优化。在目的蛋白上样后,目的蛋白洗脱之前,在淋洗液中加入低浓度的GSH (2 mmol·L-1) 洗脱非特性蛋白,最终获得了相对纯度较高的GST-AsMYC2融合蛋白。高质量GST-AsMYC2融合蛋白的获得,为今后AsMYC2多克隆抗体制备提供材料基础; 此外,白木香AsMYC2多克隆抗体的获得,可进一步通过酵母双杂交、免疫共沉淀和融合蛋白沉降技术等方法来研究AsMYC2基因功能,为全面解析沉香形成的机制提供依据。
白木香树中AsMYC2基因在茎和根中的表达丰度最高,在叶中的相对表达量最低; 而茎和根本身就是沉香形成的主要部位,表明AsMYC2基因可能与调控沉香次生代谢物,如沉香倍半萜的形成有关。但是,白木香AsMYC2基因具体的生物学功能还需要建立白木香转基因体系,这是下一步研究的重点。
| [1] | Persoon GA, Heuveling van Beek H. Growing ‘the wood of the Gods’:agarwood production in Southeast Asia//Snelder DJ, Lasco RD. Smallholder Tree Growing for Rural Development and Environmental Services:Lessons from Asia[M]. Dordrecht:Springer 2008:245-262. |
| [2] | Tamura K, Peterson D, Peterson N, et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Mol Biol Evol, 2011, 28:2731-2739. |
| [3] | Zhang XL. Studies on Relationships Between Wound-induced Defense Response and Agarwood Formation in Aquilaria sinensis (伤害诱导的白木香防御反应与沉香形成的关系研究)[D]. Beijing:Beijing Forestry University, 2013. |
| [4] | Chen HQ, Wei JH, Yang JS, et al. Chemical constituents of agarwood originating from the endemic genus Aquilaria plants[J]. Chem Biodivers, 2012, 9:236-250. |
| [5] | Chen HQ, Yang Y, Wei JH, et al. Comparison of compositions and antimicrobial activities of essential oils from chemically stimulated agarwood, wild agarwood and healthy Aquilaria sinensis (Lour.) Gilg trees[J]. Molecules, 2011, 16:4884-4896. |
| [6] | Kumeta Y, Ito M. Characterization of δ-guaiene synthases from cultured cells of Aquilaria, responsible for the formation of the sesquiterpenes in agarwood[J]. Plant Physiol, 2010, 154:1998-2007. |
| [7] | Xu YH, Zhang Z, Wei JH, et al. Identification of genes related to agarwood formation:transcriptome analysis of healthy and wounded tissues of Aquilaria sinensis[J]. BMC Genomics, 2013, 14:227. |
| [8] | Zhang Z, Yang Y, Wei JH, et al. Response of endogenous jasmonates and sesquiterpenes to mechanical wound in Aquilaria sinensis stem[J]. Acta Hort Sin (园艺学报), 2013, 40:163-168. |
| [9] | Wasternack C, Kombrink E. Jasmonates:structural requirements for lipid-derived signals active in plant stress responses and development[J]. ACS Chem Biol, 2010, 5:63-77. |
| [10] | Galis I, Gaquerel E, Pandey SP, et al. Molecular mechanisms underlying plant memory in JA-mediated defence responses[J]. Plant Cell Environ, 2009, 32:617-627. |
| [11] | Gfeller A, Liechti R, Farmer EE. Arabidopsis jasmonate signaling pathway[J]. Sci Signal, 2010, 3:4. |
| [12] | Hong GJ, Xue XY, Mao YB, et al. Arabidopsis MYC2 interacts with DELLA proteins in regulating sesquiterpene synthase gene expression[J]. Plant Cell, 2012, 24:2635-2648. |
| [13] | Zhang HB, Bokowiec MT, Rushton PJ, et al. Tobacco transcription factors NtMYC2a and NtMYC2b form nuclear complexes with the NtJAZ1 repressor and regulate multiple jasmonate-inducible steps in nicotine biosynthesis[J]. Mol Plant, 2012, 5:73-84. |
| [14] | Chini A, Boter M, Solano R. Plant oxylipins:COI1/JAZs/MYC2 as the core jasmonic acid-signalling[J]. FEBS J, 2009, 276:4682-4692. |
| [15] | Staswick PE. JAZing up jasmonate signaling[J]. Trends Plant Sci, 2008, 13:66-71. |
| [16] | Thines B, Katsir L, Melotto M, et al. JAZ repressor proteins are targets of the SCFCOI1 complex during jasmonate signaling[J]. Nature, 2007, 448:661-662. |
| [17] | Dombrecht B, Xue GP, Sprague SJ, et al. MYC2 differentially modulates diverse jasmonate-dependent functions in Arabidopsis[J]. Plant Cell, 2007, 19:2225-2245. |
 2016, Vol. 51
2016, Vol. 51


