2. 张家港市中医医院, 江苏苏州 215600
2. Zhangjiagang Hospital of Traditional Chinese Medicine, Suzhou 215600, China
马钱子又名番木鳖,是马钱科植物马钱 (Strychnos nux-vomica L.) 的干燥成熟种子,性温、味苦、有大毒,归肝、脾经,马钱子碱是从其干燥成熟种子中提取的生物碱类有效成分。本课题组的前期研究[1]表明,马钱子碱能有效抑制多种细胞的增殖,其中对肝癌细胞的抑制作用尤为显著,通过体外培养肝癌细胞发现,马钱子碱可显著抑制HepG2细胞及SMMC- 7721细胞的增殖[2, 3]。马钱子碱抑制HepG2细胞增殖的机制是通过提升细胞间钙离子浓度,触发线粒体途径进而诱导细胞凋亡。马钱子碱治疗癌症的作用虽令人鼓舞,但文献[4]报道将马钱子碱灌胃或小鼠尾静脉注射给药后发现药物在各组织均有分布,尤其在脑等中枢神经系统中分布,具有较强的中枢神经毒性,这大大限制其临床应用。因此如何提高马钱子碱在其效应靶点——线粒体中的浓度,减少在其他组织中的分布从而降低中枢神经系统毒性,是实现减毒增效的关键。
壳聚糖纳米粒作为一种新型的药物载体,具有无毒、良好的生物相容性和生物可降解性等特点,且可提高药物的稳定性,增加药物的吸收,提高药物的生物利用度,使药物在体内达到控释和靶向治疗的作用,因此壳聚糖成为目前最具前途的生物材料及药剂辅料之一[5, 6]。
本课题组前期研究中,采用化学方法合成出一组新型的壳聚糖衍生物N-甘草次酸-酸敏感桥-聚乙二醇-壳聚糖衍生物 [N-glycyrrhetinic acid (GA)- polyethylene glycol (PEG)-chitosan derivative,NGPC] 和N-季铵-壳聚糖衍生物 (N-quaternary ammonium- chitosan derivative,NQC),以此为构筑单元,马钱子碱为模型药物,构建了一种新型的纳米给药递释系统。在该系统中,NGPC上聚乙二醇基团[7]具有较长的亲水链,可以在纳米粒周围形成水化层,减少血液中巨噬细胞的吞噬,延长递释系统在体内循环时间,同时对NQC上的季铵正离子起屏蔽作用,减少其在生理环境中的毒性。NGPC水化层表面的甘草次酸具有肝实质细胞主动靶向的功能,能够增加药物在肝组织的蓄积。当载体系统被内吞进入肝细胞的内涵体/溶酶体后,由于微环境pH值的降低,纳米粒表面的水化层随着酸敏感桥GA-PEG脱落而消失,裸露出带季铵正离子的正电荷壳聚糖纳米粒,同时亚胺基团产生强烈的质子海绵效应,逃逸出溶酶体,通过正负电荷的吸引浓集于线粒体表面,释放出药物,抑制肿瘤细胞增殖,促进肿瘤细胞凋亡[8]。多功能复合型壳聚糖纳米粒 (multifunctional composite chitosan nanoparticles,MNPs) 体内外虽表现出明显的抗肿瘤活性,但药物载体被细胞内化后是如何发挥抗肿瘤作用的尚不得而知,因此本研究在前期研究的基础上,期望通过体外细胞培养的方式,考察其体外抗肿瘤活性,初步探讨促凋亡机制,为线粒体靶点药物抗肿瘤作用机制的深入探讨提供理论支撑。
材料与方法 试剂与药品马钱子碱 (日本和光纯药工业株式会社,批号100951379); DMEM/High Glucose、青霉素-链霉素溶液、磷酸盐缓冲液 (Hyclone®,美国 赛默飞世尔公司); 胎牛血清、胰蛋白酶 (Gibco® Life Technologies公司); 细胞周期与细胞凋亡检测试剂盒、Hoechst 33258细胞核染色液、Annexin V-FITC细胞凋亡检测试剂盒和JC-1线粒体膜电位检测试剂盒 (碧云天生物技术研究所); 其他试剂均为分析纯。
仪器Zetasizer Nano ZS90激光粒度仪 (英国马尔文公司); Milli-Q超纯水系统 (美国密理博公司); 细胞培养箱、酶标仪 (美国赛默飞世尔公司); 高内涵细胞分析系统 (Thermo Fishcer Cellomics Array Scan VTI700); 流式细胞仪 (FC500MPL,Beckman Coulter); 激光共聚焦显微镜 (日本奥林巴斯株式会社)。
细胞人肝癌HepG2细胞 (未分化) 购自中国科学院上海细胞库。
壳聚糖纳米粒的制备及表征采用离子交联法制备,具体制备过程参照文献[8]。制得的纳米粒经高速离心水洗后分装,于-80 ℃冰箱预冻24 h,然后置于冷冻干燥机上冻干,即得纳米粒冻干品,备用。
取适量的纳米粒冻干品,以去离子水为分散介质,激光粒度仪测定其粒径; 另取适量的纳米粒悬液,滴于敷有支撑膜的铜网上,2~3 min后,加2% 磷钨酸染色剂1滴负染,自然晾干后,置于透射电镜下观察、拍照。
细胞核的变化细胞发生凋亡时,通过细胞核染色,在高内涵细胞分析系统下观察细胞核凋亡前后的形态学变化[9, 10]。取对数生长期的HepG2细胞以1×104个/孔接种于96孔板中,完全培养液37 ℃孵育24 h后,移去培养液,每孔加入用不含血清培养液配制的给药溶液200 μL,于37 ℃孵育24 h后,4 ℃ PBS洗两次,加入多聚甲醛固定液100 μL,固定10 min。移去固定液,4 ℃ PBS洗两次,加入Hoechst 33258 (100 μL) 染色细胞核5 min后,移去染色液,4 ℃ PBS洗两次,采用高内涵细胞分析系统拍照观察。以不含血清培养液孵育细胞24 h,其余操作相同,作为阴性对照[11]。
细胞超微结构的变化取对数生长期的HepG2细胞以2×105个/孔接种于6孔板中,完全培养液37 ℃孵育24 h后,移去培养液,每孔分别加入2 mL用 不含血清的培养液稀释成20 μg·mL-1的马钱子碱溶 液、brucine/NGPC-NPs、brucine/NQC-NPs和brucine/ MNPs,于37 ℃孵育24 h后,收集培养液,4 ℃ PBS洗两次,加入胰蛋白酶消化,完全培养液终止消化,收集细胞,吸去上层PBS,用2.5% 戊二醛缓冲盐溶液固定3 h,再用1% 铁氰化钾及0.8% 四氧化锇缓冲盐溶液在4 ℃条件下固定1 h。丙酮脱水后切片,醋酸铀和柠檬酸铅染色后用透射电子显微镜 (TEM) 观察细胞及线粒体并拍照[11]。阴性对照: 以不含血清的培养液孵育细胞24 h,其余操作相同。
细胞凋亡率的检测采用Annexin V-FITC细胞凋亡检测试剂盒考察20 μg·mL-1的马钱子碱溶液和 载马钱子碱的NGPC-NPs、NQC-NPs和MNPs纳米 粒溶液对细胞产生的凋亡作用。同“细胞超微结构的变化”处理细胞,收集细胞,1 000 ×g离心5 min,弃去上清液,加入4 ℃ PBS 1mL,重悬细胞,1 000 ×g离心5 min,弃去上清液,加入500 μL binding buffer重悬细胞,Annexin V-FITC 5 μL混匀后,加入碘化丙啶 (PI) 5 μL,混匀,室温避光反应15 min,随即上流式细胞仪检测[11]。阴性对照: 以不含血清的培养液孵育细胞24 h,其余操作相同。
线粒体膜电位的测定同“细胞超微结构的变化”处理细胞,收集细胞,600 ×g离心4 min,弃去上清液,4 ℃ PBS洗涤,重悬于0.5 mL不含血清的培养液中,加入JC-1染色工作液1 mL,颠倒数次混匀,于细胞培养箱中37 ℃孵育20 min。在孵育期间,按每 1 mL JC-1染色缓冲液加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液,并放置于冰浴。37 ℃孵育结束后,600 ×g离心 (4 ℃) 3~4 min,沉淀细胞。弃上 ; 清液,用JC-1染色缓冲液 (1×) 洗涤: 加入1 mL JC-1染色缓冲液重悬细胞,600 ×g离心 (4 ℃) 3~4 min,沉淀细胞,弃上清液,重复2次。再用适量JC-1染色缓冲液 (1×) 重悬后,采用流式细胞仪测定[11]。阴性对照: 以不含血清的培养液孵育细胞24 h,其余操作相同。
Cytochrome C (Cyt.c) 释放的测定同“细胞超微结构的变化”处理细胞,收集细胞,600 ×g离心4 min,弃去上清液,4 ℃ PBS洗涤,加入0.5 mL多聚甲醛固定,制备石蜡切片。石蜡切片置于65 ℃烘箱中烘片2 h,脱蜡至水,用PBS冲洗3次,切片置于EDTA缓冲液中微波修复,中火至沸后断电,间隔10 min低火至沸,自然冷却后用PBS洗3次,切片放入3% 过氧化氢溶液,室温下孵育10 min,以阻断内源性过氧化物酶,用PBS洗3次,甩干后再用5% 牛血清白蛋白(BSA) 封闭20 min (封闭电荷),去除BSA液,每张切片加入50 μL稀释的一抗覆盖组织,4 ℃过夜,以PBS洗3次,去除PBS液,每张切片加50~100 μL相应种属的荧光二抗,避光室温下孵育50 min~1 h,避光PBS洗 3次,去除PBS液。每张切片加50~100 μL DAPI避光染核5 min,PBS洗3次,切片稍干后用抗荧光淬灭封片剂封片,4 ℃避光保存拍照[11]。阴性对照以不含血清的培养液孵育细胞24 h,其余操作相同。
统计学方法采用SPSS13.0统计软件,实验数据以± s表示,采用t检验,P < 0.05时有统计学意义。
结果与讨论 1 新型壳聚糖纳米粒的表征采用离子交联法制备的brucine/NGPC-NPs、brucine/NQC-NPs和brucine/MNPs平均粒径分别为 (169.4 ± 7.4)、(207.9 ± 8.5) 和 (185.3 ± 6.9) nm,多分散指数 (polydispersity index,PDI) 均较小,分布较为均匀。TEM下观察各纳米粒呈球形或类球形,形态规整。见图 1。

|
Figure 1 TEM images of brucine/NGPC-NPs (a),brucine/NQC- NPs (b),brucine/MNPs (c) |
与细胞坏死时细胞肿胀、胞膜破裂和胞质溶酶体释放等引起的炎症反应现象相反,细胞凋亡的特征是细胞收缩,以细胞核的形态改变尤为突出。细胞凋亡时,细胞体积缩小,失去细胞连接,染色质浓集并靠近于核膜,形成沿核膜收缩的“新月状”体。之后,体积进一步缩小,并可裂解成一个或多个致密体,形成凋亡小体[12]。由图 2可见,对照孔内的细胞核被染色后,细胞核圆整、光滑、比较饱满,没有萎缩现象。马钱子碱溶液作用于细胞后,细胞核出现了明显的收缩、边缘化,形成有“新月状”体。Brucine/NGPC- NPs、brucine/NQC-NPs和brucine/MNPs作用于细胞后,这种细胞核的形态变化更加明显,视野下出现了较多的“新月状”体,相较于brucine/NGPC-NPs和brucine/NQC-NPs组,brucine/MNPs组出现了明显的细胞核碎片,表现出更强的促凋亡作用。

|
Figure 2 Fluorescent images for nuclei shrinking and noticeable nuclear condensation (signified by yellow arrows) of HepG2 cells after applying brucine solution,brucine/NGPC-NPs,brucine/NQC-NPs and brucine/MNPs with brucine concentration 20 μg·mL-1 for 24 h. Nuclei were stained by Hoechst 33258 |
线粒体由外至内可划分为线粒体外膜 (OMM)、线粒体膜间隙、线粒体内膜 (IMM) 和线粒体基质 4个功能区。其中,线粒体外膜较光滑,起细胞器界膜的作用; 线粒体内膜则向内皱褶形成线粒体嵴,负担更多的生化反应。这两层膜将线粒体分出两个区室,位于两层线粒体膜之间的是线粒体膜间隙,被线粒体内膜包裹的是线粒体基质[13]。图 3结果显示,经不同马钱子碱制剂孵育细胞24 h后,对照组细胞的线粒体形状规整,线粒体嵴清晰可见,给药组线粒体的形状出现了不同程度的变化,其中以brucine/MNPs组变化尤为明显,线粒体出现了明显肿胀,线粒体嵴消失或不见,说明新型多功能壳聚糖纳米粒能通过影响线粒体的功能而诱导细胞凋亡。
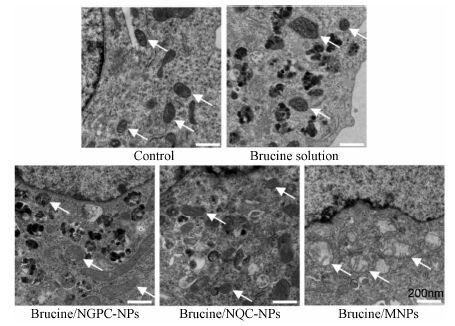
|
Figure 3 The morphology of mitochondria under TEM of various brucine/chitosan (CTS)-NPs and brucine solution after 24 h incubation. White arrows are mitochondria |
Annexin V是广泛分布于真核细胞胞浆内的钙离子依赖的磷脂结合蛋白,其可以选择性结合磷脂酰丝氨酸 (PS)。在正常细胞中,PS只分布在细胞膜内侧,在细胞凋亡早期,细胞膜中PS由膜内侧翻向外侧,与带有绿色的荧光探针FITC标记的Annexin V结合,早期凋亡细胞呈现绿色荧光。PI可以染色坏死细胞或凋亡晚期丧失细胞膜完整性的细胞,呈现红色荧光。对于坏死细胞,由于细胞膜的完整性已经丧失,Annexin V-FITC可以进入胞浆内,与位于细胞膜内侧的PS结合,从而也使坏死细胞呈现绿色荧光。利用Annexin V-FITC和PI双染细胞可以判定细胞凋亡的阶段[14]: 在双变量流式细胞仪的散点图上,左下象限为正常细胞,右下象限为早期凋亡细胞,右上象限是凋亡晚期细胞,左上象限为正常范围内的细胞碎片。总凋亡率等于右下和右上两个象限之和。由图 4A结果可知,对照组细胞凋亡较少,凋亡率约为2.2%;马钱子碱溶液组、brucine/NGPC-NPs组、brucine/ NQC-NPs组和brucine/MNPs组早期凋亡细胞所占比例分别为5.4%、14.3%、13.7% 和25.5%; 晚期凋亡细胞所占比例分别为0.6%、2.8%、1.0% 和3.9%; 细胞总凋亡率分别为6.0%、17.1%、14.7% 和29.4%。由图 4B可知,不论是从凋亡各时期还是从细胞总凋亡率来看,与马钱子碱溶液组相比,brucine/NGPC-NPs、brucine/NQC-NPs和brucine/MNPs组都表现出明显的促凋亡作用,促凋亡强度依次为brucine/MNPs > brucine/NGPC-NPs > brucine/NQC-NPs,分析原因可能是MNPs纳米粒兼有肝实质细胞靶向和溶酶体逃逸功能,既增加了细胞的摄取又增强了逃脱溶酶体进一步靶向线粒体的能力,可以使更多的药物浓集于线粒体,表现出较强的促凋亡作用。
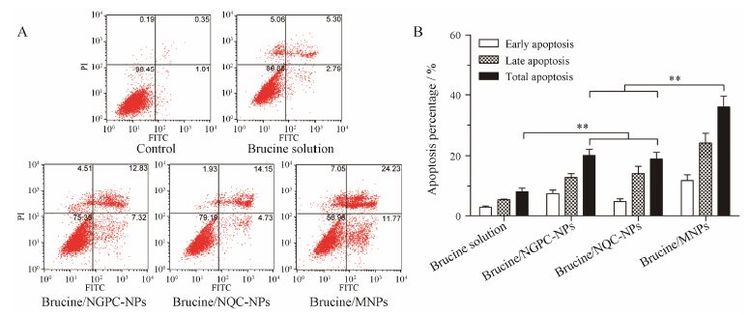
|
Figure 4 A: Flow cytometric images of apoptosis percentage of HepG2 cells after applying brucine solution,brucine/NGPC-NPs,brucine/NQC-NPs and brucine/MNPs with brucine concentration of 20 μg·mL-1 for 24 h. B: Percentages of early apoptosis,late apoptosis and total apoptosis among different formulations of brucine are presented as a histogram graph. The experiments were repeated three times and the data are shown as mean ± SD. **P < 0.01 |
线粒体膜电位的下降是细胞凋亡早期的一个标志性事件[15, 16],JC-1是一种广泛用于检测线粒体膜电位 (mitochondrial membrane potential) ∆Ψm的理想荧光探针。可以检测细胞、组织或纯化的线粒体膜电 位。在线粒体膜电位较高时,JC-1聚集在线粒体的基质 (matrix) 中,形成聚合物 (J-aggregates),可以产生红色荧光; 在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体 (monomer),可以产生绿色荧光。常用红绿荧光的相对比例来衡量线粒体去极化的比例。通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,同时也可以用JC-1从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标。采用JC-1线粒体膜电位检测试剂盒考察马钱子碱溶液、brucine/NGPC- NPs、brucine/NQC-NPs和brucine/MNPs与HepG2细胞孵育后,对HepG2细胞的线粒体膜电位的影响。由图 5显示,各组细胞绿色荧光的比例由大到小分 别为brucine/MNPs > brucine/NGPC-NPs > brucine/ NQC-NPs > 马钱子碱溶液组 > 对照组 [分别为 (59.0 ±2.8) %、(35.7 ± 2.5) %、(34.6 ± 1.8) %、(21.9 ± 4.1) %、(14.2 ± 1.2) %]。与对照组相比,绿色荧光比例的增加表示线粒体膜电位的降低。与对照组比较,brucine/ MNPs、brucine/NGPC-NPs、brucine/NQC-NPs和马钱子碱溶液组分别降低了线粒体膜电位的 (44.8 ± 2.7) %、(21.5 ± 2.4) %、(20.4 ± 1.9) % 和(7.7± 4.5) %。相较于brucine/NGPC-NPs、brucine/NQC-NPs和马钱子碱溶液组,brucine/MNPs显著降低了线粒体的膜电位,降低的比例分别是马钱子碱溶液组的5.8倍 (P < 0.01)、brucine/NQC-NPs的2.2倍 (P < 0.05) 和brucine/ NGPC-NPs的2.0倍(P < 0.05)。结果表明,具有多层次分级靶向的brucine/MNPs能有效地增强马钱子碱在细胞内传递,促进细胞凋亡,增强对细胞的杀伤力。
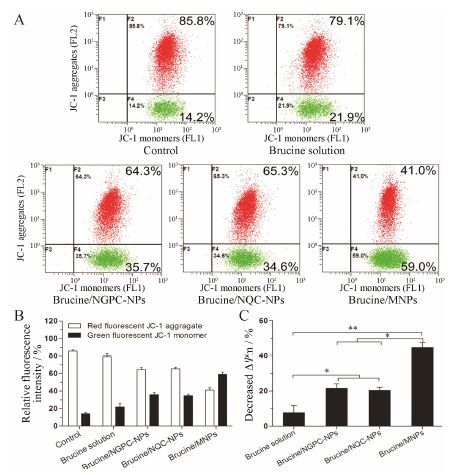
|
Figure 5 A: Flow cytometric images after applying brucine solution,brucine/NGPC-NPs,brucine/NQC-NPs and brucine/ MNPs with brucine concentration of 20 μg·mL-1 for 24 h. B: Relative fluorescence intensity of JC-1 aggregates and monomer. C: Mitochondrial membrane potential decrease after applying brucine solution,brucine/NGPC-NPs,brucine/NQC-NPs and brucine/MNPs with brucine concentration of 20 μg·mL-1 for 24 h. P < 0.05,**P < 0.01 |
细胞色素C是线粒体呼吸链的重要组成部分,它是由两个无活性的前体分子合成: 前细胞色素C (该蛋白质由细胞核基因编码,然后被转运至线粒体) 和亚铁血红素 (由线粒体合成)。由于细胞色素C具有亚铁血红素基团,它可以在呼吸链复合酶Ⅲ (细胞色素还原酶) 和IV (细胞色素氧化酶) 之间传递电子。细胞色素C缺乏时,电子传递链被阻断,将导致两方面的后果: ATP合成减少及不完全氧化造成的超氧阴离子 (ROS) 过度生成,而ROS是诱导凋亡的重要因素。在检测到经典的细胞凋亡特征以前,线粒体膜完整性就已发生了重大变化。这些变化涉及到线粒体内膜和外膜的改变,包括内膜跨膜电位 (ΔΨm) 的丧失和 (或) 蛋白质通过外膜的释放。线粒体在细胞存亡机制中的作用越来越引起人们的重视,一方面是由于线粒体膜间隙的细胞色素C释放至胞质后触发caspase级联,导致细胞死亡; 另一方面,线粒体外膜上的Bcl-2蛋白家族调控细胞色素C自线粒体的释放[17, 18, 19]。本实验采用免疫荧光染色的方法,考察给予不同马钱子碱制剂后细胞色素C的释放情况。如图 6所示,以不含血清的培养液孵育细胞作为对照,整个过程中没有观察到红色荧光的出现,说明没有细胞色素C的释放; 在给予不同马钱子碱制剂后,出现了一定程度的红色荧光,荧光强度的深浅表明了细胞色素C释放的强弱,由图可以看出,brucine/MNPs组荧光强度较brucine/NGPC-NPs、brucine/NQC-NPs和brucine solution组明显增强,且brucine/NGPC-NPs组和brucine/NQC-NPs组的荧光强度强于brucine solution组,表明经brucine/MNPs孵育后细胞出现了较高强度的细胞色素C释放,且释放的强度强于其他马钱子碱制剂组,能够发挥更强的诱导细胞凋亡的能力。
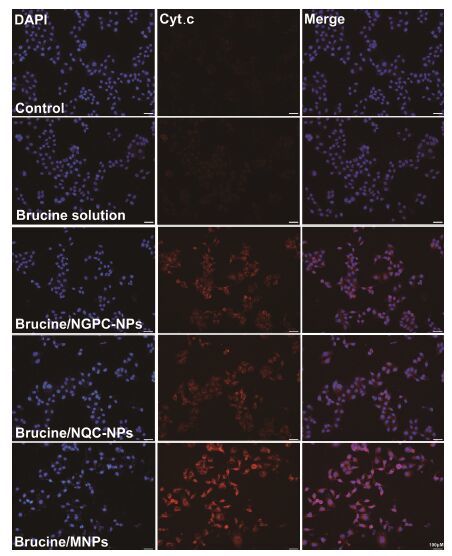
|
Figure 6 The release of cytochrome C after applying brucine solution,brucine/NGPC-NPs,brucine/NQC-NPs and brucine/ MNPs with brucine concentration of 20 μg·mL-1 for 24 h |
本研究以HepG2细胞为模型细胞,建立细胞凋亡模型,以马钱子碱为模型药物,构建具有分级逐次肝实质细胞线粒体靶向功能的MNPs,结合高内涵细胞分析系统、透射电镜、流式细胞仪和免疫荧光等先进仪器和技术系统考察了经一定浓度的马钱子碱溶液剂和马钱子碱壳聚糖纳米粒作用细胞一段时间后对细胞凋亡作用的影响,发现brucine/MNPs可以更有效地促进肿瘤细胞的凋亡,各制剂作用于线粒体途径研究结果表明,brucine/MNPs不仅可以有效地 降低线粒体的膜电位,而且能够显著促进细胞色素C释放,进而触发相关细胞凋亡因子,最终导致肿瘤细胞凋亡。
本研究所考察的MNPs虽然能有效促进肿瘤细胞的凋亡,但客观来说,为了克服各种生理屏障最后到达靶部位释放药物,需要将多种功能进行组装,而组装的多功能材料以聚合物、脂质材料等为主,具有一定的生物毒性; 此外载药量低、批间差异较大也是目前纳米药物普遍存在的另一缺点,这些都严重制约着多功能纳米药物的进一步发展。因此针对制约纳米药物发展的瓶颈问题,提高纳米药物的载药量、提高其形貌可控性、释放可控性、体内转运过程的稳定性及安全性,争取使之进入临床或临床前研究是纳米药物发展的重要方向。
| [1] | Zheng L, Wang XL, Luo WJ, et al. Brucine, an effective natural compound derived from nux-vomica, induces G1 phase arrest and apoptosis in LoVo cells[J]. Food Chem Toxicol, 2013, 58:332-339. |
| [2] | Deng XK, Yin W, Li WD, et al. The anti-tumor effects of alkaloids from the seeds of Strychnos nux-vomica on HepG2 cells and its possible mechanism[J]. J Ethnopharmacol, 2006, 106:179-186. |
| [3] | Yin W, Deng XK, Yin FZ, et al. The cytotoxicity induced by brucine from the seed of Strychnos nux-vomica proceeds via apoptosis and is mediated by cyclooxygenase 2 and caspase 3 in SMMC 7221 cells[J]. Food Chem Toxicol, 2007, 45:1700-1708. |
| [4] | Li XT, Zhang LR, Wang TK, et al. Tissue distribution of brucine in mice[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2006, 11:342-344. |
| [5] | Amidi M, Mastrobattista E, Jiskoot W, et al. Chitosan-based delivery systems for protein therapeutics and antigens[J]. Adv Drug Deliv Rev, 2010, 62:59-82. |
| [6] | Chen MC, Mi FL, Liao ZX, et al. Recent advances in chitosanbased nanoparticles for oral delivery of macromolecules[J]. Adv Drug Deliv Rev, 2013, 65:865-879. |
| [7] | Xia CF, Ye ZG, Zhou XN, et al. Tissue distribution of PEGylated puerarin in acute myocardial ischemia mode rats[J]. Acta Pharm Sin (药学学报), 2014, 49:1413-1417. |
| [8] | Chen ZP, Zhang LJ, Song Y, et al. Hierarchical targeted hepatocyte mitochondrial multifunctional chitosan nanoparticles for anticancer drug delivery[J]. Biomaterials, 2015, 52:240-250. |
| [9] | Sgonic R, Gruber J. Apoptosis detection:an overview[J]. Exp Gerontol, 1998, 33:525-533. |
| [10] | Cui Q, Tashiro S, Onodera S, et al. Mechanism of downregulation of apoptosis by autophagy induced by oridonin in HeLa cells[J]. Acta Pharm Sin (药学学报), 2007, 42:35-39. |
| [11] | Mo R, Sun Q, Xue J, et al. Multistage pH-responsive liposomes for mitochondrial-targeted anticancer drug delivery[J]. Adv Mater, 2012, 24:3659-3665. |
| [12] | O'brien PJ, Irwin W, Diaz D, et al. High concordance of drug-induced human hepatotoxicity with in vitro cytotoxicity measured in a novel cell-based model using high content screening[J]. Archiv Toxicol, 2006, 80:580-604. |
| [13] | Kroemer G, Reed JC. Mitochondrial control of cell death[J]. Nat Med, 2000, 6:513-519. |
| [14] | Eray M, Mättö M, Kaartinen M, et al. Flow cytometric analysis of apoptotic subpopulations with a combination of Annexin V-FITC, propidium iodide, and SYTO 17[J]. Cytometry, 2001, 43:134-142. |
| [15] | Zamzami N, Marchetti P, Castedo M, et al. Sequential reduction of mitochondrial transmembrane potential and generation of reactive oxygen species in early programmed cell death[J]. J Exp Med, 1995, 182:367-377. |
| [16] | Untergasser G, Rumpold H, Plas E, et al. A low-molecularweight fraction of human seminal plasma activates adenylyl cyclase and induces caspase 3-independent apoptosis in prostatic epithelial cells by decreasing mitochondrial potential and Bcl-2/Bax ratio[J]. FASEB J, 2001, 15:673-683. |
| [17] | Yang J, Liu X, Bhalla K, et al. Prevention of apoptosis by Bcl-2:release of cytochrome C from mitochondria blocked[J]. Science, 1997, 275:1129-1132. |
| [18] | Kuida K, Haydar TF, Kuan CY, et al. Reduced apoptosis and cytochrome C-mediated caspase activation in mice lacking caspase 9[J]. Cell, 1998, 94:325-337. |
| [19] | Ferrer PE, Frederick P, Gulbis JM, et al. Translocation of a Bak C-terminus mutant from cytosol to mitochondria to mediate cytochrome C release:implications for Bak and Bax apoptotic function[J]. PLoS One, 2012, 7:e31510. |
 2016, Vol. 51
2016, Vol. 51


