2. 河北省药品检验研究院, 河北石家庄 050011;
3. 石药集团中奇制药技术(石家庄)有限公司, 河北石家庄 050041
2. Hebei Institute for Drug Control, Shijiazhuang 050011, China;
3. CSPC Zhongqi Pharmaceutical Technology(Shijiazhuang) Co. Ltd., Shijiazhuang 050041, China
蛇床子为伞形科植物蛇床 [Cnidium monnieri (L.) Cussion] 的干燥成熟果实,生长于溪沟边等潮湿处,是《中华人民共和国药典》2010版收载的常用中药[1]。蛇床子主产于河北、山东、浙江、江苏等省。味辛、苦,性温; 有小毒; 归肾经。功能为温肾壮阳、燥湿、祛风、杀虫,用于治疗阳痿宫冷、寒湿带下、湿痹腰痛、外阴湿疹等证[2]。据现代药理学研究,蛇床子具有抗心律失常、抗诱变、抗肿瘤等作用[3, 4]。
研究[5, 6, 7, 8, 9]表明,蛇床子主要含有香豆素类、黄酮类、挥发油类以及有机酸类化合物。目前的化学成分研究和药理学研究揭示了香豆素类成分是影响其药理学活性的主要因素[4, 9, 10, 11, 12, 13]。蛇床子中7种主要的香豆素类活性成分为异补骨脂素、花椒毒素、佛手柑内酯、蛇床子素、异茴芹内酯、欧前胡素和二氢欧山芹醇,具有抗真菌、抗病毒、抗蛔虫和滴虫及类性激素样作用[9, 13]。
对影响蛇床子药理活性的主要化学成分进行合理的定量分析是控制药材质量的基本方法。目前,对于蛇床子的定量分析方法多是针对蛇床子素这一种活性成分,对其他香豆素类活性成分研究较少。目前蛇床子中香豆素类化合物的测定方法主要有高效液相色谱法 (HPLC)[14, 15]、液相色谱质谱联用法 (HPLC- MS)[16, 17, 18]、超高效液相色谱质谱联用法 (UPLC- MS)[19]。未见文献报道采用GC-MS法对不同产地蛇床子药材中多种香豆素类活性成分进行定量分析。本研究拟建立一种操作简单、灵敏度高、选择性强、分析速度快的GC-MS分析方法,同时测定蛇床子药材中7种香豆素类活性成分,并将其应用于 12批不同产地的药材的质量分析,为蛇床子药材的质量控制提供依据。
材料与方法 仪器QP2010Plus型气相色谱-质谱仪 (日本Shimadazu公司),GCMSSolution工作站,自带Nist08质谱库。
药品与试剂异补骨脂素 (isoporalen)、蛇床子素 (osthole)、欧前胡素 (imperatorin) 购于中国食品药品检定研究院 (纯度均大于98%); 异茴芹内酯 (isopimpinelline)、佛手柑内酯 (bergapten)、二氢欧山芹醇 (columbianetin) 购于四川维克奇生物科技有限公司 (纯度均大于98%); 花椒毒素 (xanthotoxin) 购于上海融禾医药科技发展有限公司 (纯度大于98%)。色谱纯甲醇 (Merch KGaA,Darmstadt,德国)。
蛇床子药材分别收集于我国的6个不同省份,山东省3批 (SD-1,SD-2,SD-3,种植); 河北省3批 (HB-1,HB-2,HB-3,种植); 江苏省3批 (JS-1,JS-2,JS-3,种植); 河南省1批 (HN,种植); 浙江省1批 (ZJ,种植); 四川省1批 (SC,野生)。样品经河北省药品检验研究院中药室段吉平主任药师鉴定为Fructus Cnidii。
对照品溶液的制备分别取异补骨脂素、花椒毒素、佛手柑内酯、蛇床子素、异茴芹内酯、欧前胡素和二氢欧山芹醇对照品适量,精密称定,加甲醇溶解并稀释制成各约0.2 mg·mL-1的对照品贮备液。分别精密量取一定体积对照品贮备液混合并稀释制成混合对照品溶液。将混合对照品溶液按照标准曲线要求逐级稀释成所需浓度。
样品溶液的制备将蛇床子药材粉碎,过40目筛,并于40 ℃干燥至恒重。取蛇床子干燥后的药材粉末约2.0 g,精密称定,置锥形瓶中,精密加入70% 乙醇30 mL,精密称定总重量,于水浴中超声 (功率: 100 W; 频率: 25 kHz) 提取60 min,取出,放冷,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液,离心,用0.45 μm滤膜滤过,弃去初滤液,稀释续滤液,并精密量取1 μL注入气相色谱仪。
色谱及质谱条件色谱条件 色谱柱DB-1毛细管柱 (30 m × 0.25 mm,0.25 μm); 柱温采用程序升温: 50 ℃保持2 min,以20 ℃·min-1的速率升至250 ℃,保持10 min,再以10 ℃·min-1的速率升至280 ℃,保持10 min; 进样口温度250 ℃; 分流比: 40∶1; 载气 (He) 流速1.54 mL·min-1。
质谱条件 接口温度280 ℃; 离子源温度250 ℃; 溶剂切割时间: 4 min; 四极杆温度150 ℃; 采用电子轰击离子化 (EI源) 电离方式,电子能量70 eV; 扫描方式: 选择离子检测模式 (SIM); 扫描范围: 50~350 amu。
方法学考察线性关系和定量限 分别配制质量浓度约为8~1 700 ng·mL-1的系列标准溶液,对7种香豆素类活性成分进行测定,以各对照品溶液进样浓度 (ng·mL-1) 为横坐标,以各组分色谱峰面积为纵坐标,分别绘制各待测组分的标准曲线,进行线性回归,得回归方程和相关系数。
回收率及精密度 精密量取高、中、低3个浓度水平的对照品溶液,分别加入到蛇床子粉末2.0 g中,按上述方法操作,制备供试品溶液,按上述方法测定,记录7种化合物的峰面积,平行操作6份,计算回收率。取同一批次蛇床子药材 (SD-1),粉碎,过40目筛,取约2.0 g,精密称定,取6份,按上述方法操作,制备供试品溶液,按上述方法测定,记录7个化合物的峰面积,计算RSD值。
结果 1 方法专属性在上述色谱-质谱条件下,7种香豆素类活性成分分离良好,基质成分不干扰7种香豆素类活性成分的测定。见图 1。7种香豆素类活性成分的分子质量、保留时间、采集时间范围、定量离子信息见表 1。
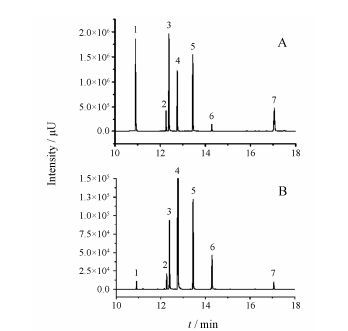
|
Figure 1 GC-MS-SIM chromatogram for a spiked standard mixture of 7 coumarins (A) and common cnidium fruit samples (B). Peaks: 1. Isoporalen; 2. Xanthotoxin; 3. Bergapten; 4. Osthole; 5. Isopimpinelline; 6. Imperatorin; 7. Columbianetin |
|
|
Table 1 The MS parameters of isoporalen,xanthotoxin,bergapten,osthole,isopimpinelline,imperatorin and columbianetin for quantification and confirmation |
结果表明,在8~1 700 ng·mL-1内,7种香豆素类活性成分的线性关系良好,r2 ≥ 0.998 6。7种香豆素类活性成分的定量限为3.21~29.88 ng·mL-1。线性、检出限和定量限结果见表 2。
|
|
Table 2 Regression data,LOD (limit of detection) and LOQ (limit of quantification) for the investigated compounds. y: Peak area; x: Concentration of compound (ng·mL-1) |
异补骨脂素、花椒毒素、佛手柑内酯、蛇床子素、异茴芹内酯、欧前胡素和二氢欧山芹醇的平均回收率分别为100.30%、97.05%、98.21%、100.50%、99.10%、99.12% 和92.38%,RSD值分别为1.2%、0.6%、1.8%、0.7%、1.1%、0.9% 和2.5%,说明该方法准确度良好。
异补骨脂素、花椒毒素、佛手柑内酯、蛇床子素、异茴芹内酯、欧前胡素和二氢欧山芹醇的日内精密度的RSD值分别为2.5%、2.1%、0.7%、2.3%、2.0%、1.1% 和2.3%,日间精密度的RSD值分别为1.5%、1.6%、1.6%、1.3%、1.2%、2.0% 和3.3%,说明该方法精密度良好。
4 实际样品的测定12批次不同来源的蛇床子药材中各待测组分的含量测定结果见表 3。
|
|
Table 3 Content of the 7 active components in Common cnidium fruit (n = 3). ND: Not detected |
蛇床子药材中7个被测成分的总含量变化为6.35~18.10 mg·g-1,表明不同产地的蛇床子药材含量显著不同。产自山东省的3批样品,7个被测成分的总含量最高; 产自河北的3批样品和产自四川的1批样品的被测成分总含量最低。12批蛇床子样品中7个被测组分的平均总含量为10.95 mg·g-1。就单个组分分析,蛇床子素 (平均含量4.73 mg·g-1) 是蛇床子药材7个待测成分中含量最高的成分,其次是欧前胡素 (平均含量3.64 mg·g-1) 和异茴芹内酯 (平均含量1.16 mg·g-1)。由上可知,各成分含量与药材的产地、生长环境和采集时间有密切关系。
讨论本实验比较了超声提取法、振摇提取法和加热回流提取法,结果表明采用超声方法进行药材的提取效果较好,故采用超声提取的方法进行药材的提取,为提高提取率分别考察了不同固液比、不同乙醇浓度的提取溶剂、不同甲醇浓度的提取溶剂和不同提取时间。通过提取率的比较,最终选择70% 乙醇以1∶15 (g·mL-1) 的比例提取60 min作为中药材蛇床子的最佳提取条件。
色谱条件的优化主要考察了两方面,包括色谱柱以及程序升温的选择。实验中考察了不同极性的色谱柱,结果表明,7个待测成分在DB-1毛细管柱 (30 m × 0. 25 mm,0.25 μm) 上的峰形和分离度最佳。色谱分离时,不仅载气流速影响分离度,而且升温程序的不同也会导致色谱峰分离度的变化。根据结果,将载气流速设定为1.54 mL·min-1是合理的,经过选择优化,最后确定采用程序升温的方式。
在待测化合物中,花椒毒素和佛手柑内酯是一对同分异构体,在质谱条件优化中发现两者产生的分子离子峰和产物离子峰基本一致 (定性离子均为216、173、145)。由于本实验采用选择离子检测模式 (SIM) 进行定量,为了使两化合物能够更好地区分定量,故在色谱条件优化过程中,通过改变程序升温,使二者在毛细管色谱柱上实现完全分离,进而使二者能够被准确定量测定。
7 个待测成分在选定的色谱条件下可以于18 min内达到良好的分离效果。在选择离子检测模式 (SIM) 下,通过与对照品比较保留时间和定性离子的一致性,可以对7个待测成分进行准确的色谱峰确证。
本研究采用GC-MS-SIM法同时定性和定量分析蛇床子药材中7个香豆素类有效成分。采用选择离子检测模式 (SIM) 检测,缩短了分析时间,提高了7个化合物的灵敏度。方法学验证结果表明,该分析方法操作简单、灵敏度高、专属性强、结果准确可靠,可为蛇床子药材质量控制提供重要参考依据。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China (中华人民共和国药典)[S]. 2010 ed. Part I. Beijing:China Medical Science Press, 2010:2191. |
| [2] | Zhu Y, Gu YH, Zhu L. Analysis of the essential oil from cnidium monnieri in two different producing areas by GC-MS[J]. China Pharm (中国药房), 2008, 19:2603-2605. |
| [3] | China Pharmaceutical University. Traditional Chinese Medicine Dictionary (中药辞海)[S]. Beijing:China Medical Science Press, 1997:345-349. |
| [4] | Chen Y, Zhang GG, Yu ZP. The advancement in the chemical and pharmacological study of the fruits of Cnidium monnieri[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2006, 23:256-259. |
| [5] | Deng HW, Ou ZQ, Li YW, et al. Study on the flavonoids of dregs in Cnidium monnieri (L.) Cusson[J]. Guangzhou Chem Ind (广州化工), 2009, 37:105-106. |
| [6] | Dong X. Research progress of Cnidium monnieri[J]. Jilin J Tradit Chin Med (吉林中医药), 2006, 26:58-59. |
| [7] | Qin LP, Wu H, Wang TJ, et al. Analysis of the volatile constituents of Fructus Cnidii and Xingan cnidium fruit[J]. Chin Tradit Herb Drugs (中草药), 1992, 23:330. |
| [8] | Xiang RD, Fu XH. Study on chemical constituents of Fructus Cnidii[J]. Chin Tradit Herb Drugs (中草药), 1984, 15:14. |
| [9] | Lian QS. Research progress on chemical constituents and pharmacological effects of Fructus Cnidii[J]. Tradit Chin Med Mater (中药材), 2003, 26:141-144. |
| [10] | Chen ZC, Duan XB. Total coumarins of Fructus Cnidii investigation on the mechanism of antiasthmatic effect[J]. China J Chin Mater Med (中国中药杂志), 1990, 15:48-50. |
| [11] | Lian QS, Zhang ZZ, Hu X, et al. Studies on the antiinflammatory effect of xanthotoxol in experimental animals[J]. Chin Tradit Herb Drugs (中草药), 1998, 29:102-104. |
| [12] | Shen LX, Zhang DS, Zhang L, et al. Action of osthol on learning and memory and its mechanism analysis[J]. Acta Pharm Sin (药学学报), 1999, 34:405-409. |
| [13] | Zhang SY, Meng L, Gao WY, et al. Advances on biological activities of coumarins[J]. China J Chin Mater Med (中国中药杂志), 2005, 30:410-413. |
| [14] | Li YM, Zhang QY, Qin LP, et al. Determination of 3 coumarins in Fructus Cnidii by HPLC[J]. J Chin Med Mater (中药材), 2015, 38:1441-1443. |
| [15] | Weng DX, Li TA. Simultaneous determination of 5 active components in Fructus Cnidii by HPLC[J]. China J Chin Mater Med (中国中药杂志), 2007, 32:1883-1885. |
| [16] | Chen Y, Fan G, Zhang Q, et al. Fingerprint analysis of the fruits of Cnidium monnieri extract by high-performance liquid chromatography-diode array detection-electrospray ionization tandem mass spectrometry[J]. J Pharm Biomed Anal, 2007, 43:926-936. |
| [17] | Jiang YJ. Analysis of coumarins in Fructus Cnidii by HPLCESI-MS[J]. J Chin Med Mater (中药材), 2006, 29:1033-1035. |
| [18] | Song GS, Zhou L, Sheng N, et al. Simultaneous quantification of 16 bioactive constituents in common cnidium fruit by liquid chromatography-electrospray ionization-mass spectrometry[J]. J Pharm Biomed Anal, 2015, 107:304-310. |
| [19] | Li KP, Gao CK, Li WM. Analysis of coumarins in extract of Cnidium monnieri by ultra-performance liquid chromatographic coupled to electrospray ionization time of flight mass/mass spectrometry[J]. Chin Tradit Pat Med (中成药), 2009, 31:584-587. |
 2016, Vol. 51
2016, Vol. 51


