2. 安徽省中医药科学院药物化学研究所, 安徽合肥 230038
2. Department of Medicinal Chemestry, Anhui Academy of Chinese Medicine, Hefei 230038, China
高脂血症是人体脂代谢异常导致的血中脂质和脂蛋白水平升高的病症,是非酒精性脂肪肝、动脉粥样硬化性心脏病和糖尿病等疾病发生的主要危险因素[1]。在我国随着人民生活水平的不断提高,高脂血症的发病率不断上升且呈年轻化趋势[2]。目前临床上治疗高脂血症常用的调血脂药物主要有贝特类和他汀类等,虽然调血脂效果明显,但价格昂贵且易引起肝损伤。 中医学认为高脂血症属“痰浊”、“瘀血”范畴; 痰浊和瘀血作为病理产物和致病因子,是高脂血症发病的关键环节, 所以对高脂血症的治疗以化痰降浊、活血化瘀为主要原则[3]。基于中医学的思维,如果能设计出一类既有活血化瘀又有降血脂作用的化合物将具有重要的临床意义。
许多查尔酮类化合物对治疗心脑血管疾病具有较好的治疗作用。Shukla等[4]设计合成了10个査耳酮芳氧烷酸衍生物,大部分化合物显示出了较好的降血脂活性,其中化合物a(图 1) 的降血脂活性要强于阳性对照药非诺贝特。Sashidhara等[5, 6]报道合成 了一系列含香豆素基、吲哚基的査耳酮芳氧烷酸类化合物,其中化合物b (图 1) 的降血脂活性要略强于阳性对照药非诺贝特。
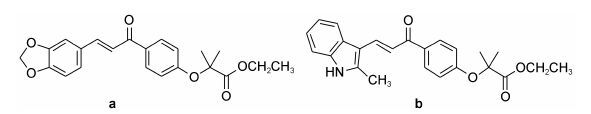
|
Figure 1 The structures of chalcone aromatic oxygen alkylacids derivatives |
李家明等[7, 8, 9]报道了一系列抗血小板聚集活性 较好的化合物,其中川阿格雷 (图 2) 对二磷酸腺苷 (ADP) 诱导的血小板聚集的抑制活性是奥扎格雷的5.7倍,有很好的临床应用价值。利用生物电子等排原理,本课题组前期用3-吡啶基替换川芎嗪基设计合成了化合物c (图 2),其对ADP诱导的血小板聚集的抑制活性明显强于奥扎格雷钠[10],基于前期的研究工作,以芳氧烷酸结构为模型化合物,设计合成了一类含川芎嗪基、吡啶基的查尔酮芳氧烷酸类化合物。它们的结构特征均为一端为碱性基团,另一端为酸性基团,同时具有查尔酮结构,期望所设计的化合物既有抗血小板聚集活性又有降血脂活性,从而为治疗高血脂症及动脉粥样硬化提供新的选择,合成见路线1。药效筛选结果显示,部分查尔酮芳氧烷酸类化合物具有较好的体外抗血小板聚集活性,其中化合物7c、8a具有较明显的体内降血脂活性,鉴于化合物7c、8a既有一定的抗血小板聚集活性,又有明显的降血脂活性,呈现出良好的药用前景。
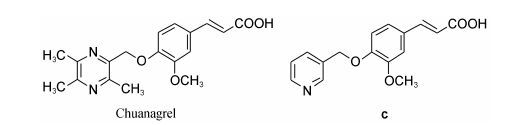
|
Figure 2 The structures of chuanagrel and compound c |
川芎嗪醛和羟基苯乙酮在碱性条件下发生Claisen-Schmidt缩合反应,因在碱性条件下过量的 羟基苯乙酮会与反应生成的化合物6进一步发生Michael加成反应生成副产物。为控制副反应的发生,应严格控制投料比以及反应时间和温度,最佳反应条件为羟基苯乙酮与川芎嗪醛的投料比为1∶1.2,反应时间为10 h,反应温度为0 ℃。
在第vii步的水解反应中,发现含两个甲基的酯的水解较难以发生,升高温度、延长反应时间或增强碱性都会生成副产物,考虑到降血脂药物非诺贝特等均是在体内经酯酶的作用迅速代谢成芳氧烷酸而起降血脂作用,故而双甲基酯化合物7c以前体药物酯的形式对小鼠进行体内给药,评价其在小鼠体内降血脂活性。
目标化合物结构经NMR、IR、ESI-MS确证,化合物的理化数据见表 1、2。
|
|
Table 1 Structure and physical propertiy of target copounds |
|
|
Table 2 Spectral data of target copounds |
体外抗血小板聚集实验结果 (表 3) 显示,所合成的化合物均表现出一定的抗血小板聚集作用,但作用不及奥扎格雷和阿司匹林明显。其中,化合物7c、8a和11a对花生四烯酸 (AA) 诱导的血小板聚集具有较好的抑制作用,化合物7c、7d、8a和11b对ADP诱导的血小板聚集具有较好的抑制作用。从合成化合物的药理数据可以发现,先导物的母核结构、取代基的位置以及种类的不同对AA及ADP诱导的血小板聚集的抑制活性不同: 苯环对位被取代其对AA诱导的血小板聚集的抑制活性要强于苯环间位被取代的活性 (化合物7a、7b除外); 当R为CH3时,其对ADP诱导的血小板聚集的抑制活性要强于R为H时的活性。化合物7a与11a比较,发现当母核川芎嗪基被吡啶基取代时,其对AA及ADP诱导的血小板聚集的抑制活性均增强; 而当R为CH3时,即化合物7c与11b相比较,发现母核川芎嗪基被吡啶基取代后,其对AA及ADP诱导的血小板聚集的抑制活性均减弱,详细的构效关系及机制有待进一步研究。

|
Reagents and conditions: (i) H2O2,HOAc,94 ℃,12 h; (ii) Ac2O,130 ℃,5 h; (iii) 20% NaOH,rt,12 h; (iv) MnO2,78 ℃,12 h; (v) 20% KOH,CH3CH2OH,0 ℃,10 h; (vi) ClCH2COOEt/BrC(CH3)2COOEt,K2CO3,KI,DMF,90 ℃,6 h; (vii) NaOH,H2O,EtOH,rt,12 h. Scheme 1 Synthetic route of the target compounds |
|
|
Table 3 The inhibitory activity against platelet aggregation of target compoundsspan> |
依据上述测试结果,结合化合物的结构特点,选择化合物7c和8a进一步评价其体内降血脂活性。以高脂饲料喂养形成的高脂血症C57/BL6小鼠为模型动物,以非诺贝特 (fenofibrate,FNB) 为阳性对照,考察化合物对TC、TG、LDL-C和HDL-C水平的影响 (表 4)。实验结果显示,与正常对照组小鼠TC、TG、LDL-C和HDL-C水平比较,模型组小鼠TC、TG、LDL-C和HDL-C水平均明显升高 (P < 0.01)。与模型组小鼠TC、TG、LDL-C和HDL-C水平比较,化合物7c (45 mg·kg-1) 能够明显降低小鼠的TC水平 (P < 0.01),同时还能降低小鼠的LDL-C水平 (P < 0.05),当将化合物7c的剂量增加一倍即90 mg·kg-1时,化合物7c还能够降低小鼠的TG水平(P < 0.05),升高小鼠的HDL-C水平 (P < 0.05); 化合物8a (45 mg·kg-1) 能够明显降低小鼠的TC水平 (P < 0.01),同时还能降低小鼠的TG和LDL-C水平 (P < 0.05),升高小鼠的HDL-C水平 (P < 0.05),剂量增加一倍后即化合物8a (90 mg·kg-1) 作用与非诺贝特 (45 mg·kg-1) 相当。体内降血脂活性评价显示,化合物7c、8a具有较明显的体内降血脂活性,连续3周给药,可以明显降低高脂血症C57/BL6小鼠血清总胆固醇和低密度脂蛋白胆固醇水平。本研究结果对进一步优化设计川芎嗪基、吡啶基査耳酮芳氧烷酸类衍生物作为高脂血症治疗剂的研究具有一定的指导意义。
|
|
Table 4 Effects of compounds 7c and 8a on serum lipid levels in hyperlipidemia C57/BL6 mice. n = 12,x± s. **P < 0.01 vs control group; △P < 0.05,△△P < 0.01 vs HFD group. HFD: High fat diet; FNB: Fenofibrate |
WRS-1B数字熔点仪、SGWX-4型显微熔点仪 (上海精密科学仪器有限公司,温度未校正); LCQADVANTAGE MAX液质连用质谱仪 (Finnigan公司); Bruker 400 or 300 MHz超导核磁共振仪 (CDCl3或DMSO-d6为溶剂,TMS为内标); Nicolet Avatar 370 DTGS型红外光谱仪 (KBr压片)。薄层和柱色谱用硅胶均为烟台德信生物科技有限公司产品,川芎嗪 (分析纯,滕州市悟通香料有限责任公司),奥扎格雷、阿司匹林均为HPLC纯,购自上海阿拉丁试剂有限公司,非诺贝特 (HPLC纯,上海梯希爱化成工业发展有限公司),其余试剂均为分析纯; C57/BL6小鼠,雄性,由南京金斯瑞生物科技有限公司提供,许可证号: SYXK (苏) 2012-0054。
1 化学合成 1.1 2-羟甲基-3,5,6-三甲基吡嗪的合成 (4)在250 mL三颈烧瓶中依次加入川芎嗪 (15.0 g,0.1 mol)、30% H2O2溶液(24 mL,0.2 mol) 和冰醋酸15 mL,94 ℃反应12 h,TLC (石油醚-乙酸乙酯1∶1) 检测反应基本完全,冷却后,用50% NaOH溶液调节pH 10,二氯甲烷萃取 (3×30 mL),合并有机相,无水Na2SO4干燥,浓缩得川芎嗪单氮氧化物 (2),白色晶体13.2 g,收率78.8%,mp 82.4~84.1 ℃ (文献[11]: mp 80~83 ℃)。
在250 mL三颈烧瓶中依次加入川芎嗪单氮氧化物 (13.2 g,86.8 mmol) 和乙酸酐 (31.2 mL,330.4 mmol),130 ℃反应5 h,TLC (石油醚-乙酸乙酯1∶1) 检测反应基本完全后,蒸除过量的乙酸酐,得 (3,5,6-三甲基吡嗪-2-基)乙酸甲酯 (3) 黑色浆状物,不经纯化直接投入下一步反应。
将 (3,5,6-三甲基吡嗪-2-基)乙酸甲酯冷却至室温,加入20% NaOH溶液80 mL,室温反应12 h,TLC (石油醚-乙酸乙酯1∶1) 检测反应基本完全,过滤,滤液用二氯甲烷萃取 (3×50 mL),合并有机相,无水Na2SO4干燥,浓缩,石油醚重结晶,得2-羟甲基-3,5,6-三甲基吡嗪 (4),淡黄色针状晶体9.7 g,收率57.8%,mp 75.3~77.2 ℃ (文献[11]: mp 76~78 ℃)。
1.2 3,5,6-三甲基吡嗪-2-甲醛的合成 (5)在250 mL三颈烧瓶中依次加入2-羟甲基-3,5,6-三甲基吡嗪 (9.5 g,62.5 mmol)、MnO2 (16.2 g,187.5 mmol) 和无水乙醇100 mL,回流12 h,TLC (石油醚-乙酸乙酯2∶1) 检测反应基本完全,冷却,过滤,减压回收乙醇,得黄色固体,经硅胶柱色谱 (石油醚-乙酸乙酯4∶1) 纯化,得淡黄色晶体8.8 g,收率93.9%,mp 84.7~86.5 ℃。
1.3 (E)-1-(4-羟基苯基)-3-(3,5,6-三甲基吡嗪-2-基)丙-2-烯-1-酮的合成 (6)在100 mL三颈烧瓶中依次加入3,5,6-三甲基吡嗪-2-甲醛 (2.0 g,13.3 mmol)、4-羟基苯乙酮 (1.5 g,11.0 mmol) 和无水乙醇10 mL,冰浴条件下缓慢滴加20% KOH溶液8.0 mL,冰浴反应10 h,TLC (石油醚-乙酸乙酯2∶1) 检测反应基本完全,将反应液倒入100 mL冰水中,用10% 稀盐酸调节pH 6~7,析出黄色沉淀。过滤,滤饼用无水乙醇重结晶,干燥得黄色晶体1.0 g,收率33.8%,mp 129.7~131.5 ℃ (文献[12]: mp 130~132 ℃)。
1.4 (E)-2-乙基(4-(3-(3,5,6-三甲基吡嗪-2-基)丙烯酰基)苯氧基)乙酯的合成[13] (7a)在100 mL三颈烧瓶中依次加入 (E)-1-(4-羟基苯基)-3-(3,5,6-三甲基吡嗪- 2-基)丙-2-烯-1-酮(1.0 g,3.7 mmol)、ClCH2COOEt (0.6 g,4.9 mmol)、K2CO3 (0.77 g,5.6 mmol)、KI (20 mg) 和DMF 10 mL,90 ℃反应6 h,TLC (石油醚-乙酸乙酯2∶1) 检测反应基本完全。冷却,过滤,滤液加水50 mL,乙酸乙酯 (3×50 mL) 萃取,合并有机相,饱和NaCl溶液 (2×25 mL) 洗涤,无水Na2SO4干燥,浓缩得黄色油状物,经硅胶柱色谱 (石油醚-乙酸乙酯 5∶1) 纯化得淡黄色晶体0.9 g,收率为68.2%,mp 119.1~120.3 ℃。用类似方法合成目标化合物7b~7d和11a~11b,谱图数据见表 2。
1.5 (E)-2-(4-(3-(3,5,6-三甲基吡嗪-2-基)丙烯酰基)苯氧基)乙酸的合成 (8a)在50 mL单颈瓶中依次加入 (E)-2-乙基(4-(3-(3,5,6-三甲基吡嗪-2-基)丙烯酰基)苯氧基)乙酯 (0.8 g,2.3 mmol)、NaOH (0.1 g,2.5 mmol)、乙醇4 mL和水8 mL,室温反应12 h,TLC (石油醚-乙酸乙酯1∶1) 检测反应基本完全。浓缩,残余物加水10 mL,用1% 稀盐酸调节pH 5,析出白色沉淀。过滤,滤饼用无水乙醇重结晶,干燥得白色晶体0.6 g,收率82.2%,mp 230.9~231.3 ℃。用类似方法合成目标化合物8b,谱图数据见表 2。
2 目标化合物生物活性评价 2.1 体外抗血小板聚集实验将雄性新西兰家兔 (体重1.8~2.2 kg) 用1% 盐酸普鲁卡因注射液局部麻醉,颈动脉插管放血,与枸橼酸钠溶液 (0.38 g枸橼酸钠和10 mL生理盐水配制成3.8% 的枸橼酸钠溶液) 以9∶1混合,以1 000 r·min-1离心10 min,取富血小板血浆 (PRP),剩余部分以3 000 r·min-1离心10 min,取贫血小板血浆 (PPP)。采用肝微粒体体外温孵方法: 微粒体体外反应体系一共1 mL,分别取NADP、G-PD、G-PDH、MgCl2以及肝微粒体适量,加入KCl-磷酸盐缓冲液,使反应体系终体积为1 mL,反应体系中分别含0.5 mmol·L-1 NADP、5.0 mmol·L-1 G-6-PD、1.0 U·mL-1 G-6-PDH、5.0 mmol·L-1 MgCl2、1.0 mg·mL-1肝微粒体。取需要进行孵育的筛选药物加入到微粒体反应体系中,于37 ℃水浴中温孵振荡60 min,放入-20 ℃冰箱内终止反应。先取300 μL PPP加入测试杯中,然后放入测试孔,定标。然后取280 μL PRP加 入测试杯中,加入10 μL不同浓度的药液,在37 ℃预温槽中预热3 min,放入测试孔后,按“开始”键时立即加入诱导剂10 μL,以测定最大聚集率,并计算IC50值。按下列公式计算血小板聚集抑制率: 血小板聚集抑制率 (%) = [(空白对照组最大聚集率 - 给药组最大聚集率) / 空白对照组最大聚集率] × 100% 。
2.2 目标化合物对高脂血症C57/BL6小鼠血脂的 影响清洁级雄性健康野生型C57/BL6小鼠84只,随机分成7组,每组12只,分别为空白组 (喂食普 通饲料)、模型组 (喂食高脂饲料)、阳性对照非诺贝特45 mg·kg-1剂量组 (喂食高脂饲料)、化合物7c 45、90 mg·kg-1剂量组 (喂食高脂饲料)、化合物8a 45、90 mg·kg-1剂量组 (喂食高脂饲料)。各组灌胃给药3周,于末次给药后 30 min眼球取血,3 000r·min-1离心 10 min,分离血清,测定小鼠血清中总胆固醇 (TC)、甘油三脂 (TG)、低密度脂蛋白胆固醇 (LDL-C) 和高密度脂蛋白胆固醇 (HDL-C) 的含量,测定方法按照试剂盒说明书进行。数据以平均值±标准差表示,结果用SPSS 17.0软件进行统计分析,用t检验评价实验结果。
| [1] | Ross R. The pathogenesis of atherosclerosis:a perspective for the 1990s[J]. Nature, 1993, 362:801. |
| [2] | Zhao WH, Zhang J, You Y, et al. Epidemiologic characteristics of dyslipidemia in people aged 18 years and over in China[J]. Chin J Prev Med (中华预防医学杂志), 2005, 39:306-310. |
| [3] | Weng XQ, Wang YQ. 80 cases of clinical observation of TCM treatment of phlegm and blood stasis type hyperlipidemia[J]. Clin J Tradit Chin Med (中医药临床杂志), 2006, 18:147-148. |
| [4] | Shukla P, Srivastava SP, Srivastava R, et al. Synthesis and antidyslipidemic activity of chalcone fibrates[J]. Bioorg Med Chem Lett, 2011, 21:3475-3478. |
| [5] | Sashidhara KV, Palnati GR, Sonkar R, et al. Coumarin chalcone fibrates:a new structural class of lipid lowering agents[J]. Eur J Med Chem, 2013, 64:422-431. |
| [6] | Sashidhara KV, Dodda RP, Sonkar R, et al. Design and synthesis of novel indole-chalcone fibrates as lipid lowering agents[J]. Eur J Med Chem, 2014, 81:499-509. |
| [7] | Li JM, Zhao YH, Zhong GC, et al. Synthesis of ferulic acid derivatives and their inhibitory effect on platelet aggregation[J]. Acta Pharm Sin (药学学报), 2011, 46:305-310. |
| [8] | Xie D, Zhang EL, Li JM, et al. Design, synthesis and antiplatelet aggregation activities of ligustrazine-tetrahydroisoquinoline derivatives[J]. Acta Pharm Sin (药学学报), 2015, 50:326-331. |
| [9] | Li JM, Zhao, YH, Ma FS, et al. Synthesis of ligustrazinearomatic acid derivatives and their inhibitory effect on platelet aggregation[J]. Chin J Org Chem (有机化学), 2008, 28:1578-1583. |
| [10] | Li JM, Ma FS, Long ZJ, et al. Synthesis of ((pyridin-3-yl) methoxy) aromatic acid derivatives and their inhibitory effects on platelet aggregation[J]. Chem Res Appl (化学研究与应用), 2011, 23:424-430. |
| [11] | Chen XM, Xu SJ, Ma YW. Synthesis of (3,5,6-trimethylpyrazin-2-yl)methanol and its effect on blood rheology[J]. Chin J Med Chem (中国药物化学杂志), 1996, 6:254-256. |
| [12] | Li GN. Design, Synthesis and Bioactivity Studies of Novel Ligustrazine-chalcone Derivatives (川芎嗪查尔酮类衍生物的设计、合成及其生物活性研究)[D]. Jinan:Shandong University, 2012. |
| [13] | Lee K, Lee JH, Boovanahalli KS, et al. (Arylo-xyacetylamino) benzoic acid analogues:a new class of hypoxia-inducible factor-1 inhibitors[J]. J Med Chem, 2007, 50:1675-1684. |
 2016, Vol. 51
2016, Vol. 51


