2. 山西大学化学化工学院, 山西太原 030006;
3. 山西医科大学第一医院, 山西太原 030001
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. First Hospital of Shanxi Medical University, Taiyuan 030001, China
抑郁症是一种高患病率、高复发率、高致残率和高自杀率的严重精神疾病,已成为危害人类健康的主要疾病之一,终身患病率高达17%[1],2020年可能发展成为世界第二大危害人体健康的疾病负担源[2, 3]。抑郁症临床症状主要表现为抑郁心境、情绪低落、焦虑、失眠、认知障碍甚至自杀倾向[4]。症状的复杂性以及与其他疾病的相关性导致了临床上抑郁症的低检出率和高误诊率。由于缺乏客观标准,目前抑郁症的诊断以及病症的严重程度主要依靠临床医生的主观判断[5],所以研究一种可靠便捷的实验室诊断方法,特别是生物标志物的发现与应用已成为目前研究的热点。
国内外有关抑郁症的治疗药物较多,其中帕罗西汀 (paroxetine) 作为一种选择性5-羟色胺 (5-HT) 再摄取抑制剂 (SSRIs)[6],临床应用较为广泛,疗效较为确切,以此作为干预药物验证抑郁症潜在生物标志物具有一定可行性。本文应用1H NMR代谢组学技术结合多元统计方法分析抑郁症患者血清中内源性代谢产物的变化规律,并以抗抑郁药物帕罗西汀进行干预,发现并验证抑郁症潜在生物标志物,为抑郁症临床诊断提供科学依据。
材料与方法 一般资料疾病组: 病例来源为山西医科大学第一附属医院精神卫生科就诊的抑郁症患者。入组标准: 符合《中国精神疾病分类及诊断标准》(CCMD-3) 诊断标准及汉密尔顿抑郁量表 (HAMD) 临床中重度抑郁症的诊断标准; 年龄32~65岁,男女不限,门诊或者住院患者; 经山西医科大学第一附属医院伦理委员会同意,所有患者签署知情同意书。排除标准: 伴精神病性症状者; 汉密尔顿抑郁量表 (HAMD) 自杀条目评分≥3分; 妊娠期、哺乳期或计划在试验期间妊娠的妇女; 有癫痫病史者; 一年内使用过抗抑郁药物者; 筛选前一个月内参加过其他药物临床试验者; 具有严重的不稳定的躯体疾病者; 一年内有符合诊断标准的酒精和药物滥用或依赖者。健康对照组: 根据与疾病组年龄、性别等相当条件选取,HAMD < 7分,肝肾功能及血常规正常,无精神病史、药物和酒精依赖史等。
药品、试剂和仪器帕罗西汀胶囊 (浙江华海药业股份有限公司提供,国药准字H20031106); D2O购于美国默克试剂公司,SC-3610低速离心机,TGL-6高速台式冷冻离心机,Bruker 600-MHz AVANCE Ⅲ核磁仪 (德国布鲁克公司)。
治疗方案疾病组患者服用抗抑郁药物帕罗西汀两周,一日一次,一次20 mg; 健康对照组不进行任何药物治疗。
血清样本采集对健康对照组、服药两周前后的抑郁症患者使用真空采血管采集5 mL静脉血,室温下3 000 r·min-1离心10 min,取上清液血清分装于EP管中,于-80 ℃保存,待分析。
血清样本的预处理与1H NMR测定血清样本置于冰水混合物中解冻,精密移取450 μL置于EP管中,加入D2O 350 μL,于4 ℃下离心20 min (13 000 r·min-1),取上清液600 μL转移至直径5 mm的核磁管中[7],在Bruker 600 MHz AVANCE Ⅲ NMR仪上 测定。采用CPMG (Carr-Purcell-Meiboom-Gill) 脉冲序列,检测温度25 ℃,FID分辨率0.188 Hz,扫描次数64次,谱宽12 019.2 Hz,脉冲时间14 μs,采样时间2.726 3 s,采样间隔40.5 μs,采样数据点65 536,弛豫延迟1.0 s。
1H NMR图谱处理采用MestReNova (Mestrelab Research,Santiago de Compostella,西班牙) 核磁图谱专业处理软件对所有血清1H NMR图谱进行傅里叶转换,并进行相位、基线调整,以肌酐 (δ 3.04,-CH3) 为标准对图谱进行化学位移校正; 排除δ4.7~5.2区域的水峰,以δ0.01为单位,对δ0.5~8.0 ppm区域的谱图等宽度分割进行分段积分并将数据进行归一化处理,使数据集中在0~1之间,然后采用SIMCA-P 13.0 (Umetric,Sweden) 软件将积分数据进行中心化和规格化后,进行偏最小二乘判别分析(PLS-DA)。
结果 1 图谱指认与分析图 1为血清1H NMR典型谱图,参照文献[8, 9]并结合Chenomx NMR Suite (Chenomx Inc,Edmonton,AB,加拿大) 软件以及HMDB (http://www.hmdb.ca/) 数据库对本实验所得1H NMR图谱进行物质指认,共确认24种化合物,其化学位移和谱峰归属见表 1。
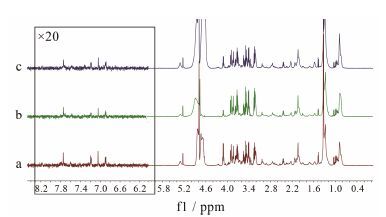
|
Figure 1 Typical 1H NMR spectrum of serum. a: Health; b: Depression; c: Paroxetine |
|
|
Table 1 Chemical shift and multiplicity of identified metabolites |
采用有监督的PLS-DA对所有血清样本进行 1H NMR代谢轮廓分析,结果如图 2a(模型参数为R2X = 0.511,R2Y = 0.898,Q2Y = 0.567),健康对照组与抑郁症患者各自聚集成两组且沿t[1] 轴明显分开; 抑郁症患者在服用帕罗西汀两周后与服药前沿t[2] 轴明显分开且抑郁症患者在治疗后接近于健康对照组并出现部分重叠,表明了药物对抑郁症患者具有显著的治疗作用。进一步对PLS-DA进行模型验证 (图 2b),累积的R2和Q2都低于原始值 (R2 = 0.926,Q2 = 0.538),且R2、Q2的截距为R2 = (0,0.714),Q2 = (0,-0.185),Q2在纵轴上的截距为负值,表明实验所建立的模型未发生过拟合,故PLS-DA散点图的模型验证成立。
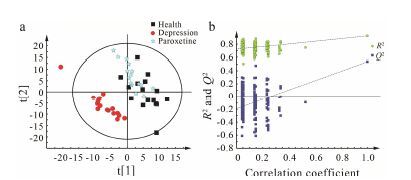
|
Figure 2 PLS-DA scores plot derived from 1H NMR spectra of serum (a) and PLS-DA validation plot derived from 1H NMR spectra of serum (b). The correlation coefficient is between the original and the arrayed data |
为了进一步发现抑郁症患者血清中的潜在生物标志物,对健康对照组、抑郁症患者服用帕罗西汀治疗两周前后的血清样本NMR数据进行PLS-DA分析,得到PLS-DA得分图和VIP图,筛选VIP > 1的代谢产物作为抑郁症潜在生物标志物的候选物质。对健康对照组和抑郁症患者的PLS-DA得分图 (图 3a) 及VIP图 (图 3b) 上VIP > 1的代谢物的峰面积用SPSS软件进行独立样本t检验,最终7个具有显著性水 平差异的血清代谢产物可被认定为抑郁症潜在生物标志物: 亮氨酸、异亮氨酸、丙氨酸、谷氨酸、谷氨酰胺和N-乙酰糖蛋白的水平显著升高,葡萄糖水平显著降低 (P < 0.05,P < 0.01)。同时抑郁症患者服用 帕罗西汀两周前后的PLS-DA得分图 (图 3c) 显示抑郁症患者治疗前后能明显分开,且帕罗西汀能不同程度使7种潜在生物标志物向正常状态回调 (表 2),表明帕罗西汀对抑郁症患者血清潜在生物标志物有显著的干预作用。
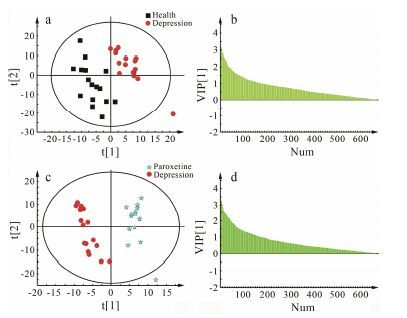
|
Figure 3 PLS-DA scores plot,VIP value derived from 1H NMR spectrum of serum. a,b: Health vs Depression; c,d: Paroxetine vs Depression. Num: The number of metabolites with different VIP values |
|
|
Table 2 Relative peak areas of potential biomarkers in 1H NMR spectra of serum. n = 16,x± s. P < 0.05,**P < 0.01 vs Health; #P < 0.05,##P < 0.01 vs Depression |
采用受试者工作特征曲线(ROC) 对潜在生物标志物进行诊断能力评估,而曲线下面积 (AUC) 的大小反映了潜在生物标志物的诊断能力及其诊断准确性。AUC > 0.9时诊断有较高准确性,0.7~0.9时有一定准确性,0.5~0.7时准确性较低,而AUC ≤0.5时诊断方法完全不起作用,无诊断价值。本实验中所发现的7种潜在生物标志物的ROC和AUC (图 4) 表 明,除葡萄糖外其余6种潜在生物标志物的曲线下 面积分布于0.7与0.9之间,表明其具有一定的诊断准确性。进一步对AUC > 0.8的潜在生物标志物即 N-乙酰糖蛋白和丙氨酸进行综合诊断,其AUC为0.922,说明这两种生物标志物的联合诊断大大提高了对疾病的识别能力。
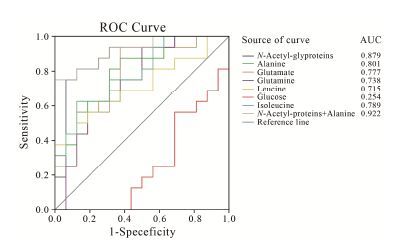
|
Figure 4 Results of ROC analysis and AUC for the potential depression biomarkers |
抑郁症是一种情志障碍性精神疾患,严重危害人类身心健康[10]。抑郁症的发病机制及病因尚不明确,造成了临床上对抑郁症难以诊断,也缺少“金指标”。在抑郁症的发病机制及临床诊断的研究中,越来越多的学者关注于生物标志物的发现及其与抑郁症发病机制的相关性,特征性生物标志物的发现与应用已成为抑郁症诊断的重要研究方向与趋势[11],而代谢组学是发现诊断生物标志物的有效手段之一。
本研究中,结合PLS-DA分析和多元统计分析方法对抑郁症患者和健康对照组两组血清样本的代谢轮廓进行分析,发现亮氨酸、异亮氨酸、丙氨酸、谷氨酸、谷氨酰胺、N-乙酰糖蛋白以及葡萄糖等7种代谢物可被认定为抑郁症患者血清潜在生物标志物。为分析所述潜在生物标志物与抑郁症的关联性,以帕罗西汀为干预药物,经研究发现抑郁症患者服用帕罗西汀两周后,7种代谢物水平表现出不同程度的回调,表明了帕罗西汀对抑郁症血清潜在生物标志物水平具有显著的干预调节作用,进而从药物干预方面证明了潜在生物标志物与抑郁症的内在关联性。
除了药物干预方面的验证,作者对潜在生物标志物相关联的重要代谢途径进行了分析,从而佐证了所述生物标志物与抑郁症的相关性。其中异亮氨酸、亮氨酸称为支链氨基酸,其与5-HT的前体物质存在竞争性抑制作用,影响5-HT前体物质的转运,而5-HT与中枢疲劳的产生密切相关[12, 13]。谷氨酸是一种重要的兴奋性神经递质[14],过度释放的谷氨酸使血清中谷氨酸浓度显著升高而诱发神经毒性作用[15, 16],血清中显著升高的谷氨酰胺有可能是为抵抗谷氨酸所诱发的神经毒性作用而出现的一种补偿适应行为[17, 18]。而血清中丙氨酸水平显著升高[19]以及葡萄糖水平的显著降低是一种能量代谢异常的表现。乙酰糖蛋白是一种急性期蛋白,并作为一种炎症介质[20],这类蛋白水平的变化直观表现了机体对内外因素 (如感染和压力等) 的反应[21]。
本实验进一步以ROC结合AUC的方法对所述抑郁症血清潜在生物标志物对抑郁症的诊断能力进行评估。对各个诊断试验 (或生物标志物) 的ROC的AUC进行比较,AUC值越大则试验的诊断价值越高。研究结果显示除葡萄糖外,其余6种潜在生物标志物的AUC值在0.7~0.9之间,表明这6种潜在生物标志物对抑郁症具有一定的诊断能力,其中以N-乙酰糖蛋白最强,其AUC值为0.879,丙氨酸的诊断能力次之,AUC值为0.801,可作为抑郁症诊断的特征性生物标志物。考虑到以联合检测6种化合物水平并应用于临床诊断的方法具有一定的困难且检测过程复杂,费用昂贵以及诊断的特异性、灵敏度等问题,故对可作为抑郁症诊断的特征性生物标志物的N-乙酰糖蛋白和丙氨酸进行联合检测 (以AUC > 0.8为标准) 并计算综合诊断率,其A UC达到0.922,故生物标志物应用于临床疾病诊断时,联合检测有助于提高其对疾病的诊断能力。
实验中所发现的抑郁症血清潜在生物标志物的诊断能力中等,其与本实验中所收集的样本量较少有关系。且在进行抑郁症血清生物标志物的筛选时,还需考虑到生物标志物在临床上的灵敏性、易检出性及经济性,同时要对一些混杂因素例如饮食对生物标志物水平的影响进行验证排除,这些问题为本实验室后续研究提供了方向和思路。
综上所述,本研究以1H NMR代谢组学技术结合多元统计分析方法在血清中筛选出7种代谢产物并可被认定为抑郁症患者血清中潜在生物标志物,其中N-乙酰糖蛋白和丙氨酸可被认定为抑郁症诊断的特征性生物标志物。结合帕罗西汀药物干预、相关代谢途径分析以及ROC分析对所述潜在生物标志物与抑郁症的相关性及应用于临床诊断的能力进行评估,为发现能够用于抑郁症临床诊断的血清特征生物标志物提供科学依据。
| [1] | Paykel ES, Brugha T, Fryers T. Size and burden of depressive disorders in Europe[J]. Eur Neuropsychopharm, 2005, 15:411-423. |
| [2] | Nestler EJ, Barrot M, DiLeone RJ, et al. Neurobiology of depression[J]. Neuron, 2002, 34:13-25. |
| [3] | Avenevoli S, Swendsen J, He JP, et al. Major depression in the national comorbidity survey-adolescent supplement:prevalence, correlates, and treatment[J]. J Am Acad Child Adolesc Psychiatry, 2015, 54:37-44. |
| [4] | Serretti A, Mandelli L, Lattuada E, et al. Depressive syndrome in major psychoses:a study on 1351 subjects[J]. Psychiatry Res, 2004, 127:85-99. |
| [5] | Kasckow JW, Karp JF, Whyte E, et al. Subsyndromal depression and anxiety in older adults:health related, functional, cognitive and diagnostic implications[J]. J Psychiatry Res, 2013, 47:599-603. |
| [6] | Gorlyn M, Keilp J, Burke A, et al. Treatment-related improvement in neuropsychological functioning in suicidal depressed patients:paroxetine vs. bupropion[J]. Psychiatry Res, 2015, 225:407-412. |
| [7] | Shi B, Tian J, Xiang H, et al. A 1H NMR plasma metabonomic study of acute and chronic stress models of depression in rats[J]. Behav Brain Res, 2013, 241:86-91. |
| [8] | Zheng P, Gao HC, Li Q, et al. Plasma metabonomics as a novel diagnostic approach for major depressive disorder[J]. J Proteome Res, 2012, 11:1741-1748. |
| [9] | Wu Q, Zhang Q, Sun B, et al. 1H NMR-based metabonomic study on the metabolic changes in the plasma of patients with functional dyspepsia and the effect of acupuncture[J]. J Pharm Biomed, 2010, 51:698-704. |
| [10] | Gilbert P. Depression:The Evolution of Powerlessness[M]. London:Psychology Press Ltd., 2014. |
| [11] | Kéri S, Szabó C, Kelemen O. Blood biomarkers of depression track clinical changes during cognitive-behavioral therapy[J]. J Affect Disorders, 2014, 164:118-122. |
| [12] | Carfagno DG, Hendrix JC. Overtraining syndrome in the athlete:current clinical practice[J]. Curr Sport Med Rep, 2014, 13:45-51. |
| [13] | Blomstrand E, Perrett D, Parry-Billings M, et al. Effect of sustained exercise on plasma amino acid concentrations and on 5-hydroxytryptamine metabolism in six different brain regions in the rat[J]. Acta Physiol Scand, 1989, 136:473-482. |
| [14] | Javitt DC. Glutamate as a therapeutic target in psychiatric disorders[J]. Mol Psychiatry, 2004, 9:984-997. |
| [15] | Sapolsky RM. The possibility of neurotoxicity in the hippocampus in major depression:a primer on neuron death[J]. Biol Psychiatry, 2000, 48:755-765. |
| [16] | Palucha A, Pilc A. The involvement of glutamate in the pathophysiology of depression[J]. Drug News Perspect, 2005, 18:262-268. |
| [17] | Mitani H, Shirayama Y, Yamada T, et al. Correlation between plasma levels of glutamate, alanine and serine with severity of depression[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2006, 30:1155-1158. |
| [18] | Ramonet D, Rodriguez MJ, Fredriksson K, et al. In vivo neuroprotective adaptation of the glutamate/glutamine cycle to neuronal death[J]. Hippocampus, 2004, 14:586-594. |
| [19] | Peng GJ, Shi BY, Tian JS, et al. 1H NMR-based metabonomics study on the antidepressant effect of genipin in rat hippocampus[J]. Acta Pharm Sin (药学学报), 2014, 49:209-216. |
| [20] | Saric J, Li JV, Swann JR, et al. Integrated cytokine and metabolic analysis of pathological responses to parasite exposure in rodents[J]. J Proteome Res, 2010, 9:2255-2264. |
| [21] | Zheng X, Tian J, Liu P, et al. Analysis of the restorative effect of Bu-zhong-yi-qi-tang in the spleen-qi deficiency rat model using 1H NMR-based metabonomics[J]. J Ethnopharmacol, 2014, 151:912-920. |
 2016, Vol. 51
2016, Vol. 51


