癫痫(epilepsy) 是脑部区域神经元短暂弥漫性异常放电导致的神经功能紊乱综合征,具有反复性、发作性、短暂性和不可控特征。发病率高、病程长、难治愈,严重影响患者的身心健康和生活质量。据国际卫生组织统计全世界约有1 000多万儿童患有癫痫,约占癫痫患者总数1/4,并且癫痫患者以每年300万~500万的速度增加,因此癫痫严重威胁着人类的身心健康,并带来巨大的财产损失和社会负担[1, 2, 3, 4]。因而癫痫也是一种重要的公共卫生和社会问题。临床诊断主要以病史、脑电图检查结合症状为主。过去15年由于脑电诊断、病因诊断以及神经影像学诊断的发展帮助了癫痫的分类,促进了癫痫的对症治疗。近几年新抗癫痫药物的应用虽然明显减轻了患者的癫痫发作并可治愈部分患者,但是有些药物可导致患者记忆和运动能力下降,对后代具有致畸致突变等药源性毒副作用,且约有1/3患者服用这些药物无效[5, 6],急需新药的出现。因此寻找新的抗癫痫药物迫在眉睫,而建立高效、可靠的体内药效筛选模型和方法成为新药研发的关键技术之一。
目前用于抗癫痫药物筛选的主要模型为大鼠和小鼠模型,但这些模型在大规模药效筛选和基础研究方面均存在局限性。斑马鱼作为低等脊椎动物在医药领域研究中的优越性,已愈来愈受到高度重视。作为研究用模式动物,斑马鱼与实验室传统的模式动物如大鼠和小鼠有很多互补性,在组织器官的结构和功能上与哺乳动物类似,斑马鱼遗传信息与人类较接近[7]。斑马鱼在受精后5天脑部发育较成熟,可以用于神经系统疾病的研究; 其高产卵量、低廉的成本及其方法学上的优势使其成为研究癫痫的优秀模型[7, 8]。斑马鱼胚胎发育5天即可自主游动,利用斑马鱼幼鱼行为检测仪可分析化合物或基因改变对斑马鱼行为的影响,结合基因及蛋白水平检测,可研究癫痫发生发展的分子基础,探索癫痫潜在的病理机制。
戊四氮 (pentylenetetrazole ,PTZ) 是一种γ-氨基丁酸转氨酶抑制剂,可抵抗γ-氨基丁酸对神经活动的抑制作用,常用于啮齿类动物癫痫模型造模; 也可以引起斑马鱼幼鱼及成鱼发生多动、抽搐和瘫痪等癫痫样反应[9]。已有文献报道,利用PTZ作用于斑马鱼不同时期,如发育2天、4天的胚胎和幼体[10]、7天的幼体[11],可分别检测到癫痫相关的c-fos基因变化、行为变化和脑神经元放电指征。然而,不同给药时期、造模药与治疗药给药顺序的不同均会导致模型效果和药效的差异。因此综合考虑多篇文献的造模参数,并在预实验的基础上,确定了一组PTZ诱导斑马鱼癫痫模型的条件,在行为表型和癫痫标志基因两个层面,验证了模型的可信性。在此模型基础上,对两个先导化合物进行了抗癫痫药效检测。本研究不仅为抗癫痫先导化合物的药效筛选提供了更为合理可靠的高效筛选平台,也为研究癫痫发病机制提供了研究平台。
材料与方法 药品与试剂斑马鱼 (Danio rerio) 野生型 (wild type,WT) AB品系由清华大学生命科学学院孟安明教授惠赠。PTZ (P6500)、丙戊酸钠 (valproate,VPA,P4543) 购自Sigma-Aldrich公司。头孢他啶(ceftazidine,CAZ) 购自中国食品药品检定研究院。Y53和BMT均为小檗碱的结构类似物,由宋丹青教授课题组合成,纯度不低于95%。高级海水晶购自天津中盐海洋生物科学有限公司。反渗水 (电导率为20~40 S·cm-1) 用纯水机 (北京爱生科技发展有限公司) 制备。
斑马鱼的饲养与繁殖斑马鱼养殖于 (28.5 ± 1) ℃的饲养水中,主要饲养条件和受精卵收集见文献[12]。参照文献[13]配制斑马鱼饲养用水,高级海水晶20 g加入80 L反渗水中,搅匀。
药液的配制以斑马鱼饲养液为溶剂配制PTZ母液100 mmol·L-1,VPA、CAZ、Y53、BMT母液 10 mmol·L-1,保存于4 ℃。临用前用斑马鱼饲养液稀释至测试浓度。
行为学检测癫痫模型组: 7 dpf (day post fertilization) 斑马鱼幼鱼分组给予2、4和6 mmol·L-1 PTZ后,立即将其置于48孔板中,每孔一条鱼,放入斑马鱼行为轨迹跟踪系统 (Daniovision,zebralab 3.3,法国ViewPoint Life Sciences Inc.) (简称: 斑马鱼行为仪) 中静置10 min后记录斑马鱼行为20 min,每2分钟采集一次数据[14]。每组8条斑马鱼幼鱼。然后在光变化条件下检测幼鱼的行为变化: 将给药后的幼鱼置于斑马鱼行为仪中,黑暗中5 min后立即给予光刺激10 s,如此转换3次,每10秒记录数据一次; 计算各组平均运动总距离与平均速度。
VPA和CAZ药物处理组: 取7 dpf幼鱼分为4组,将PTZ (4 mmol·L-1) 与VPA或与CAZ同时给药,VPA和CAZ的浓度均分别为60、300 μmol·L-1,600、1 200 μmol·L-1,PTZ单独给药为癫痫对照组,WT组为正常对照组。各组给药后立即放入48孔板检测,每孔放1条幼鱼,每组8条幼鱼,在斑马鱼行为分析仪中静置10 min后开始记录,黑暗下记录20 min,每2分钟内统计一次数据,跟踪记录各处理组幼鱼游泳行为。以斑马鱼各处理组20 min内平均运动总距离与平均速度为癫痫发作指征进行数据处理和分析。然后同上述在光变化条件下检测给药前后幼鱼的行为变化。
RT-PCR方法检测癫痫标志基因转录水平5 dpf幼鱼分别给予VPA 60、120和240 μmol·L-1,WT组为正常对照组,给药至第7 dpf; 洗去药液后给予PTZ (4 mmol·L-1) 1 h,以PTZ单独给药组为癫痫模型对照组,收集各组幼鱼各30条。用Trizol试剂提取总RNA,用AMVA反转录试剂盒 (Promega公司) 合成cDNA 1st模板,PCR检测癫痫相关的c-fos基因表达水平。20 μL体系,反应条件95 ℃ 5 min,94 ℃ 30 s,58 ℃/55 ℃ 30 s,72 ℃ 1 min,72 ℃ 10 min。PCR引物和序列见表 1。产物以1% 琼脂糖凝胶电泳,凝胶成像分析仪(Bio-RAD Gel DOCTM XR) 拍照记录。
|
|
Table 1 PCR primer sequences and PCR parameters |
原位杂交实验方法参照文献[15]。取7 dpf斑马鱼幼鱼给予4 mmol·L-1 PTZ 1 h后收取样品,ddH2O洗3遍后,加入4%多聚甲醛 (polyformaldehyde,PFA),置于4 ℃过夜固定。第二天吸出4% PFA,加入无水乙醇,置于-20 ℃脱水至少2 h。RNA探针制备的基本程序: 利用PCR克隆斑马鱼目的基因片段,连接到pBluescript KS质粒载体上作为RNA探针模板; 正义和反义RNA探针按照地高辛RNA标记试剂盒 (T7/SP6),(Roche公司,1175041) 合成。
Western blot方法检测NeuN蛋白水平表达7 dpf斑马鱼幼鱼给予4 mmol·L-1 PTZ 1 h后收取样品,ddH2O洗3遍后,利用RIPA裂解液 (北京普利莱基因技术有限公司,C1053) 提取蛋白用于后续蛋白电泳检测。NeuN抗体购自Millipore公司 (2424507)。
数据处理无光刺激数据为20 min内斑马鱼运动的总距离及平均速度,光刺激数据为10 s (每10秒采集一次数据) 内斑马鱼运动总距离及平均速度,各处理组中8条幼鱼运动总距离和平均速度各取平均值用于柱状图分析,各处理组与WT组或与单独PTZ处理组数据比较,进行统计学分析 (t-test)。
结果 1 PTZ导致斑马鱼幼体癫痫样行为将7 dpf斑马鱼幼鱼暴露于不同浓度的PTZ溶液 (2、4、10和15 mmol·L-1) 1 h,显微镜下观察发现,斑马鱼幼体躯干出现浓度依赖性的背部弯曲甚至扭曲 (图 1A),并观察到这种身体改变是由于斑马鱼剧烈抽搐导致的,这种身体扭曲与人类癫痫发作症状十分相似; 还出现了不规则转圈游动,游速加快,间歇性地剧烈游动以及侧翻等行为。这种状态在脱离PTZ环境后可以恢复常态。用斑马鱼行为检测仪测量发现,PTZ模型组幼体的运动总距离和平均速度呈浓度依赖性增加(图 1B和1C),运动轨迹图呈现过度兴奋状态 (图 1F)。在光刺激条件下,幼体这种过度兴奋状态更加剧烈,光刺激下运动总距离及平均速度比黑暗条件下增加数倍,与WT组相比各浓度组都具有显著性差异 (图 1D和1E)。斑马鱼这种光刺激的过激反应可以模拟癫痫患者受刺激后的癫痫发作。
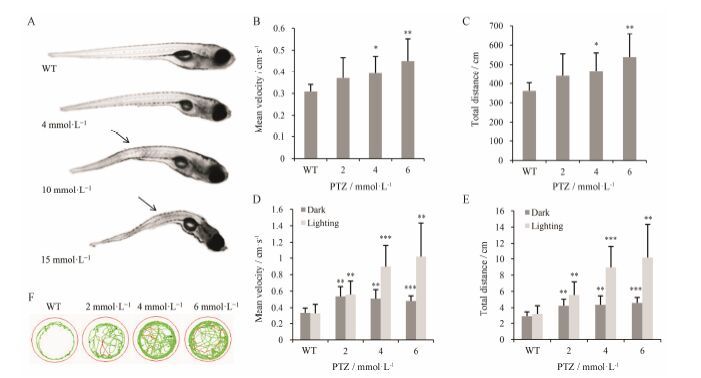
|
Figure 1 Pentylenetetrazole (PTZ) induced seizure behavior in zebrafish larvae. A: The larvae exposed to PTZ at 7 dpf (day post fertilization) presents body trunk distortion and convulsion in a concentration-dependent manner. Arrows indicate the body distortion positions. B,C: Average speed and total distance in 20 min in dark,respectively; D,E: Under the condition of light-dark transition with repeating 3 times via in dark 20 min to light stimulation for 10 s,the data show average speeds in 20 min in dark and in 30 s in light stimulation; locomotion distances per 10 s in dark and in light. n = 8,x± s. P < 0.05,**P < 0.01,***P < 0.001 vs wild type (WT). F: Swim behavioral tracks were recorded in 2 min in dark condition |
给予临床治疗癫痫药VPA,结果显示VPA对斑马鱼幼体的癫痫行为具有治疗作用。以癫痫模型组为对照,运动总距离和平均速度呈现VPA浓度依赖性降低,当浓度达1 200 μmol·L-1时幼体状态接近正常对照。斑马鱼运动轨迹图也显示相同趋势 (如图 2Aa、b、e)。光刺激实验显示,VPA给药组可更显著地抑制光刺激导致斑马鱼的过度兴奋反应 (如图 2Ac、d)。这些结果说明,VPA对PTZ诱导的斑马鱼癫痫模型具有与临床癫痫患者类似的治疗效果,也提示该斑马鱼癫痫模型模拟了人类癫痫病的部分特征。
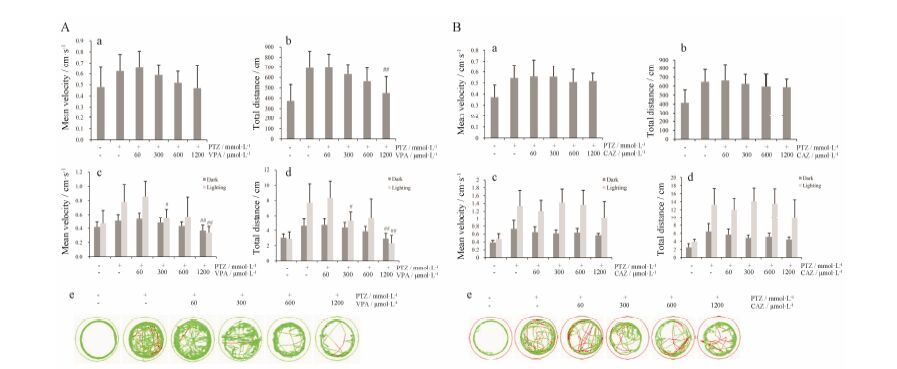
|
Figure 2 Drugs effects on seizure behavior in PTZ-zebrafish larval model. A: Valproate (VPA) inhibited the larval over-exciting locomotion in speed and distance under both conditions of non-stimulation condition (a,b,e) and cycling-lightning stimulation (c,d) in the PTZ-larval model. B: Ceftazidime (CAZ,as a negative control) did not inhibit seizure behavior in PTZ-zebrafish larvae in locomotion speed and distance under both conditions of non-stimulation (a,b,e) and of cycling-lightning stimulation (c,d). n = 8,x± s. #P < 0.05,##P < 0.01 vs PTZ model |
为了进一步验证斑马鱼癫痫模型的可信性,采用临床上非癫痫治疗药物CAZ,按照VPA方法同样处理斑马鱼癫痫模型幼体,以检测癫痫模型幼体对癫痫药物的专属性反应。已知CAZ在临床上不良反应多为胃肠道反应和皮疹; 神经毒性方面,偶见头痛、眩晕,罕见癫痫发作。检测结果显示,CAZ无论在运动速度还是运动距离上均未能降低癫痫模型鱼的过度运动参数; 游泳轨迹图也未显示行为的改善——仍与癫痫模型类似。CAZ对光刺激下的过度兴奋的癫痫幼体也未见明显影响(图 2B)。这些结果提示,PTZ诱导的斑马鱼癫痫模型对非癫痫药物是无反应的,从反面证明该癫痫模型是可信的。
3 癫痫相关基因和蛋白的表达变化对斑马鱼癫痫模型的验证为了在基因和蛋白水平上进一步验证斑马鱼癫痫模型的可靠性,采用RT-PCR和原位杂交的方法检测了癫痫相关基因c-fos和lgi1的表达水平。基因c-fos已经被公认是癫痫标志基因,c-fos信号的强弱与癫痫程度呈正相关[16]。lgi1基因编码一种神经元分泌蛋白,新近研究发现该基因缺陷与听觉刺激的癫痫发作相关[17]。RT-PCR结果显示,模型组斑马鱼随着PTZ浓度的提高,其c-fos mRNA水平也随之提高; 当加入VPA后,c-fos则随着VPA浓度的提高而下降 (图 3A和3B)。原位杂交结果显示,随着PTZ浓度的提高,c-fos信号在斑马鱼幼体脑区增强和范围扩大 (图 3C); 加入VPA后,则出现VPA浓度依赖性的c-fos信号减弱和范围缩小 (图 3D)。而lgi1基因则与c-fos的变化相反,随着PTZ浓度的提高斑马鱼脑区lgi1转录信号减弱 (图 3C); 而VPA的加入则使得lgi1信号出现VPA浓度依赖性地增强 (图 3D)。另有文献[18]报道脑成熟神经元标志蛋白神经核NeuN在癫痫患者海马中减少,因此又用Western blot方法检测了斑马鱼癫痫模型中是否有这种变化。结果显示NeuN蛋白呈PTZ浓度依赖性降低; 当给予VPA后,NeuN蛋白水平随着VPA浓度的升高而升高 (图 3E)。上述结果说明,PTZ诱导的斑马鱼幼体癫痫模型具有在人类和哺乳动物模型中的癫痫相关基因和蛋白的变化特征; VPA可使得PTZ导致的基因表达失常得以恢复至近正常水平。在分子水平再次验证了上述斑马鱼癫痫模型的可信性。

|
Figure 3 Expression of epilepsy-related genes were regulated by PTZ and VPA in zebrafish larvae. A,B: Transcription level of epilepsy-marker gene c-fos was elevated by PTZ treatment (A) and descended by VPA action in the PTZ-model (B) in a concentration- dependent manner using RT-PCR detection. C: PTZ caused c-fos signal enhanced and lgi1 signal decreased in the larval brain by analysis of in situ hybridization. D: VPA rescued c-fos’ elevating and lgi1’s descending to close to the normal level. E: Western blot test indicated that brain matured-neuron marker protein NeuN decreased by PTZ and increased by VPA also in their concentration- dependent manner. n = 5,x± s. P < 0.05,**P < 0.01 vs WT; ##P < 0.01,###P < 0.001 vs PTZ model |
为了检验上述斑马鱼癫痫模型的实用性,本研究对多种化合物进行了筛选,发现两种先导化合物Y53和BMT (均为小檗碱的结构类似物) (图 4) 对斑马鱼癫痫模型具有治疗作用且药效比VPA更强。结果如图 4所示,Y53可有效抑制斑马鱼在光刺激下的过度兴奋运动,但对无刺激时的兴奋运动抑制作用不明显 (图 4A)。与之相反,先导化合物BMT对光刺激下的过度兴奋运动未见明显的抑制作用,而对无刺激时的兴奋行为抑制作用明显 (图 4B)。由此也表明,该癫痫模型对作用机制不同的化合物具有一定辨识力。
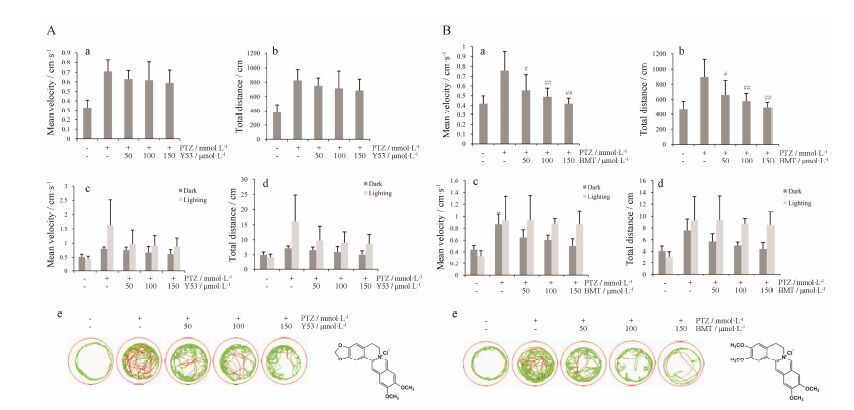
|
Figure 4 Effects of the two leading compounds on seizure behavior induced by PTZ in zebrafish larval model. A: The larval seizure behavior (locomotor distance and swimming velocity) was not obviously reduced under dark condition (a,b,e),but was suppressed under cycling-lighting condition by Y53 treatment in the PTZ-larval model (c,d). B: The larval seizure behavior (locomotor distance and swimming velocity) was notably inhibited under dark condition (a,b,e),but not affected much under cycling-lightning stimulation in the PTZ-larval model treated by BMT (c,d). n = 8,x± s. #P < 0.05,##P < 0.01 vs PTZ model |
动物癫痫模型是否具有临床癫痫病的特征,关系到该模型的可靠性。目前用于癫痫疾病研究的主要模型为大鼠和小鼠模型,但其在大规模药物筛选方面具有局限性,如不适于高通量筛选和高成本,也不适于进行分子机制的研究。为此本课题组建立并鉴定了适于高通量筛选、低成本的斑马鱼幼鱼癫痫模型。国外已有关于PTZ诱导的斑马鱼模型的文献报道,但所用斑马鱼时期不同,如2 dpf、4 dpf[10]、7 dpf、45 dpf和成体 (6~8 mpf) 等[19]。多数研究依赖于斑马鱼成体模型,抗癫痫药效以痉挛发作时间的延后和脑电图变化为检测指标[20, 21]; 此类成体模型具有与临床指征相关的行为学和脑电特征,但受制于特殊仪器和技术,且不易进行基因和蛋白标志物的检测。对大于7 dpf斑马鱼癫痫模型也是以行为学指标来检测抗癫痫化合物药效的。而对于胚胎期癫痫模型,则以癫痫标志基因c-fos表达图式的变化为检测指标,虽然在基因水平有较好的显示度,但给药时期过早易导致脱靶,且不易检测行为学指标[10]。而行为学指标与临床诊断指征紧密相关,是动物癫痫模型可信度的重要指标,不可或缺。分子机制研究又关系到新药靶的发现和确定,同样需要适当的癫痫模型。为了将基因/蛋白生物标志物与行为学指征相结合,建立更准确可靠的斑马鱼癫痫模型,本研究选择7 dpf幼体进行癫痫模型的建模研究,因这一时期的斑马鱼幼体,在行为学上可以自由游动,且已具有较强的避险行为和神经反应能力; 而其脑结构的复杂度,可以满足基因操作的条件。结果证明,7 dpf幼体对PTZ敏感性与成体斑马鱼类似,可以呈现癫痫样的过度兴奋运动行为; 此外,采用基因整体原位杂交技术来检测癫痫标志基因c-fos和lgi1在脑中的表达强度和分布变化,显示出明显的PTZ和VPA浓度依赖性的相反变化。这些检测数据在行为学和基因表达图式上的高度吻合,证明斑马鱼7 dpf幼体即可用于行为学检测,也适于基因操作。
PTZ是一种常用的癫痫造模药,其原理是利用PTZ的中枢神经兴奋作用,增加神经元对钾离子的通透性,导致脑神经元的过度兴奋而引起惊厥[22]。近几年研究发现,基因lgi1突变的个体具有易患遗传性癫痫综合征的倾向。lgi1编码一种富含亮氨酸的神经胶质瘤失活因子I的分泌蛋白,是发现的第一个不编码离子通道蛋白的癫痫病相关基因。lgi1基因的突变,与伴有听觉异常的常染色体显性颞叶癫痫相关,该基因的下调,可增加斑马鱼对PTZ的敏感性[17, 23]。那么,PTZ处理是否会影响lgi1基因的表达,或者说lgi1基因的失调是否也参与了PTZ诱导的斑马鱼癫痫样病理过程?本研究通过RT-PCR和原位杂交实验的检测,发现lgi1基因的表达确实受到了PTZ的抑制,而VPA可以恢复lgi1在斑马鱼脑区的表达水平。这一结果提示,lgi1基因水平与PTZ-癫痫程度呈负相关; PTZ诱导的癫痫模型也涉及到lgi1基因的下调。推测lgi1基因参与了PTZ诱导的斑马鱼癫痫样病理过程和VPA的治疗过程。加之神经元成熟标志蛋白NeuN的相同变化,从另一方面验证了所建模型的可信性。通过这些与临床癫痫诊断相关的行为学实验和癫痫基因、蛋白水平检测,证明PTZ诱导的癫痫模型与人类癫痫疾病发作极为相似,可以用于抗癫痫药物筛选。
抗癫痫先导化合物Y53和BMT对不同刺激下的斑马鱼癫痫症状出现差异性治疗作用: Y53可以减弱斑马鱼癫痫模型的光刺激反应; BMT可减缓非刺激下斑马鱼癫痫模型的过度运动,说明两种化合物的作用机制有所不同。另外也证明所建斑马鱼癫痫模型对不同作用机制的化合物具有一定的辨识能力。
综上所述,本研究所构建的斑马鱼幼体癫痫模型可以模拟常规哺乳动物癫痫模型并替代斑马鱼成体癫痫模型,用于抗癫痫先导化合物的筛选和抗癫痫药物的药理研究。该模型具有操作简便、成本低廉、适于多种研究技术操作的优越性,为抗癫痫先导化合物的高通量筛选提供了快速、简便、灵敏的初筛平台。
致谢: 孟杰技师对斑马鱼实验材料的保障。
| [1] | Forsgren L. Incidence and prevalence[M]//SJ Wallace, K Farrell. Epilepsy in Children. Boca Raton:CRC Press, 2004:21-25. |
| [2] | Casetta I, Pugliatti M, Faggioli R, et al. Incidence of childhood and adolescence epilepsy:a community-based prospective study in the province of Ferrara and in Copparo, Italy, 1996-2005[J]. Eur J Neurol, 2012, 19:312-316. |
| [3] | Cowan LD. The epidemiology of the epilepsies in children[J]. Ment Retard Dev Disabil Res Rev, 2002, 8:171-181. |
| [4] | Poduri A, Lowenstein D. Epilepsy genetics——past, present, and future[J]. Curr Opin Genet Dev, 2011, 21:325-332. |
| [5] | Guerrini R. Epilepsy in children[J]. Lancet, 2006, 367:499-524. |
| [6] | Petrovski S, Kwan P. Unraveling the genetics of common epilepsies:approaches, platforms, and caveats[J]. Epilepsy Behav, 2013, 26:229-233. |
| [7] | Hortopan GA, Dinday MT, Baraban SC. Zebrafish as a model for studying genetic aspects of epilepsy[J]. Dis Model Mech, 2010, 3:144-148. |
| [8] | Stewart AM, Braubach O, Spitsbergen J, et al. Zebrafish models for translational neuroscience research:from tank to bedside[J]. Trends Neurosci, 2014, 37:264-278. |
| [9] | Stewart AM, Desmond D, Kyzar E, et al. Perspectives of zebrafish models of epilepsy:what, how and where next?[J]. Brain Res Bull, 2012, 87:135-143. |
| [10] | Baxendale S, Holdsworth CJ, Meza Santoscoy PL, et al. Identification of compounds with anti-convulsant properties in a zebrafish model of epileptic seizures[J]. Dis Model Mech, 2012, 5:773-784. |
| [11] | Afrikanova T, Serruys AS, Buenafe OE, et al. Validation of the zebrafish pentylenetetrazol seizure model:locomotor versus electrographic responses to antiepilepticdrugs[J]. PLoS One, 2013, 8:e54166. |
| [12] | Zhao Z, Tong JW, Zhang JP, et al. Zebrafish model for the study on drug ototoxicity of aminoglycoside antibiotics[J]. Acta Pharm Sin (药学学报), 2011, 46:928-935. |
| [13] | Parng C, Ton C, Lin YX, et al. A zebrafish assay for identifying neuroprotectants in vivo[J]. Neurotoxicol Teratol, 2006, 28:509-516. |
| [14] | Baraban SC. Modeling epilepsy and seizures in developing zebrafish larvae[M]//Pitkänen A, Schwartzkroin PA, Moshé SL. Models of Seizures and Epilepsy. Burlington:Elsevier Academic Press, 2005:189-198. |
| [15] | Zhang CX, Liu F. A brief protocol for high-resolution whole mount in situ hybridization in zebrafish[J]. Hereditas (遗传), 2013, 35:522-528. |
| [16] | Baraban SC, Taylor MR, Castro PA, et al. Pentylenetetrazole induced changes in zebrafish behavior, neural activity and c-fos expression[J]. Neuroscience, 2005, 131:759-768. |
| [17] | Boillot M, Huneau C, Marsan E, et al. Glutamatergic neuron-targeted loss of lgi1 epilepsy gene results in seizures[J]. Brain, 2014, 137:2984-2996. |
| [18] | Engel T, Schindler CK, Sanz-Rodriguez A, et al. Expression of neurogenesis genes in human temporal lobe epilepsy with hippocampal sclerosis[J]. Int J Physiol Pathophysiol Pharmacol, 2011, 3:38-47. |
| [19] | Siebel AM, Menezes FP, da Costa Schaefer I, et al. Rapamycin suppresses PTZ-induced seizures at different developmental stages of zebrafish[J]. Pharmacol Biochem Behav, 2015, 139 Pt B:163-168. |
| [20] | Torres-Hernández BA, Del Valle-Mojica LM, Ortíz JG. Valerenic acid and Valeriana officinalis extracts delay onset of pentylenetetrazole (PTZ)-induced seizures in adult Danio rerio (zebrafish)[J]. BMC Complement Altern Med, 2015, 15:228. |
| [21] | Siebel AM, Menezes FP, Capiotti KM, et al. Role of adenosine signaling on pentylenetetrazole-induced seizures in zebrafish[J]. Zebrafish, 2015, 12:127-136. |
| [22] | Du LJ, Zhao YN. Laboratory Animals and Experimental Animal Models (实验动物与实验动物模型)[M]. Beijing:China Medical Science Press, 2012:56. |
| [23] | Teng Y, Xie X, Walker S, et al. Loss of zebrafish lgi1b leads to hydrocephalus and sensitization to pentylenetetrazol induced seizure-like behavior[J]. PLoS One, 2011, 6:e24596. |
 2016, Vol. 51
2016, Vol. 51


