2. 齐齐哈尔医学院, 黑龙江齐齐哈尔 161006
2. Qiqihar Medical College, Qiqihar 161006, China
目前,乳腺癌已成全世界女性最常见的恶性肿瘤之一,发病率呈逐年增高趋势,严重威胁着女性的健康[1, 2, 3]。其中三阴性乳腺癌约占乳腺癌人群的10%~16%[4],临床发病具有年龄小、增殖活性高、侵袭能力强和预后差等特点,受到众多学者们的重视[5]。狼毒大戟作为中药已广泛应用于临床,其中有效成分羽扇豆醇具有很好的抗肿瘤活性[6]。但其对乳腺癌的侵袭和转移是否有作用未见报道,所以本研究通过细胞黏附、迁移等行为学实验及Western blot方法,观察不同浓度的羽扇豆醇对人乳腺癌MDA- MB-231细胞侵袭转移能力的影响,并对其相关机制进行初步探讨。
材料与方法 主要试剂羽扇豆醇购自上海宝曼生物科技有限公司; 胎牛血清 (FBS) 和人工基质胶matrigel购自Hyclone公司; L-15培养基、BSA蛋白浓度试剂盒和ECL高灵敏度化学发光试剂盒购自碧云天生物技术公司; Transwell小室购自Costar公司; 金属基质蛋白2 (MMP-2)、MMP-9、环氧化酶2 (COX-2)、核转录因子NF-κB和NF-κB p65抗体购自细胞信号公司。
细胞培养人乳腺癌MDA-MB-231购自中国科学院上海细胞库,使用含10% FBS的L-15培养基,放入37 ℃、5% CO2的细胞培养箱中培养。0.25% 胰酶消化传代。
羽扇豆醇贮存液的配制取6.4 mg羽扇豆醇溶于500 μL DMSO和乙醇1∶1混合的溶液中 (加热促溶)。即配成30 mmol·L-1的母液,4 ℃保存待用。实验过程中按需要进行稀释。
MTT法检测细胞生长以每孔7 000个人乳腺癌MDA-MB-231细胞接种到96孔板中。待细胞贴壁后,加入羽扇豆醇 (终浓度分别为0、2.5、5和10 μmol·L-1) 置于培养箱中培养24 h。每孔加MTT溶液 (5 mg·mL-1) 20 μL,继续孵育4 h,终止培养,小心弃去上清液,每孔加DMSO 150 μL,震荡10 min,使紫色结晶物充分溶解。酶标仪测OD570,记录结果。
细胞与matrigel黏附实验用matrigel包被96孔板,放置37 ℃ 60 min成胶,弃上清液,用2% 的BSA封闭30 min,PBS洗板3次待用。消化乳腺癌 细胞,使其呈单细胞悬液,计数,按每孔5×104个细胞计算,重悬于1 mL完全培养基中,加入羽扇豆醇 (终浓度分别为0、2.5、5和10 μmol·L-1),将细胞分别加入已被matrigel包被的96孔板中,每个浓度组设3个复孔,置于37 ℃、5% CO2培养箱中黏附2 h,PBS洗去未黏附的细胞,0.1% 结晶紫染色30 min,显微镜下记录5个视野细胞数,计算平均值。
细胞侵袭力实验用matrigel稀释液均匀地铺在transwell上室底部膜的内表面,37 ℃培养箱成胶30 min,按每孔1×105个细胞重悬于200 μL含1% 血清培养基中,并分别加羽扇豆醇 (终浓度分别为0、2.5、5和10 μmol·L-1),加入到上室,下室加含10% FBS的培养基600 μL,培养24 h。取出小室,用棉 签擦去上室细胞,穿过膜的细胞浸泡在甲醇中固定30 min,风干后用0.1% 结晶紫染色30 min,PBS冲洗 3次,显微镜拍照。染色细胞用10% 醋酸溶解,酶标仪测OD570,记录结果。
伤口愈合细胞划痕实验取24孔板,用marker笔在板底均匀画横线,作为标记。每孔加5×105个细胞,细胞贴壁后,用枪头垂直于背后的横线划痕,PBS洗去掉落的细胞,加入羽扇豆醇 (终浓度为0、2.5、5和10 μmol·L-1),用含1% FBS的培养基培养,24 h镜下拍照。通过测定各划痕在对应时间点的宽度计算细胞迁移的距离。计算公式为: 细胞迁移距离 = (0 h划痕宽度 - 各时间点划痕宽度) / 2。
Western blot人乳腺癌MDA-MB-231按2×106个细胞种于6 cm培养皿中,培养过夜,待细胞贴壁后加入相应浓度 (0、2.5、5和10 μmol·L-1) 的羽扇豆醇。加药后24 h提取总蛋白。细胞用细胞裂解液50 μL冰上充分裂解30 min。12 000 r·min-1 4 ℃离心15 min,收集上清液,采用BSA法测定蛋白浓度。取30 μg蛋白样品进行SDS-聚丙烯酰胺凝胶电泳,转膜后,NC膜用5% 脱脂奶粉封闭,4 ℃过夜。加入抗MMP-2 (1∶1 000)、MMP-9 (1∶1 000) 和COX-2 (1∶1 000) 的抗体室温3 h。TBST洗膜3次。加入相应的二抗 (1∶ 5 000),室温2 h,1×TBST洗膜3次。用ECL Western blot化学发光试剂盒显色检测,以GAPDH为内参。
统计学方法应用SPSS 13.0统计软件进行结 果分析。计量资料均以x± s表示,多组间比较采用One-Way ANOVA,两组间比较采用Q检验。
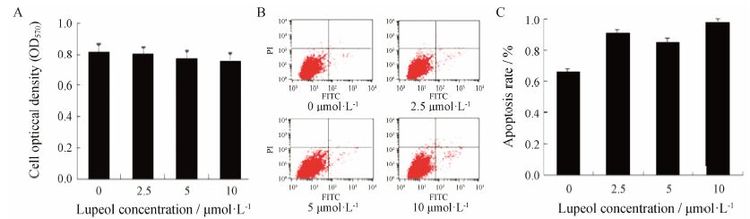
结果 1 羽扇豆醇对人乳腺癌MDA-MB-231细胞24 h生长和凋亡的影响采用MTT法和流式细胞术分别检测羽扇豆醇对人乳腺癌MDA-MB-231细胞生长和凋亡的影响,统计分析结果显示,2.5、5、10 μmol·L-1羽扇豆醇作用24 h对细胞生长和凋亡均无显著影响 (P > 0.05),结果如图 1A~C所示。
|
Figure 1 Effect of lupeol on the proliferation (A) and apoptosis (B,C) of MDA-MB-231 breast cancer cells for 24 h (P > 0.05) |
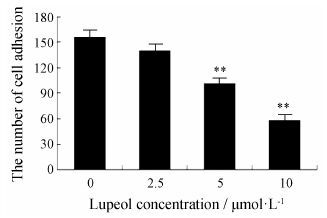
为明确羽扇豆醇是否对人乳腺癌MDA-MB-231的黏附有抑制作用,采用细胞黏附实验测定不同浓度羽扇豆醇处理的人乳腺癌MDA-MB-231的黏附能力。如图 2所示,随羽扇豆醇浓度增加,细胞的黏附数逐渐减少,呈浓度依赖关系 (P < 0.01)。
|
Figure 2 Lupeol suppressed cell adhesion to matrigel in MDA-MB-231 cells. The numbers of cell adhesion were shown as x± s. **P < 0.01 vs control group |
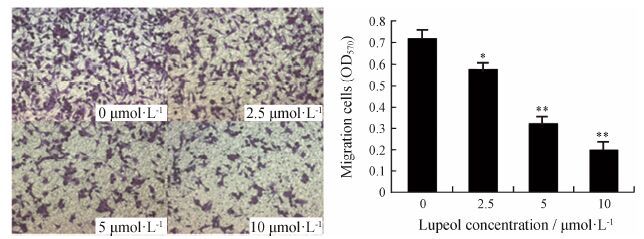
由于人乳腺癌MDA-MB-231细胞恶性程度高,侵袭能力强,所以本实验采用transwell小室检测肿瘤细胞对细胞外基质的侵袭作用,以不同浓度的羽扇豆醇处理人乳腺癌MDA-MB-231,观察计算各组侵袭率的变化。实验结果如图 3显示,随着浓度的增加,肿瘤细胞侵袭能力逐渐降低,差异具有统计学意义 (P < 0.05)。
|
Figure 3 Lupeol suppressed invasion of MDA-MB-231 cells (magnification×100). The optical densities at 570 nm of migration and invasion cells were shown as x± s. P < 0.05,**P < 0.01 vs control group |
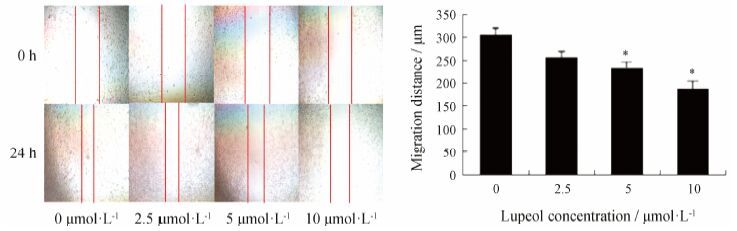
通过伤口愈合细胞划痕实验可观察到,正常组细胞在24 h后几乎完全愈合,而经羽扇豆醇处理过的人乳腺癌MDA-MB-231迁移能力受到抑制,且药物浓度越大,迁移抑制率越大,呈一定浓度依赖关系,差异具有显著性 (P < 0.05),如图 4所示。
|
Figure 4 Lupeol suppressed migration of MDA-MB-231 cells (magnification×40). The migration distance of cells were shown as x± s. P < 0.05 vs control group |
经羽扇豆醇处理后的人乳腺癌MDA-MB-231中COX-2、MMP-2和MMP-9的蛋白表达量均随药物浓度的增高而降低。结果如图 5所示。

|
Figure 5 Lupeol inhibited COX-2,MMP-2 and MMP-9 protein expression. The GAPDH was used as a loading control. P < 0.05,**P < 0.01 vs control group |
经羽扇豆醇处理后的人乳腺癌MDA-MB-231细胞中NF-κB的表达量没有显著差异,而NF-κB p65的表达量随药物的浓度增高而降低 (图 6)。

|
Figure 6 Effect of lupeol on NF-κB signal pathway in human MDA-MB-231 cells. NF-κB and NF-κB p65 were determined by Western blot analysis. The GAPDH was used as a loading control. P < 0.05,**P < 0.01 vs control group |
肿瘤侵袭转移是非常复杂的过程,肿瘤细胞从原发部位脱离,分泌金属蛋白酶 (MMPs),特别是明胶酶MMP-2和MMP-9可降解周围基质,使肿瘤细胞进入血液循环或淋巴循环。进入循环的肿瘤细胞大部分仍不能逃避免疫系统的监控而被杀死。然而活力较高、活性较强的肿瘤细胞能与血小板黏附,逃避免疫系统的杀伤。当肿瘤细胞被微血管捕获,或黏附在内皮细胞壁上时,向血管外迁移,在远隔器官形成新的转移灶[7]。此过程中肿瘤细胞分泌的金属蛋白酶是重要的调控因子,也是癌症转移的开始。
近年来,学者们发现炎症也与肿瘤有着密切的关系,在炎症环境中细胞因子和自由基等炎性应答可引起基因表达变化及翻译后修饰不稳定,从而增加肿瘤发生的机会[8]。COX是催化花生四烯酸转化为前列腺素的关键酶,有COX-1和COX-2两种亚型。COX-2在许多实体瘤中呈过度表达,与肿瘤的发生、发展高度相关,也是加速癌症转移的驱动力,更是预后不良的独立指标[9, 10]。在乳腺癌患者中COX-2亦过表达,促进转移,且预后差。临床上虽有COX-2抑制剂可控制,但是由于不良反应仍限制其使用[11, 12]。所以在分子生物学和分子药理学飞速发展的今天,中药抗肿瘤越来越受到人们的关注,近几年,从中药中寻找毒副作用小、作用明显的抗癌活性成分已取得一系列成果[13]。研究发现这些成分能够诱导细胞凋亡、抑制血管生成及其侵袭转移能力[14]。
本实验选取中药狼毒大戟的提取物三萜类化合物羽扇豆醇[15],具有很好的抗癌活性[16, 17]。细胞模型选用高转移能力的三阴性人乳腺癌MDA-MB-231。本次实验利用人工基底胶matrigel作为黏附基质,因为其成分与组织基底膜相似,可模拟体内环境,研究细胞与细胞外基质的相互作用。肿瘤细胞降解matrigel后穿越的细胞数越多代表其侵袭能力越强。从实验结果可以看出,羽扇豆醇能够有效地抑制肿瘤的侵袭和转移,并呈一定的浓度依赖性。
NF-κB是一种重要的核转录因子,p65和p50构成的二聚体存在于细胞浆中。当细胞受到刺激后可活化进入细胞核中,调节相关目的基因的表达。MMP-9基因的启动子上含有NF-κB等多个结合位点,通过这些结合位点NF-κB可诱导MMP-9的表达[18]。Western blot方法检测羽扇豆醇处理人乳腺癌MDA-MB-231细胞后发现,金属蛋白酶MMP-2、M MP-9和COX-2随着浓度升高而表达量降低,其机制可能是下调了核转录因子NF-κB p65,支持了羽扇豆醇能降低人乳腺癌MDA-MB-231细胞的侵袭转移能力的结果。
总之,羽扇豆醇能够有效地抑制人乳腺癌MDA- MB-231的侵袭转移,其机制可能是下调MMP-2、MMP-9、COX-2及相关NF-κB信号通路的表达,为中药抗肿瘤提供了新的思路和方向。
| [1] | Zhang YS, Liu YJ. A review for the surgical management of breast cancer and the latest developments[J]. J Mod Oncol (现代肿瘤医学), 2015, 23:719-723. |
| [2] | Zheng Y, Wu CX, Zhang ML. The epidemic and characteristics of female breast cancer in China[J]. China Oncol (中国癌症杂志), 2013, 23:561-569. |
| [3] | Zuang ZZ, Chen WQ, Wu CX, et al. Incidence and mortality of female breast cancer in China-a report from 32 Chinese cancer registries, 2003-2007[J]. Tumor (癌症), 2012, 32:435-439. |
| [4] | Rakha EA, EI-Sayed ME, Green AR. Prognostic markers in triple-negative breast cancer[J]. Cancer, 2007, 109:25-32. |
| [5] | Liang FL, Cao W, Li LR, et al. Clinicopthological features and prognostic factors in triple negative breast cancer[J]. J Mod Oncol (现代肿瘤医学), 2013, 21:294-298. |
| [6] | Zhang L, Zhang YC. Anticancer effect of lupeol, a triterpene[J]. J Int Oncology (国际肿瘤学杂志), 2012, 39:113-116. |
| [7] | Chaffer CL, Weinberg RA. A perspective on cancer cell metastasis[J]. Science, 2011, 331:1559-1564. |
| [8] | Liu Z, Xiao B, Mao XH, et al. Research progress on relationship between inflammation and tumor[J]. Prog Mod Biomed (现代生物医学进展), 2009, 9:591-594. |
| [9] | Sarode GS, Sarode SC, Patil A, et al. Inflammation and oral cancer:an update review on targeted therapies[J]. J Contemp Dent Pract, 2015, 16:595-602. |
| [10] | Wu YD, Zhou BP. Inflammation-a driving force speeds cancer metastasis[J]. Cell Cycle, 2009, 8:3267-3273. |
| [11] | Hogo HJ, Saunders C, Ramsay RG, et al. New insights on COX-2 in chronic inflammation driving breast cancer growth and metastasis[J]. J Mammary Gland Biol Neoplasia, 2015, 20:109-119. |
| [12] | Wang HY, Wang GP, Wang ST, et al. The relationship between the expression of COX-2, TGF-β1 and HIF-1α with invasion and metastasis in breast carcinoma[J]. Chin Clin Oncol (临床肿瘤学杂志), 2008, 13:417-420. |
| [13] | Liang XN, Zhang XD, Teng HL. The Anti-tumor effect Chinese medicine and its active ingredient[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2013, 24:119-122. |
| [14] | Xu T, Xu RA. Progress on ati-tumor mechanism of Chinese medicine and its active ingredients[J]. J Huaqiao Univ (华侨大学学报), 2009, 30:359-365. |
| [15] | Sun YX, Liu JC. Chemical constituents and biological activities of Euphorbia fischeriana Steud[J]. Chem Biodiver, 2011, 8:1205-1214. |
| [16] | Liu Y, Bi TT, Shen G, et al. Lupeol induces apoptosis and inhibits invasion in gallbladder carcinoma GBC-SD cells by suppression of EGFR/MMP-9 signaling pathway[J]. Cytotechnology, 2016, 68:123-133. |
| [17] | Lee TK, Poon RT, Wo JY, et al. Lupeol suppresses cisplatininduced nuclear factor-κB activation in head and neck squamous cell carcinoma and inhibits local invasion and nodal metastasis in an orthotopic nude mouse model[J]. Cancer Res, 2007, 67:8800-8809. |
| [18] | Hah N, Lee ST. An absolute role of the PKC-dependent NF-κB activation for induction of MMP-9 in heaptocellular carcinoma cells[J]. Biochem Biophys Res Commun, 2003, 305:428-433. |
 2016, Vol. 51
2016, Vol. 51


