2. 重庆医科大学重庆市生物化学与分子药理学重点实验室, 重庆 400016
2. Chongqing Key Laboratory of Biochemistry and Molecular Pharmacology, Chongqing Medical University, Chongqing 400016, China
国际癌症研究中心 (IRAC) 的报告显示,2012年全球新增癌症患者数超过1 400万,因癌症死亡的人数高达820万[1, 2]。癌症已经成为全球威胁人类健康的首要疾病之一,但放疗、化疗和手术治疗三大常规疗法效果仍不明显。肿瘤免疫治疗成为第四类已被证明的、具有显著临床疗效及优势的抗肿瘤治疗方法。它通过调动或激发机体自身的免疫功能,增强肿瘤周围微环境中各种免疫因子抗肿瘤的能力,从而抑制和杀伤肿瘤细胞。
胚胎干细胞 (embryonic stem cells,ESCs) 是从早期胚胎或原始性腺细胞中分离出来的一类原始细胞,具有无限增殖、自我更新能力和多向分化潜能等生物学特性,在临床和基础研究中具有广泛的应用前景[3, 4]。已经有相关研究显示,胚胎干细胞能在体外环境中诱导分化成一些抗癌相关的效应细胞[5, 6, 7]并分泌可溶性的抗肿瘤因子[8],具有抑制多种肿瘤细胞生长的作用。
然而,关于胚胎干细胞抗肿瘤的体外研究,胚胎干细胞与肿瘤细胞共培养上清液体外抗癌效应的研究少见。作者猜测,肿瘤细胞与胚胎干细胞共培养的上清液中存在一定的上述抗肿瘤因子和其他抗癌有效成分,可能对肿瘤治疗有效。
基于此猜想,本研究收集胚胎干细胞H9与乳腺癌MDA-MB-231细胞共培养上清液,探究上清液对乳腺癌MDA-MB-231细胞是否有体外抑制效应,以验证上清液是否具有体外抗癌效果,以期为开发抗肿瘤的免疫制剂开辟一种新的思路。
材料与方法 材料和试剂人胚胎干细胞系H9细胞购自北 京赛贝生物技术有限公司,人乳腺癌MDA-MB-231细胞株由重庆医科大学分子医学与肿瘤研究中心保存; PSCeasy人多潜能干细胞培养基 (北京赛贝生物技术有限公司); 胎牛血清、RPMI-1640培养基 (美国HyClone公司); MTT试剂盒 (北京鼎国昌盛生物技术有限公司); Hoechst 33258 (碧云天生物技术研究所); transwell小室 (Coster),matrigel基质胶 (Sigma公司)。
细胞培养MDA-MB-231细胞用含10% 胎牛血清、青霉素100 u·mL-1、链霉素100 µg·mL-1的RPMI 1640完全培养基在37 ℃、5% CO2培养箱中培养,3~4天传代一次,取对数期细胞进行实验。人胚胎干细胞系H9,参考说明书,培养于matrigel上,培养液为胚胎干细胞完全培养液。每天换液1次,细胞汇合度达到80% 时,用EDTA 37 ℃消化5 min,离心细胞去上清液,用PSCeasy完全培养基重悬,按1∶5~1∶10的比例传代。
上清液的制备取对数生长期的MDA-MB-231细胞,以每孔5×105个接种于已经铺满70% 胚胎干细胞H9的6孔板中,每孔加入1640完全培养基3 mL于细胞培养箱内共培养。共培养48 h后收集上清,3 000 r·min-1离心10 min以除去细胞碎片,0.22 μm微孔滤膜过滤,-20 ℃保存备用。使用时将上清与1640完全培养基分别制成20%、40%、60% 和80% 体积分数共培养上清液。体积分数 (%) = V上清液 / V培养基 × 100。单独培养的H9细胞和MDA-MB-231细胞,传代培养48 h后收集上清液,依共培养上清液的制备方法,分别制成不同体积分数的H9上清液和MDA-MB-231上清液 (以下简称231上清液)。
细胞形态学观察取对数生长期的MDA-MB- 231细胞接种于96孔板中 (每孔100 μL),每孔细胞数为5×103个。待细胞恢复贴壁生长状态后,进行以下细胞处理: 共培养上清液处理组细胞每孔分别加入20%、40%、60% 或80% 体积分数上清液200 μL,H9上清液处理组细胞加入80% 体积分数的H9培养液。将处理48 h后的MDA-MB-231细胞于倒置显微镜下观察细胞形态的变化并拍照记录。
MTT检测细胞增殖取对数生长期的MDA- MB-231细胞,按每孔细胞数3×103个接种于96孔板中。当细胞长到70% 汇合度后进行处理,实验分组及处理: 共培养上清液处理组细胞分别加入0%、20%、40%、60%、80% 体积分数共培养上清液100 μL,H9上清液处理组细胞分别加入0%、20%、40%、60%、80% 体积分数H9单独培养的上清液100 μL; 231上清液处理组细胞分别加入0%、20%、40%、60%、80% 体积分数231单独培养的上清液100 μL。每组设3个复孔,置于37 ℃、5% CO2培养箱中培养。细胞处理24或48 h后,每孔加入5 mg·mL-1 MTT 10 μL,继续培养4 h后弃上清液,向每孔中加入DMSO 100 μL,振荡10 min,在酶标仪上检测490 nm波长处的吸光度A。根据上述实验方法重复3次。细胞存活率 (%) = (A加药组细胞-A空白组)/(A对照组细胞-A空白组)×100。
Hoechst 33258染色细胞处理同“细胞形态学观察”。处理48 h后的细胞,用PBS清洗3次,加 入细胞固定液室温固定5 min,PBS清洗3次,加入Hoechest 33258染液,37 ℃染色30 min,荧光显微镜下观察细胞核形态。实验重复3次。
流式细胞术检测细胞凋亡取对数期生长的细胞,以每孔2×105个种植于6孔板中,设共培养上清液处理组 (细胞分别加入0%、20%、40%、60%、80% 体积分数的共培养上清液2 mL) 和H9上清液处理组 (细胞加入80% 体积分数的H9上清液2 mL)。细胞处理24 h后,收集各组细胞,用预冷PBS洗涤3次,胰酶消化后,收集所有细胞于离心管中,PBS洗涤3次,800 r·min-1离心5 min,将细胞悬液置于EP管中,采用AnnexinV-PI双染流式细胞术检测细胞凋亡率。重复实验3次。
细胞侵袭实验Matrigel (4 ℃) 放置过夜使之 溶解,用4 ℃预冷的无血清RPMI 1640培养液稀释至1 mg·mL-1,取稀释的matrigel 100 μL加入到transwell的上室,将transwell小室在37 ℃温育至少4~5 h,使凝胶形成[9]。对数期细胞用无血清1640培养基,饥饿培养24 h后胰酶消化离心收集,用不含血清培养基重悬细胞 (每毫升细胞数6×106个,取50 μL入上室,同时分别加入不同体积分数 (0%、20%、40%、60% 和80%) 的共培养上清液和80% 体积分数的H9上清稀释液 (此处上清稀释液是由上清液与无血清RPMI 1640培养基按相应体积比配制) 各150 μL。下室加入含20% FBS的完全培养基800 μL。于细胞培养箱培养24 h后取出transwell小室,弃去剩余培养基,PBS清洗2遍,棉签擦去上室表面细胞,甲醇固定15 min,PBS洗2遍,0.1%结晶紫室温下染30 min,PBS洗净,将transwell晾干,倒置显微镜下观察拍照。每个小室随机选取5个视野,统计视野内细胞数,求均值。
细胞迁移实验实验分组和操作步骤同侵袭 实验方法,区别仅在于所使用的transwell小室未经matrigel包被。
统计学方法采用SPSS 19.0统计软件,实验数据以± s表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为统计学具有显著性。
结果 1 细胞形态学观察共培养上清液处理MDA-MB-231细胞后,在倒置相差显微镜下观察到其形态学发生明显变化,与空白对照组 (即0% 体积分数上清液处理,下同) 细胞相比,共培养上清液处理组MDA-MB-231细胞数量增加缓慢,且随着共培养上清液浓度增加,细胞数量逐渐减少,甚至出现负增长。部分细胞出现老化甚至凋亡迹象,细胞边缘逐渐皱缩变形,细胞形态不规则且变小。而单独培养的H9上清液处理组,细胞形态学无明显变化。结果显示,共培养上清液对细胞生长有抑制作用,可诱导癌细胞凋亡,且其抑制作用呈浓度依赖性。见图 1。

|
Figure 1 Effect of co-culture supernatant on morphological changes of MDA-MB-231 cells (magnification 400×) by inverted phase contrast microscope. A: Co-culture supernatant of 0% volume fraction; B: Co-culture supernatant of 20% volume fraction; C: Co-culture supernatant of 40% volume fraction; D: Co-culture supernatant of 60% volume fraction; E: Co-culture supernatant of 80% volume fraction; F: H9 supernatant of 80% volume fraction |
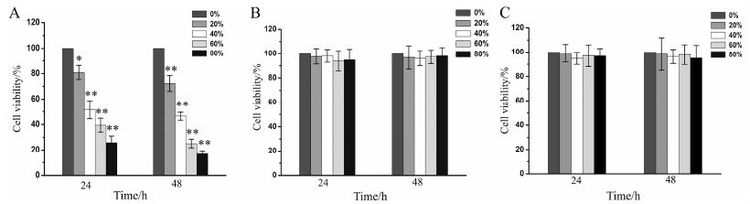
如图 2A所示,同一处理时间,随着共培养上清液浓度的增加 (20%、40%、60% 和80%),细胞生存率逐渐降低。相同浓度下,共培养上清液处理48 h的细胞生存率低于24 h的生存率。而单独培养的H9上清处理的细胞 (图 2B) 和单独培养的231上清液处理的细胞 (图 2C), 各浓度组细胞生存率无显著差异 (P > 0.05)。可知,共培养上清液能抑制MDA-MB- 231细胞增殖且其抑制作用呈浓度依赖性和时间依赖性,而单独培养的H9上清液对MDA-MB-231细胞增殖无抑制作用。利用SPSS统计软件求得共培养上清液处理24 h的MDA-MB-231细胞半数抑制浓度为 44.1% 体积分数,处理48 h的MDA-MB-231细胞半数抑制浓度为42.9% 体积分数,可知共培养上清液处理48 h对细胞的增殖抑制效果更好。
|
Figure 2 Effect of supernatant on the proliferation of MDA-MB-231 cells. The cells were treated with various of concentrations of supernatant for 24 h and 48 h. The proliferation of MDA-MB-231 cells was analyzed by using MTT assay. n = 3,x± s. P < 0.05,**P < 0.01 vs control group. A: The cells were treated with co-culture supernatant; B: The cells were treated with H9 supernatant; C: The cells were treated with MDA-MB-231 supernatant |
Hoechst 33258染色后荧光显微镜下观察,发现空白对照组细胞和H9上清处理组的细胞均只发出较弱的蓝色荧光,细胞核大小较均一,呈圆形或椭圆,
染色质分布均一。而共培养上清液组有细胞发出亮蓝色荧光,出现典型的细胞凋亡形态学改变,表现为核缩小、核碎裂,形态不规则,大小不一,偶可见核碎片游离形成的空泡。且随着共培养上清浓度增大,凋亡程度加剧 (图 3)。

|
Figure 3 Effect of co-culture supernatant on apoptotic morphological changes of MDA-MB-231 cells detected with fluorescent microscope (magnification 400×). A: Co-culture supernatant of 0% volume fraction; B: Co-culture supernatant of 20% volume fraction; C: Co-culture supernatant of 40% volume fraction; D: Co-culture supernatant of 60% volume fraction; E: Co-culture supernatant of 80% volume fraction; F: H9 supernatant of 80% volume fraction |
采用AnnexinV-PI双染法分析不同浓度上清液对MDA-MB-231细胞凋亡的影响。如图 4所示,与空 白对照组相比,各浓度共培养上清液均能诱导MDA- MB-231细胞发生不同程度的凋亡,且呈现一定的浓度依赖关系。随着共培养上清液浓度的增加,细胞凋亡率逐渐升高 (P < 0.05)。20%、40%、60% 和80% 体积分数共培养上清液作用于MDA-MB-231细胞24 h后,其凋亡率分别为6.91%、11.77%、14.48% 和22.66%,而空白对照组的细胞仅为5.6%。80% H9上清处理组细胞凋亡率为5.89%,与空白对照组相比,没有显著性差异(P > 0.05)。

|
Figure 4 Effect of co-culture supernatant on the apoptosis of MDA-MB-231 cells. A: Co-culture supernatant of 0% volume fraction; B: Co-culture supernatant of 20% volume fraction; C: Co-culture supernatant of 40% volume fraction; D: Co-culture supernatant of 60% volume fraction; E: Co-culture supernatant of 80% volume fraction; F: H9 supernatant of 80% volume fraction. n = 3,x± s. P < 0.05,**P < 0.01 vs control group |
Matrigel铺于transwell上室,研究共培养上清液对MDA-MB-231细胞侵袭能力的影响。细胞侵袭实验显示,共培养上清液各浓度组穿膜细胞数均减少,且随着共培养上清液浓度的升高,穿膜细胞数逐渐减少,与空白对照组相比具有统计学意义 (P < 0.05)。而H9上清液处理组细胞穿膜细胞数与空白对照组接近,无显著性差异 (P > 0.05),见图 5。实验证明共培养上清液能一定程度抑制MDA-MB-231细胞的侵袭能力,且其抑制能力呈浓度依赖性。

|
Figure 5 Effect of co-culture supernatant on the invasion of MDA-MB-231 cells (magnification 200×). A: Co-culture supernatant of 0% volume fraction; B: Co-culture supernatant of 20% volume fraction; C: Co-culture supernatant of 40% volume fraction; D: Co-culture supernatant of 60% volume fraction; E: Co-culture supernatant of 80% volume fraction; F: H9 supernatant of 80% volume fraction. n = 3,x± s. P < 0.05,**P < 0.01 vs control group |
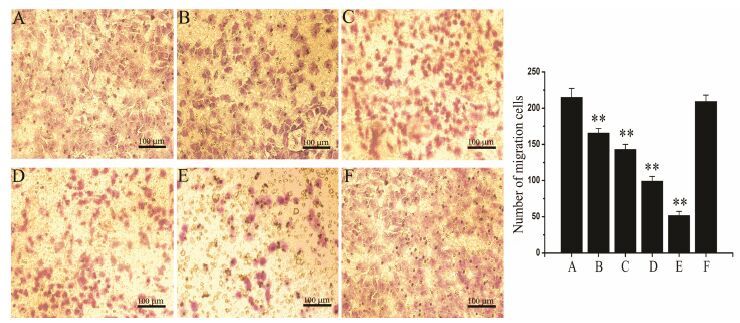
MDA-MB-231细胞直接接种于transwell上室,研究共培养上清液对MDA-MB-231细胞迁移运动能力的影响。实验显示,共培养上清液各浓度组跨膜细胞数均减少,且随着共培养上清液浓度的升高,穿膜细胞数逐渐减少,与空白对照组相比具有统计学意义 (P < 0.05)。而H9上清处理组细胞穿膜细胞数与空白对照组接近,无显著性差异 (P > 0.05),见图 6。实验证明共培养上清液一定程度上可抑制MDA-MB- 231细胞的迁移运动能力,且其抑制迁移的能力呈浓度依赖性。
|
Figure 6 Effect of co-culture supernatant on the migration of MDA-MB-231 cells (magnification 200×). A: Co-culture supernatant of 0% volume fraction; B: Co-culture supernatant of 20% volume fraction; C: Co-culture supernatant of 40% volume fraction; D: Co-culture supernatant of 60% volume fraction; E: Co-culture supernatant of 80% volume fraction; F: H9 supernatant of 80% volume fraction. n = 3,x± s. **P < 0.01 vs control group |
源自胚胎组织或胚胎干细胞抗原诱导的抗肿瘤作用研究已经进行了多年。Yaddanapudi等[10]研究证实,这种由胚胎干细胞诱导的抗肿瘤免疫并不是一种机体的“异物反应”,而有可能是由多种效应细胞和细胞因子参与构成的针对胚胎干细胞表面抗原的特异性免疫应答。Giuffrida等[8]研究发现,胚胎干细胞在体外环境中能够分泌一些可溶性的抗肿瘤因子,具有抑制多种肿瘤细胞生长的作用,并且能够阻滞肿瘤细胞的细胞周期。Lee等[11]的研究证实胚胎干细胞微环境能够改变肿瘤细胞的生长方式,诱导恶性肿瘤细胞获得一定的良性表型,从而具有抗肿瘤作用。
根据以上研究者已有的研究结论,作者推测肿瘤细胞与胚胎干细胞共培养的上清液中存在上述抗肿瘤因子和其他抗癌有效成分可能对肿瘤治疗有效。因此,本研究用人胚胎干细胞H9与人乳腺癌MDA- MB-231细胞直接接触式共培养的上清液处理MDA- MB-231细胞,并以单独培养的H9上清液和单独培养的231上清液作为对照组,探究上清液对肿瘤细胞是否有体外抑制作用。
实验结果显示,共培养上清液处理组肿瘤细胞的增殖受到一定程度抑制,而单独培养的H9或231上清液对肿瘤细胞的增殖基本无影响。在细胞形态学观察中,发现共培养上清液处理组MDA-MB-231细胞数量逐渐减少,部分细胞出现老化甚至凋亡迹象,细胞边缘逐渐皱缩变形,细胞形态不规则且变小; 而对照组细胞形态学无明显变化。Hoechst 33258染色 后观察到共培养上清液处理组凋亡细胞出现核浓缩、碎片等一些列典型凋亡态,发出亮蓝色荧光,而对照组细胞只发出较弱的蓝色荧光,细胞核无明显的形态学改变。流式细胞术检测细胞凋亡结果也显示共培养上清液处理组细胞凋亡率明显多于对照组。细胞侵袭和迁移实验结果显示共培养上清液组细胞侵袭和迁移率均低于对照组。因此,结果表明共培养上清液可以抑制乳腺癌MDA-MB-231细胞的增殖、侵袭和迁移,促进肿瘤细胞的凋亡。
共培养上清液表现出的抗癌效应其机制可能是在乳腺癌MDA-MB-231细胞的刺激下,具有多向分化潜能的干细胞被诱导分化并分泌一些抗肿瘤因子,从而对肿瘤细胞产生一定的抑制作用。至于这些抗癌因子具体成分待进一步研究。
综上所述,本研究初步证实了人胚胎干细胞H9与人乳腺癌MDA-MB-231细胞共培养的上清液有一定的体外抑癌效应,可以抑制乳腺癌MDA-MB-231细胞的增殖、侵袭和迁移,促进肿瘤细胞的凋亡。然而其抗肿瘤效应的机制和有效成分有待进一步研究验证。
| [1] | International Agency for Research on Cancer. GLOBOCAN 2012:estimated cancer incidence, mortality and prevalence worldwide in 2012[EB/OL].[2014-01-09]. http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx. |
| [2] | Bray F, Jemal A, Grey N, et al. Global cancer transitions according to the Human Development Index (2008-2030):a population-based study[J]. Lancet Oncol, 2012, 13:790-801. |
| [3] | Keller G. Embryonic stem cell differentiation:emergence of a new era in biology and medicine[J]. Genes Dev, 2005, 19:1129-1155. |
| [4] | Sun Y. New milestone in the development of clinical oncology-molecular targeted therapy[J]. Anti-tumor Pharm (肿瘤药学), 2011, 1:1-5. |
| [5] | Woll PS, Grzywacz B, Tian X, et al. Human embryonic stem cells differentiate into a homogeneous population of natural killer cells with potent in vivo antitumor activity[J]. Blood, 2009, 113:6094-6101. |
| [6] | Ohlsson LB, Varas L, Kjellman C, et al. Mesenchymal progenitor cell-mediated inhibition of tumor growth in vivo and in vitro in gelatin matrix[J]. Exp Mol Pathol, 2003, 75:248-255. |
| [7] | Mohib K, Wang L. Differentiation and characterization of dendritic cells from human embryonic stem cells[J]. Curr Protoc Immunol, 2012, Chapter 22:Unit 22F.11. |
| [8] | Giuffrida D, Rogers IM, Nagy A, et al. Human embryonic stem cells secrete soluble factors that inhibit cancer cell growth[J]. Cell Prolif, 2009, 42:788-798. |
| [9] | Zheng YB, Gong JH, Li Y, et al. Inhibition of tumor cell invasion and induction of apoptosis by ubenimex[J]. Acta Pharm Sin (药学学报), 2012, 47:1593-1598. |
| [10] | Yaddanapudi K, Mitchell RA, Putty K, et al. Vaccination with embryonic stem cells protects against lung cancer:is a broad-spectrum prophylactic vaccine against cancer possible?[J]. PLoS One, 2012, 7:e42289. |
| [11] | Lee LM, Seftor EA, Bonde G, et al. The fate of human malignant melanoma cells transplanted into zebrafish embryos:assessment of migration and cell division in the absence of tumor formation[J]. Dev Dyn, 2005, 233:1560-1570. |
 2016, Vol. 51
2016, Vol. 51


