抗体偶联药物 (antibody-drug conjugates,ADCs) 是一类单克隆抗体通过一段连接臂 (linker) 共价偶联细胞毒性小分子化合物而成的复合物,用于治疗恶性肿瘤。单克隆抗体可以靶向结合肿瘤细胞表面的抗原,通过细胞内化作用进入细胞。进入细胞后,其结构中的小分子药物在溶酶体低pH环境或蛋白酶作用下释放出来,发挥细胞毒作用。由于单克隆抗体的靶向性,正常组织细胞内药物浓度较低。因此与传统的抗肿瘤药物相比,ADC的系统毒性减少[1, 2, 3]。
ADC由于自身的优势,逐渐成为工业界新药研发的热点。目前已经有3个ADC上市: Mylotarg (gemtuzumab ozogamicin,2000年上市,由于安全性问题2010年主动撤市)[4]、Adcetris (brentuximab vedotin,2011年上市)[5]和Kadcyla (trastuzumab emtansine,T-DM1,2013年上市)。Immunomedics公司的sacituzumab govitecan (IMMU-132) 在2015年进入FDA快速审评通道。截止2013年,已有30多个ADC处于临床试验,涉及20多个靶点,分别针对血液肿瘤和实体瘤[6, 7, 8]。目前国内多家制药企业,如山东齐鲁制药、江苏恒瑞、浙江海正和正大天晴等公司纷纷开展ADC的研究; Li等[9]也合成了多种新型高活性抗CD20抗体偶联药物,其中2F2抗体的突变体定点偶联MMAE (monomethyl-auristatin E) 而成的ADC体内外抗肿瘤活性提高。
在药物研发过程中,生物分析对于药动学 (PK) 测定、PK/PD关系和安全性评价具有重要意义。随着ADC的研发热潮,ADC生物分析面临的挑战也凸显出来。本文首先概括了ADC生物分析需要考虑的因素,并总结了基于酶联免疫吸附反应 (enzyme-linked immunosorbent assay,ELISA) 和LC-MS方法的ADC相关物质的生物分析。
1 ADC生物分析的考虑因素 1.1 ADC的异质性ADC中抗体与小分子药物通过一段连接臂共价链接,小分子药物可以通过该连接臂与抗体中的赖氨酸侧链氨基结合,如T-DM1[10]; 或者与抗体链间的二硫键还原后得到的巯基结合,如抗CD30的IgG1单克隆抗体cAC10-MMAE偶联物[11, 12]; 或者与抗 体上特定位点引入的工程化半胱氨酸残基结合,如THIOMAB-药物偶联物[13, 14]。通过前两种形式得到 的ADC中小分子药物数目以及连接位置可能会不一致[15],ADC实际为混合物。有文献报道T-DM1的药物与抗体比值 (drug-to-antibody ratio,DAR) 在0~8之间,平均DAR值为3.5[16],通过链间二硫键还原得到的ADC DAR值通常为偶数[17]。通过抗体特定位点引入工程化半胱氨酸而得到的ADC异质性较低,如有文献[14]报道可以获得DAR值为2的同源ADC。
1.2 DAR值体内动态变化ADC中连接臂的化学稳定性、连接位置和溶剂可接触性 (solvent accessibility) 等因素均会影响ADC的稳定性[18]。尽管连接臂在设计时考虑到与靶标结合之前的pH值和蛋白酶等因素,理论上ADC在血浆中是稳定的,但是连接臂仍可能会在某些特殊情况下断裂,小分子药物解离。例如,以腙为基础的连接臂在血液中性 (pH 7.3~7.5) 环境下稳定,在溶酶体酶或低pH环境中小分子化合物可能会解离[19]; 通过二硫键或者半胱氨酸形成的ADC可能会对内源性含游离巯基的肽类或蛋白比较敏感,如谷胱甘肽和白蛋白等,连接臂-小分子药物会转移至谷胱甘肽或白蛋白结构中[18, 20]。小分子药物的解离会改变ADC的DAR值比例或出现新的DAR值ADC,如抗体链间二硫键还原后得到的ADC在体内可能会出现奇数DAR值[17, 21]。huC242-DM1 (即Cantuzumab mertansine) 实验中观察到结合型ADC比未结合的抗体清除快,推测与药物的解离有关系[22],有文献[23]表明ADC的清除率随DAR值增加而加快; T-DM1的体内研究表明随着时间的推移,T-DM1的平均DAR值逐渐降低[21]。尽管工程化的ADC异质性较低,但是它在体内也可能会部分解离,形成异质的混合物。小分子药物的解离和不同DAR值ADC清除率的不同,造成ADC在体内动态变化。
1.3 待测物的选择对于小分子药物和蛋白类药物,一般测定原形药物即可了解其暴露量与药效应答 (exposure- response,ER) 的关系。但是ADC中同时具有抗体和小分子药物部分,体内DAR值动态变化,再加上目前ADC临床数据有限,难以判断哪一种待测物决定或影响了ADC的ER关系。一般来说,在ADC研发初期,尽可能测定多种待测物以了解ADC中各个组成部分的PK特征。这些待测物一般包括: 总抗体 (DAR≥0,包括结合型抗体和游离的抗体)、结合型ADC(结合型抗体和结合型药物) 和游离小分子药 物[21, 24]。总抗体的测定可以用于考察其PK特征是否符合一般的抗体PK特征,不会因为药物结合而发生改变[21]。结合型抗体可以从两个角度进行考察: 测定结合型的抗体或药物,后者可以提供抗体载药量的直接信息,结合后者与总抗体的数据,可以大致评估ADC平均DAR值的变化[21]。游离小分子药物的浓度被认为与其毒性相关,如果游离小分子药物广泛分布在血浆中,可能发生脱靶作用,产生毒性[24]。上述待测物的信息综合起来有助于了解ADC的ER关系。除上述待测物外,DAR值的测定还可以提供ADC体内变化的信息,有助于选择合适的分析技术[21]。此外,ADC作为生物大分子进入体内后,可能会引起免疫原性,产生抗体 (anti-therapeutic antibody,ATA),ATA可能会导致ADC清除加快或药效降低,或者ADC被ATA带至其他部位产生毒性,因此在ADC研发过程中有必要评估ATA[21, 24, 25]。
1.4 生物分析平台的选择传统上,体内生物大分子的定量分析采用ELISA方法[26, 27],小分子药物采用LC-MS/MS方法[27]。如上所述,ADC在研发过程中均需要对其抗体部分和小分子药物部分进行生物定量,因此ELISA和LC-MS/ MS的方法成为ADC分析的常用方法。ELISA方法可以用于抗体和小分子药物测定[15, 21, 24, 28],LC-MS/ MS目前主要用于测定游离小分子[21, 24, 28]。近年来出现亲和捕获LC-MS/MS方法,该方法首先采用亲和捕获的方法纯化样品,随后经过酶消化过程测定代表性肽段或小分子药物,从而实现对总抗体、结合型抗体和结合型药物的测定[21, 29]。与小分子药物的生物分析不同,ADC生物分析中所用的对照品实际为混合物,且由于ADC的DAR值在生物体内动态变化,因此所使用的对照品并不能准确反映体内样品的真实浓度[21]。不同DAR值的ADC与实验中捕获试剂或检测试剂的结合能力可能不同,影响总抗体和结合型抗体分析的准确度[17, 23, 24, 30]。有文献[21]报道,某抗前列腺1的六跨膜上皮抗原 (six-transmembrane epithelial antigen of prostate 1,STEAP1) 的ADC在DAR值过高或过低时会由于立体位阻或低亲和力而不能被准确测定。目前的生物分析方法尚不能对单个DAR值的ADC进行定量,为准确测定样品浓度,应尽量选择对DAR值不敏感的生物分析方法[24]。在分析方法建立时,可以用纯化或富集的ADC和未结合抗体的对照品验证该方法对DAR值的不敏感性[24]。如果不能获得纯化或富集的ADC,以总抗体分析为例,可以尝试在体外基质 (如血浆) 中37 ℃孵育ADC一段时间,假设在该时间内ADC会发生药物解离,采用LC-MS方法鉴定样品中DAR值分布变化,然后用不同的总抗体方法测试DAR值分布改变的样品,如果所有样品测试结果一致,则该总抗体方法对DAR值不敏感,可以准确测定不同DAR值的ADC[21]。
基于ADC的复杂性,Genentech公司[21]、辉瑞公司[15]以及美国药学科学家协会[24]总结了针对ADC研发中的待测物的常用分析方法 (表 1),以下将重点介绍各类待测物的生物分析方法及其应用。
|
|
Table 1 Analytes commonly assessed for antibody-drug conjugates. ELISA: Enzyme-linked immunosorbent assay; HIC: Hydrophobic interaction chromatography; PD: Pharmacodynamics; PK: Pharmacokinetics; DAR: Drug-to-antibody ratio |
经典的ELISA方法为首先在载体表面 (如96孔板) 包被捕获试剂,如重组抗原胞外结构域 (extracellular domain,ECD)、互补决定区 (complementarity determining region,CDR) 的单克隆抗体 (monoclonal antibody,mAb)、抗人IgG的mAb等,然后加入待测物样品,孵育一定时间后,再加入检测试剂,如偶联辣根过氧化物酶 (horseradish peroxidase,HRP) 的抗人IgG的mAb、生物素偶联抗CDR的mAb/链霉亲和素偶联HRP,此时形成一个三明治结构,再加入酶的底物 (如3,3',5,5'-tetramethylbenzidine,TMB) 和反应终止液,检测特定波长下的吸收度,计算其浓度 (图 1)[21]。
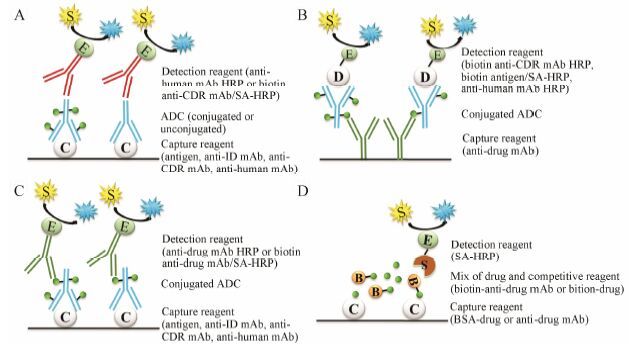
|
Figure 1 ELISA assays of total antibody (A), conjugated antibody (B), conjugated drug (C) and free drug (D). ADC: Antibody-drug conjugates; anti-CDR: Anti-complementarity determining region; HRP: Horseradish peroxidase; ID: Idiotype; mAb: Monoclonal antibody; SA-HRP: Streptavidin-horseradish peroxidase |
LC-MS/MS方法多用于测定小分子化合物,目前也逐渐用于蛋白大分子的定量。与ELISA方法相比,LC-MS/MS方法对专属性重要试剂的依赖性低,方法开发和转移相对简单,且可以同时检测多个候选药物 (表 2)[31]。对于分子质量大于10 kDa的蛋白类大分子,一般采用间接法进行定量,即检测酶切产生的一条或多 条特异性肽段,用以表征蛋白浓度 (图 2)。在样品预处理过程中,首先利用蛋白沉淀法提取蛋白或利用亲和捕获的方法富集待测物,随后进行酶切和LC-MS/MS检测[31, 32]。该方法中内标可选择稳定同位素标记 (stable isotope labeled,SIL) 的蛋白、两端添加3~6个氨基酸的SIL特异性肽段、SIL特异性肽段或未标记的蛋白/肽段类似物,不同的内标在样品处理过程中加入的时间不同,对样品处理
|
|
Table 2 Comparison of LC-MS/MS and ELISA for peptide/protein quantitation |
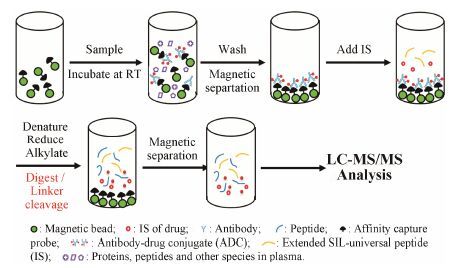
|
Figure 2 Affinity capture LC-MS/MS. IS: Internal standard; SIL: Stable isotope-labeled |
过程的校正作用也不同[31, 32, 33]。亲和捕获LC-MS/MS方法测定ADC的相关捕获试剂、检测试剂及内标见表 3。目前在LC-MS/MS法测定生物大分子方面尚没有相关法规,关于其方法开发和验证可以参见美国药学科学家协会发表的白皮书[32]。
|
|
Table 3 Reagents used for ADC affinity capture LC-MS/MS assay |
ADC在体内随着小分子药物的解离或不同DAR值ADC清除率的不同,其DAR值分布也在发生变化。研究DAR值分布有助于了解ADC的整体命运,为ADC体内生物转化提供理论依据。以上所说的ELI SA和LC-MS/MS方法并不能测定DAR值。UV/VIS光谱广泛用于测定抗体浓度和DAR值[34]。Yu等[35]利用LC-MS方法和紫外分光光度法测定了通过赖氨酸侧链残基偶联的抗Her2抗体-SMCC [N-琥珀酰亚胺- 4-(N-马来酰亚胺基)环己烷-1-羧化物]-DM1,但是该方法为缓冲液体系,不能适用于血浆/血清等复杂生物体系。Genentech公司的科学家开发出两种可以用于测定血浆/血清样品中DAR值分布的方法: 亲和捕获LC-MS方法和亲和捕获疏水作用色谱 (hydrophobic interaction chromatography,HIC) (图 3)[21, 29, 36],这两种方法均可检测完整的分子量,用不同DAR值ADC去卷积化后的峰面积表征不同DAR值的相对丰度。
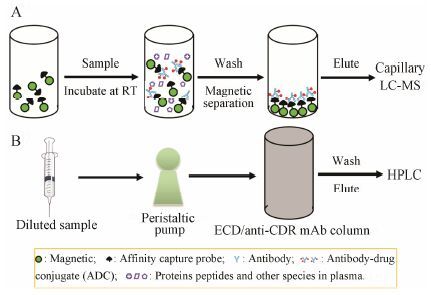
|
Figure 3 Antibody-drug conjuates drug-to-antibody ratio distributions characterization. A: Affinity capture LC-MS; B: Affinity capture HIC. ECD: Extracellular domain |
亲和捕获LC-MS方法利用直接或间接固定在磁珠上的抗原、抗小分子药物的抗体来捕获目标ADC,随后经过洗涤和洗脱等过程,样品进行毛细管柱LC-MS分析 (图 3A); 由于本方法在变性条件下完成,非共价连接的轻链和重链会分开,因此本方法只适用于含有链间二硫键且共价结合的ADC,包括通过赖氨酸侧链氨基或工程化半胱氨酸连接而成的ADC[21, 36]。使用本方法的前提条件为在检测过程中各DAR值ADC的离子化效率相同或相似,这样各DAR的峰面积才能用于表征各自的相对丰度[21, 36]。Genentech的科学家利用此方法研究了通过工程化的半胱氨酸分别引入到抗体的重链和轻链上所得的两种mAb A-vc (valine-citrulline,缬氨酸-瓜氨酸)-MMAE ADC (DAR值为2) 在食蟹猴体内的DAR值变化[36]。结果显示给药后21天,血浆内重链ADC以DAR1为主,而轻链ADC仍以DAR2为主,这表明连接臂的位置影响ADC的稳定性,连接在重链的药物更容易解离[36],这与之前的研究结果类似[18]。偶联位置影响ADC的稳定性,推测可能与马来酰亚胺交换和丁二酰亚胺环水解机制有关,前者使得小分子药物解离,后者则通过抑制马来酰亚胺交换使得ADC保持相对稳定[18]。T-DM1的体外和体内实验结果均表明随着时间的延长,T-DM1在血浆中高DAR值ADC相对丰度降低,低DAR值ADC相对丰度增加,平均DAR值降低[21, 36]。工程化定点合成的抗MUC16 TDC在食蟹猴、大鼠和人血浆中37 ℃孵育96 h后,其DAR2比例由初始的93% 降到35%~45%,DAR1由初始的7% 升高到43%~48%,DAR0增加到13%~17%; 而在PBS缓冲液中DAR值没有发生改变,表明抗MUC16 TDC在血浆中存在药物解离现象[29]。
对于通过巯基链接的ADC,变性条件如LC-MS条件下,抗体的轻链与重链分开,此时仅能获得分开后的轻链或重链的分子量和相对丰度,推测得到平均DAR值[21]。与亲和捕获LC-MS方法不同,HIC和亲和捕获HIC是在非变性条件下完成的,因此可以测定通过链间二硫键还原形成的ADC的完整分子量。Boswell等[37]利用HIC研究了两种抗STEAP1 ADC标准品的DAR值分布。亲和捕获HIC是将稀释后的样品用蠕动泵泵入偶联了ECD或抗CDR抗体的小柱,在该过程中ADC被捕获; 随后经过洗涤和洗脱等过程获得富集了ADC的样品,进行HPLC检测[21, 36] (图 3B)。该方法与亲和捕获LC-MS方法相比,灵敏度较低 (μg·mL-1级别)。Genentech科学家利用亲和捕获HIC方法研究某ADC(mAb B-vc-MMAE,DAR值为2和4) 在体外血浆中的稳定性,结果显示37 ℃孵育48 h后,丰度最高的DAR4呈降低趋势,而新出现的DAR1和DAR3呈增加趋势,在后面的时间点中DAR1丰度相对较高[36]。
由于HIC与质谱离子化不匹配,因此逐渐趋向于利用纳喷雾或中性条件下采用分子排阻色谱-质谱方法获得链间二硫键还原形成的ADC的完整分子 量[38, 39]。Seattle Genetics公司的科学家利用非变性分子排阻色谱 (size exclusion chromatography,SEC) 除盐结合LC-MS方法测定了链间二硫键还原形成的两种ADC的完整分子量,该方法测试结果与HIC结果无显著性差异,但是该方法尚不能用于血浆/血清体系[38]。离子淌度质谱 (ion mobility mass spectrometry,IMMS) 也被越来越多的用于DAR分布研究[40, 41],如非变性MS (native MS) 协同离子淌度 (ion mobility)可以用于测定T-DM1的DAR分布和平均DAR值[41]。分子排阻色谱-质谱方法、离子淌度质谱等方法目前尚未应用于生物样品分析,今后与亲和纯化过程结合后,有望用于血浆/血清等生物样品分析研究。
2.2 总抗体分析总抗体分析测定样品中所有的抗体,包括结合型的抗体 (DAR≥1) 和未结合的抗体 (DAR = 0),可以用于评估ADC是否符合单克隆抗体的一般PK特性。如果总抗体分析表明ADC快速清除,则提示ADC不能与靶标有效结合,不适用于后期开发。
总抗体分析传统上采用ELISA方法 (图 1A)。对于非临床PK和TK实验,由于专属性试剂难以获得,通常采用通用型分析方法,即捕获试剂和检测试剂均为抗人IgG的抗体。这些经过亲和纯化后的试剂往往已商业化并且不会与非临床生物基质发生交叉反应。如Xie等[22]利用山羊抗人IgG抗体作为捕获试剂,利用偶联有HRP的驴抗人IgG抗体作为检测试剂,测定了huC242-DM1在小鼠血浆中的浓度,其定量下限可以达到10 ng·mL-1; 猴血清吸附后的抗人IgG的抗体可以用于测定猴血浆/血清中抗体的浓度,但是不能用于测试临床样品[42]。
对于临床样品,一般需要用到重组抗原、抗ID (idiotype) 的抗体或抗CDR的抗体作为捕获试剂,用抗人IgG的抗体、抗ID的抗体或抗CDR的抗体作为检测试剂,以最大程度的减少基质蛋白的干扰[21]。如Gemtuzumab ozogamicin中总抗体的测定利用CD33抗原作为捕获试剂,用鼠源抗人IgG4-HRP作为检测试剂,检测其临床II样品[43]。T-DM1总抗体分析利用重组HER2 ECD作为捕获试剂,用山羊抗人IgG Fc片段的F(ab')2-HRP偶联物作为检测试剂,检测非临床或临床样品,其定量下限为0.16 ng·mL-1[16, 28]。Hamblett等[23]首先采用抗cAC10的抗体来捕获抗体cAC10,用小鼠抗人IgG抗体偶联HRP作为检测试 剂; 随后类似的方法也用于小鼠血浆中抗PSMA抗体-DM1 ADC的药动学测试[44]。为测定小鼠中1F6- C4v2-bac (bromoacetamide caproyl,溴乙酰胺己酰)- MMAF (monomethyl auristatin F) 抗体1F6-C4v2的总浓度,采用抗1F6 ID的抗体捕获1F6抗体,用抗MMAF的抗体偶联生物素/链霉亲和素偶联HRP作为检测试剂[45, 46]。为测定大鼠血浆中抗STEAP1抗体- vc-MMAE ADC中抗体的总浓度,采用抗ID的抗体5093或驴抗人Fc的抗体作为捕获试剂,利用偶联有HRP的山羊抗人IgG或Fc的抗体作为检测试剂[37]。
近年来出现了亲和捕获LC-MS/MS检测总抗体的方法 (图 2A和表 3),其融合了ELISA和LC-MS/ MS的特点,首先用捕获试剂 (如蛋白A、重组抗原、抗ID抗体等) 来亲和富集抗体,酶切水解后,利用LC-MS/MS测定专属性肽段进行定量分析。类似的亲和捕获LC-MS/MS方法已经用于多种单克隆抗体药物的定量[47, 48, 49, 50, 51]。
无论利用ELISA方法还是利用LC-MS/MS方法测定总抗体浓度,均需要保证体内各DAR值ADC均能被准确检测。DAR值高的ADC可能会由于小分 子药物的立体位阻效应,影响抗体与捕获试剂或检测试剂的结合。Stephan等[17]研究了不同ELISA方 法对两种具有异质性的ADC [抗CD22抗体-MCC (succinimidyl-4-(N-maleimidomethly)cyclohexane-1- carboxylate,琥珀酰亚胺-4-(N-马来酰亚胺甲基)环己烷-1-羧化物)-DM1和抗CD22抗体-MC (maleimidocaproyl,马来酰亚胺己酰)-MMAF] 中总抗体测定的影响。实验中平均DAR值不同的ADC分别用CD22 ECD或兔抗人IgG (Fc) 抗体作为捕获试剂,用山羊抗人IgG(Fc)-HRP或抗人IgG F(ab')2-HRP作为检测试剂,结果显示抗CD22抗体-MCC-DM1除通用型 人IgG (Fc) ELISA形式外,其他3种方法均对DAR值敏感,推测抗体上偶联的DM1数量增加可能会影响抗体与抗原或检测试剂抗人IgG F(ab')2-HRP的结合; 但是上述4种检测方式对于抗CD22抗体-MC- MMAF的DAR不敏感。
鉴于不同ADC对不同形式的ELISA方法敏感 度不一样,因此在方法开发阶段,可以比较未结合的抗体、纯化或富集的DAR组分以及平均DAR ADC对照品的回收率,如果回收率的偏差在 ± 20% 之内,则表示该方法可以用于PK样品分析,因为20% 的 差异不会显著影响PK参数的计算[21, 24, 30]。Kozak 等[52]研究发现,与传统的ELISA方法相比,半均相 (semihomogeneous assay,SHA) ELISA分析对DAR值最不敏感,各DAR值ADC回收率偏差接近且均在20% 之内。在SHA ELISA中,将ADC样品添加至捕获试剂 (如生物素化的ECD、抗ID的抗体或抗人IgG抗体) 和检测试剂 (抗人IgG-HRP) 的混合溶液中,孵育一段时间后形成三明治结构,转移部分孵育液至链霉亲和素或中性亲和素包被的板子中,加入底物进行检测; 不同分析方式的回收率分别为通用型SHA > 专属性SHA > 通用型ELISA > 专属性SHA[52]。但是不同的ADC可能会对不同的试剂和检测方式响应不同,因此需要针对具体情况选择合适的试剂和检测方式。
2.3 结合型ADC测定测定结合型ADC有两种方式: 测定结合型的抗体,其DAR≥1; 或者测定结合型的小分子药物,后者可以反映结合在抗体上的小分子药物的变化情况,与总抗体的数据相结合,可以用于评估体内基质中ADC平均DAR值的变化。Genentech公司的科学家认为在技术可行时,优先选择测定结合型小分子药物。
2.3.1 结合型抗体测定结合型抗体即与小分子药物结合的抗体,其DAR≥1。与总抗体相比,其不包含未结合抗体。结合型抗体的测定多采用ELISA方法 (图 1B),利用抗小分子药物的抗体作为捕获试剂,用重组抗原、抗CDR mAb、抗人IgG抗体作为检测试剂[16, 17, 22, 28, 37, 53, 54]。如,在T-DM1 PK分析中,Genentech公司的科学家用鼠源抗DM1的抗体作为捕获试剂,用重组HER2 ECD-生物素/链霉亲和素- HRP作为检测试剂; 该方法对平均DAR在1.90~4.10内的ADC均能准确检测[16, 28]。Hu等[55]用抗DM1抗体作为捕获试剂,用猴血清吸附后的羊抗人IgG- HRP作为检测试剂,检测猕猴血清中T-DM1的含量。Xie和Kovtun等[22, 53]利用鼠源抗DM1的抗体作为 捕获试剂,用驴抗人IgG抗体-HPR作为检测试剂,检测huC242-DM1。Advani等[54]利用兔抗卡奇霉素的多克隆抗体捕获CMC-544 ADC,用生物素化的CD22-Fc/链霉亲和素-HRP作为检测试剂。
与通用型检测试剂 (如抗人IgG抗体) 相比,专属性检测试剂可以减少背景干扰,但是有时候会低估结合型ADC浓度。如,Xu等[36]研究了利用工程化半胱氨酸产生的Tmab-MC-vc-PAB-MMAE (DAR4,Tmab重链和轻链上各有两个MMAE)在食蟹猴体内的总抗体和结合型抗体的PK。针对结合型抗体作者考察了通用型和专属性ELISA两种方式,采用抗MMAE的抗体作为捕获试剂,用山羊抗人IgG抗体 (通用型) 或HER2 ECD (专属性) 作为检测试剂。结果显示,通用型ELISA检测到的结合型抗体浓度与总抗体浓度相近,而专属性ELISA测得的浓度比通用型低。利用亲和捕获LC-MS对血浆样品中的DAR分布研究发现,在后期时间段ADC以DAR3为主要存在形式,DAR0极少。由于DAR0代表了总抗体与结合型抗体之间的差异,因此认为在本研究中通用型ELISA方法测定的数据更为准确。
理论上利用抗小分子药物的抗体作为捕获试剂的方法对DAR值不太敏感,能够捕获至少连接一个小分子药物的ADC。但是实际中,每个抗小分子药物抗体亲和力不同,捕获低DAR值ADC的能力也不同,有时会因为结合能力低而低估结合型抗体的浓度。Stephan等[17]利用抗DM1的抗体捕获抗CD22抗体-MCC-DM1,用生物素化CD22-ECD/链霉亲和素-HRP或山羊抗人IgG (Fc) 抗体偶联HRP作为检测试剂,每种检测方法对富集的不同DAR的ADC结果相近,推测抗DM1的抗体对抗体载药量不敏感,抗体上有一个DM1即可有效捕获。与抗CD22抗体- MCC-DM1相反,用抗MMAF的抗体捕获抗CD22抗体-MC-MMAF后,用生物素化CD22-ECD/链霉亲和素-HRP或山羊抗人IgG (Fc) 抗体偶联HRP作为检测试剂,结果显示每种检测方法对富集的不同DAR的ADC结果差异较大,推测实验中所用抗MMAF的抗体依靠亲和力来捕获MMAF ADC,DAR低的ADC不容易被捕获。因此,在方法建立时需要筛选合适的抗小分子药物的抗体,保证该抗体捕获不同DAR(DAR≥1) 结合型抗体的能力相同。
目前尚未有利用亲和捕获LC-MS/MS测定结合型抗体的报道,但是从理论上来说可行。与ELISA一样,首先用抗小分子药物的抗体亲和捕获结合型抗体,随后经过酶切消化后利用LC-MS/MS检测特异性肽段 (图 2和表 3)。无论选择ELISA方法还是选择亲和捕获LC-MS/MS方法,均需要选择合适的抗小分子药物的抗体,保证能够捕获所有DAR≥1的ADC,且回收率偏差在 ± 20% 以内[24]。
2.3.2 结合型药物测定与结合型抗体不同,结合型药物是从小分子药物的角度去衡量结合型ADC,用于测定所有结合在抗体上的小分子药物的总浓度。这项分析能够直接提供抗体载药量的信息,并对抗体载药量的变化高度敏感。结合型药物的测定可以选用ELISA方法,也可以采用亲和捕获LC-MS/MS方法。ELISA方法测定结合型药物,捕获试剂与检测试剂的选用恰好与结合型抗体ELISA方法相反: 结合型药物分析中选用抗ID抗体、抗原ECD或抗人IgG抗体捕获ADC中的抗体部分,用抗小分子药物的抗体作为检测试剂 (图 1C)[14, 17, 45, 56, 57]。Tolcher等[56]利用抗huC242抗体作为捕获试剂捕获huC242-DM1,用生物素化抗DM1抗体/链霉亲和素-HRP检测huC242-DM1。Stephan等[17]用不同的捕获试剂如CD22 ECD、山羊抗人IgG (Fc) 或F(ab')2捕获抗CD22抗体-MCC-DM1或抗CD22抗体-MC-MMAF,分别用抗DM1或抗MMAF的抗体进行检测,研究发现信号与ADC中载药量呈正比。Sanderson等[57]用抗ID cAC10抗体作为捕获试剂,用抗MMAE抗体作为检测试剂, 评价不同DAR值抗CD30 ADC的稳定性,研究结果表明DAR2 ADC的信号比DAR4 ADC信号低。
亲和捕获LC-MS/MS方法中首先需要用捕获试剂 (如蛋白A、抗ID抗体、抗原等) 捕获结合型ADC,随后切除连接臂,进行LC-MS/MS分析 (图 2和表 3)[21, 58]。因为实验中需要切除连接臂,因此该方法只适用于连接臂可通过酶切除或化学切除的ADC,不适用于连接臂不可切除的ADC,如T-DM1[21, 28]。利用通用型试剂如蛋白A、蛋白酶等,可以快速比较相同连接臂不同抗体组成的ADC[21]。Genentech公司的科学家报道了一例利用亲和捕获LC-MS/MS方法测定抗STEAP1 ADC中结合型小分子药物的案例,数据显示在食蟹猴血浆中孵育96 h后结合型药物降低30%,该结果与DAR分布变化相一致[21]。
与总抗体和结合型抗体分析类似,结合型小分子药物分析方法的建立也需要考虑试剂和分析形式对DAR的敏感性,保证小分子药物被准确测定[24]。
2.4 游离小分子药物测定游离小分子药物是从抗体中解离下来的药物部分。游离小分子药物的测定可以采用竞争性ELISA方法 (图 1D)[22, 43, 53, 54, 56, 57]和LC-MS/MS方法[18, 25, 28, 37, 45, 58, 59]。竞争性ELISA方法可以用BSA-小分子药物包被板 子[53, 56],也可以用抗小分子药物抗体包被板子[57]。以游离DM1的测定为例,样品首先利用乙腈沉淀去除蛋白,含有游离DM1的上清液与生物素化鼠源抗DM1抗体混合,随后转移至包被有BSA-DM1的板子中,样品中DM1会与包被的BSA-DM1竞争性结合抗DM1抗体,样品中DM1浓度越高,BSA-DM1结合的DM1抗体越少,最后通过检测试剂链霉亲和素-HRP检测得到的信号越低[53]。Sanderson等[57]测定了cAC10-Val (valine,缬氨酸)-Cit (citrulline,瓜氨酸)-MMAE体内样品在组织蛋白酶B作用下水解得到的游离MMAE的浓度,水解样品与HRP-MMAE混合后,转移至包被有抗MMAE抗体的96孔板,样品中游离MMAE浓度与检测信号呈反比。
ADC中抗体部分的分解代谢一般不涉及CYP450酶,但是小分子药物可能会在CYP450酶作用下产生代谢物。与ELISA方法相比,LC-MS/MS方法在检测小分子药物的同时,可以监测代谢物的产生并对其定量。Boswell等[37]利用LC-MS/MS方法研究了抗STEAP1抗体-vc-MMAE ( ADC) 和巯基-抗STEAP1抗体-vc-MMAE (TDC) 在大鼠体内游离MMAE的浓度,样品采用蛋白沉淀方法,内标选用MMAF,结果表明ADC中游离MMAE的浓度比TDC高,可以合理解释尽管两者总抗体结果相似,但是ADC结合型抗体浓度比TDC结合型抗体浓度低的现象。LC-MS/MS样品预处理过程可以采用蛋白沉淀和/或固相萃取 (SPE) 方法,随后进行LC-MS/MS分析。有时根据待测物的结构性质添加合适的样品预处理步骤,有助于准确定量分析。例如,T-DM1结构中DM1解离后含有游离巯基,巯基可能会与自身或基质中含巯基的谷胱甘肽、白蛋白等结合形成二硫键,影响检测分析。在DM1的样品预处理过程中,首先采用3-(2-羧乙基) 膦还原样品中的二硫键,随后用乙腈沉淀蛋 白,为防止自身产生二聚体,取上清液用N-乙基马来酰亚胺衍生化,衍生化样品进行SPE后即可进行LC-MS/MS分析[28]。实验中发现DM1的浓度在第一个给药时间点浓度最高,与理论曲线不同,推测可能是在还原过程中T-DM1中少量通过半胱氨酸残基或氧化硫醚连接的DM1从抗体部分解离,高估了样品中游离DM1的浓度[28]。近期Genentech公司的科学家用离子排阻色谱协同反相HPLC进行在线二维色谱分析,测试了ADC生物样品中的游离小分子和小分子相关杂质,该方法不需要样品预处理过程[60]。
游离小分子药物不具有三级结构,可能会对捕获试剂和检测试剂产生立体位阻,建立针对小分子的ELISA方法相对困难[28]。在条件允许下,建议使用LC-MS/MS方法测定ADC中游离小分子药物,方法验证可以参考小分子化合物的LC-MS/MS方法指导原则。
2.5 ATA分析同其他生物制品一样,ADC进入生物体内后也可能会引起免疫原性,产生响应的抗体 (ATA),影响其安全性、PK和药效。ATA有多种研究平台,包括桥连ELISA(bridging ELISA,药物用于捕获,标记的药 物用于检测)[61, 62, 63]、电化学发光分析 (electrochemiluminescence,ECL,MSD)[25, 62, 64]、放射免疫沉淀法 (radio immunoprecipitation, RIP)[65]、表面等离子共振 (surface plasmon resonance,SPR) 等[62],每种方法都有自己的优缺点[66],现在以桥连ELISA和ECL方法最为常用。目前FDA和工业界均发布了免疫原性研究的指导原则或白皮书[67, 68, 69, 70, 71, 72],ADC药物的ATA分析方法验证可以遵从上述指导原则。在MSD应用中,通常将酸处理或稀释后的样品与两种标记的ADC (生物素标记的ADC和钌标记的ADC,前者用于捕获ATA,后者用于检测ATA) 孵育,形成三明治结构,转移孵育液至链霉亲和素包被的板子中,通过链霉亲和素-生物素的相互作用,样品中的ATA会被间接固定在板子上,清洗板子后加入读取液 (read buffer) 即可检测样品信号 (图 4A)。ATA可能会产生自ADC中的抗体部分、连接臂部分或小分子药物部分,因此在ATA分析中可能会需要多个阳性抗体作为阳性对照[73]。
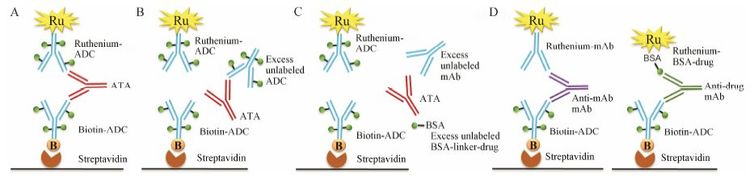
|
Figure 4 Bridging ELISA for immunogenicity assay. A: Screening assay; B: Specificity assay,excess unlabeled ADC competes with labeled ADC for ATA leading to reduction of signal; C: Epitope characterization with competition method,excess unlabeled mAb or BSA-linker-drug competes with labeled ADC for ATA; D: Epitope characterization with detection method. BSA: Bovine serum albumin |
ATA分析通常分为3步: 首先是筛选分析 (图 4A),实验允许有5% 的假阳性结果存在,如果样品响应高于筛选阈值 (screening cut point),样品可能含有ATA,需进行下一步的验证分析。在验证实验中,采用竞争性ELISA方法 (图 4B),将筛选出来的样品与过量的ADC药物预孵育一段时间,如果样品响应降低百分比高于验证阈值 (confirmatory cut point),表明该样品为阳性样品,含有ATA,需要鉴定ATA的效价 (titer) 和ATA产生部位。在ATA效价分析中,将阳性样品稀释成一系列浓度,当稀释后样品响应等于筛选阈值时,此稀释倍数即为效价。ATA产生部位鉴定实验可以分为两种: 一种采用竞争性ELISA方法 (图 4C),样品和两种标记的ADC与未标记的抗体或BSA-连接臂-小分子药物预孵一段时间,若未标记抗体孵育后的样品响应降低百分比高于方法验证中的验证阈值,则表明ATA产生自抗体,同样的情况适用于连接臂-小分子药物[25, 61]; 另一种方法采用检测方法 (图 4D),即样品和生物素标记的ADC与钌标记的抗体或者钌标记的BSA-连接臂-小分子药物孵育,如果钌标记抗体孵育样品的响应高于方法验证中的筛选阈值,则提示其产生自抗体部分,同样的情况适用于连接臂-小分子药物[25]。Genentech公司的科学家发现,食蟹猴血清样品中ATA效价高(效价4) 的ADC浓度远低于ATA效价低(效价0-2) 的样品浓度,提示ATA会影响ADC的PK特性[61]。T-DM1临床试验中鉴定得到44个产生ATA的患者,竞争性ELISA 实验表明其中37个患者的ATA不会与Tmab竞争,提示样本中的ATA可能产生自连接臂-小分子药物部分或者T-DM1中抗体与Tmab存在差异的部位[61]。Amgen公司的科学家发现样本中同时存在抗小分子药物抗体和抗mAb的抗体时,竞争性ELISA会出现假阴性结果,而检测性ELISA则会准确鉴定抗体结果,后者被认为方法更好[25]。因此,在ATA分析方法开发时,需要选择合适的试剂和分析方法准确鉴定样本中的ATA。
值得注意的是,由于不同种属产生抗体的免疫机制不同,在临床前种属中发现的ATA并不能代表人体内会出现ATA,但是临床前样本ATA分析有助于了解ADC的PK和安全性。
3 结论与展望由于ADC自身结构的复杂性以及体内动态变化特性,使得其生物分析面临多重挑战。目前临床数据有限,难以判断哪一种待测物决定或影响了ADC的ER关系,因此在ADC研发过程中一般会从多个角度考察ADC的体内过程,包括总抗体分析、结合型ADC、游离小分子药物和免疫原性分析。本文总结了利用ELISA方法和亲和捕获LC-MS/MS方法测定ADC中总抗体、结合型抗体、结合型小分子药物、游离小分子药物以及免疫原性ATA的方法,以及利用亲和捕获LC-MS和HIC测定体内外样品中DAR分布的研究。ELISA方法和亲和捕获LC-MS/MS方法开发过程中均需要考察关键试剂 (如捕获试剂和检测试剂) 和检测形式 (如通用型、专属性) 对DAR值的敏感度,可以利用未结合的抗体、纯化后单一DAR值的ADC或是富集之后平均DAR值不同的ADC进行比较,选择合适的试剂和检测形式,确保各DAR值能被准确检测。目前对利用ELISA和亲和捕获LC-MS/MS方法测定ADC尚没有相关法规,可以借鉴配体结合分析和小分子LC-MS/MS的法规进行科学完整的方法学验证。尽管现有的文献中多用ELISA方法进行抗体分析,但亲和捕获LC-MS/MS由于其自身的特点 (如开发时间短,可以同时检测多个待测物等) 将会被广泛利用。
| [1] | Wu AM, Senter PD. Arming antibodies:prospects and challenges for immunoconjugates[J]. Nat Biotechnol, 2005, 23:1137-1146. |
| [2] | Alley SC, Okeley NM, Senter PD. Antibody-drug conjugates:targeted drug delivery for cancer[J]. Curr Opin Chem Biol, 2010, 14:529-537. |
| [3] | Teicher BA, Chari RV. Antibody conjugate therapeutics:challenges and potential[J]. Clin Cancer Res, 2011, 17:6389-6397. |
| [4] | Bross PF, Beitz J, Chen G, et al. Approval summary:gemtuzumab ozogamicin in relapsed acute myeloid leukemia[J]. Clin Cancer Res, 2001, 7:1490-1496. |
| [5] | de Claro RA, McGinn K, Kwitkowski V, et al. U.S. Food and Drug Administration approval summary:brentuximab vedotin for the treatment of relapsed Hodgkin lymphoma or relapsed systemic anaplastic large-cell lymphoma[J]. Clin Cancer Res, 2012, 18:5845-5849. |
| [6] | Mullard A. Maturing antibody-drug conjugate pipeline hits 30[J]. Nat Rev Drug Discov, 2013, 12:329-332. |
| [7] | Schrama D, Reisfeld RA, Becker JC. Antibody targeted drugs as cancer therapeutics[J]. Nat Rev Drug Discov, 2006, 5:147-159. |
| [8] | Sievers EL, Senter PD. Antibody-drug conjugates in cancer therapy[J]. Annu Rev Med, 2013, 64:15-29. |
| [9] | Li ZH, Zhang Q, Wang HB, et al. Preclinical studies of targeted therapies for CD20-positive B lymphoid malignancies by ofatumumab conjugated with auristatin[J]. Invest New Drugs, 2014, 32:75-86. |
| [10] | Burris HA 3rd, Tibbitts J, Holden SN, et al. Trastuzumab emtansine (T-DM1):a novel agent for targeting HER2+ breast cancer[J]. Clin Breast Cancer, 2011, 11:275-282. |
| [11] | Sun MM, Beam KS, Cerveny CG, et al. Reduction-alkylation strategies for the modification of specific monoclonal antibody disulfides[J]. Bioconjug Chem, 2005, 16:1282-1290. |
| [12] | Doronina SO, Toki BE, Torgov MY, et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy[J]. Nat Biotechnol, 2003, 21:778-784. |
| [13] | McDonagh CF, Turcott E, Westendorf L, et al. Engineered antibody-drug conjugates with defined sites and stoichiometries of drug attachment[J]. Protein Eng Des Sel, 2006, 19:299-307. |
| [14] | Junutula JR, Raab H, Clark S, et al. Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index[J]. Nat Biotechnol, 2008, 26:925-932. |
| [15] | Kumar S, King LE, Clark TH, et al. Antibody-drug conjugates nonclinical support:from early to late nonclinical bioanalysis using ligand-binding assays[J]. Bioanalysis, 2015, 7:1605-1617. |
| [16] | Lewis Phillips GD, Li GM, Dugger DL, et al. Targeting HER2-positive breast cancer with trastuzumab-DM1, an antibody-cytotoxic drug conjugate[J]. Cancer Res, 2008, 68:9280-9290. |
| [17] | Stephan JP, Chan P, Lee C, et al. Anti-CD22-MCC-DM1 and MC-MMAF conjugates:impact of assay format on pharmacokinetic parameters determination[J]. Bioconjug Chem, 2008, 19:1673-1683. |
| [18] | Shen BQ, Xu KY, Liu L, et al. Conjugation site modulates the in vivo stability and therapeutic activity of antibody-drug conjugates[J]. Nat Biotechnol, 2012, 30:184-189. |
| [19] | Hamann PR, Hinman LM, Hollander I, et al. Gemtuzumab ozogamicin, a potent and selective anti-CD33 antibodycalicheamicin conjugate for treatment of acute myeloid leukemia[J]. Bioconjug Chem, 2002, 13:47-58. |
| [20] | Baldwin AD, Kiick KL. Tunable degradation of maleimidethiol adducts in reducing environments[J]. Bioconjug Chem, 2011, 22:1946-1953. |
| [21] | Kaur S, Xu KY, Saad OM, et al. Bioanalytical assay strategies for the development of antibody-drug conjugate biotherapeutics[J]. Bioanalysis, 2013, 5:201-226. |
| [22] | Xie HS, Audette C, Hoffee M, et al. Pharmacokinetics and biodistribution of the antitumor immunoconjugate, cantuzumab mertansine (huC242-DM1), and its two components in mice[J]. J Pharmacol Exp Ther, 2004, 308:1073-1082. |
| [23] | Hamblett KJ, Senter PD, Chace DF, et al. Effects of drug loading on the antitumor activity of a monoclonal antibody drug conjugate[J]. Clin Cancer Res, 2004, 10:7063-7070. |
| [24] | Gorovits B, Alley SC, Bilic S, et al. Bioanalysis of antibodydrug conjugates:American Association of Pharmaceutical Scientists Antibody-Drug Conjugate Working Group position paper[J]. Bioanalysis, 2013, 5:997-1006. |
| [25] | Hoofring SA, Lopez R, Hock MB, et al. Immunogenicity testing strategy and bioanalytical assays for antibody-drug conjugates[J]. Bioanalysis, 2013, 5:1041-1055. |
| [26] | DeSilva B, Smith W, Weiner R, et al. Recommendations for the bioanalytical method validation of ligand-binding assays to support pharmacokinetic assessments of macromolecules[J]. Pharm Res, 2003, 20:1885-1900. |
| [27] | Viswanathan CT, Bansal S, Booth B, et al. Quantitative bioanalytical methods validation and implementation:best practices for chromatographic and ligand binding assays[J]. Pharm Res, 2007, 24:1962-1973. |
| [28] | Dere R, Yi JH, Lei C, et al. PK assays for antibody-drug conjugates:case study with ado-trastuzumab emtansine[J]. Bioanalysis, 2013, 5:1025-1040. |
| [29] | Xu KY, Liu L, Saad OM, et al. Characterization of intact antibody-drug conjugates from plasma/serum in vivo by affinity capture capillary liquid chromatography-mass spectrometry[J]. Anal Biochem, 2011, 412:56-66. |
| [30] | Stephan JP, Kozak KR, Wong WL. Challenges in developing bioanalytical assays for characterization of antibody-drug conjugates[J]. Bioanalysis, 2011, 3:677-700. |
| [31] | Zhang S, Jian WY. Recent advances in absolute quantification of peptides and proteins using LC-MS[J]. Rev Anal Chem, 2014, 33:31-47. |
| [32] | Jenkins R, Duggan JX, Aubry AF, et al. Recommendations for validation of LC-MS/MS bioanalytical methods for protein biotherapeutics[J]. AAPS J, 2015, 17:1-16. |
| [33] | Bronsema KJ, Bischoff R, van de Merbel NC. Internal standards in the quantitative determination of protein biopharmaceuticals using liquid chromatography coupled to mass spectrometry[J]. J Chromatogr B, 2012, 893-894:1-14. |
| [34] | Rao C, Rangan VS, Deshpande S. Challenges in antibodydrug conjugate discovery:a bioconjugation and analytical perspective[J]. Bioanalysis, 2015, 7:1561-1564. |
| [35] | Yu CF, Li M, Guo W, et al. Determination of drug antibody ratio in an antibody-drug conjugate[J]. Acta Pharm Sin (药学学报), 2014, 49:363-367. |
| [36] | Xu KY, Liu L, Dere R, et al. Characterization of the drugto-antibody ratio distribution for antibody-drug conjugates in plasma/serum[J]. Bioanalysis, 2013, 5:1057-1071. |
| [37] | Boswell CA, Mundo EE, Zhang C, et al. Impact of drug conjugation on pharmacokinetics and tissue distribution of anti-STEAP1 antibody-drug conjugates in rats[J]. Bioconjug Chem, 2011, 22:1994-2004. |
| [38] | Valliere-Douglass JF, McFee WA, Salas-Solano O. Native intact mass determination of antibodies conjugated with monomethyl auristatin E and F at interchain cysteine residues[J]. Anal Chem, 2012, 84:2843-2849. |
| [39] | Chen J, Yin S, Wu Y, et al. Development of a native nanoelectrospray mass spectrometry method for determination of the drug-to-antibody ratio of antibody-drug conjugates[J]. Anal Chem, 2013, 85:1699-1704. |
| [40] | Huang RY, Deyanova EG, Passmore D, et al. Utility of ion mobility mass spectrometry for drug-to-antibody ratio measurements in antibody-drug conjugates[J]. J Am Soc Mass Spectrom, 2015, 26:1791-1794. |
| [41] | Marcoux J, Champion T, Colas O, et al. Native mass spectrometry and ion mobility characterization of trastuzumab emtansine, a lysine-linked antibody drug conjugate[J]. Protein Sci, 2015, 24:1210-1223. |
| [42] | Yang JH, Ng C, Lowman H, et al. Quantitative determination of humanized monoclonal antibody rhuMAb2H7 in cynomolgus monkey serum using a Generic Immunoglobulin Pharmacokinetic (GRIP) assay[J]. J Immunol Methods, 2008, 335:8-20. |
| [43] | Dowell JA, Korth-Bradley J, Liu HJ, et al. Pharmacokinetics of gemtuzumab ozogamicin, an antibody-targeted chemotherapy agent for the treatment of patients with acute myeloid leukemia in first relapse[J]. J Clin Pharmacol, 2001, 41:1206-1214. |
| [44] | Henry MD, Wen SH, Silva MD, et al. A prostate-specific membrane antigen-targeted monoclonal antibody-chemotherapeutic conjugate designed for the treatment of prostate cancer[J]. Cancer Res, 2004, 64:7995-8001. |
| [45] | Alley SC, Benjamin DR, Jeffrey SC, et al. Contribution of linker stability to the activities of anticancer immunoconjugates[J]. Bioconjug Chem, 2008, 19:759-765. |
| [46] | McDonagh CF, Kim KM, Turcott E, et al. Engineered anti-CD70 antibody-drug conjugate with increased therapeutic index[J]. Mol Cancer Ther, 2008, 7:2913-2923. |
| [47] | Li HY, Ortiz R, Tran L, et al. General LC-MS/MS method approach to quantify therapeutic monoclonal antibodies using a common whole antibody internal standard with application to preclinical studies[J]. Anal Chem, 2012, 84:1267-1273. |
| [48] | Huang LH, Lu JR, Wroblewski VJ, et al. In vivo deamidation characterization of monoclonal antibody by LC/MS/MS[J]. Anal Chem, 2005, 77:1432-1439. |
| [49] | Dubois M, Fenaille F, Clement G, et al. Immunopurification and mass spectrometric quantification of the active form of a chimeric therapeutic antibody in human serum[J]. Anal Chem, 2008, 80:1737-1745. |
| [50] | Ezan E, Dubois M, Becher F. Bioanalysis of recombinant proteins and antibodies by mass spectrometry[J]. Analyst, 2009, 134:825-834. |
| [51] | Liu HC, Manuilov AV, Chumsae C, et al. Quantitation of a recombinant monoclonal antibody in monkey serum by liquid chromatography-mass spectrometry[J]. Anal Biochem, 2011, 414:147-153. |
| [52] | Kozak KR, Tsai SP, Fourie-O'Donohue A, et al. Total antibody quantification for MMAE-conjugated antibody-drug conjugates:impact of assay format and reagents[J]. Bioconjug Chem, 2013, 24:772-779. |
| [53] | Kovtun YV, Audette CA, Ye Y, et al. Antibody-drug conjugates designed to eradicate tumors with homogeneous and heterogeneous expression of the target antigen[J]. Cancer Res, 2006, 66:3214-3221. |
| [54] | Advani A, Coiffier B, Czuczman MS, et al. Safety, pharmacokinetics, and preliminary clinical activity of inotuzumab ozogamicin, a novel immunoconjugate for the treatment of B-cell non-Hodgkin's lymphoma:results of a phase I study[J]. J Clin Oncol, 2010, 28:2085-2093. |
| [55] | Hu BH, Che JJ, Xu XX, et al. Development of enzyme linked immunosorbent assay for quantitative determination of antibody-drug conjugate T-DM1[J]. Lett Biotechnol (生物技术通讯), 2014, 25:693-696. |
| [56] | Tolcher AW, Ochoa L, Hammond LA, et al. Cantuzumab mertansine, a maytansinoid immunoconjugate directed to the CanAg antigen:a phase I, pharmacokinetic, and biologic correlative study[J]. J Clin Oncol, 2003, 21:211-222. |
| [57] | Sanderson RJ, Hering MA, James SF, et al. In vivo druglinker stability of an anti-CD30 dipeptide-linked auristatin immunoconjugate[J]. Clin Cancer Res, 2005, 11:843-852. |
| [58] | Myler H, Rangan VS, Wang J, et al. An integrated multiplatform bioanalytical strategy for antibody-drug conjugates:a novel case study[J]. Bioanalysis, 2015, 7:1569-1582. |
| [59] | van der Lee MM, Groothuis PG, Ubink R, et al. The preclinical profile of the duocarmycin-based HER2-targeting ADC SYD985 predicts for clinical benefit in low HER2-expressing breast cancers[J]. Mol Cancer Ther, 2015, 14:692-703. |
| [60] | Li Y, Gu C, Gruenhagen J, et al. A size exclusion-reversed phase two dimensional-liquid chromatography methodology for stability and small molecule related species in antibody drug conjugates[J]. J Chromatogr A, 2015, 1393:81-88. |
| [61] | Carrasco-Triguero M, Yi JH, Dere R, et al. Immunogenicity assays for antibody-drug conjugates:case study with adotrastuzumab emtansine[J]. Bioanalysis, 2013, 5:1007-1023. |
| [62] | Liang MN, Klakamp SL, Funelas C, et al. Detection of highand low-affinity antibodies against a human monoclonal antibody using various technology platforms[J]. Assay Drug Dev Technol, 2007, 5:655-662. |
| [63] | Patton A, Mullenix MC, Swanson SJ, et al. An acid dissociation bridging ELISA for detection of antibodies directed against therapeutic proteins in the presence of antigen[J]. J Immunol Methods, 2005, 304:189-195. |
| [64] | Loyet KM, Deng R, Liang WC, et al. Technology comparesons for anti-therapeutic antibody and neutralizing antibody assays in the context of an anti-TNF pharmacokinetic study[J]. J Immunol Methods, 2009, 345:17-28. |
| [65] | Bartelds GM, Wijbrandts CA, Nurmohamed MT, et al. Clinical response to adalimumab:relationship to antiadalimumab antibodies and serum adalimumab concentrations in rheumatoid arthritis[J]. Ann Rheum Dis, 2007, 66:921-926. |
| [66] | Mire-Sluis AR, Barrett YC, Devanarayan V, et al. Recommendations for the design and optimization of immunoassays used in the detection of host antibodies against biotechnology products[J]. J Immunol Methods, 2004, 289:1-16. |
| [67] | Gupta S, Indelicato SR, Jethwa V, et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics[J]. J Immunol Methods, 2007, 321:1-18. |
| [68] | Koren E, Smith HW, Shores E, et al. Recommendations on risk-based strategies for detection and characterization of antibodies against biotechnology products[J]. J Immunol Methods, 2008, 333:1-9. |
| [69] | Shankar G, Devanarayan V, Amaravadi L, et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products[J]. J Pharm Biomed Anal, 2008, 48:1267-1281. |
| [70] | EMA. Guideline on Immunogenicity Assessment of Biotechnology-derived Therapeutic Proteins.[EB/OL]. 2008-04[2015-09-08]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003946.pdf. |
| [71] | FDA. Guidance for Industry:Assay Development for Immunogenicity Testing of Therapeutic Proteins.[EB/OL]. 2009-12[2015-09-08]. http://www.fda.gov/downloads/Drugs/Guidance ComplianceRegulatoryInformation/Guidances/UCM192750.pdf. |
| [72] | Hock MB, Thudium KE, Carrasco-Triguero M, et al. Immunogenicity of antibody drug conjugates:bioanalytical methods and monitoring strategy for a novel therapeutic modality[J]. AAPS J, 2015, 17:35-43. |
| [73] | Swann PG, Tolnay M, Muthukkumar S, et al. Considerations for the development of therapeutic monoclonal antibodies[J]. Curr Opin Immunol, 2008, 20:493-499. |
 2016, Vol. 51
2016, Vol. 51


