2. 中国药科大学药物科学研究院, 江苏南京 210009
2. Institute of Pharmaceutical Sciences, China Pharmaceutical University, Nanjing 210009, China
硫化氢 (hydrogen sulfide,H2S) 是一种具有臭鸡蛋味的无色有毒气体。长期以来,H2S作为一种矿物燃料中不可避免的成分和一种有机材料生物降解时形成的副产物,被认为是空气和水源的重要污染物,过量吸入可影响肺、脑、肾等多种脏器的正常功能[1]。以往对H2S的研究都偏重其毒性作用,直到20世纪90年代中期,发现人体内H2S可作为一种神经活性物质存在,才对其进行了新的研究和探索。现已证明,H2S是继一氧化氮 (nitric oxide,NO) 和一氧化碳 (carbon monoxide,CO) 之后的第三种内源性气体信号分子,在机体中发挥着重要的生理功能,有关H2S的研究已成为生物学研究领域的热点之一[2]。
随着对H2S研究的深入,越来越多的实验结果证实,H2S不仅是一种内源性的气体信号分子,而且在体内尤其是心血管系统和神经系统中具有多种生理作用。研究表明,H2S可以调节心脏的收缩功能,在舒张血管、抑制血管重构和保护心肌方面都具有重要的生理作用,并与多种心血管系统疾病密切相关[3, 4]。研究还表明,H2S对神经系统和消化道也具有重要的调节作用[5, 6]。本文就H2S的生物学特性、生理作用、H2S供体及其相关药物等方面的研究进展进行综述。
1 H2S的生物学特性 1.1 H2S的理化性质H2S是一种无色带有臭鸡蛋气味的有毒小分子气体,溶于水、乙醇。在pH为7.4的生理条件下,1/3以气体H2S形式存在,2/3以硫氢根离子 (HS-) 形式存在,两者保持一种动态平衡,这样既可以使H2S在体内稳定存在,同时又维持了内环境的pH水平[7]。H2S的脂溶性是其水溶性的5倍,因此它可以自由通过细胞膜,进行广泛的生理病理调节[8]。有研究表明,H2S的生理浓度为10~100 μmol·L-1 [9],在人的大部分组织和血清中的水平为52 μmol·L-1 [10]。
1.2 内源性H2S的来源及分布在哺乳动物组织中,内源性H2S主要通过3条途径产生[11],其中前2条是5-磷酸吡哆醛 (PLP) 的酶依赖调节途径,即以L-半胱氨酸 (Cys) 和同型半胱氨酸 (Hcy) 为底物,由胱硫醚-β-合成酶 (CBS) 和胱硫醚-γ-裂解酶 (CSE) 催化而成; 第3条是不依赖于PLP的3-硫基丙酮酸硫基转移酶 (3-MST) 途径,以含硫的氨基酸为底物催化而生成。CBS、CSE及3-MST的表达均具有组织特异性,CBS主要存在于大脑和神经组织中,CSE则主要在肝、肾、血管平滑肌及心血管系统中表达[12]。Cys和Hcy在CBS和CSE作用下产生H2S后,H2S又能负反馈作用于这两种酶的活性,Cys的转硫作用被认为是内源性H2S生成的主要途径[13]。与CBS和CSE不同,3-MST是存在于线粒体中而并非胞浆中的H2S合成酶,属于巯基转移酶类家族,它主要存在于大脑、肝脏、肾脏、心脏、肺、胸腺、睾丸和胸主动脉[14]。3-MST不直接合成H2S,而是通过催化过硫化物等转硫物质合成硫化 物,后者在一定条件下释放H2S,维持线粒体电子流及细胞生物能[15]。
1.3 体内H2S的代谢H2S在机体内主要存在以下4条代谢途径[16]: ① 通过线粒体氧化代谢生成硫酸盐和硫代硫酸盐。② 在多种组织、红细胞以及血浆内经氧化代谢形成硫代硫酸盐和硫酸盐而解毒,其终产物是铵和丙酮酸盐。③ 极少部分在胞质溶液中通过甲基化代谢转化为毒性较低的甲硫醇和二甲基硫酸盐化合物。④ 在血浆中可被高铁血红蛋白清除。部分体内代谢产物可在24 h内从肾脏和肠道排出,少部分以原形经肺呼出[17]。
2 H2S在心血管和神经系统中的生理作用H2S作为一种最新发现的内源性气体信号分子,具有广泛的生物学效应,在消化系统、呼吸系统以及泌尿系统特别是心血管系统和神经系统中有着重要生理作用和意义。
2.1 H2S在心血管系统中的生理作用H2S是心血管功能调节的新型气体信号分子,对整个心血管系统结构和功能的调节具有普遍性作用。研究表明它可调节心肌舒缩功能,直接舒张体、肺循环血管,抑制血管平滑肌细胞 (VSMCs) 增殖并调控其表型转化。此外,H2S尚有抗心肌缺血再灌注损伤、参与炎症反应和抗氧化应激等多种效应,主要参与肺动脉高压、高血压病、冠心病、心肌缺血再灌注损伤、休克等的病理生理过程。下面就H2S在心血管系统中的生理作用进行详细阐述。
2.1.1 舒张血管、降低血压大量研究表明,H2S在心血管系统中具有舒张血管、降低血压的作用,其作用途径有别于其他两种内源性气体信号分子NO和CO (NO和CO通过鸟苷酸环化酶cGMP通路),H2S的主要作用途径如下: ① 通过开放VSMCs上的KATP通道,减少细胞外Ca2+内流,且H2S直接与KATP通 道蛋白作用,并不干预细胞内ATP代谢,H2S是目前第一个被确定的VSMCs膜上KATP通道的气体开放 剂[18]。② H2S可以与NO相互作用,促进内皮细胞中NO的释放,同时H2S还和NO协同舒张平滑肌; 另外,由于NO可以增加CSE的表达和刺激CSE的活性,是内源性H2S生成的调节物质,提示气体分子的相互作用可能作为调节血管张力的一种分子开关[19]。③ H2S可通过激活Cl-/HCO3-交换导致细胞内酸化,这一作用可介导 (至少部分介导) H2S的血管舒张效应[20]。④ H2S对血压的调节不仅通过舒张外周血管平滑肌来实现,也可通过作用于下丘脑使得血压、心率下降,该作用机制可能也是KATP通道介导的[21]。
2.1.2 抑制血管平滑肌细胞增殖、抑制血管重构H2S可以促进VSMCs凋亡、抑制VSMCs增殖、抑制血管重构。研究发现,H2S在基础状态下并未参与VSMCs增生的抑制; 在缺氧和内皮素异常升高及细胞过度增殖的病理状态下,H2S呈浓度 (5×10-5~5×10-4 mol·L-1) 依赖地抑制内皮素-1 (ET-1) 诱导的细胞增殖效应,其效应与抑制ET-1激活丝裂原活化蛋白激酶 (MAPK) 有关,H2S可通过下调MAPK的活性,下调凋亡抑制因子Bcl-2及NF-κB的水平,最终激活效应因子caspase-3活性,从而抑制平滑肌的增殖,促进VSMCs凋亡,缓解血管结构重建,维持血管的正常结构和功能[19, 22]。
2.1.3 心肌保护作用许多研究表明,内源性和外源性H2S均具有保护心肌缺血再灌注损伤的作用: ① 内源性H2S水平的降低可明显减弱缺血预处理对离体心脏和心肌细胞的保护作用,当使用蛋白激酶C (PKC) 抑制剂与肌膜KATP阻滞剂时,二者均可抑制NaHS预处理或者缺血预处理诱导的心肌保护作用,而使用线粒体KATP阻断剂则对NaHS预处理的心肌保护作用无影响。以上研究表明,NaHS预处理能够诱导心肌保护作用,内源性H2S同样具有心肌保护作用,该作用机制可能与PKC和肌膜KATP通道的活性有关[23]。② 通过NaHS预处理或缺血预适应,不仅可以减少离体心脏对于缺血再灌注损伤所致心律失常的持续时间和严重程度,而且还可以增加离体心肌缺血再灌注后细胞的活性及电诱导钙瞬变的幅度[24]。③ 另有研究发现,外源性Cys通过促进合成H2S,从而对缺血再灌注心肌产生保护作用[25]。
2.1.4 心脏负性肌力作用研究发现,内源性H2S对心肌组织具有明显的负性肌力作用,用1×10-4~1×10-6 mol·L-1 NaHS灌注离体大鼠心脏,可浓度依赖性地抑制左心室内压最大变化速率,当用更高浓度NaHS (1×10-3 mol·L-1) 灌注时,除了负性肌力作用外,心率及心室的收缩也明显受到抑制,导致冠脉灌流量下降,同时也观察到近生理浓度H2S抑制左心室功能; 在体实验也同样发现,静脉注射NaHS在引起平均动脉压下降的同时,也可引起暂时性心脏负性肌力作用。除了左心室内压最大变化速率下降外,左心室收缩末期压和左心室舒张末期压以及中心静脉压也显著下降[26, 27]。进一步研究表明,H2S对心脏的负性肌力作用是通过开放心肌细胞膜上KATP来实现的,其可能的机制为[28]: H2S可通过开放KATP通道,使K+外流增加造成心肌细胞膜的超极化,心肌细胞去极化时间延长,Na+内流减少; 同时,由于K+外流,可抑制Ca2+内流,使心肌细胞的收缩功能受到抑制。
2.1.5 参与炎症反应H2S可以参与炎症反应,且对炎症反应具有双重作用: ① 有研究发现H2S能够显著减轻脂多糖诱导的中性粒细胞在组织器官 (肝脏和肺脏) 中的堆积,降低肿瘤坏死因子-α (TNF-α) 和血浆白细胞介素-1 (IL-1β) 水平,升高血浆IL-10水平,从而抑制炎性介质反应[29]。② 也有一些研究结果表明,H2S会显著加重败血症,导致全身性炎性介质反应[30]。由此来看,H2S的这种双重作用是其作用在疼痛系统不同水平所致,在不同的病理状态下,H2S对炎症反应有着不同的调节作用。
2.1.6 抗氧化应激近年来研究发现H2S是一种潜在的强抗氧剂,其抗氧化作用对治疗心血管疾病起着至关重要的作用。现已证明,H2S可能通过直接消除活性氧和上调抗氧化防御系统两种不同的机制发挥抗氧化应激作用: ① 体外研究显示,H2S通过抑制肌细胞氧自由基的产生,可以直接清除活性氧 (包括过氧化氢和超氧阴离子),降低异丙肾上腺素诱导的心肌缺血性损伤引起的心脏脂质过氧化反应[27, 31]。此外,研究还发现外源性H2S (NaHS) 能够抑制过氧化氢引起的胃黏膜上皮细胞凋亡,给予NaHS可以有效地保护心肌细胞,该作用可能通过直接清除氧自由基和减少脂质过氧化反应堆积来实现[32]。② 研究发现,在谷氨酸诱导的氧化应激模型中,H2S通过增加提高γ-谷氨酰半胱氨酸合成酶的活性和增加胱氨酸转运来增加谷胱甘肽 (抗氧化剂) 水平,从而保护神经元,减少细胞死亡[33]。另有研究表明,在大鼠心肌缺血再灌注模型中,H2S可不同程度地升高超氧化物歧化酶和谷胱甘肽过氧化物酶的水平,从而降低脂质过氧化,减少其产物的生成,通过增加内源性抗氧化物酶系统活性来改善缺血再灌注损伤的作用[34]。
2.2 H2S在神经系统中的生理作用内源性H2S作为一种新型非典型神经递质,对神经系统功能有着重要的调节作用。研究表明,H2S在神经系统中具有神经调节、抑制炎症反应和抗氧化应激等作用。同时,H2S也参与了阿尔茨海默病 (AD)、帕金森病 (PD)、脑缺血、热性惊厥、唐氏综合征等神经系统疾病的病理生理过程。下面详细阐述H2S在神经系统中的生理作用。
2.2.1 神经调节作用内源性H2S作为一种新的神经调质,参与调节多种神经生理功能。H2S通过激活腺苷酸环化酶及其后的环腺苷酸/蛋白激酶A级联反应,增强海马神经元N-甲基-D-天冬氨酸 (NMDA) 受体活动,易化海马长时程增强 (LTP) 的产生,从而调节学习和记忆[33]; 在血管性痴呆大鼠模型中,适量的外源性H2S能通过抑制神经元凋亡,改善神经元功能,保护其免受结扎颈总动脉所致的损伤[35]。研究还发现,H2S可以增加星形胶质细胞内的Ca2+浓度,诱发星形细胞胶质产生钙波,从而介导神经元及星形胶质细胞间的信号传递。此外,H2S还可以促进星形胶质细胞摄取谷氨酸,维持神经元正常突触传递等[36]。
2.2.2 抗氧化应激2004年,研究人员在谷氨酸处理胚胎大鼠原代培养大脑皮层神经元建立的氧化应激损伤模型中观察到,外源性H2S (NaHS) 呈剂量依赖性地抑制谷氨酸兴奋性毒性作用引起的神经元死亡,使细胞存活率升高,首次证实H2S具有抗氧化应激和神经元保护作用[30]。随后,在小鼠海马神经细胞株 (HT22细胞) 进一步证实H2S能保护HT22细胞对抗氧化应激 (谷氨酸) 引起的损伤[37]。研究还发现,H2S也能保护神经细胞对抗次氯酸及过氧化亚硝酸盐诱导的氧化应激损伤[38]。H2S保护神经元对抗氧化应激损伤的作用机制可能为: ① 抗氧化作用,H2S是一种还原剂,容易与过氧化氢反应,因此H2S可直接清除ROS[39]。② 线粒体保护作用,氧化应激可损伤神经元的线粒体,使线粒体膜电位降低,但是外源性的H2S可以阻断Aβ或鱼藤酮对神经元线粒体的损伤作用,明显地提高线粒体膜电位,这可能是H2S保护神经元对抗氧化应激损伤的另一作用机制[40]。③ H2S可以激活KATP通道和囊性纤维化跨膜传导调节氯通道,这是H2S保护海马神经元对抗氧化应激损伤的又一作用机制[37]。
2.2.3 抑制炎症反应研究发现,H2S可通过抑制炎症因子的生成并促进抗炎细胞因子的生成,以此来减轻神经元细胞炎症反应: 在鱼藤酮引起的大鼠PD 模型中,一方面,H2S可以抑制纹状体的炎症介质NO及TNF-α的释放; 另一方面,NaHS能抑制鱼藤酮对ED-1 (一个小胶质细胞活动的指标) 表达的上调作用,说明H2S能抑制小胶质细胞活动; 研究还发现,H2S能抑制鱼藤酮引起的NF-κB亚基的磷酸化及核移位,表明H2S可通过抑制NF-κB通路的活化而发挥抗炎症作用[41]。
3 H2S供体 3.1 硫化盐目前可用作外源性H2S供体的硫化盐主要有硫氢化钠 (NaHS)、硫化钠 (Na2S) 和硫化钙 (CaS),它们可以在生理缓冲液中快速释放出HS-和H2S[42]。但是,研究表明硫化盐在水溶液中可以在数秒时间内释放出H2S,从而使得组织细胞在短时间内经受高浓度的H2S暴露,可能会造成组织细胞的毒性损伤,这也就限制了它们的临床应用[43]。
3.2 自然界中存在的H2S供体大蒜(garlic) 含有脂溶性和水溶性的硫化物,因此具有抗菌、抗病毒、抗肿瘤和预防心血管疾病 等生物学功能。如图 1所示,源于大蒜的H2S供体 主要有二烯丙基三硫醚 (DATS)、二烯丙基二硫醚 (DADS) 和二烯丙基硫醚 (DAS)。2007年,Benavides等[44]研究表明大蒜硫化物DATS和DADS在人体红细胞膜内外巯基交换转变可以释放出H2S。2010年,Bonaventura等[45]研究表明大蒜提取液多硫化物及纯品DADS对脱氧血红蛋白中β链cysteine-93 (β-93C) 或cysteine-112 (β-112C) 的修饰可以生成H2S。这些结果大大推进了大蒜硫化物转化为H2S的基础研究进程。

|
图 1 几种自然界存在的H2S供体 |
萝卜硫素 (sulforaphane)、芥酸精 (erucin) 和3-甲磺酰基丙基异硫代氰酸酯 (iberin) 也是自然界存在的H2S供体,研究表明,它们可以上调人乳腺癌MCF-7细胞中的硫氧还蛋白还原酶1的水平,通过3-MST途径释放出H2S; 此外,半胱氨酸类似物,如S-正丙基半胱氨酸 (SPC)、S-烯丙基半胱氨酸 (SAC)、S-炔丙基半胱氨酸 (SPRC) 和N-乙酰基半胱氨酸 (NAC) 也是自然界中存在的H2S供体 (图 1)[46]。
3.3 人工合成的H2S供体如图 2所示,Lawesson’s reagent是一种广泛应用于有机合成的硫化试剂,研究表明它是一种H2S供体,在水溶液中可以自发释放出H2S[47],但由于其水溶性较低,限制了其进一步应用。GYY4137是一种新型水溶性H2S缓释剂,由Moore等[48]于2008年 以Lawesson’s复合物的化学结构为基础首次合成,在体内和体外都成缓释状态,且呈温度和pH依赖性地缓慢释放H2S。研究显示GYY4137具有抗休克、抗肿瘤、抗血栓形成等作用[49, 50, 51],且相关研究呈逐年上升趋势。近年来研究发现,去甲茴三硫 (ADTOH)、ACS 5、ACS 48、ACS 50和TBZ均可在体外及体内释放出H2S,因而作为H2S供体被广泛应用于基础实验研究中[46, 52]。
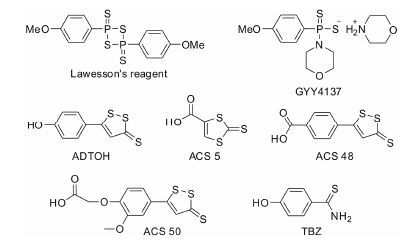
|
图 2 几种人工合成的H2S供体 |
传统的非甾体抗炎药 (NSAIDs) 临床应用极为广泛,但严重的胃肠道和新近发现的心血管不良反应限制了它们进一步的应用[53]。为了减弱NSAIDs对胃肠道、肝、肾以及血液系统等的不良反应,研究人员常将H2S供体基团和NSAIDs拼合,从而形成新的化学实体。
ACS 6 (表 1) 是以西地那非 (sildenafil) 为原药与ADTOH拼合而成的H2S供体型衍生物,研究发 现ACS 6可以缓慢释放出H2S从而增强药效,其舒 张海绵平滑肌作用远强于西地那非[54, 55]。研究还发 现ACS 6通过上调对氧磷酯酶-1 (PON-1) 水平,发挥抗Hcy诱导的神经毒性和抗氧化应激效应,从而保护PC12细胞[56]。
|
|
表 1 在研的H2S-NASIDs概述 |
ACS 14 (表 1) 是阿司匹林 (aspirin) 与ADTOH拼合而成的H2S供体型衍生物,研究显示,ACS 14在保留原有药效的基础上,降低了原药的胃肠道副反应[57]。研究发现,与原药阿司匹林相比,ACS 14具有更强的抗血小板聚集和抗血栓活性[58]。研究还发现,ACS 14可抑制白血病Jurkat细胞的生长、调节β-连环蛋白的表达[59]。
ACS 15 (表 1) 是双氯芬酸 (disclofenac) 与ADTOH拼合而成的H2S供体型衍生物,可在体内/外释放出H2S,从而不仅提高了抗炎活性,而且显著减轻胰腺炎引起的相关肺损伤[60]。另有研究发现ACS 15具有抗心肌缺血再灌注损伤活性,而双氯芬酸则没有此活性[61]。最新研究表明,ACS 15具有抗骨质再吸收作用,通过抑制破骨细胞的形成和活性,从而抑制乳腺癌细胞诱导的破骨细胞形成并防止骨质溶解,这对于治疗溶骨性疾病可能具有重要的临床应用价值[62]。
以拉坦前列腺素 (latanoprost) 和ADTOH合成的H2S供体型衍生物ACS 67 (表 1),可增加兔眼房水中谷胱甘肽的生成,拮抗过氧化氢对眼底神经元细胞的氧化损伤,从而缓解视网膜缺血损伤[63]。此外,有研究发现,ACS 67可以抑制L型Ca2+通道,降低胰岛β细胞中的L型电压依赖性Ca2+通道电流,从而抑制胰岛素分泌,但抑制作用低于NaHS[64]。
ATB-343 (表 1) 是吲哚美辛 (indomethacin) 和ADTOH拼合而成的H2S供体型衍生物,研究表明ATB-343不仅可以降低白细胞黏附作用,从而使抗炎活性增强,而且降低了原药的副作用[65]。
ATB-346 (表 1) 是将萘普生 (naproxen) 和H2S供体TBZ拼合得到的衍生物,与萘普生相比,ATB- 346不仅可以更有效地抑制COX-2的活性,还可以减少对胃肠道的损伤,加速已有胃溃疡病灶的愈合,可用于改善骨关节炎和牙周炎的治疗[66, 67]。此外,研究还发现ATB-346可以用于中枢神经系统疾病的二次损伤的有效预防[68]和结肠直肠癌的化学预防[69]。
ATB-352 (表 1) 是酮洛芬 (ketoprofen) 和ADTOH拼合得到的H2S供体型衍生物,研究表明,ATB-352不仅具有与酮洛芬相似的抗炎活性,而且对胃肠道的副反应几乎为零,可用于肿瘤的化学预防[70]。
将美沙拉嗪 (mesalamine) 和ADTOH拼合得到的化合物ATB-429 (表 1),与美沙拉嗪相比,其抗炎镇痛活性提高,胃肠道副作用明显降低,能减轻小鼠结肠炎模型中的白细胞渗出,对伴随炎症性肠胃病的内脏痛的镇痛效果显著[71, 72]。
4.2 H2S供体型神经系统药物基于H2S在神经系统中的保护作用,作者以抗脑缺血药物丁苯酞 (3-n-butylphthalide) 的开环化合物为先导物,将其与H2S供体ADTOH相杂合,设计合成了一类H2S供体型丁苯酞开环衍生物 (HS-1~HS-7,图 3),并初步研究了其生物学活性。结果表明所有目标化合物的体外血小板聚集抑制作用均显著强于原药丁苯酞,其中化合物HS-5的抑制作用最为突出。构成HS-5的相关片段单独或联合给药后,均具有一定的抗血小板聚集活性,但活性远不及HS-5,提示HS-5的相关片段对血小板聚集具有协同抑制作用,而不是简单的加和作用。此外,与丁苯酞和阿司匹林相比,HS-5也表现出较高的体内抗血栓活性[73]。进一步的抗脑缺血活性和作用机制正在研究中。
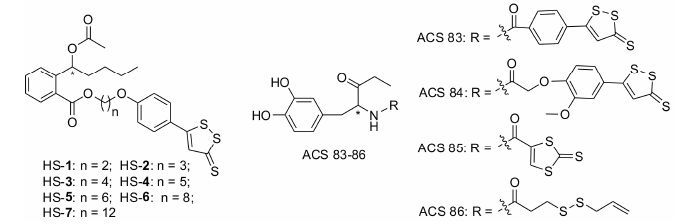
|
图 3 H2S供体型中枢神经系统药物 |
McGeer课题组以抗震颤麻痹药左旋多巴 (levodopa) 为先导物,将其分别与4种不同的H2S供体相拼合,得到了化合物ACS 83~86 (图 3)。研究结果显示,ACS 83~86不仅具有抗炎作用,而且可以显著降低左旋多巴的胃肠道副作用,更为重要的是,ACS 83~86可以抑制MAOB的活性,从而有助于恢复和维持多巴胺水平,可作为PD候选药物,具有重要的临床应用价值[74]。
4.3 NO-H2S双供体型药物NO和H2S作为气体信号分子,有广泛的组织分布和多样的生物学效应。有趣的是,研究发现,NO和H2S并不是孤立存在的,它们在代谢途径、转运、作用靶点、信号转导通路等方面存在复杂的相互作用: 一方面,NO可以增加血管平滑肌上CSE的活性,诱导CSE生成H2S,从而协同发挥舒张血管作用[75]; 另一方面,H2S可以阻断 或减轻ROS在脑缺血状态 下对神经血管单元的损伤作用,同时也可从源头上阻断过氧化亚硝基的生成,为NO发挥作用奠定基 础[76, 77]。
Kashfi等[78]将NO供体和H2S供体同时和阿司匹林拼合,形成NO和H2S双供体型阿司匹林化合物NOSH-

|
图 4 NO-H2S双供体型药物 |
H2S作为一种最新发现的内源性气体信号分子,在舒张血管平滑肌、促进血管生成、抗凋亡、抗氧化应激、神经保护以及抗炎等方面均发挥了重要的作用。在此基础上,H2S供体型药物的问世也引起了人们的关注。然而,由于研究时间不长,H2S从生理组织产生到释放的过程及与其他调节因子相互间的作用还有待进一步阐明,其在病理条件下的生物学功能以及相关信号转导通路的影响也有待深入探究。此外,H2S供体的类型还不多,须进一步挖掘和验证。
研究表明,糖基化修饰是改善药物水溶性、稳定性、靶向性、降低药物的毒副作用和增强其生物学活性等非常有效的手段[82]。药物的糖基化改造是开发新药的有效途径之一,糖基的引入一方面可以赋予分子重要的性状特征和空间电子性质,增加其结构多样性; 另一方面可以提高药物分子的靶向性、改善其代谢的动力学参数并调节分子的药理活性[83]。因此,基于作者之前的研究基础以及目前的工作平台,正在开展糖基化修饰的H2S供体型药物的研发,期望可以获得水溶性更好、药效更强、安全性更高的新型H2S供体型药物。
综上所述,对于H2S的研究,仍然需要开展大量基础研究及其应用方面的探索工作。期待H2S的研究成果早日应用于临床,为广大心血管和神经系统等疾病患者拓宽临床治疗途径。
| [1] | Wang R. Two's company, three's a crowd:can H2S be the third endogenous gaseous transmitter[J]. FASEB J, 2002, 6:1792-1798. |
| [2] | Lu M, Liu YH, Goh HS, et al. Hydrogen sulfide inhibits plasma renin activity[J]. J Am Soc Nephrol, 2010, 21:993-1002. |
| [3] | Shen Y, Shen Z, Luo S, et al. The cardioprotective effects of hydrogen sulfide in heart diseases:from molecular mechanisms to therapeutic potential[J]. Oxid Med Cell Longev, 2015, 2015:925167. DOI:10.1155/2015/925167. |
| [4] | Salloum FN. Hydrogen sulfide and cardioprotection-mechanistic insights and clinical translatability[J]. Pharmacol Ther, 2015, 152:11-17. |
| [5] | Wallace JL, Wang R. Hydrogen sulfide-based therapeutics:exploiting a unique but ubiquitous gasotransmitter[J]. Nat Rev Drug Discov, 2015, 14:329-345. |
| [6] | Wu D, Wang J, Li H, et al. Role of hydrogen sulfide in ischemia-reperfusion injury[J]. Oxid Med Cell Longev, 2015, 2015:186908. DOI:10.1155/2015/186908. |
| [7] | Hosoki R, Matsuki N, Kimura H. The possible role of hydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide[J]. Biochem Biophys Res Commun, 1997, 237:527-531. |
| [8] | Moore PK, Bhatia M, Moochhala S. Hydrogen sulfide:from the smell of the past to the mediator of the future?[J]. Trends Pharmacol Sci, 2003, 24:609-611. |
| [9] | Wang R. The gasotransmitter role of hydrogen sulfide[J]. Antioxid Redox Signal, 2003, 5:493-501. |
| [10] | Jiang LH, Wu HC, Li ZL, et al. Changes of the new gaseous transmitter H2S in patients with coronary heart disease[J]. Acad J First Med Coll PLA (第一军医大学学报), 2005, 25:951-954. |
| [11] | Stipanuk MH, Beck PW. Characterization of the enzymic capacity for cysteine desulphhydration in liver and kidney of the rat[J]. Biochem J, 1982, 206:267-277. |
| [12] | Kamoun P. Endogenous production of hydrogen sulfide in mammals[J]. Amino Acids, 2004, 26:243-254. |
| [13] | Kredich NM, Foote LJ, Keenan BS. The stoichiometry and kinetics of the inducible cysteine desulfhydrase from Salmonella typhimurium[J]. J Biol Chem, 1973, 248:6187-6196. |
| [14] | Kimura H. Hydrogen sulfide:its production, release and functions[J]. Amino Acids, 2011, 41:113-121. |
| [15] | Zhang Y, Tang ZH, Ren Z, et al. Hydrogen sulfide, the next potent preventive and therapeutic agent in aging and ageassociated diseases[J]. Mol Cell Biol, 2013, 33:1104-1113. |
| [16] | Tang C, Li X, Du J. Hydrogen sulfide as a new endogenous gaseous transmitter in the cardiovascular system[J]. Curr Vasc Pharmacol, 2006, 4:17-22. |
| [17] | Furne J, Springfield J, Koenig T, et al. Oxidation of hydrogen sulfide and methanethiol to thiosulfate by rat tissues:a specialized function of the colonic mucosa[J]. Biochem Pharmacol, 2001, 62:255-259. |
| [18] | Liew HC, Khoo HE, Moore PK, et al. Synergism between hydrogen sulfide (H2S) and nitric oxide (NO) in vasorelaxation induced by stonustoxin (SNTX), a lethal and hypotensive protein factor isolated from stonefish Synanceja horrida venom[J]. Life Sci, 2007, 80:1664-1668. |
| [19] | Yang G, Sun X, Wang R. Hydrogen sulfide-induced apoptosis of human aorta smooth muscle cells via the activation of mitogen-activated protein kinases and caspase-3[J]. FASEB J, 2004, 18:1782-1784. |
| [20] | Lee SW, Cheng Y, Moore PK, et al. Hydrogen sulphide regulates intracellular pH in vascular smooth muscle cells[J]. Biochem Biophys Res Commun, 2007, 358:1142-1147. |
| [21] | Dawe GS, Han SP, Bian JS, et al. Hydrogen sulphide in the hypothalamus causes an ATP-sensitive K+ channel-dependent decrease in blood pressure in freely moving rats[J]. Neuroscience, 2008, 152:169-177. |
| [22] | Du J, Hui Y, Cheung Y, et al. The possible role of hydrogen sulfide as a smooth muscle cell proliferation inhibitor in rat cultured cells[J]. Heart Vessels, 2004, 19:75-80. |
| [23] | Pan TT, Feng ZN, Lee SW, et al. Endogenous hydrogen sulfide contributes to the cardioprotection by metabolic inhibittion preconditioning in the rat ventricular myocytes[J]. J Mol Cell Cardiol, 2006, 40:119-130. |
| [24] | Bian JS, Yong QC, Pan TT, et al. Role of hydrogen sulfide in the cardioprotection caused by ischemic preconditioning in the rat heart and cardiac myocytes[J]. J Pharmacol Exp Ther, 2006, 316:670-678. |
| [25] | Elsey DJ, Fowkes RC, Baxter GF. L-Cysteine stimulates hydrogen sulfide synthesis in myocardium associated with attenuation of ischemia-reperfusion injury[J]. J Cardiovasc Pharmacol Ther, 2010, 15:53-59. |
| [26] | Geng B, Yang J, Qi Y, et al. H2S generated by heart in rat and its effects on cardiac function[J]. Biochem Biophys Res Commun, 2004, 313:362-368. |
| [27] | Geng B, Chang L, Pan C, et al. Endogenous hydrogen sulfide regulation of myocardial injury induced by isoproterenol[J]. Biochem Biophys Res Commun, 2004, 318:756-763. |
| [28] | Zhong GZ, Li YB, Liu XL, et al. Hydrogen sulfide opens the KATP channel on rat atrial and ventricular myocytes[J]. Cardiology, 2010, 115:120-126. |
| [29] | Li L, Rossoni G, Sparatore A, et al. Anti-inflammatory and gastrointestinal effects of a novel diclofenac derivative[J]. Free Radic Biol Med, 2007, 42:706-719. |
| [30] | Zhang H, Zhi L, Moore PK, et al. Role of hydrogen sulfide in cecal ligation and puncture-induced sepsis in the mouse[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290:L1193-L1201. |
| [31] | Yan SK, Chang T, Wang H, et al. Effects of hydrogen sulfide on homocysteine-induced oxidative stress in vascular smooth muscle cells[J]. Biochem Biophys Res Commun, 2006, 351:485-491. |
| [32] | Yonezawa D, Sekiguchi F, Miyamoto M, et al. A protective role of hydrogen sulfide against oxidative stress in rat gastric mucosal epithelium[J]. Toxicology, 2007, 241:11-18. |
| [33] | Kimura Y, Kimura H. Hydrogen sulfide protects neurons from oxidative stress[J]. FASEB J, 2004, 18:1165-1167. |
| [34] | Whiteman M, Armstrong JS, Chu SH, et al. The novel neuromodulator hydrogen sulfide:an endogenous peroxynitrite ‘scavenger’?[J]. J Neurochem, 2004, 90:765-768. |
| [35] | Zhang LM, Jiang CX, Liu DW. Hydrogen sulfide attenuates neuronal injury induced by vascular dementia via inhibiting apoptosis in rats[J]. Neurochem Res, 2009, 34:1984-1992. |
| [36] | Nagai Y, Tsugane M, Oka J, et al. Hydrogen sulfide induces calcium waves in astrocytes[J]. FASEB J, 2004, 18:557-559. |
| [37] | Kimura Y, Dargusch R, Schubert D, et al. Hydrogen sulfide protects HT22 neuronal cells from oxidative stress[J]. Antioxid Redox Signal, 2006, 8:661-670. |
| [38] | Whiteman M, Cheung NS, Zhu YZ, et al. Hydrogen sulphide:a novel inhibitor of hypochlorous acid-mediated oxidative damage in the brain?[J]. Biochem Biophys Res Commun, 2005, 326:794-798. |
| [39] | Meng JL, Mei WY, Dong YF, et al. Heat shock protein 90 mediates cytoprotection by H2S against chemical hypoxiainduced injury in PC12 cells[J]. Clin Exp Pharmacol Physiol, 2011, 38:42-49. |
| [40] | Hu LF, Lu M, Wu ZY, et al. Hydrogen sulfide inhibits rotenone-induced apoptosis via preservation of mitochondrial function[J]. Mol Pharmacol, 2009, 75:27-34. |
| [41] | Hu LF, Lu M, Tiong CX, et al. Neuroprotective effects of hydrogen sulfide on Parkinson's disease rat models[J]. Aging Cell, 2010, 9:135-146. |
| [42] | Deleon ER, Stoy GF, Olson KR. Passive loss of hydrogen sulfide in biological experiments[J]. Anal Biochem, 2012, 421:203-207. |
| [43] | Li ZG, Ding XJ, Du PF. Hydrogen sulfide donor sodium hydrosulfide-improved heat tolerance in maize and involvement of proline[J]. J Plant Physiol, 2013, 170:741-747. |
| [44] | Benavides GA, Squadrito GL, Mills RW, et al. Hydrogen sulfide mediates the vasoactivity of garlic[J]. Proc Natl Acad Sci USA, 2007, 104:17977-17982. |
| [45] | Bonaventura J, Rodriguez EN, Beyley V, et al. Allylation of intraerythrocytic hemoglobin by raw garlic extracts[J]. J Med Food, 2010, 13:943-949. |
| [46] | Kashfi K, Olson KR. Biology and therapeutic potential of hydrogen sulfide and hydrogen sulfide-releasing chimeras[J]. Biochem Pharmacol, 2013, 85:689-703. |
| [47] | Spiller F, Orrico MI, Nascimento DC, et al. Hydrogen sulfide improves neutrophil migration and survival in sepsis via K+ATP channel activation[J]. Am J Respir Crit Care Med, 2010, 182:360-368. |
| [48] | Li L, Whiteman M, Guan YY, et al. Characterization of a novel, water-soluble hydrogen sulfide-releasing molecule (GYY4137):new insights into the biology of hydrogen sulfide[J]. Circulation, 2008, 117:2351-2360. |
| [49] | Wang K, Demir IE, D'Haese JG, et al. The neurotrophic factor neurturin contributes toward an aggressive cancer cell phenotype, neuropathic pain and neuronal plasticity in pancreatic cancer[J]. Carcinogenesis, 2014, 35:103-113. |
| [50] | Sanz-Moreno V, Marshall CJ. The plasticity of cytoskeletal dynamics underlying neoplastic cell migration[J]. Curr Opin Cell Biol, 2010, 22:690-696. |
| [51] | Friedl P, Wolf K. Plasticity of cell migration:a multiscale tuning model[J]. J Cell Biol, 2010, 188:11-19. |
| [52] | Caliendo G, Cirino G, Santagada V, et al. Synthesis and biological effects of hydrogen sulfide (H2S):development of H2S-releasing drugs as pharmaceuticals[J]. J Med Chem, 2010, 53:6275-6286. |
| [53] | Wallace JL, McKnight W, Reuter BK, et al. NSAID-induced gastric damage in rats:requirement for inhibition of both cyclooxygenase 1 and 2[J]. Gastroenterology, 2000, 119:706-714. |
| [54] | Shukla N, Rossoni G, Hotston M, et al. Effect of hydrogen sulphide-donating sildenafil (ACS 6) on erectile function and oxidative stress in rabbit isolated corpus cavernosum and in hypertensive rats[J]. BJU Int, 2009, 103:1522-1529. |
| [55] | d'Emmanuele di Villa Bianca R, Sorrentino R, Maffia P, et al. Hydrogen sulfide as a mediator of human corpus cavernosum smooth-muscle relaxation[J]. Proc Natl Acad Sci USA, 2009, 106:4513-4518. |
| [56] | Tang XQ, Chen RQ, Dong L, et al. Role of paraoxonase-1 in the protection of hydrogen sulfide-donating sildenafil (ACS 6) against homocysteine-induced neurotoxicity[J]. J Mol Neurosci, 2013, 50:70-77. |
| [57] | Sparatore A, Perrino E, Tazzari V, et al. Pharmacological profile of a novel H2S-releasing aspirin[J]. Free Radic Biol Med, 2009, 46:586-592. |
| [58] | Pircher J, Fochler F, Czermak T, et al. Hydrogen sulfidereleasing aspirin derivative ACS 14 exerts strong antithrombotic effects in vitro and in vivo[J]. Arterioscler Thromb Vasc Biol, 2012, 32:2884-2891. |
| [59] | Chattopadhyay M, Nath N, Kodela R, et al. Hydrogen sulfide-releasing aspirin inhibits the growth of leukemic Jurkat cells and modulates β-catenin expression[J]. Leuk Res, 2013, 37:1302-1308. |
| [60] | Wallace JL, Caliendo G, Santagada V, et al. Gastrointestinal safety and anti-inflammatory effects of a hydrogen sulfidereleasing diclofenac derivative in the rat[J]. Gastroenterology, 2007, 132:261-271. |
| [61] | Rossoni G, Sparatore A, Tazzari V, et al. The hydrogen sulphide-releasing derivative of diclofenac protects against ischaemia-reperfusion injury in the isolated rabbit heart[J]. Br J Pharmacol, 2008, 153:100-109. |
| [62] | Frantzias J, Logan JG, Mollat P, et al. Hydrogen sulphidereleasing diclofenac derivatives inhibit breast cancer-induced osteoclastogenesis in vitro and prevent osteolysis ex vivo[J]. Br J Pharmacol, 2012, 165:1914-1925. |
| [63] | Osborne NN, Ji D, Abdul Majid AS, et al. ACS 67, a hydrogen sulfide-releasing derivative of latanoprost acid, attenuates retinal ischemia and oxidative stress to RGC-5 cells in culture[J]. Invest Ophthalmol Vis Sci, 2010, 51:284-294. |
| [64] | Tang G, Zhang L, Yang G, et al. Hydrogen sulfide-induced inhibition of L-type Ca2+ channels and insulin secretion in mouse pancreatic beta cells[J]. Diabetologia, 2013, 56:533-541. |
| [65] | Wallace JL. Hydrogen sulfide-releasing anti-inflammatory drugs[J]. Trends Pharmacol Sci, 2007, 28:501-505. |
| [66] | Ekundi-Valentim E, Mesquita FP, Santos KT, et al. A comparative study on the anti-inflammatory effects of single oral doses of naproxen and its hydrogen sulfide (H2S)-releasing derivative ATB-346 in rats with carrageenan-induced synovitis[J]. Med Gas Res, 2013, 3:24-32. |
| [67] | Herrera BS, Coimbra LS, da Silva AR, et al. The H2Sreleasing naproxen derivative, ATB-346, inhibits alveolar bone loss and inflammation in rats with ligature-induced periodontitis[J]. Med Gas Res, 2015, 5:4-12. |
| [68] | Campolo M, Esposito E, Ahmad A, et al. Hydrogen sulfidereleasing cyclooxygenase inhibitor ATB-346 enhances motor function and reduces cortical lesion volume following traumatic brain injury in mice[J]. J Neuroinflammation, 2014, 11:196-210. |
| [69] | Elsheikh W, Blackler RW, Flannigan KL, et al. Enhanced chemopreventive effects of a hydrogen sulfide-releasing antiinflammatory drug (ATB-346) in experimental colorectal cancer[J]. Nitric Oxide, 2014, 41:131-137. |
| [70] | Gemici B, Elsheikh W, Feitosa KB, et al. H2S-releasing drugs:anti-inflammatory, cytoprotective and chemopreventative potential[J]. Nitric Oxide, 2015, 46:25-31. |
| [71] | Distrutti E, Sediari L, Mencarelli A, et al. 5-Amino-2-hydroxybenzoic acid 4-(5-thioxo-5H-[1,2] dithiol-3yl)-phenyl ester (ATB-429), a hydrogen sulfide-releasing derivative of mesalamine, exerts antinociceptive effects in a model of postinflammatory hypersensitivity[J]. J Pharmacol Exp Ther, 2006, 319:447-458. |
| [72] | Fiorucci S, Orlandi S, Mencarelli A, et al. Enhanced activity of a hydrogen sulphide-releasing derivative of mesalamine (ATB-429) in a mouse model of colitis[J]. Br J Pharmacol, 2007, 150:996-1002. |
| [73] | Wang XL, Wang LN, Sheng X, et al. Design, synthesis and biological evaluation of hydrogen sulfide releasing derivatives of 3-n-butylphthalide as potential antiplatelet and antithrombotic agents[J]. Org Biomol Chem, 2014, 12:5995-6004. |
| [74] | Lee M, Tazzari V, Giustarini D, et al. Effects of hydrogen sulfide-releasing L-DOPA derivatives on glial activation:potential for treating Parkinson disease[J]. J Biol Chem, 2010, 285:17318-17328. |
| [75] | Chunyu Z, Junbao D, Dingfang B, et al. The regulatory effect of hydrogen sulfide on hypoxic pulmonary hypertension in rats[J]. Biochem Biophys Res Commun, 2003, 302:810-816. |
| [76] | Hu LF, Lu M, Tiong CX, et al. Neuroprotective effects of hydrogen sulfide on Parkinson's disease rat models[J]. Aging Cell, 2010, 9:135-146. |
| [77] | Wang MJ, Cai WJ, Li N, et al. The hydrogen sulfide donor NaHS promotes angiogenesis in a rat model of hind limb ischemia[J]. Antioxid Redox Signa, 2010, 12:1065-1077. |
| [78] | Kodela R, Chattopadhyay M, Kashfi K. NOSH-aspirin:a novel nitric oxide-hydrogen sulfide-releasing hybrid:a new class of anti-inflammatory pharmaceuticals[J]. ACS Med Chem Lett, 2012, 3:257-262. |
| [79] | Chattopadhyay M, Kodela R, Olson KR, et al. NOSH-aspirin (NBS-1120), a novel nitric oxide-and hydrogen sulfidereleasing hybrid is a potent inhibitor of colon cancer cell growth in vitro and in a xenograft mouse model[J]. Biochem Biophys Res Commun, 2012, 419:523-528. |
| [80] | Lee M, McGeer E, Kodela R, et al. NOSH-aspirin (NBS-1120), a novel nitric oxide and hydrogen sulfide releasing hybrid, attenuates neuroinflammation induced by microglial and astrocytic activation:a new candidate for treatment of neurodegenerative disorders[J]. Glia, 2013, 61:1724-1734. |
| [81] | Drochioiu G, Tudorachi L, Murariu M. NOSH aspirin may have a protective role in Alzheimer's disease[J]. Med Hypotheses, 2015, 84:262-267. |
| [82] | Talisman IJ, Marzabadi CH. Carbohydrate-based drugs in the treatment of epilepsy, depression and other affective disorders[J]. Curr Top Med Chem, 2008, 8:159-170. |
| [83] | Fernández-Tejada A, Cañada FJ, Jiménez-Barbero J. Recent developments in synthetic carbohydrate-based diagnostics, vaccines, and therapeutics[J]. Chemistry, 2015, 21:10616-10628. |
 2016, Vol. 51
2016, Vol. 51



