烟酰胺腺嘌呤二核苷酸磷酸氧化酶 (NOX) 是在体内组织和器官中广泛分布的一种膜蛋白,因其能通过NADPH依赖的单电子还原将体内氧分子还原成超氧负离子,是体内活性氧簇 (reactive oxygen species,ROS) 的主要来源,也是体内唯一直接产生ROS的酶[1]。活性氧簇,如超氧化物、过氧化氢和羟基自由基等在体内具有免疫防御作用,也可作为第二信使,参与细胞信号通路的调节,维持细胞内环境的稳定[2]。在人类细胞中,NOX家族蛋白含有7种 亚型,其中NOX1~5为6次跨膜蛋白,DUOX1与DUOX2为7次跨膜蛋白。此外,NOX的激活还需要其他的一些亚基和调控蛋白[3]。
研究表明,NADPH氧化酶催化产生的ROS在细胞内氧化应激反应中扮演着重要角色,并在加速纤维化[4]、炎症和肿瘤形成[5]等病理过程中起着重要作用。NOX依赖的ROS与诸如心血管疾病、神经退行性疾病、糖尿病及其并发症、癌症等多种疾病相关[6]。因此,NOX被认为是治疗这些病理紊乱与疾病的一个潜在的药物靶点。多种结构类型的NOX抑制剂也随之出现。本文将对NOX参与的病理过程及其抑制剂的研究进展作一综述。
1 NOX的结构、活化及体内分布NOX2 (通常也称作gp91phox) 是首个发现的NOX家族蛋白[7]。NOX2拥有6次跨膜的结构域,C-末端和N-末端都伸向细胞质中,C-末端含有高度保守的NADPH和FAD的结合区域,该区域对于将NADPH中的电子转移到氧分子形成超氧化物起着决定性作用。NOX1是第一个被发现的NOX2的同源蛋白,与NOX2有60% 的氨基酸序列保持一致,同样在C-末端拥有高度保守的NADPH和FAD的结合区域[8]。其他的NOX家族蛋白也都是基于NOX2的蛋白序 列而发现的NOX2的同源物,包括: NOX3~5以及DUOX1与DUOX2。不同的NOX蛋白亚型在结构特征、活化机制 (图 1) 以及体内分布 (表 1)[9, 10, 11] 都存在一定的差异。
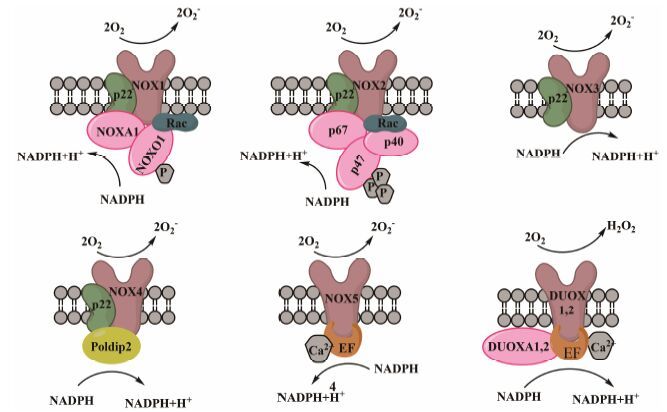
|
图 1 NOX 家族蛋白的组装与活化示意图 |
|
|
表 1 NOX家族蛋白在体内的分布 |
NOX蛋白本身几乎没有催化活性,它们需要与多种调节亚基结合,形成稳定的复合物,才能发挥催化作用[12]。首先,NOX蛋白的稳定需要辅因子,第一个发现的辅因子是p22phox,p22phox是一个两次跨膜的蛋白,它与gp91phox结合形成一个在558 nm处有强吸收的复合物,故将此复合物称作cytb558。p22phox没有催化活性,但是对于NOX蛋白复合物的稳定起着重要作用。p22phox是NOX1~4必需的一个辅助因子。除了p22phox外,NOX1~3的激活还需要多个调节亚基。NOX2中,在未激活的情况下,3个多畴调节亚基
p40phox、p47phox和p67phox以一个复合物的形式存在于细胞质中[12]; 在受激活的情况下,p47phox磷酸化,整个复合物转移至细胞膜与膜上的cytb558结合,形成一个酶复合物。同样地,NOX1的激活需要NOXO1与NOXA1形成的复合物,NOXO1是p47phox的一个同源物,NOXA1是p67phox的同源物。此外,NOX1~3催化活性的发挥对诸如Rac1与Rac2等小分子GTP酶表现出不同程度的依赖性[13]。活化了的NOX通过黄素、血红素等辅基将电子从基质转移至氧分子,形成超氧化物。NOX4的活化不需要上述调节亚基,其活化机制尚不明确。但有研究表明,NOX4的活化需要聚合酶Poldip2[14]。
NOX5是结构最特异的一个亚型,尽管它与其他NOX家族蛋白一样,有一个6次跨膜的结构和高度保守的C-末端,但它的N-末端比其他NOX蛋白的大并拥有4个与Ca2+结合的EF-手结构域。EF-手结构是Kretsinger在用X射线晶体衍射分析Ca2+结合蛋白的三维结构时提出的蛋白结构模型[15],该结构域与细胞内Ca2+的结合对NOX5的活性调节起着决定性的作用。虽然NOX5可以与p22phox结合,但是它的活性不会因为p22phox的缺失而减弱[16],说明NOX5的活化不需要p22phox。
DUOX1与DUOX2在结构上有很大的独特之处。DUOXs与其他NOX蛋白相比,有一个额外的 跨膜区域,这使得它的C-末端与N-末端分处细胞膜内外两侧。此外,DUOXs拥有一个细胞外的N-末端的过氧化物酶样结构域。然而,人类DUOXs是否能够发挥过氧化物酶活性尚未被确定。与NOX5一样,DUOXs的N-末端也有与细胞内Ca2+结合的EF-手结构域,DUOXs有两个EF-手结构域,同样对其活性 的调节起着决定性作用[17]。与NOX1~4不一样的是,DUOXs不需要p22phox,但DUOX1与DUOX2的稳定及活化分别需要DUOXA1与DUOXA2[18]。
2 NOX的生理学功能NOX几乎存在于所有的哺乳动物细胞中,其功能是催化氧分子的还原,形成超氧化物或过氧化物等活性氧簇。NOX催化产生的ROS在许多生理学 过程中都起着重要作用,最主要的是免疫防御作用。NOX催化产生的ROS在由病原微生物介导的呼吸爆发中扮演着关键角色。呼吸爆发是指再灌注组织重新获得氧供应的短时间内,激活的中性粒细胞耗氧量显著增加,产生大量氧自由基,又称为氧爆发,这是再灌注时自由基生成的重要途径之一[19]。该过程中,中性粒细胞与巨噬细胞产生大量ROS,杀伤吞噬进入细胞的病原体。NOX功能的缺失能导致中性粒细胞与巨噬细胞功能紊乱,引发慢性肉芽肿病 (CGD),CGD为一种免疫缺陷症,表现为无法根除细菌感染[20]。除了免疫作用外,NOX催化产生的ROS也参与到细胞增殖、凋亡、血管生成、内分泌和细胞外基质的氧化修饰以及信号通路的调节等生理过程[21, 22]。
3 NOX参与的病理过程 3.1 NOX与氧化应激氧化应激是指机体受有害刺激时ROS产生增多或清除减少,导致ROS在体内蓄积而引起分子、细胞和机体的损伤。正常生理条件下,机体的抗氧化系统和氧化能力之间保持着相对的动态平衡,机体产生的ROS能迅速地被体内抗氧化系统清除[23],但在某些病理情况如高血糖状态下,包括NADPH氧化酶、醛糖还原酶以及蛋白激酶C被激活,刺激体内的ROS过度产生,并导致机体抗氧化能力下降,当氧化能力大大超过抗氧化能力时引发氧化应激[24]。氧化应激参与了包括血管疾病、肾脏疾病、癌症与老化等多种疾病的病理过程[25]。
细胞内产生ROS的酶有多种,如黄嘌呤氧化酶、细胞色素P450、环加氧酶、脂氧合酶、一氧化氮合成酶和NADPH氧化酶等。其中,除了NADPH氧化酶将催化产生ROS作为唯一功能外,其他的酶产生的ROS都是作为催化过程中的副产物出现的。NADPH氧化酶催化产生的ROS是吞噬细胞呼吸爆发以及非吞噬细胞氧化应激过程中ROS的主要来源[1]。
3.2 NOX与炎症反应炎症是机体针对外源病原体或异物的免疫防御性反应。在外源病原体或异物入侵的先天性免疫反应中,机体会发生急性炎症反应,伴随着血管舒张、血管渗透性增加和白细胞迁移。这个过程虽然有利于病原体或异物的清除,但是如果不加以控制,可以导致机体的损伤和疾病的发生[26]。
NOX催化产生ROS在炎症过程中起到重要作用。在炎症部位,中性粒细胞中的ROS产生增多,引起血管内皮功能障碍和组织损伤。血管内皮是大分子和炎性细胞从血液转移至组织的通道。在炎症条件下,中性粒细胞产生的ROS导致血管内皮间隙开放,促进炎症细胞穿越内皮间隙转移至组织。转移的炎症细胞在清除病原体或异物的同时,也对组织产生损伤[27]。
3.3 NOX与纤维化纤维化是许多慢性炎症性疾病共同的、最终的病理特征,主要由大量的细胞外基质在炎症组织和受损组织周围沉积而引起[28]。细胞外基质由纤维组织母细胞和肌纤维母细胞合成,这两种细胞主要由生长转化因子 (TGF-β) 进行调控,TGF-β是纤维化发生过程中起主要调节作用的一类细胞因子。
近年来,大量的研究表明,NOX依赖的氧化还原信号在TGF-β调节的纤维化过程有着重要影响,尤其是NOX4在这个过程中扮演着关键的角色[29, 30, 31]。一方面,NOX4可以作为TGF-β调节纤维化过程的下游信号直接影响纤维化过程,主要表现在TGF-β可以增加纤维化组织中NOX4基因的表达,而NOX4催化产生的ROS则可以促进纤维化反应[32]。另一方面,NOX依赖的氧化还原信号也能够以一种反馈的形式调节TGF-β/Smad信号通路,从而间接促进纤维化过程[4]。
3.4 NOX与肿瘤肿瘤由基因突变引起,并在特殊的环境中生长发展。NOX催化产生的ROS对肿瘤形成和肿瘤微环境中信号的传导起着重要作用[33]。一方面,NOX催化产生的ROS可以导致DNA损伤和基因组的不稳定,引起肿瘤的发生。另一方面,肿瘤细胞中NOX被过度激活,肿瘤细胞产生大量的ROS,调节肿瘤环境中的信号转导,有利于肿瘤的生长发展[34]。研究表明,用NOX抑制剂抑制NADPH氧化酶的活性,可以抑制体内肿瘤的生长,因此,NOX可能成为未来肿瘤防治的一个新靶点[35]。
4 NOX抑制剂 4.1 早期NOX抑制剂早期发现的NOX抑制剂 (图 2) 大部分都是非特异性、非选择性的NOX抑制剂[36]。这些抑制剂能够产生脱靶效应,在作用于NOX的同时,也能作用于其他的一些酶。其中二亚苯基碘 (DPI,1) 与荚竹兰乙酮 (2) 在实验中一直沿用至今。DPI是一个广泛的黄素蛋白抑制剂,能够抑制一氧化氮合酶、黄嘌呤氧化酶以及线粒体电子传递链上的其他蛋白[37]。荚竹兰乙酮已被证明是一个ROS清除剂,而并非直接作用于NOX[38],此外它还能作用于Rho激酶[39]。用这些抑制剂对NOX研究所得出的结论是不可靠的,因此,NOX的研究需要新型的具有特异性和选择性的抑制剂。
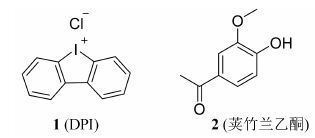
|
图 2 早期NOX抑制剂 |
随着NOX在氧化应激、炎症、纤维化与肿瘤形成等病理过程中作用研究的深入,NOX已经成为治疗糖尿病肾病、特发性肺纤维化、癌症等相关疾病的热门靶点。多种新的结构类型的NOX抑制剂随之出现,但是由于研究时间尚短,除了GKT137831已经完成了以糖尿病肾病为适应证的Ⅱ期临床试验外,其他的一些NOX抑制剂都停留在初步研究阶段。
4.2.1 吡唑并吡啶二酮衍生物GenKyoTex公司通过对136 000个化合物的高通量筛选发现了吡唑并吡啶二酮类化合物(图 3) 具有选择性的NOX抑制活性[40]。其中化合物3在体外的无细胞系统中对NOX4抑制 的Ki值为373 nmol·L-1,是对NOX2抑制活性 (Ki = 4 720 nmol·L-1) 的12倍。但是,在体内药代动力学研究中发现化合物3有严重的首关效应,口服生物利用度低[41]。
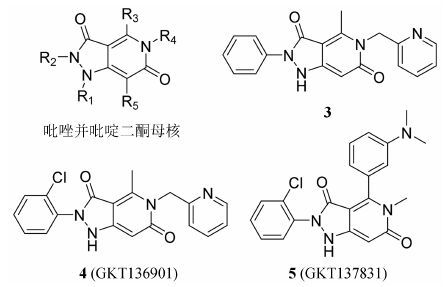
|
图 3 吡唑并吡啶二酮衍生物 |
通过对化合物3的改造,发现了GKT16901 (4) 与GKT137831 (5)。其中,GKT137831对NOX1与NOX4抑制的Ki值分别为110与140 nmol·L-1 [42]。该化合物具有良好的药代动力学性质与安全性,已于2015年5月完成了以糖尿病肾病为适应证的Ⅱ期临床试验,目前结果尚未公布。吡唑并吡啶二酮类化合物作为一类选择性的NOX1与NOX4抑制剂,有望开发成一类新型的糖尿病肾病与特发性纤维化的治疗药物。
4.2.2 三唑并嘧啶衍生物三唑并嘧啶衍生物 (图 4) 是Vasopharm公司发现的一类NOX抑制剂。在他们报道的11个化合物中,VAS2870 (6) 和VAS3947 (7) 最有前景,对NOX2高表达的人早幼粒白血病细胞株 (HL-60细胞) 抑制活性IC50值小于2 µmol·L-1 [43, 44]。但是,并没有关于VAS2870与VAS3947对其他NOX家族蛋白作用的详细报道。
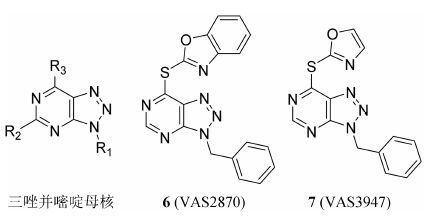
|
图 4 三唑并嘧啶衍生物 |
由于VAS2870与VAS3947溶解性与药代动力学性质较差,使得其在体内实验中的研究受到了限制。另外,Sun等[45]发现VAS2870能够通过亲核反应使得半胱氨酸上的硫醇烷基化,在体外对兰尼碱受体钙通道 (RYR1) 和谷胱甘肽 (GSH) 产生影响。此类NOX抑制剂的研究需改善其成药性,还需对S原子进行改造以减少脱靶效应,另外,其选择性还需更多的实验与数据支撑。
4.2.3 吡唑并嘧啶衍生物Shionogi公司报道了一类以吡唑并嘧啶为母核的化合物可作为NOX抑制剂。大部分化合物都是在R1和R5进行取代基的变动,这些化合物对牛主动脉瓣膜上NADPH氧化酶的抑制活性的IC50值小于1 µmol·L-1,Shionogi公司称这类化合物可以抑制中性粒细胞以及血管组织中的NOX2[46]。
然而,Gatto等[47]在对此类化合物的作用机制的研究中发现,此类化合物在无细胞系统中对半重组NOX2并无任何抑制作用,对βⅡ型蛋白激酶C (PKCβⅡ) 有较强活性,其中化合物8与化合物9 (图 5) 的IC50值分别为4.6与9.4 nmol·L-1。考虑到PKCβⅡ在中性粒细胞中对于NOX2的激活极为重要,故推测这类化合物可能是通过抑制PKCβⅡ的活性而间接抑制NOX2的激活。

|
图 5 吡唑并嘧啶衍生物 |
吩噻嗪类化合物 (图 6) 是通过以人结肠癌细胞系HT29细胞为基础的高通量筛选发现的一类NOX抑制剂。Gianni等[48]通过实验证明,这类化合物的代表ML171 (10) 对NOX1的抑制活性IC50值为130~250 nmol·L-1,比对NOX2、3、4以及黄嘌呤氧化酶的抑制能力要高出20倍。此外,ML171对线粒体ROS的形成并没有抑制作用,它能够通过减少ROS依赖的ECM的降解,从而特异性的阻断结肠癌细胞侵袭伪足功能的形成,妨碍结肠癌细胞的转移。
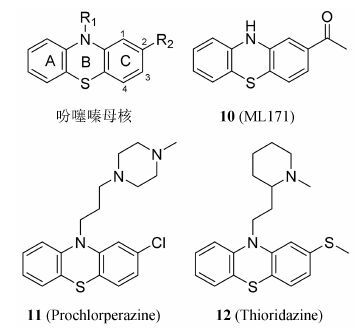
|
图 6 吩噻嗪衍生物 |
Seredenina等[49]发现,在吩噻嗪母核的N原子上用脂肪胺链取代时 (如化合物11),该类化合物则对NOX2、4、5抑制活性增强,对NOX1和NOX3抑制活性减弱; 当C环的2位用甲硫基取代时 (如化合物12),则对NOX1与NOX3抑制活性较强。另外,他们还发现化合物12能够减少人成纤维细胞分化成肌纤维母细胞。吩噻嗪类化合物已作为抗精神病药物使用,说明这类化合物有较好的成药性,但是因其能作用于多巴胺和5-羟色胺等信号分子,脱靶效应的产生将会是这类化合物的主要问题。
4.2.5 天然产物雷公藤红素 (13) 是从卫矛科植物雷公藤中分离得到的一个活性天然结构 (图 7)。在细胞实验中,它对NOX1 (IC50 0.41 µmol·L-1) 和NOX2 (IC50 0.59 µmol·L-1) 抑制活性比NOX4 (IC50 2.97 µmol·L-1) 和NOX5 (IC50 3.13 µmol·L-1) 高。在无细胞系统中,它对NOX2 (IC50 1.24 µmol·L-1) 和NOX5 (IC50 8.4 µmol·L-1) 也表现出一定选择性。机制研究表明,雷公藤红素可以结合到p47phox上,从而干扰p47phox与p22phox的结合。然而,NOX4与NOX5的激活并不依赖p47phox,所以雷公藤红素对NOX家族蛋白的抑制可能还有其他更复杂的机制[50]。

|
图 7 天然产物 |
红杉醇 (14) 是从红豆杉等植物中提取的一种天然产物,对糖尿病的治疗有一定的效果[51]。Chen等[52]在研究红杉醇治疗糖尿病的机制时发现红杉醇能够下调2型糖尿病大鼠肝脏中p22phox和p47phox的表达。Li等[53]通过进一步的研究发现红杉醇能够抑制2型糖尿病大鼠主动脉NOX4的表达。因其能影响NOX1~4所必需的稳定亚基p22phox的表达,故红杉醇有可能成为NOX1~4抑制剂。
中药历史悠久,很多中草药能够干扰体内的氧化还原平衡,对抗氧化应激[54]。其中有些中草药可能是作为ROS清除剂起作用的,其他的可能是通过干扰诸如NADPH氧化酶等产生ROS的酶而起作用的,因此,从这些中草药分离得到天然结构化合物是发现新型NOX抑制剂比较有希望的一个途径。
4.2.6多肽类NOX抑制剂NOX2ds-tat最初称作gp91ds-tat,是含有18个氨基酸的多肽,其中9个氨基酸的序列模拟了NOX2上一个B-loop区域的氨基酸序列。可以特异性的妨碍B-loop区域与p47phox结合,选择性的影响NOX2的激活[55]。NOX2ds-tat的另外9个氨基酸序列与HIV-tat运输区域的氨基酸序列一致,该序列可以促进NOX2ds-tat内化进入细胞内。NOX2ds-tat在浓度为100 µmol·L-1时对无细胞系统中超氧化物生成的抑制率为80%,然而对完整的嗜中性粒细胞中超氧化物的抑制率却只有35%[56]。
NOXA1ds是以与NOX2ds-tat同样的药物设计 思路设计的NOX1抑制剂。它的11个氨基酸序列与NOXA1上和NOX1结合区域的氨基酸序列相同,可以特异性地结合到NOX1上,抑制NOX1的激活。生物学研究发现NOXA1ds能够选择性的抑制NOX1,而对NOX2、NOX4和NOX5没有作用[57]。多肽类抑制剂可以特异性的针对某一类NOX蛋白设计,具有较好的选择性,但是由于其低效和不能口服给药等特点,目前多肽类抑制剂仅用于实验中对NADPH氧化酶的研究。
以上几类具有代表性的NOX抑制剂的特点总结见表 2。
|
|
表 2 各类抑制剂中代表化合物对NOX亚型的选择性及作用位点。a: 在无细胞系统中测得; b: 数据为Ki值; c: 在过表达的细胞中测得; N: 在10 µmol·L-1时无明显抑制活性 |
NOX在加速氧化应激、炎症、纤维化以及肿瘤等病理过程中的作用已经逐步明确,NOX抑制剂成为了治疗与之相关的疾病的一种新的策略。目前,GKT137831已经完成了以糖尿病肾病为适应证的Ⅱ期临床试验。然而其他的一些NOX抑制剂都停留在初步研究阶段,尚缺乏能特异性作用于NOX蛋白、选择性作用于不同NOX亚型、且具有良好成药性的NOX抑制剂。
现有的NOX抑制剂主要以高通量筛选获得,然而高通量筛选虽然可以快速地筛选数以千计的化合物,提供一些潜在的NOX抑制剂,但是却无法保证所筛选的化合物对NOX蛋白的特异性以及对不同NOX亚型的选择性。参考多肽类NOX抑制剂的设计思路,设计能够靶向干扰NOX蛋白与其亚基或调控蛋白相互作用的抑制剂是特异性的、选择性的NOX抑制剂发现的一种新思路。另外,目前NOX抑制剂的研究尚缺乏可靠筛选体系,建立一套完整的可靠的筛选体系对于选择性的NOX抑制剂的发现很有必要。
| [1] | Spencer NY, Engelhardt JF. The basic biology of redoxosomes in cytokine-mediated signal transduction and implications for disease-specific therapies[J]. Biochemistry, 2014, 53:1551-1564. |
| [2] | Mao S, Huang S. The signaling pathway of NADPH oxidase and its role in glomerular diseases[J]. J Recept Signal Transduct Res, 2014, 34:6-11. |
| [3] | Panday A, Sahoo MK, Osorio D, et al. NADPH oxidases:an overview from structure to innate immunity-associated pathologies[J]. Cell Mol Immunol, 2015, 12:5-23. |
| [4] | Jiang F, Liu GS, Dusting GJ, et al. NADPH oxidasedependent redox signaling in TGF-β-mediated fibrotic responses[J]. Redox Biol, 2014, 2:267-272. |
| [5] | Bonner MY, Arbiser JL. Targeting NADPH oxidases for the treatment of cancer and inflammation[J]. Cell Mol Life Sci, 2012, 69:2435-2442. |
| [6] | Bedard K, Krause KH. The NOX family of ROS-generating NADPH oxidases:physiology and pathophysiology[J]. Physiol Rev, 2007, 87:245-313. |
| [7] | Babior BM. NADPH oxidase:an update[J]. Blood, 1999, 93:1464-1476. |
| [8] | Banfi B, Maturana A, Jaconi S, et al. A mammalian H1 channel generated through alternative splicing of the NADPH oxidase homolog NOH-1[J]. Science, 2000, 287:138-142. |
| [9] | Lin CC, Lee IT, Yang YL, et al. Induction of COX-2/PGE(2)/IL-6 is crucial for cigarette smoke extract-induced airway inflammation:role of TLR4-dependent NADPH oxidase activation[J]. Free Radic Biol Med, 2010, 48:240-254. |
| [10] | Banfi B, Malgrange B, Knisz J, et al. NOX3, a superoxidegenerating NADPH oxidase of the inner ear[J]. J Biol Chem, 2004, 279:46065-46072. |
| [11] | Krause KH. Tissue distribution and putative physiological function of NOX family NADPH oxidases[J]. Jpn J Infect Dis, 2004, 57:S28-S29. |
| [12] | Brandes RP, Weissmann N, Schroder K. NOX family NADPH oxidases:molecular mechanisms of activation[J]. Free Radic Biol Med, 2014, 76:208-226. |
| [13] | Touyz RM, Chen X, Tabet F, et al. Expression of a functionally active gp91phox-containing neutrophil-type NAD(P)H oxidase in smooth muscle cells from human resistance arteries:regulation by angiotensin II[J]. Circ Res, 2002, 90:1205-1213. |
| [14] | Lyle AN, Deshpande NN, Taniyama Y, et al. Poldip2, a novel regulator of Nox4 and cytoskeletal integrity in vascular smooth muscle cells[J]. Circ Res, 2009:105:249-259. |
| [15] | Nakayama S, Kretsinger RH. Evolution of the EF-hand family of proteins[J]. Annu Rev Biophys Biomol Struct, 1994, 23:473-507. |
| [16] | Kawahara T, Ritsick D, Cheng G, et al. Point mutations in the proline-rich region of p22phox are dominant inhibitors of NOX1 and NOX2 dependent reactive oxygen generation[J]. J Biol Chem, 2005, 280:31859-31869. |
| [17] | Ameziane-El-Hassani R, Morand S, Boucher JL, et al. Dual oxidase-2 has an intrinsic Ca2+-dependent H2O2-generating activity[J]. J Biol Chem, 2005, 280:30046-30054. |
| [18] | Grasberger H, Refetoff S. Identification of the maturation factor for dual oxidase. Evolution of an eukaryotic operon equivalent[J]. J Biol Chem, 2006, 281:18269-18272. |
| [19] | Thelen M, Dewald B, Baggiolini M. Neutrophil signal transduction and activation of the respiratory burst[J]. Physiol Rev, 1993, 73:797-821. |
| [20] | Dinauer MC, Orkin SH. Chronic granulomatous disease[J]. Annu Rev Immunol, 1992, 43:117-124. |
| [21] | Cope AP. Harmful waste products as novel immune modulators for treating inflamatory arthritis[J]. PLoS Med, 2006, 3:1471-1473. |
| [22] | Drummond GR, Selemidis S, Griendling KK, et al. Combating oxidative stress in vascular disease:NADPH oxidases as therapeutic targets[J]. Nat Rev Drug Discov, 2011, 10:453-471. |
| [23] | Poljsak B, Šuput D, Milisav I. Achieving the balance between ROS and antioxidants:when to use the synthetic antioxidants[J]. Oxid Med Cell Longev, 2013, 2013:956792. |
| [24] | Piwkowska A, Rogacka D, Audzeyenka I, et al. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes[J]. J Cell Biochem, 2011, 112:1661-1672. |
| [25] | Pisoschi AM, Pop A. The role of antioxidants in the chemistry of oxidative stress:a review[J]. Eur J Med Chem, 2015, 95:55-74. |
| [26] | Clark R, Kupper T. Old meets new:the interaction between innate and adaptive immunity[J]. J Invest Dermatol, 2005, 125:629-637. |
| [27] | Mittal M, Siddiqui MR, Tran K, et al. Reactive oxygen species in inflammation and tissue injury[J]. Antioxid Redox Signal, 2014, 20:1126-1167. |
| [28] | Wynn TA, Ramalingam TR. Mechanisms of fibrosis:therapeutic translation for fibrotic disease[J]. Nat Med, 2012, 18:1028-1040. |
| [29] | Samarakoon R, Overstreet JM, Higgins PJ. TGF-beta signaling in tissue fibrosis:redox controls, target genes and therapeutic opportunities[J]. Cell Signal, 2013, 25:264-268. |
| [30] | Chan EC, Peshavariya HM, Liu GS, et al. NOX4 modulates collagen production stimulated by transforming growth factor beta1in vivo and in vitro[J]. Biochem Biophys Res Commun, 2013, 430:918-925. |
| [31] | Barnes JL, Gorin Y. Myofibroblast differentiation during fibrosis:role of NAD(P)H oxidases[J]. Kidney Int, 2011, 79:944-956. |
| [32] | Cucoranu I, Clempus R, Dikalova A, et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts intomyofibroblasts[J]. Circ Res, 2009, 97:900-907. |
| [33] | Roy K, Wu Y, Meitzler JL, et al. NADPH oxidases and cancer[J]. Clin Sci, 2015, 128:863-875. |
| [34] | Meitzler JL, Antony S, Wu Y, et al. NADPH oxidases:a perspective on reactive oxygen species production in tumor biology[J]. Antioxid Redox Signal, 2014, 20:2873-2889. |
| [35] | Weyemi U, Redon CE, Parekh PR, et al. NADPH oxidases NOXs and DUOXs as putative targets for cancer therapy[J]. Anticancer Agents Med Chem, 2013, 13:502-514. |
| [36] | Aldieri E, Riganti C, Polimeni M, et al. Classical inhibitors of NOX NAD(P)H oxidases are not specific[J]. Curr Drug Metab, 2008, 9:686-696. |
| [37] | O'Donnell VB, Smith GC, Jones OT. Involvement of phenyl radicals in iodonium inhibition of flavoenzymes[J]. Mol Pharmacol, 1994, 46:778-785. |
| [38] | Heumüller S, Wind S, Barbosa-Sicard E, et al. Apocynin is not an inhibitor of vascular NADPH oxidases but an antioxidant[J]. Hypertension, 2008, 51:211-217. |
| [39] | Schlüter T, Steinbach AC, Steffen A, et al. Apocynin-induced vasodilation involves Rho kinase inhibition but not NADPH oxidase inhibition[J]. Cardiovasc Res, 2008, 80:271-279. |
| [40] | GenKyoTex SA. Preparation of pyrazolopyridine derivatives as NADPH oxidaes inhibitors:WO, 0352291[P]. 2010-4-1. |
| [41] | Laleu B, Gaggini F, Orchard M, et al. First in class, potent, and orally bioavailable NADPH oxidase isoform 4(NOX4) inhibitors for the treatment of idiopathic pulmonary fibrosis[J]. J Med Chem, 2010, 53:7715-7730. |
| [42] | Aoyama T, Paik YH, Watanabe S, et al. Nicotinamide adenine dinucleotide phosphate oxidase in experimental liver fibrosis:GKT137831 as a novel potential therapeutic agent[J]. Hepatology, 2012, 56:2316-2327. |
| [43] | Vasopharm Biotech Gmb H. Preparation of compounds containing a N-heteroaryl moiety linked to fused ring moieties for the inhibition of NAD(P)H oxidases and platelet activation:WO, 111041[P]. 2005-11-24. |
| [44] | Wind S, Beuerlein K, Eucker T, et al. Comparative pharmacology of chemically distinct NADPH oxidase inhibitors[J]. Br J Pharmacol, 2010, 161:885-898. |
| [45] | Sun QA, Hess DT, Wang B, et al. Off-target thiol alkylation by the NADPH oxidase inhibitor 3-benzyl-7-(2-benzoxazolyl) thio-1,2,3-triazolo[4,5-d]pyrimidine (VAS2870)[J]. Free Radic Biol Med, 2012, 52:1897-1902. |
| [46] | Shionogi. Preparation of pyrazolo[1,5-a]pyrimidine derivatives as NAD(P)H oxidase inhibitors:WO, 091256[P]. 2003-11-6. |
| [47] | Gatto GJ Jr, Ao Z, Kearse MG, et al. NADPH oxidasedependent and-independent mechanisms of reported inhibitors of reactive oxygen generation[J]. J Enzyme Inhib Med Chem, 2013, 28:95-104. |
| [48] | Gianni D, Taulet N, Zhang H, et al. A novel and specific NADPH oxidase-1(NOX1) small-molecule inhibitor blocks the formation of functional invadopodia in human colon cancer cells[J]. ACS Chem Biol, 2010, 5:981-993. |
| [49] | Seredenina T, Chiriano G, Filippova A, et al. A subset of N-substituted phenothiazines inhibits NADPH oxidases[J]. Free Radic Biol Med, 2015, 86:239-249. |
| [50] | Jaquet V, Marcoux J, Forest E, et al. NADPH oxidase (NOX) isoforms are inhibited by celastrol with a dual mode of action[J]. Br J Pharmacol, 2011, 164, 507-520. |
| [51] | Shen H, Shao M, Cho KW, et al. Herbal constituent sequoyitol improves hyperglycemia and glucose intolerance by targeting hepatocytes, adipocytes, and β-cells[J]. Am J Physiol Endocrinol Metab, 2012, 302:E932-E940. |
| [52] | Chen XP, Yang JR, Li XW, et al. Effects of sequoyitol on expression of NADPH oxidase subunits p22 phox and p47 phox in rats with type 2 diabetic liver disease[J]. Acta Pharm Sin (药学学报), 2013, 48:489-494. |
| [53] | Li XW, Hao W, Liu Y, et al. Effect of sequoyitol on expression of NOX4 and eNOS in aortas of type 2 diabetic rats[J]. Acta Pharm Sin (药学学报), 2014, 49:329-336. |
| [54] | Matkowski A, Jamiolkowska-Kozlowska W, Nawrot I. Chinese medicinal herbs as source of antioxidant compounds-where tradition meets the future[J]. Curr Med Chem, 2013, 20:984-1004. |
| [55] | Rey FE, Cifuentes ME, Kiarash A, et al. Novel competitive inhibitor of NAD(P)H oxidase assembly attenuates vascular O2- and systolic blood pressure in mice[J]. Circ Res, 2001, 89:408-414. |
| [56] | Csányi G1, Cifuentes-Pagano E, Al Ghouleh I, et al. NOX2 B-loop peptide, NOX2ds, specifically inhibits the NADPH oxidase NOX2[J]. Free Radic Biol Med, 2011, 51:1116-1125. |
| [57] | Ranayhossaini DJ, Rodriguez AI, Sahoo S, et al. Selective recapitulation of conserved and nonconserved regions of putative NOXA1 activation domain confers isoform specific inhibition of NOX1 oxidase, attenuation of endothelial cell NOX and migration[J]. J Biol Chem, 2013, 288:36437-36450. |
 2016, Vol. 51
2016, Vol. 51


