太子参为大宗常用中药材,系石竹科假繁缕属植物孩儿参Pseudostellaria heterophylla (Miq.) Pax ex Pax et Hoffm.的干燥块根[1],具益气健脾、润肺生津之传统功效及保护心肌功能、促进免疫、抗应激、治疗糖尿病、止咳等药理作用,临床上用于脾虚体倦、食欲不振、病后虚弱、气阴不足、自汗口渴、肺燥干咳等症,是治疗小儿脾虚而食欲不佳之要药,疗效确切,临床用量大[2, 3, 4, 5, 6]。由于太子参野生资源日渐减少,而原药材市场需求量又逐年增加,除江苏句容传统产区栽培外,全国现已在福建柘荣、贵州施秉、安徽宣城等地建立了大规模种植基地。目前,太子参药材品质形成研究主要集中在指标成分含量测定、指纹图谱评价、栽培技术等方面[7, 8, 9, 10, 11, 12]。为了保持太子参品质的优良性,在太子参的品质形成机制研究中有必要系统开展太子参的蛋白质组学研究,以揭示不同生态型太子参次生代谢物差异的成因及其药材品质形成的蛋白质机制。
同位素标记相对定量和绝对定量 (isobaric tags for relative and absolute quantification,iTRAQ) 技术是通过利用同位素标签标记伯氨基结合质谱分析的方法,同时可以对4种或8种不同样品中的蛋白质进行绝对或相对含量的比较,寻找差异表达蛋白,并分析其蛋白功能。iTRAQ技术作为一种新的蛋白质组学定量研究技术,具有良好的定量效果及较高的重复性,近年来已广泛应用于医学、药物学、植物学、食品科学及微生物学等生命科学的诸多领域[13, 14, 15, 16, 17],但在中药学特别是中药资源与鉴定研究中尚少见应用报道。
本实验在完成太子参RNA-Seq转录组测序的基础上,采用iTRAQ技术对野生型与栽培型太子参进行定量蛋白质组学研究,分析两种生态型太子参蛋白质组表达水平的差异,并对差异蛋白质进行GO (gene ontology) 功能注释和分类、KEGG代谢通路分析、STRING网络通路分析,以获得与太子参两种生态型生物学特征相关的蛋白谱信息,找出野生型与栽培型太子参蛋白质组表达水平的差异,并分析与不同生态型太子参间差异化学成分相关的关键蛋白。从而为解析不同生态型太子参次生代谢物差异的成因及其药材品质形成的蛋白质机制提供基础资料。
材料与方法材料 Dionex Ultimate 3000型高效液相色谱仪 (美国Thermo公司); 色谱柱为Gemini-Nx C18 (2 mm × 150 mm,3 μm) 和Acclaim PepMap RSLC C18 (75 μm × 150 mm,2 μm) (美国Phenomenex公司); Q Exactive质谱仪 (美国Thermo公司); H2050R冷冻离心机 (上海沪粤名科技有限公司); JY96-ⅡN超声仪 (宁波新芝生物科技股份有限公司); Concentrator Plus 真空离心浓缩机 (德国Eppendorf公司); 765Pc分光光度计 (上海光谱仪器有限公司); NanoDrop ND-2000 (美国Thermo公司); BioRad CFX96实时荧光定量PCR仪 (美国BIO-RAD公司)。
iTRAQ Reagents-8plex Kit (美国ABI公司); BCA 定量试剂盒 (上海生工生物工程股份有限公司); SYBR Premix Ex Tag II染料荧光定量试剂盒 (日本TaKaRa公司); 二硫苏糖醇 (美国Bio-Rad公司),胰酶 (北京生物技术有限公司); 尿素、碘乙酰胺、三乙基碳酸氢氨甲酸铵、氢氧化钠 (美国Sigma公司)。甲醇、丙酮、乙腈、甲酸 (美国Thermo公司)。
野生型太子参样品于2013年7月实地采集于江苏句容天王镇袁巷集镇瓦屋山 (北纬119°16′49″,东经31°38′47″) (S1),栽培型太子参样品于2013年7月下旬分别采集于福建柘荣 (北纬119°54′2″,东经27°13′48″) (S2)、安徽宣州 (北纬118°45′,东经30°56′59″) (S3)、江苏句容 (北纬119°16′25″,东经31°41′15″) (S4)、贵州施秉 (北纬108°7′12″,东经27°1′48″) (S5) 种植基地,每产地多点随机混合采样,各采30个植株,取其块根流水洗净后,用吸水纸吸干表面水分,于液氮中速冻后迅速置-80 ℃超低温冰箱备用。经南京中医药大学药学院刘训红教授鉴定为石竹科太子参Pseudostellaria heterophylla (Miq.) Pax ex Pax et Hoffm.的块根。留样保存于南京中医药大学中药鉴定实验室。
蛋白提取 采用改良的苯酚提取法[18]提取太子参蛋白,从-80 ℃冰箱取5 g太子参根 (破碎后) 放入液氮预冷的研钵中,加液氮研磨成粉。加入0.1 mg PVPP,倒入离心管中,在离心管中加入10 mL Tris饱和酚和10 mL蛋白抽提液,摇匀后6 000 r·min-1于 4 ℃离心20 min,吸取上层酚相。加入等体积的蛋白抽提液和5倍体积的醋酸铵甲醇沉淀液,摇匀后 -20 ℃沉淀过夜。离心后去上清,沉淀物加入甲醇和丙酮,12 000 r·min-1于4 ℃离心20 min,去上清液,将沉淀物表面残余的丙酮稍微晾干,加入RIPA裂解液离心后收集沉淀。
蛋白定量 取7只EP管分别标记,精密量取BSA标准溶液 (1 mg·mL-1) 1、2、4、6、8、10 µL加入上述对应EP管中,测试样品取1 µL,各管加入对应体积去离子水使蛋白溶液样品体积为100 µL,各管加入100 μL BCA反应液,涡旋振荡20 s混匀 后离心,60 ℃反应1 h,575 nm处测定吸光值,制备 标准曲线计算样品浓度。根据此方法,制备得到标准曲线: Y = 72X - 2.325,R2 = 0.997。S1质量浓度为3.05 mg·mL-1,S2、S3、S4、S5的质量浓度分别为3.15、3.17、3.22、4.31 mg·mL-1。
FASP酶解 取200 µg蛋白溶液置于离心管中,加入4 µL还原剂,60 ℃反应1 h后加入2 µL半胱氨酸封闭剂,室温10 min。将还原烷基化后的蛋白溶液转入10 kD超滤离心管中,12 000 r·min-1离心20 min,弃去管底溶液,加入1 mol·L-1 TEAB 100 µL,12 000 r·min-1离心20 min,弃去管底溶液,重复3次。按质量比1∶50加入胰蛋白酶及1 mol·L-1 TEAB,使最终体积为50 µL,过夜酶解。次日,离心收集酶解消化后的肽段溶液,并干燥保存。
iTRAQ标记 将5个酶解后的肽段样品各取100 µg,分别用116标记S2,117标记S1,118标记S3,119标记S4,121标记S5 (具体操作按照试剂盒说明书进行) 后,等量混合。
第一维高pH-RP液相分离 用第一维高pH-RP液相A相重溶,混匀上样,从线性梯度开始收集组 分,收集到24个EP管中,每分钟接1次,流速为0.2 mL·min-1,梯度为45 min,反复循环接样; 根据峰形和时间共收取24个组分,用50% TFA酸化,真空干燥。高pH-RP液相分级梯度设置如下: 0~5 min,缓冲液A 95%,缓冲液B 5%; 5~15 min,缓冲液A 75%,缓冲液B 25%; 15~60 min,缓冲液A 50%,缓冲液B 50%; 60~80 min,缓冲液A 10%,缓冲液B 90%; 80~90 min,缓冲液A 95%,缓冲液B 5%。缓冲液 A为20 mmol·L-1甲酸铵,pH 10; 缓冲液B为20 mmol·L-1甲酸铵,80% 乙腈,pH 10。
第二维纳升级串联液相高效色谱分离与质谱分析 第二维采用纳升流速HPLC液相系统Easy nLC进行分离。肽段用样品溶解液 (0.1% 甲酸、1% 乙腈)溶解,充分振荡涡旋,4 ℃、13 500 ×g离心20 min。上样后经色谱柱分离,流速为0.3 mL·min-1。液相梯度如下: 0~5 min,缓冲液A 96%,缓冲液B 4%; 5~45 min,缓冲液A 50%,缓冲液B 50%; 45~50 min,缓冲液A 10%,缓冲液B 90%; 50~65 min,缓冲液A 96%,缓冲液B 4%。A液为0.1% 甲酸,B液为0.1% 甲酸和80% 乙腈。将分离的肽段直接进入Q Exactive质谱仪进行在线检测。
蛋白鉴定和生物信息学分析 采用Protein Pilot 5.0对肽段的MS/MS的数据在太子参转录组数据库中进行检索。将116、118、119和121 (S2、S3、S4和S5) 混合作为栽培组,117 (S1) 为野生组。按栽培组与野生组的离子的峰面积比值(116∶117、118∶117、119∶117、121∶117),选择置信度在95% 以上的结果进行报告。为了提高蛋白的可信度,将每个蛋白比率 ≥20或小于等于0.05的除去[19]。对其进行t检验,P ≤ 0.05且蛋白质平均比率 ≥ 1.5或 ≤0.667分别为上调和下调的差异蛋白。选择欧洲生物信息研究所 (European Bioinformatics Institute,EMBL-EBI) 维护的QuickGO (http://www.ebi.ac.uk/QuickGO/) 注释工具对差异蛋白进行基因功能聚类GO分析,采用KEGG通路数据库对差异蛋白涉及的代谢通路进行分析,STRING对差异蛋白进行网络通路分析。
荧光定量PCR (qPCR)验证 为了验证iTRAQ结果,选择部分差异蛋白质进行mRNA表达水平的验证。根据NCBI中核苷酸序列设计引物,以肌动蛋白作为内参基因,按照Trizol试剂盒操作手册提取总RNA,并反转录为cDNA后进行qPCR检测。反应条件为95 ℃ 5 min; 95 ℃ 30 s、60 ℃ 1 min,40个循环。实验重复3次,采用2-ΔΔCT法进行相对表达量计算。
结 果 1 质谱鉴定结果质谱数据经过Protein Pilot 5.0软件对太子参转录组数据库进行检索,报告置信度在95% 以上的蛋白质共3 775个,其中可定量蛋白质有3 676个; 差异蛋白为332个,其中上调差异蛋白127个,下调差异蛋白205个。将鉴定蛋白质分布的理化性质主要范围通过Excel图示化,蛋白分子质量范围是5.3~563.6 kD,等电点范围是3.5~12.2,疏水性范围是-2.2~1.1,见图 1。
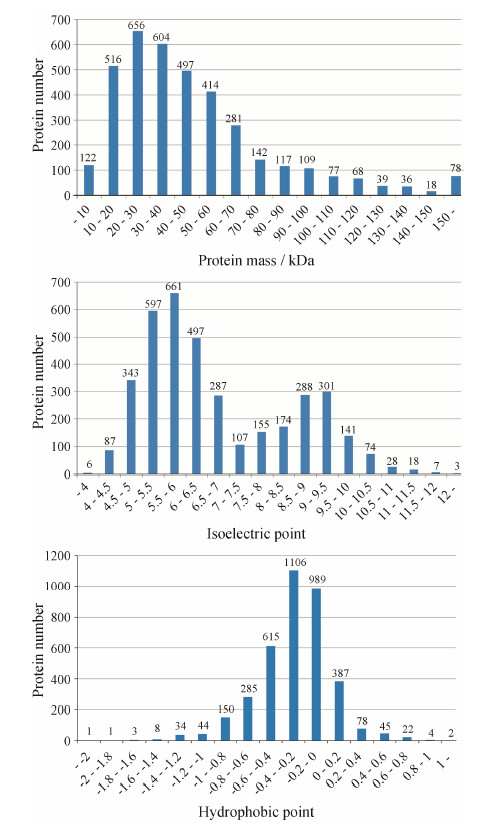 | Figure 1 Protein mass distribution, isoelectric point distribution and hydrophobic property analysis of identified proteins |
GO注释主要是对蛋白质的分子功能 (molecular function)、细胞位置 (cellular component)、生物过程 (biological process) 进行分析。这332个差异蛋白中主要参与的分子功能有14个,其中占比例较高的前5个是离子结合 (35.2%)、氧化还原酶活性 (16.3%)、裂合酶活性 (5.7%)、水解酶活性 (4.8%)、激酶活性(3.9%); 细胞位置12个,所占比例较高的前5个是细胞质 (22.9%)、细胞溶质(14.8%)、线粒体 (12.0%)、蛋白质复合体 (8.7%)、质膜 (8.4%); 生物过程14 个,其中占比例较高的前5个主要是生物合成过程 (28.3%)、应激反应 (19.9%)、小分子代谢过程 (19.5%)、碳水化合物代谢过程 (18.9%)、分解代谢过程 (18.9%),见图 2。
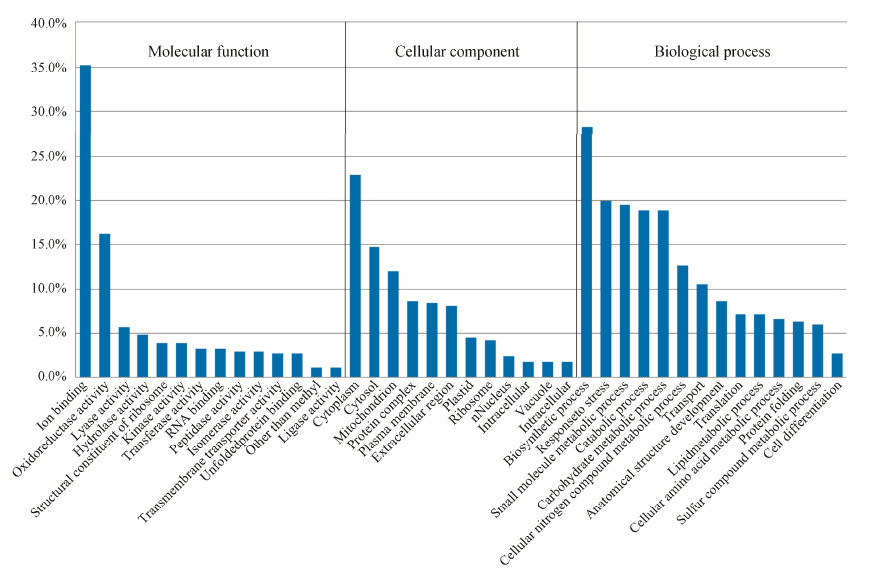 | Figure 2 GO classification of the differentially expressed proteins in cultivated Pseudostellaria heterophylla and its wild type |
KEGG代谢通路分析表明差异蛋白一共参与139个信号转导通路,其中排名前10的代谢通路为核糖体代谢通路 (7.9%)、内质网蛋白加工通路 (7.9%)、碳代谢通路 (7.2%)、糖酵解通路 (5.8%)、淀粉和蔗糖代谢通路 (5.8%)、氨基酸的生物合成通路 (5.0%)、丙酮酸代谢 (3.6%)、氨基糖和核苷酸糖代谢 (3.6%)、EB病毒感染 (3.6%)、柠檬酸循环 (2.9%),见表 1。
|
|
Table 1 Pathway enrichment analysis of differentially expressed proteins |
生物信息数据库STRING内的蛋白相互作用关系是建立在已报道文献、已有实验数据及生物学预 测基础上,因为STRING中未收录太子参这个物种,所以采用BLASTP将太子参蛋白比对到拟南芥的蛋白中,然后从STRING数据库中查找蛋白相互作用关系。在332个差异蛋白质中,共有116个蛋白经STRING筛选存在相互作用,并构成一个结构复杂的多中心差异表达基因互作网络 (图 3),各差异蛋白间通过多条作用通路进行调节。处于网络中心位置的一些节点,除与网络周边节点之间存在相互作用外,与其他网络中心节点之间也存在着广泛的互作关系。
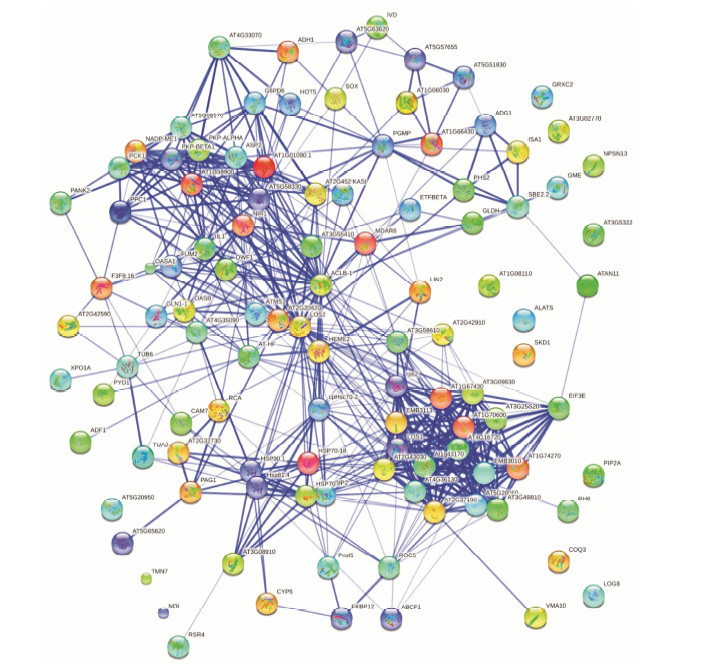 | Figure 3 Interaction network analysis of differentially expressed proteins |
根据差异蛋白的表达量、分子功能、代谢通路和网络通路,筛选出71个目标差异蛋白,见表 2。主要分成9类: 热休克蛋白 (heat shock proteins)、转移酶 (transferases)、氧化还原酶 (oxidoreductases)、裂解酶 (lyases)、异构酶 (isomerases)、连接酶 (ligases)、水解酶 (hydrolases)、微管蛋白 (tubulins)、移位酶 (translocases),分别有6、18、20、9、5、4、6、2、1个,见图 4。
|
|
Table 2 Significantly differential expressed proteins in cultivated Pseudostellaria heterophylla and its wild type |
 | Figure 4 The nine categories of significantly differential expressed proteins in cultivated Pseudostellaria heterophylla and its wild type |
为了验证蛋白质在基因水平上的变化是否和蛋白水平变化一致,选择了HSP_8、HSP83、Atlg60420、BAM1、GWD1、CAT、GBE1 7个蛋白质进行qPCR验证 (图 5)。结果显示,CAT、GBE1、BAM1、At1g60420基因的表达水平和蛋白水平呈现出一致性。此外,相对于野生组,栽培组蛋白水平上调的HSP_8和HSP83,在mRNA水平中下调; GWD1的mRNA水平也表现出相反的结果。在生物系统中,基因组是遗传信息的储存体,mRNA (转录水平) 是基因表达的中间体而蛋白质 (蛋白水平) 是基因功能的执行体。通常人们认为生物体为了节约资源,这两种表达水平是相符的。但实际上多个研究小组已经报道了蛋白质组和转录组的不相关或负相关结果,并用统计方法
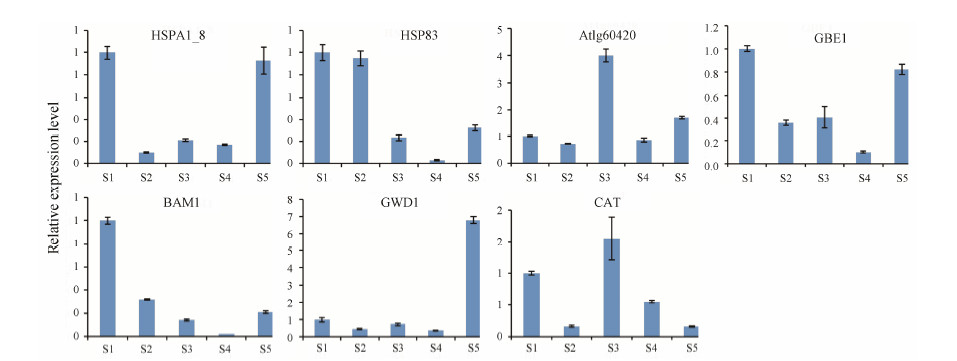 | Figure 5 Relative abundance of select differentially expressed proteins revealed by qPCR analysis |
验证了这种显著差异是由生物因素造成的[20]。造成这种不相关或负相关的原因可能有: ① 蛋白质的翻译后修饰 (如磷酸化、糖基化、泛素化等) 将影响蛋白质的分泌与降解[21]。② 基因转录后mRNA的稳定性。有研究表明[22],mRNA的稳定性与其3′ UTR的特定核苷酸序列及相应的结合蛋白有关。③不同基因受到转录后调控的影响不一致,因而会导致不同基因的两个水平表达出现差异。
讨 论药用植物所携带的生物学信息沿着DNA-mRNA- 蛋白质-代谢产物这一路径传递,蛋白质是生命活动的具体执行者,生物体在生长、发育及各种生理、病理过程中,虽然其基因组通常是稳定不变的,但是其蛋白质组的表达和构成却在随时发生着改变。不同的环境生态因子能够诱导基因表达产物的变化,出现
差异表达蛋白,从而导致次生代谢物代谢的积累差异[23]。因此,蛋白质组学的研究有助于对中药材有效成分合成积累及其品质形成的机制进行深层次规律的诠释。
实验结果显示,野生型与栽培型太子参在蛋白质组表达水平存在差异,差异蛋白为332个,其中上调差异蛋白127个,下调差异蛋白205个。生物信息学分析得到71个目标差异蛋白,主要分成热休克蛋白、转移酶、氧化还原酶、裂解酶、异构酶、连接酶、水解酶、微管蛋白、移位酶9类,以下为9类目标差异蛋白的功能分析。
在6个目标差异热休克蛋白中,与野生型太子参相比,栽培型太子参中3个为上调差异蛋白,3个为下调差异蛋白,这些蛋白主要参与抗应激和蛋白质折叠的生物过程。其中HSPA1_8和HSP83的蛋白表达量最高,均为上调差异蛋白。HSPA1_8属于HSP70蛋白,这种蛋白已经被证实与植物耐热性有关[24]。在高温下,植物产生的HSP70蛋白可以保护机体免遭损伤或者修复已经损伤的蛋白质,从而对植物起到保护作用且这种蛋白质在热激时会向细胞核的功能内移动,在核仁和核质中积累,在热激恢复后回到细胞质,能保护细胞核免受损伤。HSP70蛋白也起到分子伴侣的作用,与新生、未折叠、错折叠或聚集的蛋白质相结合,使某些蛋白质聚集物解离,加速正确的肽链折叠,维持某些肽链的伸展状态以利其跨膜转位,同时促进一些变性蛋白的清除,重新激活某些酶的作用,以维持细胞的功能和生存[25]。HSP83作为分子伴侣蛋白,在细胞周期控制和信号转导的时候能够促进特定目标蛋白的成熟,维持其结构[26]。故在热休克蛋白方面,栽培型太子参抗应激能力强于野生型太子参。
在18个转移酶中,与野生型太子参相比,栽培型太子参中有5个上调、13个下调蛋白,这些蛋白主 要参与碳水化合物代谢和细胞内氨基酸代谢。其中GWD1、PHS1、GBE1、metE、CYS的蛋白表达量较高且均为下调差异蛋白。GWD1是植物淀粉降解中重要的酶,负责淀粉的磷酸化。研究表明[27],在高等植物中,GWD1的缺乏会导致植物暂时无法调动淀粉,它的分子功能及其对淀粉粒的调节在调动淀粉的过程中起到重要的作用。PHS1是碳水化合物代谢中重要的变构酶,主要作用是提供葡萄糖分子,在对抗环境压力或是快速适应环境中起到重要的作用[28]。GBE1是形成植物体内淀粉的关键酶,对植物中的淀粉的调节起到重要作用[29]。metE参与甲硫氨酸的合成,在细胞代谢中占据重要位置,联系着蛋白质合成、甲基转移、多胺和乙烯的合成等功能[30]。CYS能催化植物合成半胱氨酸[31]。由此表明,野生型太子参转移酶的碳水化合物代谢和细胞内氨基酸代谢能力强于栽培型太子参。
在20个氧化还原酶中,与野生型太子参相比,栽培型太子参中有12个上调和8个下调蛋白,这些蛋白主要参与抗应激和生物合成过程。其中At1g60420、G6PDH和CAT的表达量较高,前两者为上调蛋白,后者为下调蛋白。At1g60420属于TRX家族,通过调控细胞中氧化还原状态发挥重要的作用。At1g60420参与植物新陈代谢,能够调节植物生长发育并且在植物抗病性方面发挥重要的作用[32]。研究表明G6PDH是磷酸戊糖途径的限速酶,参与植物防御反应,能提高植物的抗生物和非生物刺激[33]。CAT广泛的存在于植物体中,是植物中重要的抗氧化酶,也是植物演化过程中建立起来的植物防御系统的关键酶。在植物体中,H2O2有双重作用,过量的H2O2会导致过氧化损伤,对植物自身造成伤害。CAT能抑制H2O2过量增长,是植物体内控制H2O2水平和植物细胞的氧化还原平衡的重要酶[34]。另有研究表明,高水平的CAT活性是植物抗氧化胁迫必须的,同时CAT也是过氧化物的重要清除剂,在植物抗逆性 (抗干旱、低温、盐碱、重金属病害等) 方面起到重要的作用,能增强植物的防御能力[35]。在两种类型太子参氧化还原酶中,上调蛋白的数目和表达量均高于下调蛋白,故氧化还原酶在栽培型太子参中的抗应激、分解代谢等作用强于野生型太子参。
在9个裂解酶中,与野生型太子参相比,栽培型太子参中有6个上调和3个下调蛋白,这些蛋白主要参与抗应激、细胞内氨基酸代谢、生物合成过程。其中PDC1的表达量比较高,为上调蛋白。研究表明PDC1在抗非生物压力中起到重要的作用且其能在 缺氧的环境下生存,因此PDC1能在缺氧的幼苗中 起到作用[36]。在两种类型太子参裂解酶中,上调蛋白的数目和表达量均高于下调蛋白,故裂解酶在栽培型太子参中的抗应激等作用强于野生型太子参。异 构酶中有5个目标差异蛋白且均为下调差异蛋白,主要参与碳水化合物代谢、含氮化合物的代谢等过程。其中PGM的表达量较高,主要参与葡萄糖的合成和分解[37],这说明野生型太子参中异构酶的碳水化合物代谢功能强于栽培型太子参。
在4个连接酶中,分别有2个上调和2个下调 目标差异蛋白,主要参与小分子代谢等过程。共有6个水解酶,相对于野生型太子参,栽培型太子参中有2个上调和4个下调蛋白,主要参与分解代谢和碳 水化合物的代谢过程。其中BAM1的表达量最高,为下调蛋白。在淀粉降解和麦芽糖代谢中起到重要的作用[38]。这表明野生型太子参中连接酶的碳水化合物代谢略强于栽培型。此外,还存在2个微管蛋白和1个移位酶,均为下调蛋白,对于保持细胞形状、运动和胞内物质运输起到关键作用。本实验建立基于iTRAQ技术的太子参定量蛋白质组学研究方法,找出野生型与栽培型太子参蛋白质组表达水平的差异,通过差异蛋白质的生物信息学分析发现,野生型太子参的碳水化合物代谢和氨基酸代谢功能较栽培型太子参强,而抗应激能力较栽培型太子参弱。蔗糖是植物体内碳水化合物代谢的主要形式,也是碳水化合物短暂储存的形式之一。近年来,越来越多的证据表明,蔗糖可以在基因表达水平上对细胞内的代谢过程进行调控,它在植物生长发育过程中的重要作用已得到广泛的关注[39]。本课题组前期已对野生型和栽培型太子参差异化学成分进行研究,初步筛选并鉴定出两种生态型太子参间22种差异显著的化学成分,其中蔗糖,亮氨酸、谷氨酸、酪氨酸等在野生型太子参中含量明显高于栽培型太子参,与本实验结果相稳合,且有文献报道野生型太子参中的氨基酸含量高于栽培型太子参[40]。由此可以推测GWD1、PHS1、GBE1、PGM和BAM1可能是调节不同生态型太子参中蔗糖变化的5种关键蛋白,metE和CYS可能是导致不同生态型太子参氨基酸差异的2种关键蛋白,这将为今后进一步研究太子参次生代谢通路提供重要信息。本研究为解析不同生态型太子参次生代谢物差异的成因及其药材品质形成的蛋白质机制提供基础资料。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中国药典2010版:一部)[S]. 2010ed. Part 1. Beijing:China Medical Science Press, 2010:196. |
| [2] | Shen XC, Tao L, Bo S, et al. Ameliorated effects of Radix Pseudostellariaeon oxidative stress in rat chronic heart failure induced by acute cardiac infarction[J]. West Chin J Pharm Sci (华西医药杂志), 2008, 23:413-416. |
| [3] | Zhang CL, Zheng XX. Effects of polysaccharides from Pseudostellaria heterophylla on exercise endurance capacity and oxidative stress in forced swimming rats[J]. Sci Res Essays, 2011, 6:2360-2365. |
| [4] | Sheng R, Xu XX, Tang Q, et al. Polysaccharide of Radix Pseudostellariae improves chronic fatigue syndrome induced by poly I:C in mice[J]. Evid Based Complement Alternat Med, 2011, 8:1-10. |
| [5] | Ni SD, Xia LZ, Xu XX, et al. Effect of Pseudostellaria polysaccharides in diabetic mice by alloxan[J]. Anhui Med Pharm J (安徽医药), 2010, 14:521-522. |
| [6] | Pang W, Lin S, Dai Q, et al. Antitussive activity of Pseudostellaria heterophylla (Miq.) Pax extracts and improvement in lungfunction via adjustment of multi-cytokine levels[J]. Molecules, 2011, 16:3360-3370. |
| [7] | Qing MJ, Yu YB, Huang W, et al. Quality assay of Radix Pseudostellariae collected from different regions[J]. Chin Med J Res Pract (现代中药研究与实践), 2005, 19:29-32. |
| [8] | Gong ZN, Dai Y, Ma H, et al. The effect of Radix Pseudostellariae from 8 habitats on spleen-deficiency and immunologic function[J]. J Chin Med Mater (中药材), 2001, 21:281-282. |
| [9] | Liu XH, Tan XH, Zeng YP, et al. Comparison of quality of Radix Pseudostellariae from different habitats[J]. Chin Med J Res Prac (现代中药研究与实践), 2007, 22:36-38. |
| [10] | Shi XM, Jiang WW, Wang ZZ, et al. Overview of cultivation technology of Pseudostellaria heterophylla[J]. Strait Pharm J (海峡药学), 2013, 25:15-28. |
| [11] | Xiao CH, Zhou T, Jiang KW, et al. Genetic diversity and quality analysis of cultivated Pesudostellaria heterophylla[J]. Chin Tradit Herb Drugs (中草药), 2014, 45:1319-1325. |
| [12] | Yang J, Wang DQ, Yao Y, et al. Observation on biological characteristics of wild Pseudostellaria heterophylla[J]. J Chin Med Mater (中药材), 2011, 34:1323-1328. |
| [13] | Lei T, Zhao X, Jin S, et al. Discovery of potential bladder cancer biomarkers by comparative urine proteomics and analysis[J]. Clin Genitourin Cancer, 2013, 1:56-62. |
| [14] | Lin ST, Chou HC, Chang SJ, et al. Proteomic analysis of proteins responsible for the development of doxorubicin resistance in human uterine cancer cells[J]. J Proteomics, 2012, 75:5822-5847. |
| [15] | Kambiranda D, Katam R, Basha SM, et al. iTRAQ-based quantitative proteomics of developing and ripening muscadine grape berry[J]. J Proteome Res, 2014, 13:555-569. |
| [16] | Fang X, Chen W, Xin Y, et al. Proteomic analysis of strawberry leaves infected with Colletotrichum fragariae[J]. J Proteomics, 2012, 75:4074-4090. |
| [17] | Shi WX, Chen XH. Simultaneous determination of free amino acids in three edible Russula fungi by stable isotope isobaric tage quantitation labeled-LC MS/MS[J]. Food Ferment Ind (食品与发酵工业), 2015, 41, 2:179-183. |
| [18] | Dumas-Gaudot E, Amiour N, Weidmann S, et al. A technical trick for studying proteomics in parallel to transcriptomics in sym-biotic root-fungus interactions[J]. Proteomics, 2004, 4:451-453. |
| [19] | Guarnieri MT, Nag A, Smolinski SL, et al. Examination of triacylglycerol biosynthetic pathways via de novo transcripttomic and proteomic analyses in an unsequenced microalga[J]. PLoS One, 2011, 6:1-13. |
| [20] | Tian Q, Stepaniants SB, Mao M, et al. Integrated genomic and protemomic analyses of gene expression in mammalian cells[J]. Mol Cell Proteomics, 2004, 3:960-969. |
| [21] | Beyer A, Hollunder J, Nasheuer HP, et al. Post-transcriptional expression regulation in the yeast Saccharomyces cerevisiae on a genomic scale[J]. Mol Cell Proteomics, 2004, 3:1083-1092. |
| [22] | Waggoner SA, Liebhaber SA. Regulation of alpha-globin mRNA stability[J]. Exp Biol Med (Maywood), 2003, 228:387-395. |
| [23] | Wei QY, Meng X, Wang YY. The application of proteomics in genuine traditional Chinese medicine[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2012, 23:457-459. |
| [24] | Parsell DA, Lindquist S. The function of heat-shock proteins in stress tolerance-degradation and reactivation of damaged proteins[J]. Annu Rev Genet, 1993, 27:437-496. |
| [25] | Pegoraro C, Mertz ML, Maia DCL, et al. Importance of heat shock proteins in Maize[J]. J Crop Sci Biotech, 2011, 14:85-95. |
| [26] | Goes FS, Martin J. Hsp90 chaperone complexes are required for the activity and stability of yeast protein kinases Mik1, Wee1 and Swe1[J]. Eur J Biochem, 2001, 268:2281-2289. |
| [27] | Mikkelsen R, Mutenda KE, Mant A, et al. α-Glucan, water dikinase (GWD):a plastidic enzyme with redox-regulated and coordinated catalytic activity and binding affinity[J]. Proc Natl Acad Sci USA, 2005, 102:1785-1790. |
| [28] | Yu F, Jen Y, Takeuchi E, et al. α-Glucan phosphorylase from Escherichia coli. cloning of the gene, and purification and characterization of the protein[J]. J Biol Chem, 1988, 263:13706-13711. |
| [29] | Yandeau-Nelson MD, Laurens L, Shi Z, et al. Starchbranching enzyme IIa is required for proper diurnal cycling of starch in leaves of Maize[J]. Plant Physiol, 2011, 156:479-490. |
| [30] | Nohzadeh MS, Habibi RM, Heidari M, et al. Proteomics reveals new salt responsive proteins associated with rice plasma membrance[J]. Biosci Biotechnol Biochem, 2007, 71:2144-2154. |
| [31] | Noji M, Saito K. Molecular and biochemical analysis of serine acethltrassferase and cysteine synthase towards sulfur metabolic engineering in plants[J]. Amino Acids, 2002, 22:231-243. |
| [32] | Kim YB, Garbisu C, Pickering IJ, et al. Thioredoxin h over expressed in barley seeds enhances selenite resistance and uptake during germination and early seedling development[J]. Planta, 2003, 218:186-191. |
| [33] | Yu DQ, Tang HR, Zhang Y. Research progress in glucose-6-phosphate dehydrogenase in higher plants[J]. Chin J Biotechnol (生物工程学报), 2012, 28:800-812. |
| [34] | Nan ZR, Fan YX. Advance of research on catalase in plants[J]. Anhui Agric Sci Bull (安徽农学通报), 2008, 14:27-30. |
| [35] | Song XH, Zhao YF. Research progress on catalase in plants[J]. J Anhui Agri Sci (安徽农业科学), 2007, 35:9824-9827. |
| [36] | Kürsteiner O, Dupuis I, Kuhlemeier C. The pyruvate decarboxylase1 gene of Arabidopsis is required during anoxia but not other environmental stresses[J]. Plant Physiol, 2003, 132:968-978. |
| [37] | Dai JB, Liu Y, Ray WJ, et al. The crystal structure of muscle phosphoglucomutase refined at 2.7-angstrom resolution[J]. J Biol Chem, 1992, 267:6322-6337. |
| [38] | Scheidiq A, Fröhlich A, Schulze S, et al. Down regulation of a chloroplast-targeted beta-amylase leads to a starch-excess phenotype in leaves[J]. Plant J, 2002, 30:681-591. |
| [39] | Gibson SI. Plant sugar-response pathway. Part of a complex regulatory web[J]. Plant Physiol, 2000, 124:1532-1539. |
| [40] | Lin WJ, Xu RQ, Zhang YM. Optimize the ultrasonic extraction condition for animo acid from Radix Pseudostellariae[J]. Strait Pharm J (海峡药学), 2006, 18:33-35. |
 2016, Vol. 51
2016, Vol. 51


