2. 广州医科大学附属第二医院, 广东广州 510260;
3. 南方医科大学南方医院, 广东广州 510515
2. The Second Affiliated Hospital of Guangzhou Medical University, Guangzhou, 510260, China;
3. Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
黑色素瘤严重危害人类健康。尽管出现了免疫治疗法,但效果不佳。目前有关肿瘤的微环境涉及到许多不同的概念,其中黑色素瘤细胞所面对的免疫耐受被研究者所关注[1]。CD47是一个分布较广的膜受体,属于免疫球蛋白超家族[2]。CD47和巨噬细胞表面表达的调节蛋白a (SIRPa) 之间的交联转导信号抑制巨噬细胞的吞噬功能[3]。CD47利用自身作为标记,在巨噬细胞发挥吞噬功能时区别自我和外在细胞。CD47在多种肿瘤中高表达,如血液肿瘤、膀胱癌和淋巴癌等[4]。众所周知,炎症和免疫监控逃逸在肿瘤的发展过程中扮演重要的角色[3]。过表达CD47可能是癌细胞逃脱巨噬细胞带来的天然免疫的一种结果。
大量的研究已经证明抗CD47的单克隆抗体 (mAbs) 出现在治疗骨髓瘤[5]、平滑肌肉瘤[6]和淋巴瘤等疾病中,它是通过阻断CD47/SIRPa相互作用来抑制肿瘤细胞增殖和迁移。尽管基于抗体治疗有效,但由于CD47广泛表达,因此安全性备受关注,特别是在造血细胞中。如接受抗体急性注入的小鼠出现暂时的贫血和嗜中性白血球减少症[7]。
轮烷 (rotaxane) 是环状分子与线性分子通过非共价键连接在一起的超分子体系,线性分子的两端用大基团封闭。Inoue等[8]通过将阳离子化的α-环糊精分子穿过PEG链 (Mn = 4 kDa) 并用氧羰基的酪氨酸基团通过二巯键同时封住两端,显示了聚合物在基因传递应用程序中的效用。作者使用早期开发的叶酸修饰的聚轮烷衍生物 (folate modified polyrotaxane,FPP,由聚乙二醇、环糊精和叶酸构建组成),在其环糊精上通过酰胺键嫁接聚乙烯亚胺而成[9]。在前期的结果中作者发现FPP能有效包载阿霉素逆转CDDP诱导的乳腺癌MCF耐药细胞株,并且有效地诱导其凋亡[9]。
本研究中,作者将测试CD47在人类黑色素瘤 患者上的表达,考察FPP作为传递系统传递siRNA- CD47靶向敲除CD47,治疗黑色素瘤的作用。
材料与方法材料 小鼠的CD47 siRNA序列5'-GGAAUGAC CUCUUUCACCA-3'; 对照的siRNA序列5'-AATTCT CCGAACGTGTCACGT-3' (Sigma-Aldrich公司)。叶酸修饰的FPP由广州医科大学药学院自制[9]。腺病毒转染GL3荧光素酶基因到小鼠黑色素瘤B1610细胞(复旦大学医学院医学实验中心提供)。细胞培养在含有10% 胎牛血清的DMEM (Life Technologies公司)。
FPP (CD47)纳米粒的制备 精密称取FPP聚合物,置于25 mL量瓶中,加入PBS (pH 7.4) 溶解,配成质量浓度为20 μg·mL-1,超声分散。分别取适量与质粒siRNA-CD47按N/P比(聚合物载体中的氨基与质粒DNA中的磷酸基的电荷摩尔比) 为10的比例混合,室温静置30 min。即得FPP (CD47) 复合物。使用马尔文粒径仪测定纳米粒的粒径和电位,扫描电镜测试其粒径及其表面形态。
氯膦酸盐脂质体制备 氯膦酸盐脂质体的制备参考文献[8]: 磷脂0.4 g与胆固醇0.06 g溶解在含氯膦酸盐的氯仿中,置50 mL茄形瓶中旋转蒸发成膜后,再置真空干燥器中过夜。加入PBS (pH 7.4) 2.5 mL,置空气浴摇床中,37 ℃、180 r·min-1,20 min 水化,水浴超声5 min脱膜,探头超声制备得到氯膦酸盐脂质体。氯膦酸盐脂质体包含20 g·L-1氯膦酸盐。
临床样本获取及Western blot分析 临床样本来源于广州医科大学附属第二医院肿瘤科,患者均签署知情同意书,并经过医院伦理委员会审查同意。按照参考文献[10],临床样本和黑色素细胞按分子克隆实验指南方法提取总蛋白,取样品10 μL稀释10倍后进行蛋白定量,并统一调整样品蛋白质量浓度为500 μg·mL-1,样品分装后于 -80 ℃保存备用。配胶、点样、电泳、转膜 (半干法转移) 和封闭,结合一抗CD47 (美国Cell Signaling公司),结合二抗,NBT/BCIP显色,5~30 min后肉眼观察到特异性条带显蓝黑色,反应终止,用PBS终止反应。应用扫描软件进行数据分析处理。以鼠抗人GAPDH抗体作为一抗进行Western blot检测,作为判断结果的内参照。
MTS细胞增殖评估 短期的增殖评估: 每孔5×103个种植于96孔板中,加入FPP (CD47) (含250 nmol·L-1抗CD47 siRNA) 或FPP (Con) 纳米粒 (对照组) 转染24 h后,细胞使用MTS试剂盒检测 (Promega公司)。长期的增殖评估: 每孔5×103个种植于96孔板中,使用FPP (CD47) 0~250 nmol·L-1 siRNA转染7天,使用MTS试剂盒测试。
克隆形成实验 参考文献[10],0.35%琼脂糖上种植1×105个FPP (CD47) 转染的细胞,细胞每周加入新鲜的培养基2次。培养2周后,细胞使用Gel-Pro 4.0分析软件记数。
侵袭实验 参考文献[11],6孔细胞转染24 h后,将培养小室插入到24孔板中,取2×106个转染后细胞重悬于200 μL无血清的DMEM培养基中,将细胞混合液缓慢加入到小室的上层; 小室的下层中加入含20% FBS的MEM培养基作为趋化因子,5% CO2、37 ℃条件下培养24 h后,取出小室,吸出小室中DMEM培养基,小心擦去上层细胞,PBS洗3次,倒置晾干,室温下甲醇固定10 min,倒置晾干,0.1% 结晶紫染色5 min,清水轻轻浸洗数次,倒置晾干,去膜,中性树胶封片。镜下观察,随机计数6个视野,计算结晶紫染色细胞数,即为穿膜细胞。以上实验均重复3次。
裸鼠成瘤抑制实验 取B16F10细胞(每毫升1×107个) 皮下注射0.1 mL到裸鼠 [(20 ± 2) g,南方医科大学实验动物中心,粤实动准1号],右肩胛背部,注射后8周,肿瘤体积直径长至4 mm,再将荷瘤裸鼠随机分为5组,它们分别是PBS组、FPP (CD47)、FPP (Con)、氯膦酸盐脂质体和氯膦酸盐脂质体 + FPP (CD47),每组5只。从第8周开始每3天向瘤内相应注射FPP (CD47) 和FPP (Con) (其中siRNA分别为0.6 mg·kg-1)。氯膦酸盐脂质体100 mg·kg-1为首次剂量,第2、3天为50 mg·kg-1。氯膦酸盐脂质体为接种后第3天开始给药,连续3天。肿瘤体积使用游标卡尺进行跟踪测量,所有动物实验经过广州医科大学动物伦理委员会审核。
流式细胞仪测试 流式细胞仪 (Becton Dickinson公司) 用于本次实验[12]。将对数生长期的细胞以每孔5×105个接种于6孔板中,37 ℃培养24 h后,每孔加PBS组、FPP (CD47)、FPP (Con)、氯膦酸盐脂质体和氯膦酸盐脂质体 + FPP (CD47) 孵育0.5 h后,细胞用预冷的PBS冲洗2次停止细胞的摄取。而后加入0.5% trypsin-EDTA消化,细胞量使用流式细胞仪计数。每个实验重复3次。
荧光定量PCR RNeasy kit (武汉博士生物有限公司) 从肿瘤组织中提取总RNA。PCR反应总体积是50 μL,50 ℃,2 min; 95 ℃,10 min; 95 ℃,15 s; 和60 ℃,1 min; 共40循环。小鼠CD47引物 (上游: 5'-GTTCA GCTCAACTACTGT-3',下游: 5'-CTCTTATTCGTATG GCTG-3'); 小鼠actin上游: 5'-ATATCGCTGCGCTGG TCGTC-3',下游: 5'-AGGATGGCGTGAGGGAGAGC- 3' (上海生工公司)。反应结束后,用计算机将样本和标准曲线对比,计算出反应体系中待测标本的DNA拷贝数。
统计学分析 绿色荧光蛋白 (GFP) 阳性细胞率使用BD CellQuest (BD Biosciences) 软件。统计分析使用SPSS19.0软件。两组间比较用t检验,多组间比较用方差分析。P < 0.05表示差异有统计学意义。
结 果 1 CD47 在人黑色素瘤中高表达对16名临床黑色素瘤患者进行CD47表达的检测。图 1a、b显示,与人正常组织中表皮黑色素细胞株相比,患者CD47的表达显著升高。过表达的CD47不仅表达在白血病上[13],而且也出现在实体瘤上。表明CD47的表达被看成是患者肿瘤或者恶化的重要标志。
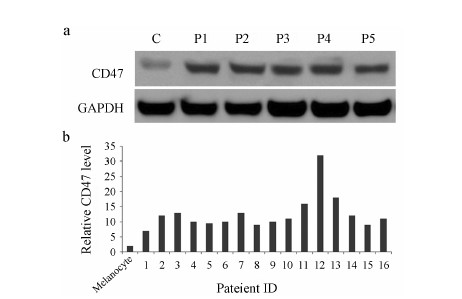 | Figure 1 CD47 is elevated in clinical melanoma samples. a: 5 specimens of patients with clinical were tested by Western blot (P1-P5). “C” indicated melanocyte as control. b: CD47 mRNA levels of 16 clinical specimens from melanoma patients were detected by RT-PCR. Melanocyte was regarded as a control group, 1-16 indicated 16 samples of clinical patients |
FPP (CD47) 平均粒径80 nm,电荷10 mV (图 2a)。FPP纳米粒 (FPP-NPs) 的电镜分析显示粒径分布均匀 (图 2b)。FPP-NPs转入24 h后,与FPP (Con) 相比,FPP (CD47) 组中CD47蛋白表达显著降低 (图 2c),说明FPP并没有引起非特异性靶基因下调。
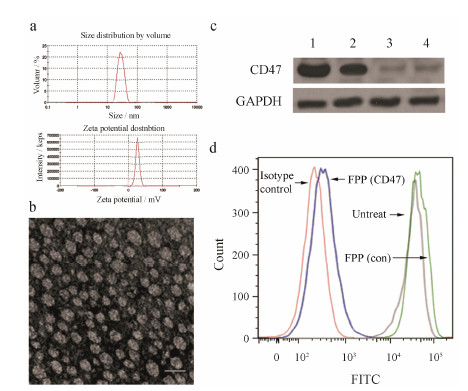 | Figure 2 In vitro transfection of FPP knockdown CD47 expression in B16F10 cells. a: Representative of size and zeta potential of FPP (CD47) determined by Malvern particle size instrument. b: Representative of scanning electron microscope image of FPP (CD47). Scale bar: 100 nm. c: Western blot analysis of CD47 protein level (top) in the B16F10 melanoma cells after transfectionfor 24 h. Lane 1: Untreated; Lane 2: Cells transfected with LPH (Con siRNA); Lane 3: Cells transfected with positive control TransIT (CD47 siRNA); Lane 4: Cells transfected with FPP (CD47 siRNA). d: Flow cytometry analysis of B16F10 cells treated with the FPP (CD47). Cells were stained with FITC- conjugated, anti-CD47 antibody 24 h after transfection |
FITC荧光强度标记细胞表面CD47的数量,流式细胞仪利用荧光强度定量FPP (CD47) 靶向沉默效应。图 2d显示,与FPP (Con) 相比,FPP (CD47) 的CD47显著减少至4.2%。在红细胞和血小板上,较低的CD47表达可以保护细胞避免巨噬细胞吞噬[12]。说明完全敲除CD47将增加巨噬细胞识别和清除异常癌症细胞的能力。
3 沉默 CD47 抑制黑色素瘤的增殖作为治疗靶标,CD47的吞噬功能并没有阐述。为了评价沉默CD47的影响,FPP (CD47) 转入到B16F10细胞2天后,MTS结果显示CD47的丢失并没有直接影响短期的细胞增殖能力 (图 3a)。基质胶侵袭实验显示,与FPP (Con) 组比较,FPP (CD47) 组没有明显变化,提示癌症细胞的侵袭受到抑制 (图 3b)。软琼脂克隆形成实验进一步证实CD47的沉默抑制B16F10细胞的增殖,与未治疗组相比,FPP (CD47) 组克隆数降低了91%,并且减少了克隆的大小。另外,FPP包载各种浓度抗CD47 siRNA形成的纳米粒测试细胞抑制的剂量效应显示: 随着剂量增大,抑制效应增强。较高的抗CD47 siRNA浓度导致较高的抑制能力 (结果未显示)。
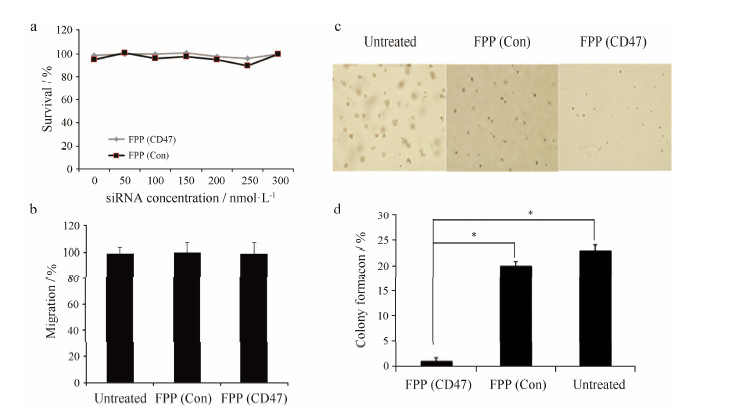 | Figure 3 Silence CD47 inhibits melanoma cell proliferation. a: MTS tests proliferation which FPP (CD47/Con) transfected B16F10 cells for 24 h; b: Quantitative evaluation of the migration experiment; c: Clone formation assay; d: Quantitative experiments of clone formation. n = 3, x±s. P < 0.05 |
图 4a、b显示,FPP (CD47) 显著抑制实体瘤的生长。与未治疗组相比,瘤体积减少了90% (P < 0.001)。Tyner等[13]报道,LPH-NPs (siRNA) 在0.15~1.2 mg·kg-1剂量内有较小的免疫刺激性,而小鼠使用低剂量FPP (CD47) 未观察到显著诱导炎症因子。为了证实巨噬细胞介导小鼠肿瘤的增长抑制。在FPP (CD47) 治疗前,氯膦酸盐脂质体注射进入小鼠体内并消除巨噬细胞[14,15]。氯膦酸盐脂质体与FPP (CD47) 共同注射荷瘤小鼠的结果显示,与对照组相比,肿瘤增大 (P < 0.05)。标有FITC抗CD47抗体检测CD47蛋白敲除后,结果显示FPP (CD47) 治疗后沉默的CD47标志物显著 (图 4c)。Western blot和RT-PCR分析肿瘤的结果进一步肯定了CD47蛋白和mRNA的减少 (图 4c、d)。这些结果证实肿瘤的抑制是依赖CD47和巨噬细胞。
 | Figure 4 Inhibition of melanin solid tumor with FPP (CD47) treatment. a: FPP (CD47) inhibits tumor growth by intravenous injection. n = 5, x±s. b: Images of representative of tumors in mice after treatment. c: Western blot analysis CD47 expression in tumor after treatment. d: Quantitation of CD47 mRNA level in the tumors after treatment. n = 3, x±s. P < 0.05, **P < 0.001 |
多聚 (准) 轮烷 (pseudo-polyrotaxanes) 是一种通过非共价键相互作用组合得到的超分子结构,当线状分子两端用大基团封闭时称为轮烷; 而没有对线性分子进行封端得到的超分子配合物称为准轮烷。轮烷的主体主要有环糊精 (CD)、冠醚和杯芳烃等。CD与大分子间的组装以其选择性、可调控性和生物相容性等优势引起广泛关注[16]。
CD成为重要的多聚 (准) 轮烷主体化合物之一,首先是来源丰富,易于纯化,有较好的化学稳定性;第二,与冠醚等分子相比,CD所具有的天然的桶状三维结构,能与许多小分子或高分子链形成结构独特的包合物; 另外,CD分子空腔大小可以变化 (从α-CD到γ-CD,腔径依次增大,并且通过对“桶”周围羧基的化学修饰可以改变CD的性质,实现分子 设计,进而实现对聚合物包合物物理化学性质的调控。本实验构建的FPP中CD的大容量,在前期工作中包载大量的阿霉素 (DOX),借助载体胞饮进入细胞,在肿瘤细胞酸性环境中酰胺键断裂,释放DOX。由于大量释放DOX,可以忽略肿瘤细胞内高表达的糖蛋白泵药效应,从而达到逆转耐受、诱导凋亡的作用[9]。
与慢病毒相比,非病毒构建的传递系统因在传递药物/基因方面有着安全性高、易制备等优点而倍受重视,但转染效率低、载药量不足成为限制其发展的瓶颈,超分子聚轮烷因其聚乙二醇穿接大量的CD可以解决载药量不足的问题; 通过靶向修饰,如嫁接叶酸可以解决毒副作用高和转染效率低的问题; 同时在CD表面嫁接聚乙烯亚胺 (PEI),通过聚轮烷中PEG的修饰,不但降低PEI毒性,而且可以借助其高效压缩基因转染细胞的能力而发挥治疗作用。另外,传递系统中的PEG可以延长在血液循环过程中的时间,达到较长时间治疗的效果[9]。
在本研究中,临床黑色素瘤患者的CD47水平显著高于黑色素细胞,其结果相似于在白血病或淋巴瘤以及其他癌症中的表现。不同于抗体治疗方法,使用更多的选择性方法 (RNA干扰法),通过FPP传递抗siRNA-CD47进入癌细胞内阻断癌症细胞被巨噬细胞吞噬的抑制信号,从而显著抑制黑色素瘤的生长。
黑色素瘤细胞一旦被免疫抑制微环境检测到,其高侵袭和转移性将通过天然免疫的逃逸表现出其强大的生存力,因此逆转免疫耐受是治疗黑色素瘤的关键[1]。CD47是一个广泛表达在细胞膜上的受体,它传递自我信号到巨噬细胞,从而避免被免疫系统清除,产生免疫耐受。这种横跨膜受体最近已经受到关注,因为肿瘤细胞呈现出高表达的CD47可以降低巨噬细胞对其的识别[17]。黑色素瘤患者表达较高的CD47水平,该现象阐述了免疫肿瘤发展的机制,为逃避免疫监控和分子治疗提供了合理性。这种发现提 供了一种重要的假说: siRNA沉默CD47作为一种治疗方法可以抑制黑色素瘤的发展和侵袭。尽管SIRPa和CD47之间的关系已经在多种部位得到证实[18],但这种关系应该被看成是一种经典的对抗吞噬作用而并非是自我标志的认识[18]。因此,使用免疫耐受的B16F10小鼠黑色素瘤细胞株及其制备的荷瘤小鼠作为体内肿瘤的评价模型,检测siRNA的抗癌效应。
除了抗吞噬功能,CD47也被应用于调节细胞钙浓度的信号转导[19]、凋亡[20]、增殖[21],甚至是压力耐受[22]。CD47吞噬活性大部分都是使用单克隆抗体或多肽来研究。因此,CD47在细胞生存、增殖和转移等方面看似很矛盾的作用归属于研究的需要。例如,CD47抗体不仅阻碍SIRPa和CD47的交联,也依赖性刺激抗体,获得细胞免疫毒性[23]。与此相比,通过siRNA敲除CD47将提供一种证明CD47此功能的方法。
MTS实验说明CD47的敲除并不能影响细胞的短暂的生存和侵袭 (图 3a、b)。然而,克隆形成实验显示它可以独立于内外界刺激的情况下扩增细胞 (图 3)。更多可靠的方法测试了细胞转化。有报道,CD47的敲除能保护组织免受粒子辐射的伤害[24],并且在T细胞上沉默CD47,且放射照射后,自噬体的形成显著增加。这些机制都认为敲除CD47可以通过激活免疫来保护机体[25]。
体内的数据和克隆形成实验一致,即敲除CD47可以抑制肿瘤的增长。当氯膦酸盐脂质体消除巨噬细胞后,肿瘤抑制的现象也随之消失 (图 4a)。皮下瘤模型实验证明巨噬细胞在RNAi靶向作用CD47的过程中扮有重要作用。相同的治疗效果同样在肺癌的迁移模型中观察到,即沉默CD47阻碍巨噬细胞的抗吞噬信号,破坏体内促进和抑制吞噬的生理平衡,最终抑制肿瘤的生长和转移。
FPP-NPs叶酸靶向传递siRNA-CD47抑制黑色素瘤。纳米粒治疗显著延长了半衰期,增加了药物的生物利用度[9],最重要的是准确把握了治疗方向。纳米粒在癌细胞组织的累积可以大量引发药物在肿瘤组织中渗透作用[26]。纳米粒表面的功能化或靶向配体的修饰有助于受体介导的内化和药物的释放。因此,siRNA-CD47 的传递将通过特定化靶向传递方式来达到治疗目的。
总之,使用黑色素瘤作为模型评价并得出通过FPP转载RNAi靶向CD47可有效抑制黑色素瘤,进一步确定CD47作为治疗黑色素瘤靶点,此结果为后期的机制研究及制剂开发打下基础。
| [1] | Niu ZS, Bai FL, Sun T, et al. Antitumor efficacy of the recombinant Newcastle disease virus rNDV-IL15 on melanoma models[J]. Acta Pharm Sin (药学学报), 2014, 49:310-315. |
| [2] | Xu JF, Pan XH, Zhang SJ, et al. CD47 blockade inhibits tumor progression human osteosarcoma in xenograft models[J]. Oncotarget, 2015, 6:23662-23670. |
| [3] | Shi L, Bian Z, Chen CX, et al. CD47 deficiency ameliorates autoimmune nephritis in Fas mice by suppressing IgG autoantibody production[J]. J Pathol, 2015, 6:3211-3235. |
| [4] | Jaiswal S, Jamieson CHM, Pang WW, et al. CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis[J]. Cell, 2009, 138:271-285. |
| [5] | Kim D, Wang J, Willingham SB, et al. Anti-CD47 antibodies promote phagocytosis and inhibit the growth of human myeloma cells[J]. Leukemia, 2012, 26:2538-2545. |
| [6] | Edris B, Weiskopf K, Volkmer AK, et al. Antibody therapy targeting the CD47 protein is effective in a model of aggressive metastatic leiomyosarcoma[J]. Proc Natl Acad Sci USA, 2012, 109:6656-6661. |
| [7] | Majeti R, Chao MP, Alizadeh AA, et al. CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells[J]. Cell, 2009, 138:286-299. |
| [8] | Inoue Y, Miyauchi M, Nakajima H, et al. Self-threading of a poly(ethylene glycol) chain in a cyclodextrin-ring:control of the exchange dynamics by chain length[J]. J Am Chem Soc, 2006, 128:8994-8998. |
| [9] | Wang H, Yin HH, Yan FJ, et al. Folate-mediated mitochondrial targeting with doxorubicin polyrotaxane nanoparticles overcomes multidrug resistance[J]. Oncotarget, 2015, 6:2827-2842. |
| [10] | McCracken MN, Cha AC, Weissman IL. Molecular pathways:activating T cells after cancer cell phagocytosis from blockade of CD47"don't eat me" signals[J]. Clin Cancer Res, 2015, 21:3597-3601. |
| [11] | Wang H, Yang S, Zhou H, et al. Aloperine executes antitumor effects against multiple myeloma through dual apoptotic mechanisms[J]. J Hematol Oncol, 2015, 8:26. |
| [12] | Chao MP, Jaiswal S, Weissman-Tsukamoto R, et al. Calreticulin is the dominant pro-phagocytic signal on multiple human cancers and is counterbalanced by CD47[J]. Sci Transl Med, 2010, 2:63-94. |
| [13] | Tyner JW, Uchida O, Kajiwara N, et al. CCL5-CCR5 interaction provides antiapoptotic signals for macrophage survival during viral infection[J]. Nat Med, 2005, 11:1180-1187. |
| [14] | Kim SK, Jeong TD, Kim SY, et al. Characteristics of unexpected protein bands in multiple myeloma patients after autologous stem cell transplantation[J]. Clin Biochem, 2014, 47:588-592. |
| [15] | Chao MP, Alizadeh AA, Tang C, et al. Anti-CD47 antibody synergizes with rituximab to promote phagocytosis and eradicate non-Hodgkin lymphoma[J]. Cell, 2010, 142:699-713. |
| [16] | Jun C, Huang XL, Lin TT, et al. Inclusion complex formation between α, γ-cyclodextrins and organic-inorganic star-shaped poly(ethylene glycol) from an octafunctional silsesquioxane core[J]. Polymer Phys, 2004, 42:1173-1180. |
| [17] | Sick E, Niederhoffer N, Takeda K, et al. Activation of CD47 receptors causes histamine secretion from mast cells[J]. Cell Mol Life Sci, 2009, 66:1271-1282. |
| [18] | Subramanian S, Parthasarathy R, Sen S, et al. Species-and cell type-specific interactions between CD47 and human SIRPα[J]. Blood, 2006, 107:2548-2556. |
| [19] | Pettersen RD, Hestdal K, Olafsen MK, et al. CD47 signals T cell death[J]. J Immunol, 1999, 162:7031-7040. |
| [20] | Manna PP, Frazier WA. CD47 mediates killing of breast tumor cells via Gi-dependent inhibition of protein kinase A[J]. Cancer Res, 2004, 64:1026-1036. |
| [21] | Sick E, Boukhari A, Deramaudt T, et al. Activation of CD47 receptors causes proliferation of human astrocytoma but not normal astrocytes via an Akt-dependent pathway[J]. Glia, 2011, 59:308-319. |
| [22] | Sick E, Jeanne A, Schneider C, et al. CD47 update:a multifaceted actor in the tumour microenvironment of potential therapeutic interest[J]. Br J Pharmacol, 2012, 167:1415-1430. |
| [23] | Soto-Pantoja DR, Miller TW, Pendrak ML, et al. CD47 deficiency confers cell and tissue radioprotection by activation of autophagy[J]. Autophagy, 2012, 8:1628-1642. |
| [24] | Maxhimer JB, Soto-Pantoja DR, Ridnour LA, et al. Radioprotection in normal tissue and delayed tumor growth by blockade of CD47 signaling[J]. Sci Transl Med, 2009, 1:992. |
| [25] | Li SD, Huang L. Stealth nanoparticles:high density but sheddable PEG is a key for tumor targeting[J]. J Control Release, 2010, 145:178-181. |
| [26] | Yan Y, Ochs CJ, Such GK, et al. Bypassing multidrug resistance in cancer cells with biodegradable polymer capsules[J]. Adv Mater, 2010, 22:5398-5403. |
 2016, Vol. 51
2016, Vol. 51


