2. 北京中医药大学, 北京 100029
2. Beijing University of Chinese Medicine, Beijing 100029, China
疏血通注射液是由水蛭和地龙提取的一种动物源性中药复方中药注射液,富含糖、氨基酸、多肽和嘌呤类等成分[1,2]。临床常用于活血化淤、通经活络,治疗淤血阻络所致的中风中经络急性期和急性期脑梗塞等症状,是临床急救应用较为广泛的一类中药注射液[2]。
研究认为,多肽和氨基酸可能是注射液的主要活性成分,但是针对氨基酸的检测,目前仅测定多肽水解后的总氨基酸含量,且主要集中在标准规定的氨基酸的检测,并未对其他常见游离氨基酸进行定性定量分析[2, 3, 4, 5, 6]。目前,在动物源性中药制剂中,很少研究游离氨基酸的组成和含量,本文认为控制游离氨基酸组成能更好地预测氨基酸在进入人体后所发挥的生理学作用[7]。
为此,本研究尝试采用高效薄层色谱法 (HPTLC)、氨基酸柱前衍生的超高效液相色谱法 (UPLC) 以及离子色谱法对疏血通注射液中多种游离氨基酸进行鉴别。通过对不同方法适用性的比较,对注射液中多种氨基酸,特别是现行标准未检测的氨基酸进行定性定量研究,为更加全面地分析疏血通注射液中游离氨基酸的组成和活性提供数据支持。
材料与方法 试剂与仪器Waters ACQUITY UPLC H-Class- PDA四元超高效液相色谱系统 (美国Waters公司),配备Empower 3色谱管理软件,AccQ-TagTM Ultra (2.1 mm × 100 mm,1.7 μm,PN: 186003837); 高效薄层色谱仪Camag Automatic TLC Sampler 4点样仪、Camag TLC Visualizer薄层照相系统 (瑞士Camag公司); HPTLC Silcon Gel 60 (20 cm × 10 cm,德国Merck公司); ICS5000离子色谱仪 (美国Thermo Fisher Scientific公司),配备ED 5000电化学检测器、化学抑制型电导检测器、Chromeleon 6.8色谱工作站、AS-AP自动进样器,保护柱CarboPacTM PA20 (PN: 060144),分析柱CarboPacTM PA20 (PN: 060142),氨基酸捕获柱Amino TrapTM (PN: 046122)。AccQ-Tag deriation kit衍生试剂盒购于美国Waters公司; 甲醇和乙腈均为色谱纯、50% (质量分数) 的氢氧化钠 (NaOH) 溶液、电化学分析用醋酸钠 (NaOAc) 购于美国Thermo Fisher Scientific公司; 甲酸和甲酸铵购于美国Sigma-Aldrich公司; 其他试剂均为分析纯,购于国药集团化学试剂有限公司; 实验室用水由Millipore超纯水系统制备,电阻率为18.2 MΩ·cm。氨基酸化合物对照品中脯氨酸 (L-proline,Pro)、苯丙氨酸 (L-phenylalanine,Phe)、苏氨酸 (L-threonine,Thr)、酪氨酸 (L-tyrosine,Tyr)、甘氨酸 (L-glycine,Gly)、丙氨酸 (β-alanine,Ala)、组氨酸 (L-histidine,His)、色氨酸 (L-tryptophane,Trp)、亮氨酸 (L-leucine,Leu)、甲硫氨酸 (L-methionine,Met)、缬氨酸 (valine,Val)、异亮氨酸 (L-isoleucine,Ile)、胱氨酸 (L-cysteine,Cys)、精氨酸 (L-argnine,Arg)、谷氨酸 (L-glutamic acid,Glu)、丝氨酸 (L-serine,Ser)、赖氨酸 (L-lysine,Lys)、天冬氨酸 (L-aspartic acid,Asp) 购于中国食品药品检定研究院 (140624-200805,纯度均 ≥ 99.0%); 牛磺酸(taurine,Tau)、鸟氨酸 (L-ornithine,Orn)、羟赖氨酸 (D/L-hydroxylysin)、天冬酰胺 (D-asparagine,Asn) 和谷氨酰胺 (L-glutamine,Gln) 购于美国Sigma公司 (纯度均 ≥ 99.0%); γ-氨基丁酸 (γ-aminobutyric acid,GABA)、羟基脯氨酸 (hydroxyproline,Hypro) 购于Alfa-aesar公司; 茶氨酸 (L-theanine) 购于浙江天瑞公司。
样品的制备 薄层色谱法取18种氨基酸化学对照品,分别称取10 mg氨基酸对照品置于100 mL量瓶,加甲醇溶解并定容至刻度,制成HPTLC混合对照品溶液; 量取疏血通注射液2 mL置于10 mL量瓶用甲醇定容至刻度,配制成HPTLC样品溶液,直接进行分析。
柱前衍生UPLC法取氨基酸对照品用甲醇配制为各含0.1 μmol·mL-1的UPLC氨基酸混合对照品; 量取疏血通注射液2 mL置于100 mL量瓶用甲醇定容至刻度,配制成UPLC样品溶液。
AQC (1,6-氨基喹啉基-N-羟基琥珀酰亚氨基甲酸酯) 衍生化分别吸取100 μL UPLC样品溶液和氨基酸混合对照品溶液于1.5 mL EP管中,加入20 μL硼酸盐缓冲溶液,涡旋混合15 s,加入荧光衍生试剂溶液10 μL,涡旋混合10 s,封口膜封口,室温下放置1 min,55 ℃下加热30 min,然后冷却至室温,配制成衍生化试液,直接进样分析。
离子色谱量取疏血通注射液1 mL置于100 mL量瓶用超纯水定容至刻度,配制成离子色谱样品溶液,直接进行分析。
色谱条件 薄层色谱法取HPTLC对照品和样品溶液各 5 μL,分别点于同一硅胶HPTLC G薄层板上,以正丁醇-冰醋酸-水 (19∶5∶5) 为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105 ℃加热至斑点显色清晰。
柱前衍生UPLC法取衍生化试液,色谱柱采用AccQ-TagTM Ultra (2.1 mm × 100 mm,1.7 μm,PN: 186003837)。流动相为AccQ-Tag deriation kit衍生试剂盒提供: 流动相 A: AccQ TagTM Ultra Eluent A; 流动相B: 10% AccQ TagTM Ultra Eluent B; 流动相C: 超纯水; 流动相D: AccQ TagTM Ultra Eluent B。流速: 0.70 mL·min-1; 检测波长: 260 nm; 柱温: 49 ℃; 进样体积: 1 μL; 梯度洗脱程序: 0~0.29 min,2.0% A,0 B,98.0% C,0D; 0.29~5.49 min,2.0%~9.0% A,0~80.0% B,98.0%~11.0% C,0D; 5.49~7.10 min,9.0%~8.0% A,80%~15.6% B,11.0%~57.9% C,0~18.5% D; 7.10~7.30 min,8.0% A,15.6% B,57.9% C,18.5% D; 7.30~7.69 min,8.0%~7.8% A,15.6%~0 B,57.9%~70.9% C,18.5%~21.3% D; 7.69~7.99 min,7.8%~4.0% A,0 B,70.9%~36.3% C,21.3%~59.7% D; 7.99~8.59 min,4.0% A,0 B,36.3% C,59.7% D; 8.59~8.68 min,4.0%~2.0% A,0 B,36.3%~98.0% C,59.7%~0D; 8.68~10.20 min,2.0% A,0 B,98.0% C,0D。
离子色谱法采用两套柱体系分离: ① CarboPacTM PA20 (3 mm × 30 mm) 保护柱和CarboPacTM PA20 分析柱 (3 mm × 150 mm); ② Amino TrapTM Column氨基酸捕获柱 (4 mm × 50 mm)、CarboPacTM PA20保护柱和CarboPacTM PA20分析柱。淋洗液/流动相组 成: 0~30 min,7.5 mmol·L-1 NaOH; 30.1~35 min,200 mmol·L-1 NaOH; 流速: 0.45 mL·min-1; 进样体积: 10 µL。
结 果 1 定性分析 1.1 高效薄层色谱分析按照“薄层色谱法”进行实验,采用全自动点样仪、全自动展开体系进行样品分析,重现性良好。在茚三酮试液105 ℃显色至斑点显色清晰。结果供试品色谱中,在与对照品色谱相应的位置上,显相同的颜色斑点。经比对,注射液样品共检出6个明显条带,对应6种氨基酸,将这6种氨基酸对照与样品溶液重复实验,根据Rf值确定这六种氨基酸由下至上分别为组氨酸、天冬氨酸、甘氨酸、丙氨酸、缬氨酸和亮氨酸,色谱图见图 1。
 | Figure 1 TLC analysis between amino acid controls and the Shuxuetong injection. 1: His; 2: Asp; 3: Gly; 4: Ala; 5: Val; 6: Leu; 7, 8: Shuxuetong injection |
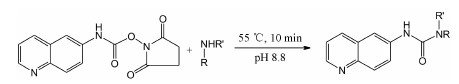 | Scheme 1 Discovery of AQC derivatized amino metabolites |
疏血通注射液中的氨基酸经衍生化,氨基酸化合物中氨基的活泼氢被衍生化基团取代 (反应路线图 1),生成含有特征官能团的衍生产物,从而使氨基酸在PDA检测中响应值大大增强。
液相色谱法根据峰的保留时间和紫外光谱图定性,离子色谱法根据峰的保留时间定性。结果显示,26种对照氨基酸 (27个对照峰,其中羟赖氨酸分D型和L型) 均能完全分离,样品中有24种氨基酸被检出,在药品质量标准中规定的有16种氨基酸被检出,但未检出高于检出限的丝氨酸,推断丝氨酸可能主要存在于肽片段的水解产物中。
另有8种游离氨基酸在疏血通注射液中被首次检出,分别为羟脯氨酸、羟赖氨酸、牛磺酸、γ-氨基丁酸、酪氨酸、谷氨酰胺、天冬酰胺和色氨酸。样品和对照品谱图见图 2。
 | Figure 2 Comparison chromatogram of AQC derivatized amino metabolites between 27 kinds of reference standards mixture and Shuxuetong injection. a: Shuxuetong injection; b: 27 kinds of reference standards mixture. 1: HyPro; 2: His; 3: Asn; 4: Tau; 5: Ser; 6: Gln; 7: Arg; 8: Gly; 9: Asp; 10: Glu; 11: Thr; 12: Ala; 13: γ-Aminobutyric acid (GABA); 14: Theanine; 15: Pro; 16: HyLys-1; 17: HyLys-2; 18: Orn; 19: Cys; 20: Lys; 21: Tyr; 22: Met; 23: Val; 24: Ile; 25: Leu; 26: Phe; 27: Trp |
本实验采用两套分离体系对氨基酸的组成进行分析比较。由于注射液中的氨基酸和糖在离子色谱中的分离条件比较接近,与配置氨基酸捕获柱的体系相比,在未安装氨基酸捕获柱的分离色谱图中,氨基酸峰和糖峰有明显的重叠。由于目前没有特异去除样品中的糖类物质的离子色谱,所以本研究认为,由于注射液中糖的存在干扰了氨基酸的检测,因此离子色谱法暂不适用于对疏血通注射液中的氨基酸成分的分离和鉴定。
2 定量分析 2.1 柱前衍生的UPLC方法实验选择柱前衍生的UPLC方法进行定量实验,结果见表 1。
|
|
Table 1 Results of samples determination and methods verification |
选取3批次疏血通注射液样品考察建立方法的适用性。方法线性关系由标准样品混合溶液分别稀释为0.1、0.5、1.0、2.0和4.0 μmol·mL-1 5个浓度制备线性回归曲线,相关系数r2在 [0.983,1.000] 之间。最低检出限 (LOD) 均小于1.0 pmol·mL-1,最低定量限 (LOQ) 均小于3.0 pmol·mL-1。理论塔板数均大于1×104,实验准确性和重复性良好。回收率实验,取UPLC氨基酸混合对照品50 μL,加入UPLC样品50 μL制成加样回收溶液,共6份,按“AQC衍生化”项下进行衍生化实验,计算回收率在 [80.0%,122.4%] 之间,RSD (n = 6) 在[0.4%,8.5%] 之间。实 验共测得24种氨基酸,含量在 (0.01,1.10) μmol·mL-1之间。含量最高的为Ala,最低的为Cys (表 1)。精密度实验,连续进样6次,记录色谱图,以峰面积计算RSD,24种氨基酸的RSD (n = 6) 在(0,0.2%) 之间。溶液稳定性实验,AQC衍生化样品在4 ℃下放置,分别于0、4、8、12、16、20和24 h进行测定,记录色谱图,以峰面积计算含量的RSD,24种氨基酸的RSD 在(0.1%,0.4%) 之间。表明供试品溶液在4 ℃下的24 h内基本稳定。
实验中共使用了27种氨基酸对照品,检测到了24种氨基酸,其中疏血通注射液注册质量标准要求的17种氨基酸,检出16种,丝氨酸含量低于检出限,推断可能原因为丝氨酸主要来源于多肽水解产物。还有8种常见的游离氨基酸也被检出,且含量范围在 (0.02,0.64) μmol·mL-1之间,其中羟基脯氨酸 (HyPro) 含量较高,测得值为0.638 μmol·mL-1,它和羟基赖氨酸 (HyLys) 主要是胶原蛋白的特征性成分; 其他检出氨基酸包括牛磺酸、γ-氨基丁酸、酪氨酸、谷氨酰胺、天冬酰胺和色氨酸。
讨 论实验中采用了药品质量控制中常用的三种方法对疏血通注射液中的氨基酸组成进行定性分析,即HPTLC法、柱前衍生的UPLC法和离子色谱法[7, 8, 9]。这三种方法各有优势,应用也较为广泛。HPTLC方法在实验中采用了高效薄层板和全自动薄层展开系统,大大提高了有效塔板数,显著改善了薄层板的分辨能力,提高了实验的准确性和重现性。同时,与另两个色谱方法相比较,HPTLC方法还有成本低和分析方法简单等优点。当然,HPTLC方法存在检出限较高,由于氨基酸种类繁多,相近颜色和Rf的斑点不易辨认等情况[10, 11, 12]。大多数氨基酸缺乏天然的紫外和荧光吸收,进行柱前化学衍生化可以有效地提高氨基酸检测的灵敏度。本实验采用UPLC配置PDA检测器对衍生化的氨基酸进行定性定量分析,色谱分析时间约为10 min,可将27种氨基酸对照品进行基线分离,其优点在于无需考虑衍生反应的动力学因素; 有确定高效的衍生化试剂,反应条件比较成熟,反应时间短,对疏血通注射液的分离效果很好。缺点是: 衍生化试剂盒价格较高,UPLC费用较高等问题[13]。在使用离子色谱分析时,由于糖的干扰,疏血通注射液中的氨基酸成分不易被完全分离,不能进行直接的定性分析[14]。实验共检出24种游离氨基酸,其中8种是首次在疏血通注射液中检出,含量较高且有特殊生物学活性[14],建议在今后疏血通注射液标准提高中加入这8种氨基酸的色谱检查项。
| [1] | Jiang JJ, Liao X, Xie YM. Building safety evidence body of shuxuetong injection[J]. China J Chin Mater Med (中国中药杂志), 2014, 39:3630-3632. |
| [2] | Chinese Pharmacopoeia Commission. State Drug Standarad (国家食品药品监督管理局国家药品标准) WS3-548(Z-084) 2005(Z)[S]. Beijing:Chemical Industry Press. |
| [3] | Yan D, Zhang Y, Han YM, et al. HPLC-ELSD direct determination of 17 underivatized amino acids in Shuxuetong injection[J]. Chin J Pharm Anal (药物分析杂志), 2007, 27:558-560. |
| [4] | Wang YH, Shen KY, Li P, et al. Simultaneous determination of 20 underivatized amino acids by high performance liquid chromatography-evaporative light-scattering detection[J]. Chin J Chromatogr (色谱), 2011, 29:908-911. |
| [5] | Karabacak K, Kaya E, Ulusoy KG, et al. Effects of taurine on contractions of human internalmammary artery:a potassium channel opening action[J]. Eur Rev Med Pharmacol Sci, 2015, 19:1498-1504. |
| [6] | Sagara M, Murakami S, Mizushima S, et al. Taurine in 24-h urine samples is inversely related to cardiovascular risks of middle aged subjects in 50 populations of the world[J]. Adv Exp Med Biol, 2015, 803:623-636. |
| [7] | Ding YF, Zhong DF. Tyrosine kinase inhibitor pharmacokinetics drug-drug interaction[J]. Acta Pharm Sin (药学学报), 2013, 48:1080-1090. |
| [8] | Favre-Godal Q, Queiroz EF, Wolfender JL. Latest developments in assessing antifungal activity using TLC-bioautography:a review[J]. J AOAC Int, 2013, 96:1175-1188. |
| [9] | Zhang JJ, Zhang CX, Zhang YN, et al. Metabolic profiling analysis of amino metabolites in plant extract based on precolumn derivatization-ultra high performance liquid chromatography-mass spectrometry[J]. Chin J Chromatogr (色谱), 2015, 33:613-621. |
| [10] | Avula B, Wang YH, Rumalla CS, et al. Analytical methods for determination of magnoflorine and saponins from roots of Caulophyllum thalictroides (L.) Michx. using UPLC, HPLC and HPTLC[J]. J Pharm Biomed Anal, 2011, 56:895-903. |
| [11] | Li Y, Xu LL, Ruan JX. Research progress of enhancing quantitative sensitivity by using LC-MSn with derivatization method in bio-matrices[J]. Acta Pharm Sin (药学学报), 2011, 46:637-641. |
| [12] | Hou LX. Application of high performance thin layer chromatography in American herbal medicine[J]. Med Forum (基层医学论坛), 2009, 29:941-942. |
| [13] | Sun YC, Xu XZ, Xu XL, et al. Determination of 17 amino acids in fish eggs by ultra performance liquid chromatography coupled with precolum derivatization[J]. Chin J Chromatogr (色谱), 2013, 31:275-280. |
| [14] | Zhou TT, Fan GR, Wu YT. Application of supercritical fluid extraction in the pretreatment of biological materials[J]. Acta Pharm Sin (药学学报), 2004, 39:317-320. |
 2016, Vol. 51
2016, Vol. 51


