2. 兰州大学基础医学院GLP实验中心, 甘肃兰州 730000;
3. 兰州大学第一医院, 甘肃兰州 730000;
4. 兰州大学口腔医学院, 甘肃兰州 730000
2. GLP Lab Centre, School of Basic Medicine, Lanzhou 730000, China;
3. The First Hospital, Lanzhou 730000, China;
4. School of Stomatology of Lanzhou University, Lanzhou 730000, China
CO分子是一种重要的生物信使分子[1],同时大量的体内外实验证实CO具有保护细胞、抗炎、舒张血管等生理学活性[2,3]。但由于CO气体分子的生物利用度低,与血红蛋白结合度高等不良反应,很难直接利用[4],所以利用一氧化碳释放分子 (CORMs) 代替CO气体分子是一种切实可行的有效途径之一[5,6]。目前大部分的CORMs是含有过渡金属的羰基金属化合物。[Ru(CO)3Cl2]2及其衍生物是首先进行活性测试的CORMs,随后陆续报道了含Fe、Mn、Mo等过渡金属的一氧化碳释放分子,另外,Cr、W、Rh、Co、Ir等过渡金属也被用于CORMs的合成中,这些化合物均表现出保护细胞、抗炎、血管舒张等生物活性[7, 8, 9]。其中有些分子还可抑制并杀灭金葡菌和绿脓杆菌[10,11]。
在这些羰基CORMs分子中,羰基钴配合物作为抗肿瘤候选分子被人们研究的较早[12,13],生物活性实验表明: 含有金属钴的配合物其活性与配体的结构有关,其中一些含有抗炎药物结构的配体可以提高化合物的抗癌活性,乙酰水杨酸羰基钴配合物是人们关注较多的配合物之一,实验发现其对于人乳腺癌细胞系MCF-7和MDA-MB-231的抑制作用甚 至强于金属抗癌类药物顺铂[14]。然而羰基钴配合物作为CORMs研究才是近年的事,体外实验证实该类配合物具有抗炎作用,而这种作用是通过释放CO抑制亚硝酸盐的产生实现的[15]。可见羰基钴CORMs是一种多靶点的活性分子模式,寻找理化性质优良的配体结构,将使羰基钴CORMs有可能发展成一类结构新颖的抗炎兼抗肿瘤的模型分子。
目前尽管人们合成了为数不少的Co-CORMs,但对它们的体内毒性、CO的释放半衰期与抗炎活性之间的关系等方面未见报道,因此本文在文献及前期工作的基础上,合成了含乙酰水杨酸、对氨基苯甲酸、7-羟基香豆素为结构片段的羰基钴一氧化碳释放分子,并对它们的一氧化碳释放能力、细胞毒性、小鼠经口毒性、抗肿瘤活性及抗炎活性等方面进行了一系列研究,为含钴CORMs的临床应用提供理论依据。
结果与讨论 1 CORMs 的合成与表征在3个配合物中,含乙酰水杨酸片段的配合物1文献已有报道,而配合物2结构中含有对氨基苯甲酸片段,因为对氨基苯甲酸是生物体所需要的; 配合物3含7-羟基香豆素结构片段,是期望借助香豆素的荧光特性来跟踪其在细胞中的分布情况。目标分子1、2的合成是先通过将乙酰水杨酸或对氨基苯甲酸转化为丙炔酯,再与Co2(CO)8反应得到。配合物3是通过7-羟基香豆素与溴丙炔在碳酸钾的作用下生成相应的丙炔醚后,再与Co2(CO)8反应得到 (合成路线1)。所有化合物的结构都通过核磁、质谱、红外光谱进行了表征,除此之外,还获得了配合物2、3的单晶结构 (图 1)。在红外光谱中,配合物1~3均在1 900~2 100 cm-1出现3个很强的吸收峰,该吸收峰为金属端羰基的典型吸收峰。在配合物1、2中除出现羰基吸收峰外,且在1 729和1 723 cm-1处出现酯键中羰基吸收峰,配合物3在1 720 cm-1处出现7-羟基香豆素分子内酯结构中羰基吸收峰。在配合物1~3的配体1H NMR谱图中,端炔上氢原子的位移分别为δ 2.53、2.66和2.56,与钴原子相连的碳上的氢原子都呈单峰,化学位移分别为δ 6.12、6.52和6.01,在配合物3中该碳原子上氢的化学位移较配合物1、2上同碳氢的化学位移略有减小。1H NMR谱图中,氢原子的信号表现出信号减弱、峰形加宽等现象,这是由于化合物中金属钴的顺磁性所致。
 | Scheme 1 Syntheses and structures of complexes 1-3 |
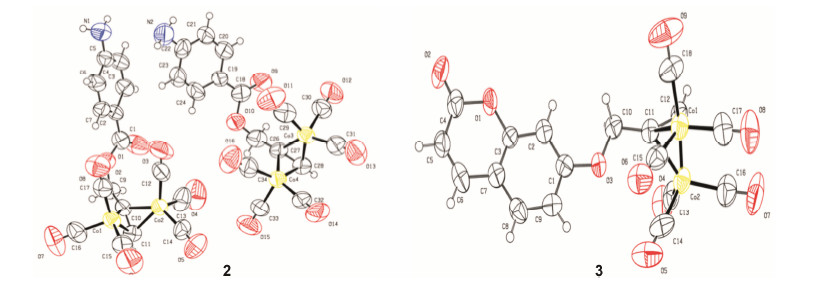 | Figure 1 Molecular structures of complexes 2 (left) and 3 (right). Complex 2: C16H9NO8Co2, monoclinic; P21/n; a: 18.411 1 (10), b: 7.468 3 (3), c: 28.513 1 (19) Å. Complex 3: C18H8O9Co2, triclinic, P-1; a: 7.028 (2), b: 12.076 (4), c: 12.441 (6) Å |
在ESI-MS谱图中,配合物1和2在m/z 506.9和483.9处出现了典型的 [M+Na]+ 峰,配合物3在486.9处出现 [M+H]+ 峰。这说明合成所得的化合物为目标分子。
2 CORMs 1~3的CO释放检测由于脱氧肌红蛋白与CO有很强的结合作用,同时CO与脱氧肌红蛋白结合的过程可以利用紫外可见分光仪追踪检测。脱氧肌红蛋白最大吸收峰为560 nm,当CO与脱氧肌红蛋白结合时,在540和578 nm处会出现两个最大吸收峰,而原来560 nm处的吸收峰会逐渐降低。因此一般选用这种方法检测一氧化碳释放分子在体外的释放能力。
在相应的条件下测定配合物1~3的CO释放能力,从图 2中可以看出,随着时间的延长,脱氧肌红蛋白的最大吸收强度逐渐降低,而脱氧肌红蛋白与CO结合后的吸收强度逐渐增强,这说明化合物在含有脱氧肌红蛋白的条件下释放CO是逐步的,而配体的不同会导致化合物的释放半衰期发生变化。配合物1~3的释放半衰期分别为41.8、49.7和53.2 min。与含Ru、Cr、Mo和W的CORMs的CO释放半衰期相比,半衰期普遍较长,属于较慢的一氧化碳释放分子,通常Ru-CORMs的半衰期一般较短,在1.0~15.8 min内[15,16],含Cr、Mo、W的一氧化碳释放分子半衰期在6.5~33.4 min内[17]。
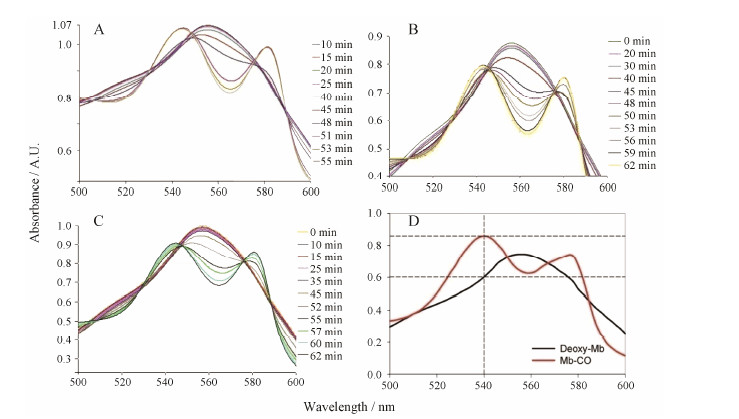 | Figure 2 The typical changes in the electronic spectrum of myoglobin as CO releasing from complexes. A for complex 1 (40 µmol·L-1); B for 2 (40 µmol·L-1); C for 3 (40 µmol·L-1); D for myoglobin binds one CO molecule to form carbonyl myoglobin |
不管哪一类含有过渡金属的CORMs,结构中非CO配体都对CO释放的速度有着显著影响。Co-CORMs的CO释放半衰期较长,这一特性可能对整个分子生物活性产生较大影响,如起效缓慢,作用时间延长。
3 动物毒性目前,对于羰基钴CORMs的研究仅限于细胞水平,乙酰水杨酰基羰基钴配合物优良的抗肿瘤活性,尤其对乳腺癌MCF-7的选择性和活性,以及钴廉价易得的特性,促使对含钴的CORMs分子在体内的毒性进行研究。为了减少动物数量,采用ATC法测定化合物对小鼠的半数致死剂量 (LD50)[18],结果表明配合物1~3的LD50分别为2 500~5 000、2 500~3 000和1 500~2 000 mg·kg-1,说明它们对小鼠的毒性较小,其中配合物1的毒性最小。
为了进一步研究目标分子的毒性,配合物1多 次灌胃给药,每天剂量为0.01 mmol·kg-1,其间收集尿液,8天后处死大鼠,同时采集血液,肝脏、肾脏等主要器官。血液、尿液生化检测显示 (表 1,2): 实验大鼠连续灌胃8天后,大鼠血液中AST大约升高 20 U·L-1,与对照组相比有显著性增长,ALT与对照组相比变化不大,总蛋白和白蛋白与对照组相比含量都降低,但肌酐含量增加。
|
|
Table 1 The test results of blood biochemistry of the rats treated with complex 1 after 8 days of successive administration (0.01 mmol·kg-1·d-1) |
|
|
Table 2 The test results of urine of the rats treated with complex 1 after 8 days of successive administration (0.01 mmol·kg-1·d-1) |
通过组织切片染色,然后置于显微镜下观察: 肝小叶结构完整 (图 3A: a),中央静脉扩张淤血,部分肝细胞脂肪变性 (图 3A: b); 近曲小管上皮细胞肿胀胞浆疏松,淡染 (图 3B: a),肾小管管腔呈星芒状 (图 3B: b)。在透射电镜下: 肝细胞出现线粒体扩张 (图 3A: c),核畸形,染色质边集 (图 3A: d); 肾脏组织出现肾小球上皮细胞核固缩 (图 3B: c),系膜增生不明显,肾小管细胞部分出现核固缩等现象 (图 3B: d)。同时对尿液的检测表明尿液中有大量的蛋白质,表明配合物1对肾脏的功能有严重影响。
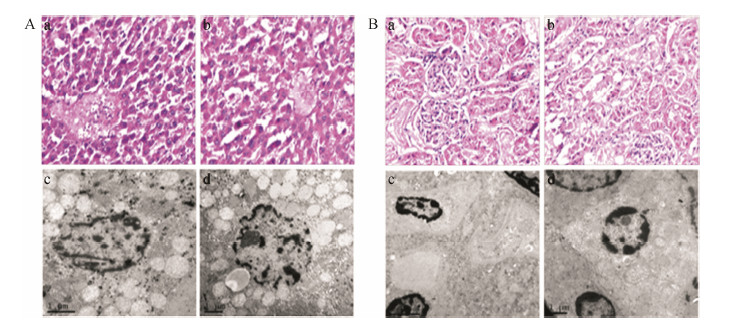 | Figure 3 Optical microscopy (color) and TEM images of liver and kidney cam from rats treated with complex 1. A for liver cells; B for kidney cells |
综上所述,在连续给药的情况下,配合物1会对肝肾组织有所影响,但其对于肝肾的影响略有不同。配合物1会对肝肾组织有所影响,它不仅降低了大鼠肝脏的蛋白合成功能,对肝细胞的生理形态产生较大影响,而且对肾脏的形态和功能都产生较为严重的影响。导致这些毒副作用的因素是多方面的,但化合物代谢过程中金属离子的蓄积可能是主要因素之一。
4 活性研究 4.1 抗肿瘤细胞活性选用HeLa细胞系及HepG2细胞系,选取25、50、100、200、400和800 µmol·L-1梯度浓度,利用MTT法测定目标分子对肿瘤细胞生长的抑制效应,获得了它们的IC50值,结果如表 3所示。对HeLa细胞来说,配合物1~3的IC50分别为36.20、131.03和110.21 µmol·L-1,而对于HepG2细胞而言,它们的IC50值分别为39.25、84.50和139.04 µmol·L-1; 很明显,配合物1对于两种细胞系均表现出较强的生长抑制作用,配合物2对于HeLa细胞的增殖抑制作用低于对照组5-FU,而其余2个均强于对照组。3个分子中,配合物3对HepG2细胞系作用最弱,但都强于对照组5-FU,这说明配合物对不同细胞系表现出的毒性强弱与配合物的配体结构有着密切的关系。
|
|
Table 3 Toxic and physical-chemical parameters of all complexes |
含钴CORMs之所以具有抗肿瘤作用,目前研究认为可能来自3个方面: ① CORMs进入细胞后释放的CO,通过与细胞线粒体电子转移链蛋白结合,导致细胞内ROS增多,杀死肿瘤细胞; ② 通过影响细胞凋亡和干扰细胞周期产生抗癌作用; ③ CORMs释放CO过程中产生的活性钴碎片杀死肿瘤细胞。本课题组近期的研究结果表明,配合物1主要诱导HeLa细胞晚期凋亡,而且凋亡的细胞数目随着CORMs浓度的增加呈递增趋势; 配合物1可以阻碍细胞的分裂,使细胞分裂停留在G2/M期,从而抑制细胞的增殖; 配合物1可诱导细胞产生ROS,而且ROS的浓度与配合物的浓度呈正相关[19]。
4.2 抗炎活性NO是一种炎症介质。在炎症反应的病理进程中,大量生成的诱导型NO合成酶,会产生大量的NO而对细胞毒性起到主导作用。机体发生炎症反应的组织不仅能产生大量的NO (nmol水平),也能聚集大量的超氧阴离子O2-,NO和O2-能生成过 氧化亚硝酸盐 (ONOO-),ONOO-及其分解产物羟自由基与NO相互作用,形成亚硝酸盐,主导着炎症反应的病理损伤作用,如引起细胞核酸亚硝酰化,破坏DNA结构,形成亚硝酰铁络合物,引起蛋白激酶硝基化,以及抑制糖有氧氧化过程中顺乌头酸酶的生成,抑制线粒体的呼吸作用等。因而,测试巨噬细胞内 亚硝酸盐水平,可反应出细胞内炎症发展的情况,CORMs释放的CO通过鸟苷酸环化酶途径抑制iNOS的活性,使NO的合成受阻,检测亚硝酸盐含量的变化,可作为评价目标分子的抗炎活性的指标之一。
本实验采用小鼠单核巨噬细胞Raw264.7细胞系来研究目标分子的抗炎活性。在内毒素 (LPS) 刺激下,巨噬细胞与不同浓度的目标分子共同孵育24 h,然后利用试剂盒检测细胞内亚硝酸盐浓度。
实验表明3个配合物均可降低巨噬细胞内亚硝酸盐的浓度水平 (图 4),与之相比较,相应的炔酯配体并没有表现出抑制亚硝酸盐的浓度水平,这就说明配合物的生物活性来自于分子结构片段Co2(CO)6释放的CO的作用和功能; 而且它们的活性效应是剂量依赖性的,随着剂量的增加,活性增强。3个配合物中,配合物1和2比配合物3表现出更强的降低亚硝酸盐水平的能力,这就说明配合物结构中的配体结构对其功能的发挥有一定的影响,实际上,这些配体的影响主要体现在影响配合物CO释放的快慢上。同时,注意到3个化合物的脂水分配系数logP都在1.8左右(表 3),而且与活性之间并不是正相关,说明化合物较强的透膜能力并不是决定其作用的唯一条件,也可能是导致毒副作用的因素之一。
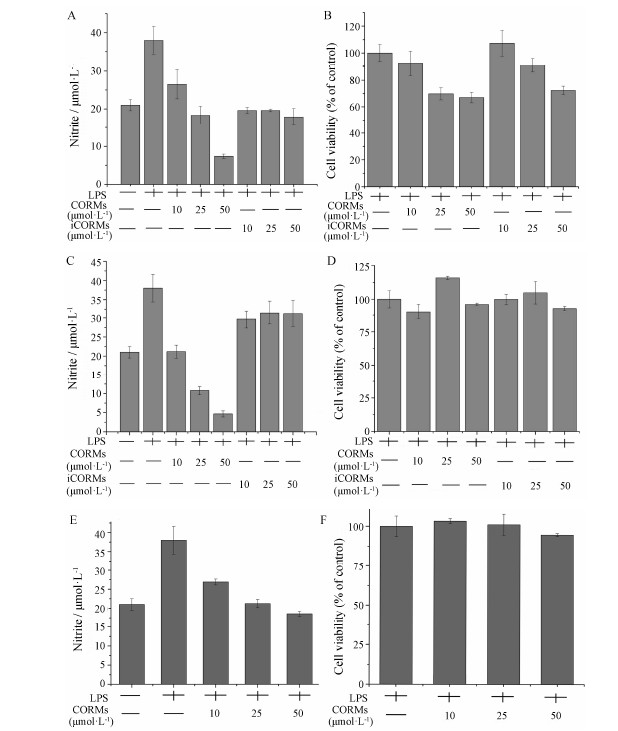 | Figure 4 Effect of complexs 1-3 on LPS-stimulated nitrite production in RAW264.7 macrophages (A, C, E). Cells were exposed to 1 μg·mL-1 LPS in the presence of increasing concentrations of complexs 1-3 (10, 25 and 50 µmol·L-1) or its inactive counterpart (iCORM). Nitrite levels, an index of NO production, were assessed after 24 h exposure. Control cells were incubated with medium alone (open bars). Cell viability was assessed 24 h after exposure of macrophages to 1 μg·mL-1 LPS in the presence or absence of complex 1-3 (10, 25 and 50 µmol·L-1) (B, D, F). Viability was expressed as percentage of control. Data represent the mean ± SEM of four independent experiments. A, B: Complex 1; C, D: Complex 2; E, F: Complex 3. CORMs: CO releasing molecules |
为了保证在测试浓度范围内抗炎实验的顺利 进行,就要求目标分子对巨噬细胞的毒性作用较小,这样细胞中NO介导的炎症通路受到的影响也较小,抗炎实验才有意义。为此用MTT法测试了在实验浓度下巨噬细胞的存活率,结果表明配合物1对巨噬 细胞的毒性较配合物2和3大,用10 µmol·L-1配合物1处理巨噬细胞24 h后,细胞存活率为92%,而用50 µmol·L-1处理后,相对存活率降低到67%; 用10~50 µmol·L-1的配合物2和3处理后,细胞存活率都在90%以上,所以这一浓度梯度基本满足实验的基本要求,但是不排除由于细胞毒性导致细胞死亡而对结果产生影响。通过配合物3抑制亚硝酸盐水 平的程度,以及相应化合物的细胞存活率来看,配合物3是在未造成细胞大量死亡条件下产生了较强的活性。由于7-羟基香豆素丙炔醚细胞存活率相比对照组(细胞+LPS) 的存活率低于50%。所以没有进一步计算其亚硝酸盐含量。
5 小 结3种含金属钴的配合物CO释放半衰期较长,可能影响它们的抗炎活性。小鼠LD50显示它们的毒性都较小; 大鼠连续等剂量给药8天后,配合物1对大鼠肝脏功能有所影响,同时对肝细胞的生理形态影响较大; 对肾脏的功能和生理形态的影响都较为严重。配合物1对于HeLa细胞系和HepG2细胞系均表现出较强的生长抑制作用,配合物2对于HeLa细胞的增殖抑制作用低于对照组5-FU。3个配合物中,配合物3对于HepG2细胞系作用最弱,但都强于对照组5-FU。3个配合物中,配合物1和2比配合物3表现出更强的降低亚硝酸盐水平的能力。通过抗炎实验表明这3个配合物都具有一定的抗炎活性,它们的抗炎作用是通过抑制体内炎症介质的生物合成来实现的,这与阿司匹林类非甾体抗炎药的抗炎机制是完全不同的 (抑制PEG的生物合成)。至于这3个Co-CORMs分子,能否进入临床前研究行列,需要对它们的代谢、分布等动力学性质研究之后才能取舍,这方面的研究正在进行之中。
实验部分AVANCE Ⅲ 400型核磁仪 (400 MHz,TMS为内标)、maXis4G TOF质谱仪 (德国Brucker); Nicolet NEXUS 360 FT-IR红外光谱仪 (美国Nieolet); Lambda 25紫外可见光谱仪 (美国PerkinElmer); CO2培养箱; 酶标仪 (Thermo Varioskan Flash 3000); Beckman- Coulter LX-20全自动化生化分析仪; JEM-1230透射电镜; vario EL cube元素分析仪。
肌红蛋白、亚硝酸盐/硝酸盐检测试剂盒 (Sigma),其他试剂均为分析纯。所用试剂均经过干燥处理,PBS缓冲液为0.1 mol·L-1,pH= 7.4,在使用前用N2鼓泡排除空气。
实验动物购置于兰州大学实验动物中心GLP实验室,实验动物合格证: SCXK (甘) 2009-0004,昆明小鼠,清洁级雄性 (20 ± 20) g; Vista大鼠 (200 ± 20) g。所有动物饲养7天后再进行实验。HeLa细胞系、HepG2细胞系购于上海生命科学研究院。
1 化学合成 1.1 乙酰水杨酸丙炔酯的合成将2.1 g(10 mmol) 的乙酰水杨酸溶于5 mL二氯亚砜中,油浴条件下加热至80 ℃并保持4 h。待乙酰水杨酸完全转化为乙酰水杨酰氯,真空抽去多余的二氯亚砜。将制备好的乙酰水杨酰氯溶于10 mL二氯甲烷中,在冰浴条件下缓慢滴入含有43 mL (10 mmol) 丙炔醇和2 mL三乙胺的二氯甲烷溶液中,滴加结束后撤去冰浴继续搅拌,1 h后结束反应,减压抽干溶剂,粗产物进行柱色谱分离 (流动相: 乙酸乙酯-石油醚 = 1∶4),最终得到白色针状晶体2.05 g,产率85.4%。IR (KBr disk/cm-1): 2 135 w,1 724 vs,1 718 vs,1 260 v,1 226 v,1 201 v,1 083 v; 1H NMR (CDCl3,δ): 2.38 (s,3H,OCH3),2.53 (s,1H,≡CH),4.88 (s,2H,-OCH2),7.13~8.06 (m,4H,Ar-H); 13C NMR (CDCl3,δ): 52.6 (OCH2),75.5 (≡C-H),77.3 (C≡),111.7,117.6,119.2,130.0,136.1,161.7 (Ar-C),169.3 (COO); ESI-MS: m/z [M+Na]+ 241.1; Elemental Anal.: Calcd. for C12H10O4: C,66.0; H,4.6; Found: C,65.9; H,4.6。
1.2 对氨基苯甲酸丙炔酯的合成将对氨基苯甲酸 (823.0 mg,6 mmol)、DCC (1350 mg,9.0 mmol) 和DMAP (1.768 mg,1.35 mmol) 依次加入到30 mL DMF溶剂中搅拌反应,并用薄层色谱硅胶板进行检测,待反应完全,减压除去多余的溶剂。粗产物进行柱色谱分离 (流动相: 乙酸乙酯-石油醚 = 2∶1),最终得到产物912.5 mg,产率87.6%。IR (KBr disk/cm-1): 2 131 w,1 768 vs,1 708 vs,1 228 v,1 210 v,1 073 v; 1H NMR (CDCl3,δ): 2.66 (t,C2H,1H,J = 2.4 Hz),4.08 (br,Ar-NH2,2H,J = 2.4 Hz),4.95 (d,O-CH2,2H,J = 2.4 Hz),6.62 (d,Ar-H,1H,J = 2.0 Hz),6.63 (d,Ar-H,1H,J = 2.0 Hz),7.95 (d,Ar-H,1H,J = 2.0 Hz),7.97 (d,Ar-H,1H,J = 1.6 Hz); 13C NMR (CDCl3,δ): 52.0 (OCH2),74.7 (≡C-H),79.4 (C≡),114.0,119.7,132.0,151.4 (Ar-C),166.0 (COO); ESI-MS: m/z [M+H]+ 176.1。
1.3 7-羟基香豆素丙炔醚的合成将7-羟基香豆素 (5 mmol,640.23 mg) 溶于25 mL DMF中,然后依次加入3-溴丙炔 (45 μL,6.0 mmol) 和碳酸钾 (630.32 mg,7.5 mmol),加热至80 ℃反应1 h,待反应结束后过滤,减压除去滤液,粗产物利用柱色谱分离 (流动相: 乙酸乙酯-石油醚=1∶2),最后得到白色固体产物765.4 mg,产率76.3%。IR (KBr disk/cm-1): 2 122 w,1 721 vs,1 638 v,1 319 v,1 180 v; 1H NMR (CDCl3,δ): 2.56 (t,C2H,1H,J = 2.0 Hz),4.74 (d,O-CH2,2H,J = 2.4 Hz),6.26 (d,C=CH,1H,J = 9.6 Hz),6.90 (dd,Ar-H,2H,J = 14.0,5.6 Hz),7.38 (d,Ar-H,1H,J = 8.8 Hz),7.64 (d,Ar-CH=C,1H,J = 8.0 Hz); 13C NMR (CDCl3,δ): 56.3 (OCH2),77.0 (≡C-H),77.5 (C≡),102.2 (Ar-C),113.1 (Ar-C),113.2 (Ar-C),113.7 (Ar-C=C),115.7 (Ar-C),129.9 (Ar-C),143.4 (C=C-COO),161.0 (Ar-C),161.1 (COO); ESI-MS: m/z [M+H]+ 201.1。
1.4 目标配合物1~3的合成配合物1的合成 将乙酰水杨酸丙炔酯 (218 mg,1.0 mmol) 溶于干燥过的四氢呋喃 (30 mL) 中搅拌,再加入八羰基二钴 (Co2(CO)8) (456 mg,1.2 mmol),反应液在N2的保护下室温搅拌过夜。减压 去除多余溶剂,粗产物利用柱色谱分离 (流动相: 丙酮-正己烷 = 1∶10),最后得到红色固体产物304 mg,产率63.4%。IR (KBr disk/cm-1): 2 131 w,2 089 vs,2 073 vs,2 006 vs,1 729 vs,1 179 v; 1H NMR (CDCl3,δ): 2.37 (s,3H,COCH3),5.47 (s,2H,OCH2),6.12 (s,1H,-C2H),7.14 (s,1H,Ar-H3),7.31 (s,1H,Ar-H5),7.59 (s,1H,Ar-H4),8.11 (d,1H,Ar-H6); 13C NMR (CDCl3,δ): 28.6 (CH3),68.4 (OCH2),75.1,77.3 (C≡CH),122.0,124.0,130.5,134.2 (Ar-CH),170.5,172.7 (COO),201.8 (Co-CO); ESI-MS: m/z [M+Na]+ 506.9; Elemental Anal.: Calcd. for C18H10Co2O10: C,42.08; H,2.00; Found: C,41.97; H,1.877。
配合物2的合成 配合物2的合成过程与配合 物1相似,最终得到红色固体产物284 mg,产率59%。产物在混合溶液(甲醇-氯仿-正己烷 = 1∶3∶1) 重结晶析出针状晶体。IR (KBr/cm-1): 2 094 vs,2 087 vs,2 029 vs (Co-CO),1 683 s (COO); 1H NMR (CDCl3,δ): 4.69 (br,Ar-NH2,2H,J = 2.6 Hz),5.16 (O-CH2,2H),6.52 (s,C2H,1H),6.82 (s,Ar-H,1H),7.13 (s,Ar-H,1H),7.85 (s,Ar-H),7.97 (s,Ar-H,1H); 13C NMR (CDCl3,δ): 53.9 (OCH2),75.6 (≡C-H),80.163 (C≡),115.0,120.7,133.0,153.4 (Ar-C),169.9 (COO),201.7 (Co-CO); ESI-MS: m/z [M+Na]+ 483.9; Elemental Anal.: Calcd. for C16H9Co2NO8: C,41.68; H,1.97; N,3.04; Found: C,41.53; H,1.895; N,2.98。
配合物3的合成 配合物3的合成过程与配合 物1相似,最终得到红色固体产物298 mg,产率61%。产物在混合溶液(氯仿-正己烷 = 4∶1) 重结晶析出针状晶体。IR (KBr/cm-1): 2 097 vs,2 059 vs,2 022 vs (Co-CO),1 720 s (COO); 1H NMR (CDCl3,δ): 5.43 (s,O-CH2,2H),6.01 (s,C2H,1H),6.46 (d,C=CH,1H,J = 9.6 Hz),7.42~7.08 (m,Ar-H,2H),7.67 (s,Ar-H,1H),7.84 (s,Ar-CH=C); 13C NMR (CDCl3,δ): 68.8 (OCH2),78.3 (≡C-H),88.796 (C≡),103.3 (Ar-C),115.4 (Ar-C),116.5 (Ar-C),117.8 (Ar-C=C),120.8 (Ar-C),131.9 (Ar-C),142.7 (C=C-COO),161.4 (Ar-C),162.1 (COO),199.6 (Co-CO); ESI-MS: m/z [M+H]+ 486.9; Elemental Anal.: Calcd. for C18H8Co2O9: C,43.75; H,3.26; Found: C,43.74; H,3.254。
2 LogP的测定称取配合物1 4.83 mg (10 μmol) 溶于5.0 mL正辛醇饱和的PBS溶液中,再向该溶液中加入5.0 mL PBS缓冲液饱和的正辛醇溶液,37 ℃置于摇床上8 h,使化合物在两相中的分配达到平衡后,离心溶液取PBS缓冲液层,进行ICP-AES检测,测定金属钴的含量,最终计算出配合物1的logP,其余配合物logP的测定与此相同。
3 CO 释放检测体外释放CO可以利用紫外可见分光光谱法进行检测: 将10 mg肌红蛋白溶于10 mL的PBS缓冲溶液。向该溶液中加入0.1% 的连二亚硫酸钠,将肌红蛋白还原为脱氧肌红蛋白,此时脱氧肌红蛋白的浓度为60 μmol·L-1。吸取配置好的脱氧肌红蛋白2 mL,向其中加入8 mmol·L-1配合物1的DMSO溶液10 μL,混合均匀后置于37 ℃下用紫外可见分光光谱法检测并记录溶液500~600 nm的吸收曲线,叠加曲线得到相应的CO释放图谱,通过计算得出化合物的CO释放半衰期。其余化合物的CO释放半衰期检测与此相同[16]。
4 LD50测定LD50测定使用小鼠经口毒性分级法[16]。设置5 000、2 000、1 000、500 mg·kg-1 4个实验剂量组进行实验,各实验剂量组每次使用3只雄性昆明小鼠,化合物均用0.4% CMC-Na配制成为所需要的剂量,每次吸取0.5 mL依次灌胃给药。给药后3天统计小鼠死亡数量,并参照文献确定实验进度。给药组存活小鼠连续观察11天以上,在此期间如小鼠死亡则计入死亡数量中。实验结束后根据文献确定化合物的LD50范围。
5 生物活性实验 5.1 抗肿瘤活性实验HeLa细胞系与HepG2细胞系分别用含有10% 胎牛血清的1640培养基在37 ℃、5% CO2条件下置于细胞培养箱中培养,待细胞处于对数期时以每孔6×103个细胞接种于96孔板中,培养24 h后移去旧培养基后加入含有待测样品的培养基 (将0.08 mmol目标化合物溶于0.5 mL DMSO后配制成实验浓度25、50、100、200、400和800 µmol·L-1),每个浓度设置4个平行样品,同时设置空白对照组。细胞培养24 h后,加入20 μL MTT溶液,孵育4 h后将96孔板内的上清液吸出,每孔加入150 μL DMSO,振荡20 min。在490 nm波长用酶标仪测定各孔的吸光值 (OD值),计算化合物对细胞的半数抑制剂量。
5.2 体外抗炎实验小鼠单核巨噬细胞 (Raw 264.7细胞) 用含有10% 优质进口胎牛血清的DMEM高糖培养基,在37 ℃、5% CO2条件下置于细胞培养箱中培养。巨噬细胞在加入实验组设计的待测化合物的浓度 (10、25和50 µmol·L-1) 的同时用内毒素 (LPS,1 μg·mL-1) 进行刺激,亚硝酸盐含量在培养24 h结束后测定,每个浓度设置4个平行样品,同时设置阴性对照组 (iCORMs),最终确定亚硝酸盐含量的变化是否与化合物释放出的CO分子有关。培养结束后亚硝酸盐含量通过Griess法进行检测[18],简要步骤如下: 将状态良好且处于对数期的细胞以每孔4×105个细胞接种于96孔板中,培养24 h后移去培养液,加入配置好的待测化合物继续培养24 h,收集各孔的培养液及其细胞,离心后取上清液。将Griess试剂加入96孔板中进行反应并摇晃,10 min后在550 nm条件下置于酶标仪 (Thermo Varioskan Flash 3000) 进行读数。最终每个样品的亚硝酸盐含量通过标准曲线换算得来。
5.3 巨噬细胞RAW264.7生长抑制实验小鼠单核巨噬细胞 (Raw 264.7) 用含有10% 优质进口胎牛血清的DMEM高糖培养基,在37 ℃、 5% CO2条件下置于细胞培养箱中培养。巨噬细胞在加入实验组设计的待测化合物的浓度 (10、25和50 µmol·L-1) 的同时用LPS (1 μg·mL-1) 进行刺激,每 个浓度设置4个平行样品,同时设置阴性对照组 (iCORMs)。细胞培养24 h后,加入20 μL MTT溶液,孵育4 h后将96孔板内的上清液吸出,每孔中加入150 μL DMSO,振荡20 min。在490 nm波长用酶 标仪测定各孔的吸光值 (OD值),并计算出各实验组相对于用内毒素 (LPS,1 μg·mL-1) 进行刺激后培养24 h后的细胞相对存活率。
| [1] | Otterbein LE. Carbon monoxide:innovative anti-inflammatory properties of an age-old gas molecule[J]. Antioxid Redox Sign, 2002, 4:309-319. |
| [2] | Wang Y, Yang B, Yang J, et al. Influence of carbon monoxide on growth and apoptosis of human umbilical artery smooth muscle cells and vein endothelial cells[J]. Int J Biol Sci, 2012, 10:1431-1446. |
| [3] | Ryter SW, Alam J, Choi AMK. Heme oxygenase-1/carbon monoxide:from basic science to therapeutic applications[J]. Physiol Rev, 2006, 86:583-650. |
| [4] | Johnson TR, Mann BE, Clark JE, et al. Metal carbonyls:a new class of pharmaceuticals?[J]. Angew Chem Int Ed, 2003, 42:3722-3729. |
| [5] | Motterlini R, Mann BE, Johnson TR, et al. Bioactivity and pharmacological actions of carbon monoxide-releasing molecules[J]. Curr Pharm Des, 2003, 9:2525-2539. |
| [6] | Motterlini R, Otterbein LE. The therapeutic potential of carbon monoxide[J]. Nat Rev Drug Discov, 2010, 9:728-743. |
| [7] | Heffern MC, Yamamoto N, Holbrook RJ, et al. Cobalt derivatives as promising therapeutic agents[J]. Curre Opin Chem Biol, 2013, 17:189-196. |
| [8] | Trachootham D, Alexandre J, Huang P. Targeting cancer cells by ROS-mediated mechanisms:a radical therapeutic approach?[J]. Nat Rev Drug Discov, 2009, 8:579-591. |
| [9] | Zobi F. CO and CO-releasing molecules in medicinal chemistry[J]. Future Med Chem, 2013, 5:175-188. |
| [10] | Tavares AF, Teixeira M, Romao CC, et al. Reactive oxygen species mediate bactericidal killing elicited by carbon monoxidereleasing molecules[J]. J Biol Chem, 2011, 286:26708-26717. |
| [11] | Tavares AFN, Nobre LS, Saraiva LM. A role for reactive-oxygen species in the antibacterial properties of carbon monoxide-releasing molecules[J]. FEMS Microbiol Lett, 2012, 336:1-10. |
| [12] | Ott I, Schmidt K, Kircher B, et al. Antitumor-active cobaltalkyne compounds derived from acetylsalicylic acid:studies on the mode of drug action[J]. J Med Chem, 2005, 48:622-629. |
| [13] | Schmidt K, Jung M, Keilitz R, et al. Acetylene hexacarbonyldicobalt compounds, a novel class of antitumor drugs[J]. Inorg Chim Acta, 2000, 306:6-16. |
| [14] | Wilson JL, Kobeissi SF, Oudir S, et al. Design and synthesis of new hybrid molecules that activate the transcription factor Nrf2 and simultaneously release carbon monoxide[J]. Chem Eur J, 2014, 20:14698-14704. |
| [15] | Wang P, Liu H, Zhao Q, et al. Syntheses and evaluation of drug-like properties of CO-releasing molecules containing ruthenium and group 6 metals[J]. Eur J Med Chem, 2014, 74:199-215. |
| [16] | Wang PP, Liu HP, Zhao QY, et al. Toxicology and tissue distribution of Ruthenium (Ⅱ) CO-releasing molecules and its interaction with endogenous substances[J]. Acta Pharm Sin (药学学报), 2013, 48:1677-1687. |
| [17] | Liu H, Wang P, Zhao Q, et al. Syntheses, toxicity and biodistribution of CO releasing molecules containing M(CO)5(M=Mo, W and Cr)[J]. Appl Organometal Chem, 2014, 28:169-179. |
| [18] | Schlede E, Genschow E, Spielmann H, et al. Oral acute toxic class method:a successful alternative to the oral LD50 test[J]. Regul Toxicol Pharmacol, 2005, 42:15-23. |
| [19] | Gong Y, Zhang T, Liu H, et al. Synthesis, toxicities and cell proliferation inhibition of CO-releasing molecules containing cobalt[J]. Transition Met Chem, 2015, 40:413-426. |
 2016, Vol. 51
2016, Vol. 51


